失血性休克后肠淋巴液引流恢复小鼠肾组织ACE/ACE2平衡的作用
失血性休克后肠淋巴液引流恢复小鼠肾组织ACE/ACE2平衡的作用*
刘俊芬,蒋丽娜,张立民,刘桂青,赵自刚,刘圣君△,牛春雨△
(河北北方学院微循环研究所,河北 张家口 075029)
[摘要]目的: 观察失血性休克后肠淋巴液(PHSML)引流对失血性休克小鼠肾组织血管紧张素转换酶(ACE)/ACE2平衡的作用。方法: 复制小鼠失血性休克模型,随机分为休克组与休克+引流组,行液体复苏;休克+引流组液体复苏后,引流肠淋巴液。在液体复苏后6 h,检测肾组织ACE、ACE2、血管紧张素II(Ang II)1型受体(AT1R)、Mas相关G蛋白偶联受体(MasR)的mRNA表达以及Ang II、Ang (1-7)含量。结果: 失血性休克提高了肾组织ACE mRNA、AT1R mRNA和Ang II水平,降低了ACE2 mRNA、MasR mRNA 和Ang(1-7)水平,PHSML引流抑制了失血性休克对ACE2和AT1R mRNA表达的影响;同时PHSML引流也降低了失血性休克增加ACE/ACE2、Ang II/Ang(1-7)和AT1R/MasR比值的作用。结论: PHSML引流恢复了失血性休克后肾组织的ACE/ACE2平衡,有利于减轻失血性休克所致的肾损伤。
[关键词]失血性休克; 淋巴液; 引流术; 急性肾损伤; 血管紧张素转换酶
[中图分类号]R364.1+4; R331.4[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.028
[文章编号]1000-4718(2015)11-2101-06
[收稿日期]2015-06-05[修回日期] 2015-09-01
[基金项目]*国家自然科学基金资助项目(No.81330007;No.81120108003);广东省科技计划国际合作项目(No.2014A050503047)
通讯作者△Tel: 020-83827812-51155; E-mail: yuxycn@aliyun.com
Role of post-hemorrhagic shock mesenteric lymph drainage in restoring balance of ACE/ACE2 in kidney of miceLIU Jun-fen, JIANG Li-na, ZHANG Li-min, LIU Gui-qing, ZHAO Zi-gang, LIU Sheng-jun, NIU Chun-yu
(InstituteofMicrocirculation,HebeiNorthUniversity,Zhangjiakou075029,China.E-mail:ncylxf@126.com;lyz19920206@sohu.com)
ABSTRACT[]AIM: To study the role of post-hemorrhagic shock mesenteric lymph (PHSML) drainage on the balance of angiotensin-converting enzyme (ACE) and ACE2 in the kidney. METHODS: A hemorrhagic shock model was established and then fluid resuscitation was performed to the animals in shock and shock+drainage groups, and the PHMSL was drained in shock+drainage group after fluid resuscitation. After 6 h of resuscitation, the mRNA expression of ACE, ACE2, angiotensin II (Ang II) type 1 receptor (AT1R) and Mas-related G-protein-coupled receptor (MasR), and the levels of Ang II and Ang (1-7) in the renal tissues were observed. RESULTS: Hemorrhagic shock increased the levels of ACE mRNA, AT1R mRNA and Ang II, and decreased the levels of ACE2 mRNA, MasR mRNA and Ang(1-7) in the kidney. PHSML drainage abolished the effect of hemorrhagic shock on ACE2 and AT1R mRNA expression. Meanwhile, PHSML drainage reduced the hemorrhagic shock-induced increases in the ratios of ACE/ACE2, Ang II/Ang(1-7) and AT1R/MasR. CONCLUSION: The PHSML drainage restores the balance of ACE/ACE2, which is beneficial to alleviate acute kidney injury following hemorrhagic shock in the mice.
[KEY WORDS]Hemorrhagic shock; Lymph fluid; Drainage; Acute kidney injury; Angiotensin-converting enzyme
重度失血性休克后急性肾损伤(acute kidney injury,AKI)引起的内环境紊乱与多器官衰竭(multiple organ failure,MOF)的发生和患者的死亡率相关[1]。证据表明,失血性休克后肠淋巴液(post-hemorrhagic shock mesenteric lymph,PHSML)回流与MOF有关[2],结扎肠淋巴管可以减轻失血性休克后肾脏的功能障碍与氧化应激程度[3],但其详细机制还需深入研究。肾素-血管紧张素系统(renin-angiotensin system,RAS)是人体内重要的体液调节系统,维持内环境稳态[4]。研究表明,RAS的2条关键轴血管紧张素转换酶(angiotensin-converting enzyme,ACE)-血管紧张素(angiotensin,Ang)II-Ang II 1型受体(Ang II 1 receptor,AT1R)、ACE2-Ang(1-7)-Mas相关G蛋白偶联受体(Mas-related G-protein-coupled receptor,MasR)失衡参与了止血带性休克再灌注后引起的AKI,即:止血带性休克引起AKI的同时,ACE表达上调,ACE2表达下调;敲除ACE2基因的小鼠发生AKI的程度降低[5-6]。但在失血性休克后AKI的发生过程中,肾组织ACE和ACE2的平衡状态如何?PHSML引流对肾组织ACE和ACE2的平衡有何作用?尚未见报道。为此,本研究观察了PHSML引流对失血性休克小鼠肾组织RAS这2条关键轴的作用,为补充失血性休克引起AKI的肠淋巴机制提供新的实验资料。
材料和方法
1实验动物与分组
24只雄性BALB/c小鼠(20~28 g),购自中国军事医学科学院实验动物中心,实验动物许可证号为SCXK(军) 2011-004,经适应性饲养后用于本实验。小鼠在实验前1 d禁食12 h,自由饮水;然后随机均分为:正常对照(control)组、假手术(sham)组、休克(shock)组和休克+引流(shock+drainage)组。实验过程中动物的处置方法符合动物伦理学规范。
2实验方法
2.1失血性休克小鼠模型的复制小鼠经腹腔注射1%戊巴比妥钠(70 mg/kg)麻醉后,参照我室大鼠失血性休克模型的建立方法[7],进行了部分调整,建立失血性休克模型。具体过程为钝性分离右侧股动脉,用自制玻璃针经股动脉注射肝素钠(1 mL/kg,500 U/kg)用于全身抗凝,连接生物信号采集系统,用于连续监测平均动脉血压(mean artery pressure,MAP);钝性分离左股侧动脉,然后连接1 mL注射器固定于程控式抽注机(New Era Pump Systems Inc.),用于放血和输液;腹部正中线做一个3 cm左右的切口,分离肠淋巴管及其伴行的肠系膜上动脉,用于肠淋巴液引流或假引流;待所有手术完成、稳定30 min后,经左股动脉、应用抽注机匀速放血,10 min内将MAP降至40 mmHg,实验过程中通过推注机调整放血量维持MAP在40 mmHg水平;维持低血压60 min后,将放出的全血与林格氏液按1∶1混匀,结合文献报道的方法[8-10],经左侧股动脉输液复苏,30 min完成。休克组观察至液体复苏结束后6 h;休克+引流组在液体复苏结束后,引流休克肠淋巴液至6 h;假手术组动物仅进行相同的手术操作,但不放血、不输液,观察至与休克小鼠相对应的时间;正常对照组麻醉后直接取材。
2.2肾组织取样在上述各组动物实验结束后的相应时间,在深麻醉状态下,留取肾组织。其中,左肾直接冷冻于-75 ℃冰箱,用于组织匀浆制备、检测Ang II和Ang(1-7)含量;右肾保存于RNA保护液中,冷冻于-75 ℃冰箱,用于检测ACE、ACE2、AT1R和MasR的mRNA表达。
2.3实时荧光定量逆转录聚合酶链反应取右肾组织,按TRIzol试剂(碧云天生物技术研究所)操作说明提取肾组织总RNA,应用紫外分光光度计检测总RNA浓度,A260/A280在1.8~2.0范围为合格;按照FastQuant cDNA第一链合成试剂盒(天根生化科技有限公司)操作说明逆转录反应合成cDNA;取1 μg cDNA作为反应模板进行PCR扩增。PCR反应条件均为95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min。PCR引物(上海生物工程股份有限公司合成)序列、产生长度及循环次数见表1;GAPDH作为内参照。
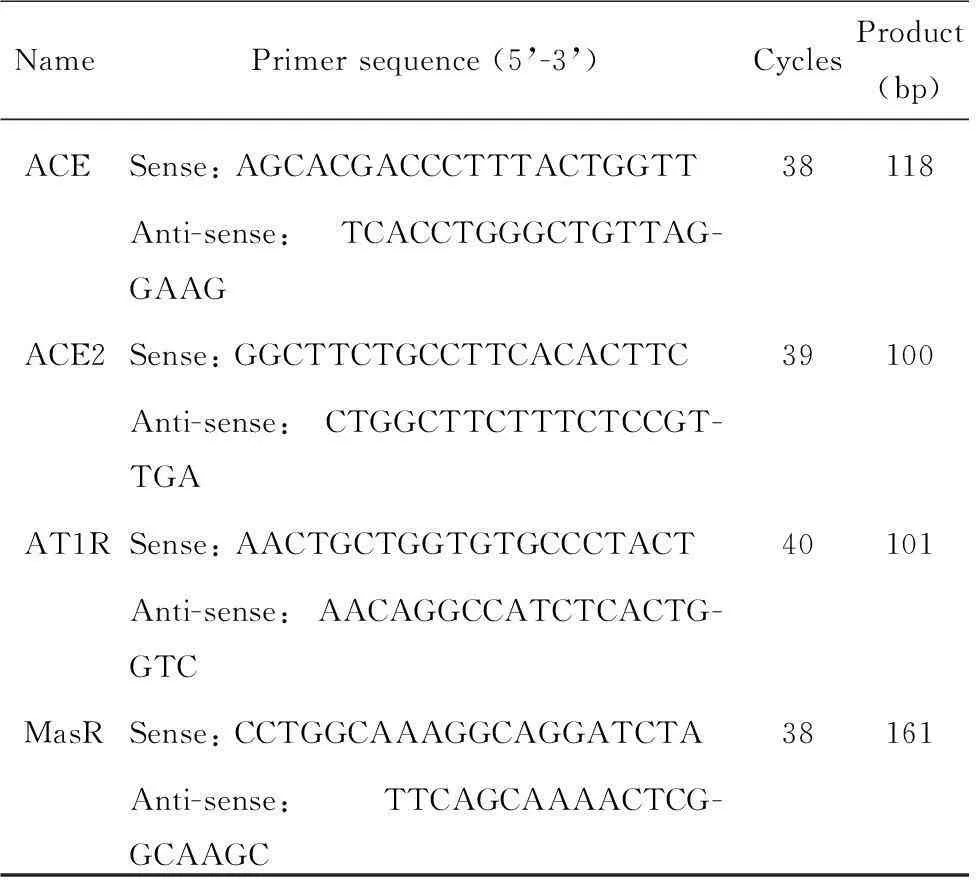
表1 引物序列
2.4酶联免疫吸附实验取冷冻保存的左肾组织,分析天平称重后,按1∶9比例,加入4 ℃的生理盐水,应用玻璃研磨器研碎;3 000 r/min、4 ℃离心20 min,留取上清,制备10%组织匀浆。应用ELISA试剂盒检测小鼠肾组织Ang II和Ang (1-7) 水平(R&D)。肾组织匀浆蛋白定量采用BCA法(BCA试剂盒由碧云天生物技术研究所提供)。
3统计学处理
计量数据以均数±标准差(mean±SD)表示。应用SPSS 16.0统计软件包,多组间比较应用单因素方差分析。首先进行齐性检验,方差齐的数据各组间比较采用Bonferroni校正的t检验,方差不齐的数据采用Tamhame’s T2检验。以P<0.05为差异有统计学意义。
结果
1肠淋巴液引流对失血性休克小鼠肾组织ACE和ACE2 mRNA表达的作用
与正常对照组与假手术组相比,休克组与休克+引流组小鼠肾组织ACE的mRNA表达增高,ACE2的mRNA表达显著降低,休克组小鼠肾组织ACE/ACE2比值显著增高(P<0.05);与休克组相比,休克+引流组小鼠肾组织ACE2的mRNA表达显著增高,ACE/ACE2比值显著降低(P<0.05)。此外,假手术组小鼠肾组织中ACE2的mRNA表达显著低于正常对照组(P<0.05),ACE的mRNA表达和ACE/ACE2比值与正常对照组相比差异无统计学意义(P>0.05),见图1。
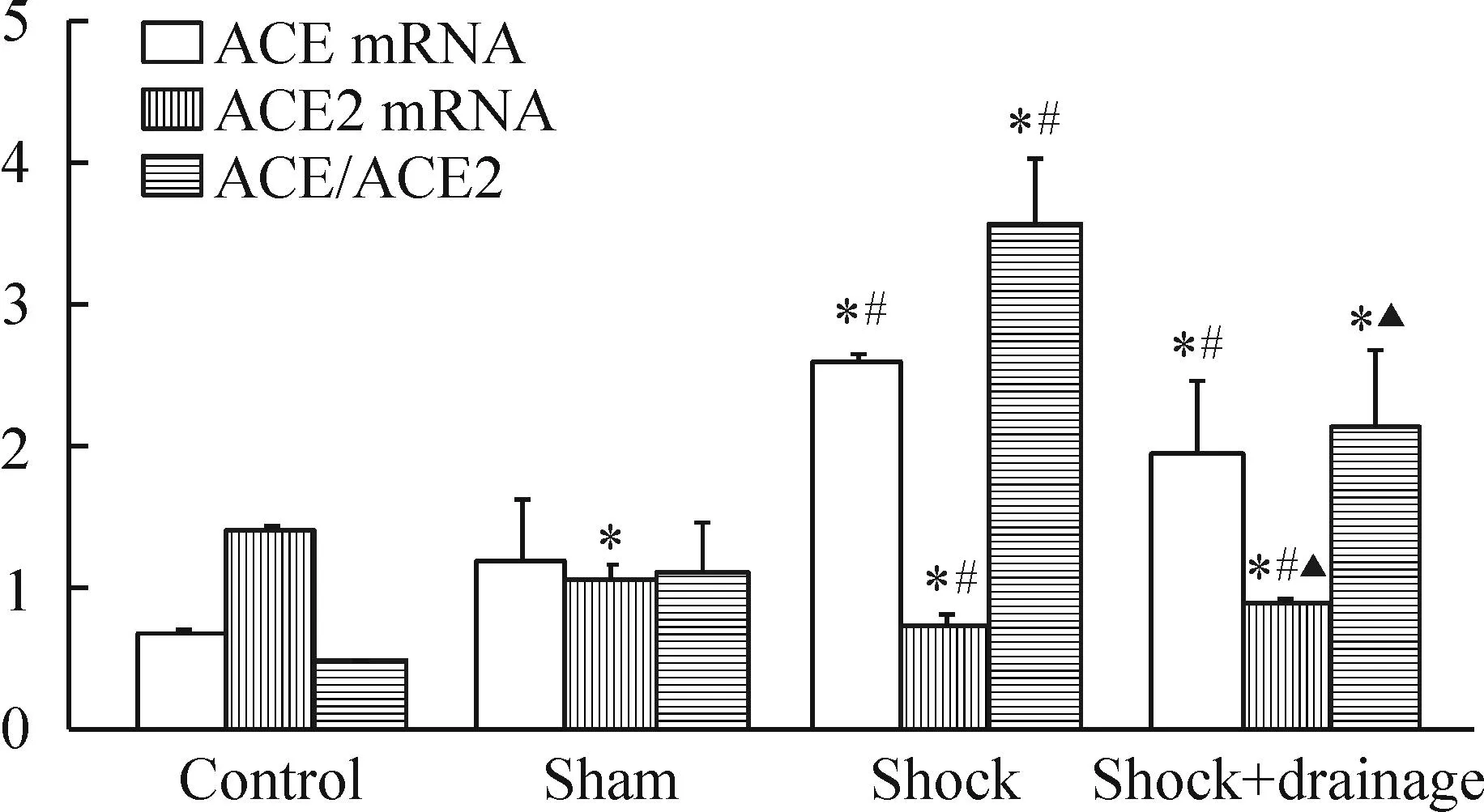
Figure 1.Effects of post-hemorrhagic shock mesenteric lymph drainage on the mRNA expression of angiotensin- converting enzyme (ACE) and ACE2, and the ratio of ACE/ACE2 in the kidney of the mice following hemorrhagic shock. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssham group;▲P<0.05vsshock group.
图1肠淋巴液引流对失血性休克小鼠肾组织ACE和ACE2 mRNA表达以及ACE/ACE2比值的影响
2肠淋巴液引流对失血性休克小鼠肾组织Ang II和Ang(1-7)含量的作用
休克组小鼠肾组织Ang II含量和Ang II/Ang(1-7) 比值显著高于正常对照组与假手术组,Ang (1-7)含量显著低于正常对照组(P<0.05),休克+引流组小鼠肾组织的上述指标与正常对照组与假手术组差异无统计学意义;与休克组相比,休克+引流组小鼠肾组织Ang II/Ang(1-7) 比值显著降低(P<0.05),Ang II与Ang(1-7)含量未见显著差异;此外,正常对照组与假手术组小鼠肾组织的Ang II和Ang(1-7)含量以及Ang II/Ang(1-7) 比值均无显著差异,见图2。
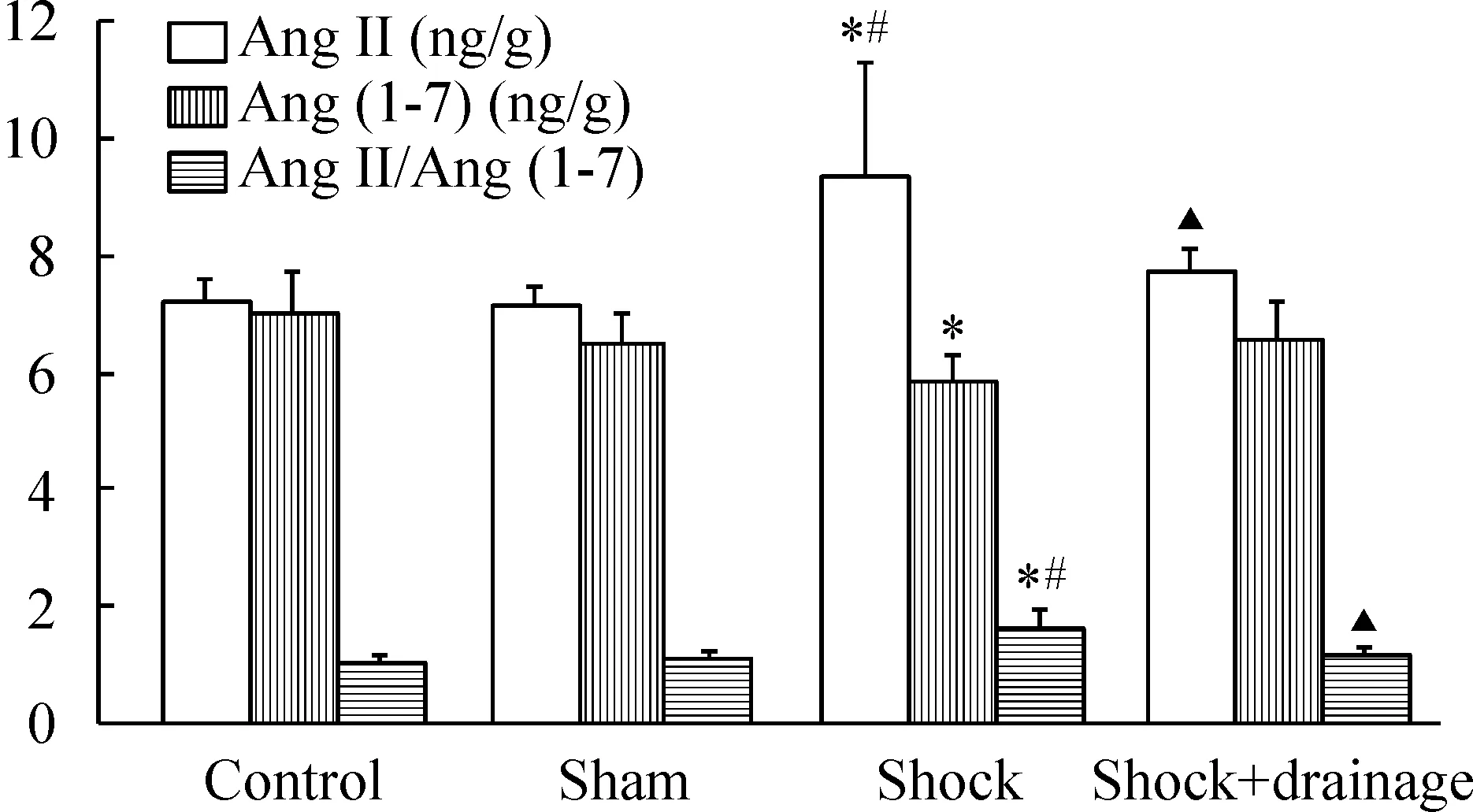
Figure 2.Effects of post-hemorrhagic shock mesenteric lymph drainage on the levels of angiotensin II (Ang II) and Ang(1-7), and the ratio of Ang II/Ang(1-7) in the kidney of the mice following hemorrhagic shock. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vssham group;▲P<0.05vsshock group.
图2肠淋巴液引流对失血性休克小鼠肾组织Ang II和Ang(1-7) mRNA表达以及Ang II/Ang(1-7)比值的影响
3肠淋巴液引流对失血性休克小鼠肾组织AT1R和MasR mRNA表达的作用
与正常对照组与假手术组相比,休克组和休克+引流组小鼠肾组织AT1R mRNA表达显著增高,MasR的mRNA表达显著降低,ATR/MasR比值显著增高(P<0.05);与休克组相比,休克+引流组小鼠肾组织ATR的mRNA表达与AT1R/MasR比值显著降低(P<0.05),MasR的mRNA表达与休克组差异无统计学意义;此外,正常对照组与假手术组小鼠肾组织的AT1R和MasR mRNA表达以及AT1R/MasR比值均无显著差异(P>0.05),见图3。
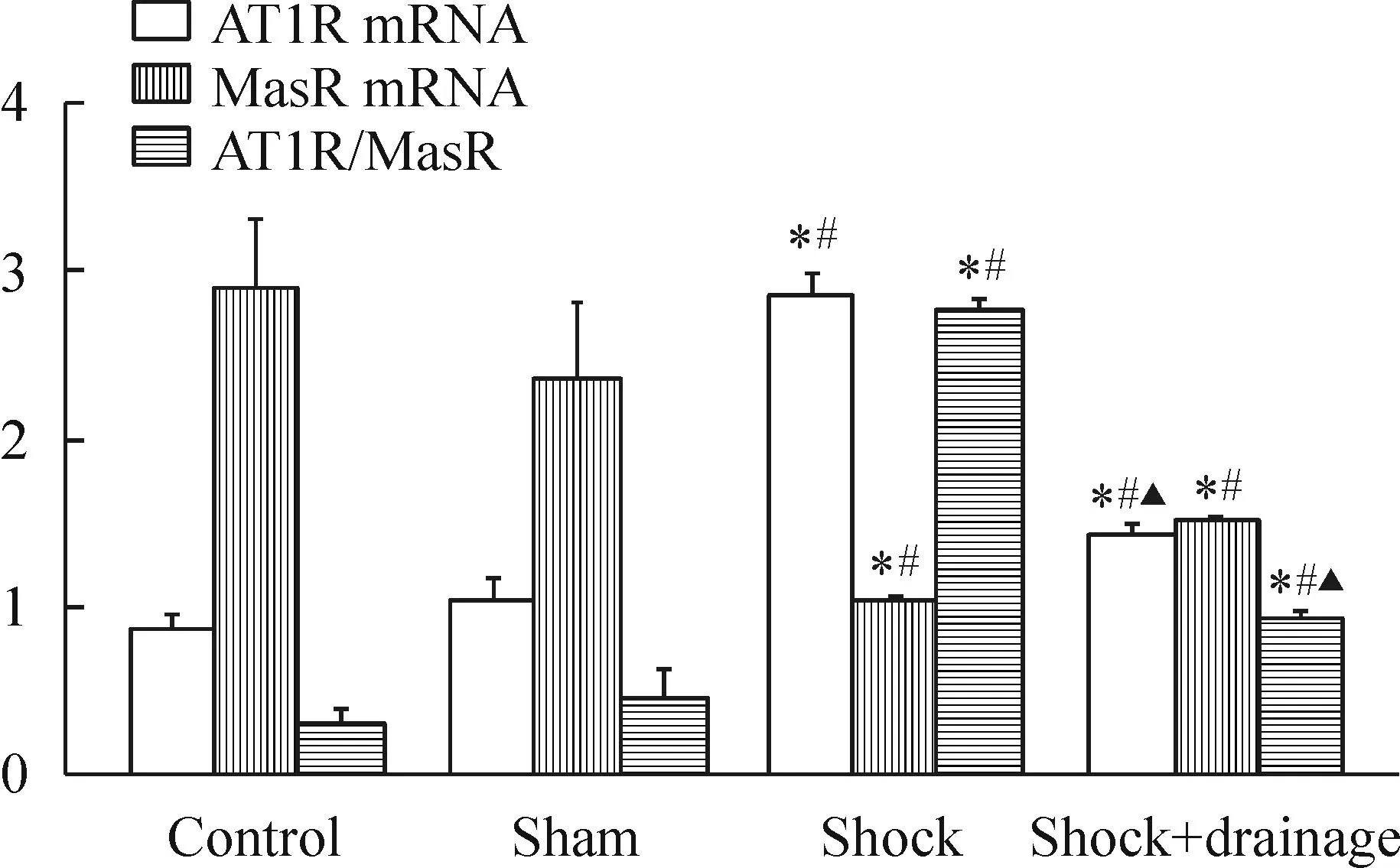
Figure 3.Role of post-hemorrhagic shock mesenteric lymph drainage on the mRNA expressions of angiotensin II type 1 receptor (AT1R) and Mas-related G-protein-coupled receptor (MasR), and the ratio of AT1R/MasR in the kidney of the mice following hemorrhagic shock. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssham group;▲P<0.05vsshock group.
图3肠淋巴液引流对失血性休克小鼠肾组织AT1R和MasR mRNA表达以及ATR/MasR比值的影响
讨论
肾组织是RAS的2个关键酶ACE与ACE2存在的关键位置。最近文献报道,ACE与ACE2失衡参与了多种应激状态下AKI的发生[11-12]。本研究在项目组前期发现肠淋巴管结扎或PHSML引流,均可显著减轻失血性休克大鼠AKI的基础上,建立了小鼠失血性休克模型,发现失血性休克上调了肾组织ACE-Ang II-AT1R轴表达,下调了ACE2-Ang(1-7)-MasR轴表达,引起了ACE/ACE2失衡;而这种负性作用部分则被PHSML引流抑制,从而使ACE/ACE2向平衡的方向发展。
ACE是RAS的核心酶,其作用产物Ang II是RAS发挥效应的最重要组成部分;失血性休克后,受急性失血的影响,交感神经兴奋,RAS活化,Ang II分泌增多,通过AT1R,引起腹部器官以及骨骼肌血管收缩,导致血液重新分布,这对于恢复回心血量、保证心脑的血液灌注发挥了重要的作用。但是,长期、持续的RAS系统活化、Ang II过度分泌和AT1R高表达,则会加重局部器官缺血从而出现缺血性坏死,也会引起心脑血管收缩导致缺血性损伤。因此,如何避免ACE-Ang II-AT1R轴的过度上调,对于防治休克具有积极的意义。为此,本研究首先观察了PHSML引流对失血性休克小鼠肾组织ACE-Ang II-AT1R轴的作用。研究发现,休克引起了小鼠肾组织ACE、AT1R的mRNA表达与Ang II水平均显著升高,而PHSML引流显著降低了休克组小鼠肾组织的AT1R mRNA表达水平,对ACE mRNA表达以及Ang II水平也有降低的作用。这说明过度活化的ACE-Ang II-AT1R与失血性休克后肾组织缺血及其带来的AKI有关,该实验结果与止血带休克、肾缺血再灌注后引起的AKI是相一致的[5-6, 11];考虑到AT1R是Ang II发挥作用的关键受体,故可以认为PHSML引流减轻AKI的作用是通过抑制ACE-Ang II-AT1R过度活化实现的,从PHSML引流降低ACE/ACE2、Ang II/Ang(1-7)和ATR/MasR比值的作用也能进一步体现出来。已有的实验观察发现,PHSML中含有高浓度的毒素,经肠淋巴途径回流至全身后引起炎症反应与器官损伤[13],结合内毒素休克后大鼠肾组织ACE和AngⅡ表达增高的事实[14],故推测PHSML引流降低肾组织ACE表达的机制可能与经PHSML回流至全身的毒素减少引起对机体的不良刺激减轻有关,但具体机制还需要进一步研究。
ACE2是RAS的一个新成员,是ACE的同源物,但却抑制ACE活性,具有与ACE相反的作用。ACE2通过催化Ang II转化成Ang(1-7)、促进Ang (1-7)与其受体MasR结合,从而发挥扩张血管、减少细胞增殖等作用[15-17],对于恢复肾组织的血液灌注具有重要作用[18]。为此,本研究观察了PHSML引流对失血性休克小鼠肾组织ACE2-Ang(1-7)-MasR轴的作用。结果发现,失血性休克显著降低了小鼠肾组织ACE2、MasR mRNA表达与Ang(1-7)含量,出现了与止血带性休克后相似的变化[5-6];说明ACE2-Ang(1-7)-MasR轴受抑制参与了休克后AKI的发生;其机制可能为,通过降低Ang(1-7)含量,下调血管舒张功能,从而加重肾缺血,引起缺血性损伤。更为重要的是,本研究也发现,PHSML引流提高了休克小鼠肾组织ACE2表达以及Ang (1-7)含量,说明PHSML引流减轻AKI的作用可能是通过增加ACE2-Ang(1-7)-MasR轴的活性来实现的,但这种作用的长期效果如何,有待进一步研究。
一般来说,生理条件下,RAS的2条关键轴ACE-Ang II-AT1R和ACE2-Ang(1-7)-MasR是平衡的,二者的平衡决定了血管的舒缩状态与血液的灌注状态,从而影响预后[19-20]。为此,本研究中观察了PHSML引流对小鼠肾组织ACE/ACE2、Ang II/Ang(1-7)和 AT1R/MasR比值的影响,以了解二者的平衡状态。结果发现,休克组小鼠肾组织ACE/ACE2、Ang II/Ang(1-7)和ATR/MasR比值均显著增加;PHSML引流显著降低了这些比值,使之恢复或接近平衡状态。尤其是,PHSML引流尽管只是出现了增加MasR表达的趋势,却使AT1R/MasR比值下调,更进一步表明了失血性休克引起AKI的机制与ACE和ACE2轴失衡有关,减少PHSML回流有利于恢复二者平衡。同时,也应该看到,PHSML引流组小鼠肾组织的ACE和AT1R mRNA表达仍高于、ACE2和MasR mRNA表达仍低于对照组和假手术组,说明引起肾ACE-Ang II-AT1R上调、ACE2-Ang(1-7)-MasR下调的因素除了PHSML回流的作用外,还有其它因素参与。
此外,尽管在实验过程中,尽量减少了手术创伤对小鼠的影响,但在研究中也观察到了一个现象,行假手术的小鼠肾组织ACE2 mRNA表达较对照组显著降低,这可能是由于手术创伤引起的;也说明ACE2可能较其它指标更为敏感,这需要在将来进一步探讨。应当指出,本研究采用小鼠这一小型动物作为观察对象,故股部、腹部手术均在手术显微镜下操作;由于小鼠的股动脉、股静脉毗邻很近,钝性分离二者容易造成某一血管的破裂,因此本文的实验中并未实施将动、静脉钝性分离手术,这也是本实验中通过股动脉进行肝素注射抗凝和液体复苏的原因。当然,本实验方法是参考了相关文献[8-10]报道来实施的。应当指出,本文仅从mRNA水平观察了肾组织ACE、ACE2、AT1R和MasR的变化,初步显示了ACE与ACE2的平衡状态;今后应进一步从蛋白水平上进行相关的检测分析,将更有利于分析失血性休克后肾组织ACE与ACE2的平衡情况以及PHSML引流的作用。
总之,失血性休克后肾组织ACE-Ang II-AT1R轴上调,ACE2-Ang(1-7)-MasR轴下调;PHSML引流调节了失血性休克小鼠肾组织ACE/ACE2的平衡。研究结果也提示,探讨减少PHSML回流的治疗措施,关注改善ACE/ACE2平衡的治疗手段,有利于防治失血性休克后的AKI。
[参考文献]
[1]Faubel S. Acute kidney injury and multiple organ dysfunction syndrome [J]. Minerva Urol Nefrol, 2009, 61(3): 171-188.
[2]Deitch EA. Gut-origin sepsis: evolution of a concept [J]. Surgeon, 2012, 10(6): 350-356.
[3]赵自刚,牛春雨,张静,等. 肠系膜淋巴管结扎对休克大鼠肾功能不全的干预机制[J]. 中国病理生理杂志, 2008, 24(4):743-748.
[4]Nguyen Dinh Cat A, Touyz RM. A new look at the renin-angiotensin system: focusing on the vascular system [J]. Peptides, 2011, 32(10):2141-2150.
[5]Yang XH, Wang YH, Wang JJ, et al. Role of angiotensin-converting enzyme (ACE and ACE2) imbalance on tourniquet-induced remote kidney injury in a mouse hindlimb ischemia- reperfusion model [J]. Peptides, 2012, 36(1):60-70.
[6]王建军,杨秀红,邓巍,等. 小鼠止血带休克后肾组织ACE/ACE2 表达变化及意义[J]. 中国病理生理杂志, 2011, 27(12):2399-2402.
[7]孙改霞,郭亚雄,杜会博,等. 失血性休克肠淋巴液提高血管通透性的作用[J]. 中国病理生理杂志, 2014, 30(8):1506-1512, 1536.
[8]Li Y, Xiang M, Yuan Y, et al. Hemorrhagic shock augments lung endothelial cell activation: role of temporal alterations of TLR4 and TLR2 [J]. Am J Physiol Regul Integr Comp Physiol, 2009, 297(6):R1670-R1680.
[9]Xiang M, Yin L, Li Y, et al. Hemorrhagic shock activates lung endothelial reduced nicotinamide adenine dinucleotide phosphate (NADPH) oxidase via neutrophil NADPH oxidase[J]. Am J Respir Cell Mol Biol, 2011, 44(3):333-340.
[10]Fan J, Li Y, Vodovotz Y, et al. Hemorrhagic shock-activated neutrophils augment TLR4 signaling-induced TLR2 upregulation in alveolar macrophages: role in hemorrhage-primed lung inflammation[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(4): L738-L746.
[11]Fang F, Liu GC, Zhou X, et al. Loss of ACE2 exacerbates murine renal ischemia-reperfusion injury [J]. PLoS One, 2013, 8(8):e71433.
[12]Ma C, Xin H, Jiang XY, et al. Relationship between renal injury and the antagonistic roles of angiotensin-converting enzyme (ACE) and ACE2 [J]. Genet Mol Res, 2014, 13(2):2333-2342.
[13]牛春雨,侯亚利,赵自刚,等. 肠淋巴途径在失血性休克大鼠肠源性细菌/内毒素移位发病学中的作用[J]. 中国危重病急救医学, 2007, 19(5):266-269
[14]Nitescu N, Grimberg E, Guron G. Low-dose candesartan improves renal blood flow and kidney oxygen tension in rats with endotoxin-induced acute kidney dysfunction [J]. Shock, 2008, 30(2):166-172.
[15]Carroll MA, Kang Y, Chander PN, et al. Zilsartan is associated with increased circulating angiotensin-(1-7) le-vels and reduced renovascular 20-HETE levels[J]. Am J Hypertens, 2015, 28(5):664-671.
[16]Shil PK, Kwon KC, Zhu P, et al. Oral delivery of ACE2/Ang-(1-7) bioencapsulated in plant cells protects against experimental uveitis and autoimmune uveoretinitis [J]. Mol Ther, 2014, 22(12):2069-2082.
[17]Parajuli N, Ramprasath T, Patel VB, et al. Targeting angiotensin-converting enzyme 2 as a new therapeutic target for cardiovascular diseases[J]. Can J Physiol Pharmacol, 2014, 92(7):558-565.
[18]Mizuiri S, Ohashi Y. ACE and ACE2 in kidney disease [J]. World J Nephrol, 2015, 4(1):74-82.
[19]Chappel MC, Ferrario CM. ACE and ACE2: their role to balance the expression of angiotensin II and angiotensin-(1-7) [J]. Kidney Int, 2006, 70(1):8-10.
[20]Ingelfinger JR. ACE2: a new target for prevention of diabetic nephropathy? [J]. J Am Soc Nephrol, 2006, 17(11):2957-2959.
(责任编辑: 陈妙玲, 罗森)

·综述·

