消栓通络有效成分组对SH-SY5Y细胞氧糖剥夺损伤的影响
谢欣梅,赵清辉,赵 艳,陈若芸,庞晓斌*,杜冠华*
(1.河南大学 药物研究所,河南开封 475004;2.青岛市市立医院,山东青岛 266011;3.中国医学科学院&北京协和医学院药物研究所 国家药物筛选中心,北京 100050)
消栓通络有效成分组对SH-SY5Y细胞氧糖剥夺损伤的影响
谢欣梅1,赵清辉1,赵艳2,陈若芸3,庞晓斌1*,杜冠华3*
(1.河南大学 药物研究所,河南开封 475004;2.青岛市市立医院,山东青岛 266011;3.中国医学科学院&北京协和医学院药物研究所 国家药物筛选中心,北京 100050)
摘要:目的研究消栓通络有效成分组(XECG)对SH-SY5Y细胞氧糖剥夺(OGD)损伤的保护作用,并探讨其可能的作用机制。方法体外培养SH-SY5Y细胞,将细胞随机分为正常组、氧糖剥夺模型组和XECG组(1、3、10 mg·L-1),建立体外OGD/R细胞模型。倒置显微镜观察细胞形态;MTT法测定细胞存活率;酶标法试剂盒测定乳酸脱氢酶(LDH)漏出量;Western Blot检测凋亡相关蛋白Bcl-2、Bax蛋白表达的变化。结果与模型组相比,XECG能明显改善OGD/R引起的SH-SY5Y细胞的损伤,提高细胞存活率(P<0.05),减少LDH的释放量(P<0.05),能提高缺糖缺氧神经元Bcl-2/Bax比值。结论XECG对OGD/R引起的SH-SY5Y细胞损伤有保护作用,其机制可能与影响凋亡相关基因Bcl-2、Bax的表达有关。
关键词:XECG;SH-SY5Y;糖氧剥夺;细胞凋亡
中图分类号:R743.3
文献标识码:识码: A
文章编号:号: 1672-7606(2015)01-0013-04
收稿日期:2014-12-19
基金项目:国家自然科学基金资助项目 (81273652)。
作者简介:谢欣梅(1973-),女,内蒙古乌兰浩特人,硕士,讲师,从事药理学与药效学评价的教学与科研工作。
通讯作者:*庞晓斌(1973-),男,河南洛阳人,博士,副教授,从事中药药效物质基础与作用机制研究工作;杜冠华(1956-),男,山东滕州人,研究员,博士生导师,从事药物发现的理论和技术研究工作。
Abstract:ObjectiveTo investigate the effects of the effective components group of Xiaoshuantongluo (XECG) on SH SY5Y cells induced by the oxygen-glucose deprivation and reoxygenation, and to probe into its possible mechanisms. MethodsIn vitro, SH-SY5Y cells were divided into normal group,model group and XECG group(1, 3, 10 mg·L-1). The oxygen-glucose deprivation/reperfusion (OGD/R) model was made. The protective effect of XECG were observed by morphological identification, MTT assay, and LDH release, while the expressions of Bcl-2 and Bax were detected by Western Blot. ResultsCompared with the model group,XECG could relieve the damage of SH SY5Y cells and increase the survival of the cells, lower their LDH level, and increased Bcl-2/Bax ratio. Conclusion XECG can protect SH-SY5Y cells from the injury induced by OGD/R, its mechanism may be related to impact the expression of gene related to cell apoptosis.
Effects of the effective components group of Xiaoshuantongluo on SH-SY5Y Cells Induced by the Oxygen-Glucose Deprivation
XIE Xinmei1, ZHAO Qinghui1, ZHAO Yan2, CHEN Ruoyun3, PANG Xiaobin1*, DU Guanhua3*
(1.PharmaceuticalInstitute,HenanUniversity,Kaifeng,Henan475004,China; 2.QingdaoMunicipalHospital,Qingdao,Shandong266011,China; 3.NationalCentreforPharmaceuticalScreening,InstituteofMaterialMedical,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100050,China)
Key words: XECG; SH-SY5Y cells; oxygen-glucose deprivation; cell apoptosis
脑中风是目前继心血管疾病、肿瘤之后的全球第三大致死疾病,主要致病原因为脑血管阻塞或狭窄导致脑缺血,发病机制与神经细胞凋亡、炎症反应、能量代谢障碍、血—脑屏障损伤等均有关[1,2]。
消栓通络方是临床常用治疗脑中风的传统秘方,由川芎、丹参、黄芪、泽泻、三七等11味中药根据中医药理论配伍而成[3,4]。消栓通络有效成分组 (the effective components group of Xiaoshuantongluo, XECG) 是从消栓通络方中经分离提取获得的多种有效成分组合,具有抑制血栓形成、改善脑血流、抑制血管内皮细胞损伤等功能[5,6]。
为探讨XECG对脑缺血损伤的神经保护作用及其机制,本研究以SH-SY5Y细胞为研究对象,通过建立OGD/R模型模拟卒中的缺血再灌注过程,观察XECG对氧糖剥夺损伤SH-SY5Y细胞的保护作用,并初步探讨其可能的作用机制。
1材料与仪器
1.1 细胞
SH-SY5Y细胞株由军事医学科学院提供。
1.2 药品与试剂
消栓通络有效成分组(XECG)(中国医学科学院药物研究所陈若芸研究员提供);四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)、0.25%的胰蛋白酶购自Sigma公司;DMEM/F12培养基、胎牛血清(FBS)均购自Gibco公司;乳酸脱氢酶(LDH)测定试剂盒购自南京建成生物工程研究所产品;蛋白质提取试剂盒、SABC试剂盒购自武汉博士德公司;Bcl-2、Bax多克隆抗体、辣根过氧化物酶(HRP)标记羊抗兔IgG购自北京中杉试剂公司提供;ECL化学发光试剂购自碧云天生物技术公司。其余试剂为分析纯。
1.3 常用仪器
CO2培养箱(美国 Thermo);倒置显微镜(日本Olympus IX70);酶标仪(美国 Bio-Rad680);超净工作台(上海智城分析仪器制造有限公司)。
2方法
2.1 细胞培养方法
SH-SY5Y细胞用含体积分数为10%胎牛血清的DMEM /F12的培养基在37 ℃,体积分数为5%CO2的培养箱内培养,3 d左右传代换液1次。取对数生长期细胞进行实验。
2.2 实验分组及OGD模型的制备
取以上培养的细胞分为5组,分别是正常组、OGD 模型组、XECG组(1mg·L-1、3mg·L-1、10 mg·L-1)。将对数生长期SH-SY5Y细胞按照1×105个/mL的密度接种于96孔板培养24 h。模型组和XECG各组细胞换为无糖无血清培养基,置37 ℃恒温密闭的缺氧盒内,持续通入95%N2+体积分数为5% CO2培养4 h后取出,换正常培养液置37 ℃、体积分数为5% CO2培养箱内培养24 h。正常对照组不作OGD处理。
2.3 光镜观察细胞形态变化
细胞经OGD/R处理后,于倒置相差显微镜下观察各组细胞的形态。
2.4 MTT法测定细胞存活率
细胞经OGD/R处理后,分别吸弃上清培养液,然后每孔加入5%MTT 20 μL,37 ℃培养4 h后吸弃上清;每孔加入100 μL DMSO,振荡混匀10 min,用酶标仪在490 nm波长处测定OD值(以不加细胞孔调零),得到各组与对照组OD值比值,即为SH-SYSY细胞在不同氧糖剥夺时间细胞存活率。每组实验重复至少3次。
2.5 LDH释放的测定
将1×105个细胞接种于24孔板中,细胞经OGD/R处理后,收集培养液,按LDH试剂盒说明操作,测定LDH含量。
2.6 Western blot法检测Bcl-2、Bax蛋白表达
分别收集各组细胞,加入蛋白裂解液提取总蛋白,测定样品蛋白浓度。分别取50 g蛋白加入上样缓冲液,经SDS-PAGE电泳后,电转膜至PVDF膜,封闭,分别加入Bcl-2、Bax一抗,4 ℃下摇床孵育过夜,TBST洗涤3次,加入二抗溶液孵育2 h 后,ECL法显影、定影,拍照。对胶片进行扫描与拍照,采用图像分析系统进行显影条带灰度值分析。
2.7 统计学方法
3结果
3.1 XECG对OGD/R损伤SH-SY5Y细胞的影响
对照组SH-SY5Y细胞呈锥形,胞体饱满,细胞分布均匀,突起分支较多且形成网络;OGD/R损伤后,细胞皱缩,体积缩小,并从贴壁状态变为悬浮状态;XECG各组可有效改善造模细胞形态,尤其是3mg·L-1、10 mg·L-1剂量组效果显著。见图1。
3.2 XECG对OGD/R损伤SH-SY5Y细胞存活率的影响
实验结果表明,与对照组相比,模型组SH-SY5Y细胞存活率显著下降(P<0.01);与模型组相比,XECG各组细胞的存活率明显提高(P<0.05,P<0.01),差异有统计学意义。见图2。
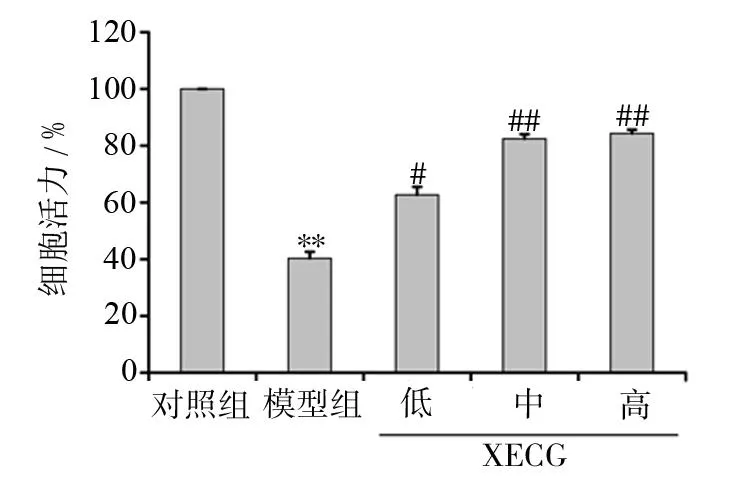
图2 XECG对OGD/R损伤SH-SY5Y存活率的影响(n=6,±s)与对照组相比,*P<0.05;与模型组相比,#P<0.05
3.3 XECG对SH-SY5Y细胞LDH释放的影响
实验结果表明,与对照组相比,模型组细胞培养液中LDH含量明显升高(P<0.01);XECG能剂量依赖性降低细胞培养液中LDH含量,与模型组相比,显著差异(P<0.01,P<0.05)。见表1。
表1XECG对SH-SY5Y细胞LDH释放的影响

注:与对照组相比,**P<0.01;与模型组相比,##P<0.01,#P<0.05。
3.4 XECG对SH-SY5Y细胞Bcl-2、Bax蛋白表达的影响
与对照组比较,模型组Bcl-2、Bax蛋白表达均增加,细胞Bcl-2/Bax显著降低(P<0.05);与模型组相比,XECG各剂量组可见Bcl-2蛋白表达增加,Bax蛋白表达减少,Bcl-2/Bax增加(P<0.05,P<0.01),差异有统计学意义。见图3。

图3 XECG对SH-SY5Y细胞Bcl-2、Bax蛋白表达的影响与正常组相比,*P<0.05;与模型组相比,##P<0.01,#P<0.05
4讨论
临床上脑卒中(脑缺血)病死率高,由于缺血性脑血管病发病机理复杂,并且存在动物的个体差异以及手术过程中的操作等干扰因素,因此通过稳定的细胞模型对机制进行研究具有许多优点[7,8]。神经细胞的氧糖剥夺模型(oxygen-glucose deprivasion/reperfution,OGD/R)近年来多被用于在细胞水平模拟临床脑卒中过程进行细胞自主修复及药物研究[9,10]。来源于人神经母细胞瘤的SH-SY5Y细胞,分化程度较低,形态呈锥形且具有明显轴突,某些生理功能亦与正常神经元相似,被广泛应用于神经系统疾病发病和药物作用机制方面的研究[11-13]。
XECG是从消栓通络方中分离获得的多种有效成分组合制剂。研究表明,XECG对血管系统和神经细胞具有保护作用[5,6,14]。我们采用培养的SH-SY5Y细胞,建立OGD/R模型,通过对损伤细胞形态、细胞存活率、乳酸脱氢酶(LDH)漏出量的观察和检测,评价XECG对氧糖剥夺SH-SY5Y细胞损伤的保护作用。结果显示,XECG可明显改善受损细胞的形态,提高受损细胞存活率,减少LDH释放量,差异有统计学意义。说明XECG对OGD/R损伤细胞具有明显保护作用。
细胞凋亡是脑缺血再灌注损伤的重要机制之一。在凋亡过程中,Bcl-2家族是线粒体引发的Caspase激活通路的主要调节者,Bax与Bcl-2是目前凋亡调控中研究较多的Bcl-2家族成员[15,16]。Bcl-2、Bax是细胞内一对与凋亡密切相关的基因,Bcl-2为抑制细胞凋亡的基因,而Bax为促进细胞凋亡的基因,二者互相拮抗,两者的比率将决定细胞的存亡。本实验结果显示,OGD损伤后,SH-SY5Y细胞内Bcl-2/Bax比值显著降低,XECG可提高Bcl-2蛋白的表达,抑制Bax蛋白表达的增加,提高Bcl-2/Bax比例。以上结果提示,XECG可能通过上调抗凋亡基因Bcl-2及降低促凋亡基因Bax的表达,提高Bcl-2/Bax,发挥对缺氧细胞的保护作用。
综上所述,XECG对OGD/R损伤的SH-SY5Y细胞具有明显的保护作用,其机制可能通过上调Bcl-2表达,提高Bcl-2/Bax比值,对抗细胞的凋亡过程而发挥对缺氧损伤细胞的保护作用。XECG作用的具体靶点还需进一步确定。
参考文献:
[1] Kong Q X, Wu Z Y, Chu X, et al. Study on the anti-cerebral ischemia effect of borneol and its mechanism[J]. Afr J Tradit Complement Altern Med, 2014,11(1):161-164.
[2] Liu P, Liu X, Akf L E, et al. The Neuroprotective Mechanism of Erythropoietin-TAT Fusion Protein Against Neurodegeneration from Ischemic Brain Injury[J]. CNS Neurol Disord Drug Targets, 2013.
[3] 赵艳,刘敏,杨钊,等. UPLC-MS/MS法同时测定消栓通络方中18种成分的含量[J].Journal of Chinese Pharmaceutical Sciences, 2014,4(1):51.
[4] 叶晓萍,骆小伟,吴仲夏,等.消栓通络片中主要药效成分的质量控制[J].郑州大学学报:理学版,2009(04):89-92.
[5] 谭初兵,高梅,王洪庆,等.消栓通络方有效成分组的筛选研究[J].中药药理与临床,2011(01):75-78.
[6] 张冉,戴瑛,程新锐,等.消栓通络方有效成分组抗血栓作用及其机制研究[J].中成药,2006(10):1 479-1 481.
[7] 谢欣梅,庞晓斌,赵艳,等. 消栓通络有效成分组对氧糖剥夺损伤原代培养神经元的保护作用[J].药学学报,2014(8):1 130-1 135.
[8] Ebert A D, Kodo K, Liang P, et al. Characterization of the molecular mechanisms underlying increased ischemic damage in the aldehyde dehydrogenase 2 genetic polymorphism using a human induced pluripotent stem cell model system [J].Sci Transl Med, 2014,6(255):130r-255r.
[9] Bleilevens C, Roehl A B, Goetzenich A, et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model[J]. Exp Brain Res, 2013,224(2):155-164.
[10] Lin Y, Zhang J C, Fu J, et al. Hyperforin attenuates brain damage induced by transient middle cerebral artery occlusion (MCAO) in rats via inhibition of TRPC6 channels degradation[J]. J Cereb Blood Flow Metab, 2013,33(2):253-262.
[11] Merrill R A, Ahrens J M, Kaiser M E, et al. All-trans retinoic acid-responsive genes identified in the human SH-SY5Y neuroblastoma cell line and their regulated expression in the nervous system of early embryos[J]. Biol Chem, 2004,385(7):605-614.
[12] Zhang H, Gao Y, Zhao F L, et al. Hydrogen Sulfide-Induced Processing of the Amyloid Precursor Protein in SH-SY5Y Human Neuroblastoma Cells Involves the PI3-K/Akt Signaling Pathway[J]. Cell Mol Neurobiol, 2014.
[13] Xie B, Lin F, Peng L, et al. Methylglyoxal increased dopamine level and led to oxidative stress in SH-SY5Y cells[J]. Acta Biochim Biophys Sin (Shanghai), 2014.
[14] 赵艳,于昕,时丽丽,等.消栓通络方有效成分组对大鼠急性血瘀模型的影响[J].药学学报,2012,59(5):604-608.
[15] Yao K, Zhu H X, Zhang R, et al. Effects of TIEG1 on K562 Cell Apoptosis and Expression of BCL-2/BAX, PTEN[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2014,22(5):1 278-1 281.
[16] Zeren T, Inan S, Vatansever H S, et al. Significance of apoptosis related proteins on malignant transformation of ovarian tumors: A comparison between Bcl-2/Bax ratio and p53 immunoreactivity[J]. Acta Histochem, 2014.
[责任编辑段金卯]

