清脉饮含药血清对体外TNF-α损伤EAhy-926细胞的影响
康浩浩1魏 齐1魏彦宁1张伟芳2赵 凯3*1.宁夏医科大学,宁夏 银川 750004; 2.宁夏医科大学附属回医医院,宁夏 吴忠 751100;3.宁夏医科大学总医院中医科,宁夏 银川 750004
清脉饮含药血清对体外TNF-α损伤EAhy-926细胞的影响
康浩浩1魏齐1魏彦宁1张伟芳2赵凯3*
1.宁夏医科大学,宁夏银川750004; 2.宁夏医科大学附属回医医院,宁夏吴忠751100;
3.宁夏医科大学总医院中医科,宁夏银川750004
【摘要】目的:研究清脉饮含药血清对肿瘤坏死因子α(TNF-α)诱导的人脐静脉内皮细胞(Ehay926)的影响.方法:制备含药血清;将体外培养的EAhy-926细胞,随机分为正常对照组、清法组、活血组、全方组、软坚组、西药组、TNF-α损伤组等;清脉饮含药血清与TNF-α共同处理血管内皮细胞24h后,光学显微镜(下称光镜)下观察细胞的形态变化,电子显微镜(下称电镜)下观察细胞的细胞器改变.结果:①光镜下细胞大体形态变化:清脉饮含药血清与TNF-α共同处理的细胞,各组损伤均较少,细胞数量多,活血组细胞数量相对较少;②电镜下细胞结构的改变:清脉饮含药血清与TNF-α共同处理的细胞器损害较单纯TNF-α损伤组的细胞小,其中以中剂清法组、软坚组、西药组对细胞器的损伤最少,细胞的超微结构与正常对照组比较没有明显差异.结论:清脉饮含药血清可一定程度上对TNF-α损伤的血管内皮细胞保护作用,减少其对细胞器的损害,且含药血清对细胞的保护作用存在血清浓度差异,其机制可能与抑制TNF-α的促炎作用以减少其对细胞器的损害有关.
【关键词】清脉饮;含药血清; TNF-α; EAhy-926
The influence of qing mai yin ontaining serum on VECs injuried by TNF-α
KANG Hao-hao1,WEI Qi,WEI Yan-ning1,ZHANG Wei-fang2,ZHAO Kai3
1. Ningxia Medical University,Yinchuan 750004,China; 2. Ningxia medical university affiliated to the medical hospital of traditional Chinese medicine,Wuzhong 751100,China; 3. Ningxia medical university general hospital,Yinchuan 750004,China
Abstract:Objective To research the influence of Qing Mai Yin medicated serum on human umbilical vein endothelial cells(EA-hy-926)by tumor necrosis factor alpha(TNF alpha).Methods Preparation of medicated serum; The EAhy-926 cells were incubated in vitro and divided into normal control group,the low dose Qing Fa group,the normal dose Qing Fa group,the high dose Qing Fa group,Huo Xue group,Quan Fang group,Ruan Jian group,medicine group,TNF-α injury group etc.The serum containing medicine and different concentrations of Qing Fa serum containing handle with the TNF-αendothelial cells 24 hours after,morphological changes of EAhy-926 cells were observed under light microscope; cell organelles change of EAhy-926 cells were observed under the electron microscope; Results①The changes in general morphological cells under light microscope compared with TNF-α injury group,the serum containing medicine was significantly increased the cell viability,each group damage less and cell number,cells of Huo Xue group are relatively few;②The changes in the structure cells under electron microscope.The damage compared with TNF-α injury group,the serum containing medicine was significantly pure TNF alpha cells of small injury group.The cell organelles was least damage in Qing Fa group,Ruan Jian group,medicine group and the cell ultrastructure was no significant difference compared with normal control group.Conclusion Qing Mai Yin medicated serum can be a certain level of TNF alpha injury of vascular endothelial cell protection,reduce the damage to the organelles,and serum medicated serum concentration differences of cell protection,its mechanism may be related to inhibition of TNF-α proinflammatory role,reduce the damage to the organelles.
Key words:Qing mai yin; containing serum; TNF-α; EAhy-926
动脉粥样硬化闭塞症(Atherosclerotic Occlusion,ASO)是指动脉粥样硬化(Atherosclerotic,AS)累及周围动脉并引起慢性闭塞的一种AS相关疾病.而AS与高血脂、高血压、糖尿病、吸烟、年龄、遗传的关系已基本确定,近年来证实感染因素亦是诱发原因之一.此类疾病病程较长、病情较重、病人痛苦、难以根治,严重危害着人类的健康.在对有关动脉粥样硬化的发病机制理论研究中,Ross[1-2]早在1974年提出,Ross教授后来又较系统全面地综述了多年文献,以新的论据在损伤反应学说的基础上,明确提出“AS是一种炎症性疾病”,认为内皮损伤,不论物理损伤还是更细微的细胞损害是动脉粥样硬化中一个重要的早期事件.内皮损伤不但是指内皮剥脱,还包括内皮功能变化及内皮功能障碍[3].近年发现内皮功能损害是动脉粥样硬化发病的首要和最早环节,且是导致其不断进展的重要因素[4],所以AS的早期防治和开发新药成为研究的重点.中药治疗AS相关疾病临床疗效显著,并有一定预防作用,有良好的发展前景.目前此类研究多集中在活血化瘀方面,从清法药物对动脉粥样硬化进行研究的较少.因此,本实验拟从中医不同治法含药血清对TNF-α损伤的EAhy-926细胞的影响进行研究,为进一步明确其保护血管内皮的可能机制.
1 材料和方法
1. 1试剂、动物肿瘤坏死因子α(批号: 0607B25,美国PEPRO TECH公司); DMEM(Hyclone批号: NZH1209); PBS(Hyclone批号: NZH1195);胎牛血清(Hyclone批号: NZH1439);胰蛋白酶(Hyclone批号: J140028);二甲基亚飒(Sigma批号: BCBH2085V,美国Sigma公司).SD雄性大鼠60只,体重(250±50)g,普通级,由宁夏医科大学动物中心提供[scxk(宁)2013-0035].
1. 2药物全方(清脉饮):垂盆草、大黄、昆布、煅牡蛎、丹参、蒲黄、姜黄、夏枯草、茵陈、泽泻、海藻等;清法组:大黄、垂盆草、夏枯草、昆布等;软坚组:昆布、煅牡蛎、海藻、夏枯草等;活血组:丹参、蒲黄、姜黄、大黄等;以上中药均由宁夏古方大药房提供,各组方药分别按照传统中药煎煮方法,煎煮、滤液,根据大鼠的体重计算用药量后,浓缩至需要浓度[5],用蒸馏水配制.西药组:辛伐他汀片(批号: 110622,山东罗欣药业股份有限公司)10mg/片.
2 实验方法
2. 1含药血清的制备
2. 1. 1分组及给药方法将56只雄性SD大鼠随机分为八组(即正常对照组、低剂量清法方组、中剂量清法方组、高剂量清法方组、全方组、软坚方组、活血组、辛伐他汀组),每组7只.按体型系数换算法[6]中人鼠等效药量换算方法计算给药剂量,全方组16. 9g/(kg· d),低剂清法方组2. 9g/(kg·d),中剂清法方组5. 99g/(kg·d),高剂清法方组12. 21g/(kg·d),软坚方组2. 61g/(kg·d),活血方组1. 7g/(kg·d)(均为生药量),辛伐他汀组0. 67mg,给大鼠灌胃,同时以等量生理盐水灌饲正常对照组,每日一次.
2. 1. 2动物采血及分离血清每天灌胃2次,连续3d后,当夜禁食不禁水,第4d再给药一次,中药组在末次给药后1. 5~2h,西药组在给药后1h心脏采血;加盖静置2h后,待血液固缩,无菌条件下分离血清,离心(3000r/min,15min);同组混合用0. 22μm的滤器过滤以消除个体差异,再水浴锅灭活(56℃,30min),分装1ml EP管中,-20℃保存备用.
2. 2 TNF-α的溶解及配制①试剂开盖前,将TNF-α冻干粉离心5min,3000~3500r/min;②用无菌水重悬至0. 1~1. 0mg/ml,用移液枪的枪头轻吹几下,即可使细胞因子完全溶解,不可振荡,将重悬液静置于室温下2h以上;③用含10%胎牛血清的DMEM培养液稀释成20ng/ml,分装,-20℃保存备用.
2. 3人脐静脉内皮细胞(EAhy-926)培养细胞由上海市中国科学院细胞库提供,用含有10%胎牛血清的DMEM培养基,同时加入100U/ml青霉素和0. 1mg/ml链霉素,在37℃,体积分数5% CO2的细胞培养箱中培养细胞;待细胞生长至近汇合状态、铺满瓶壁80%以上时,进行传代;将生长良好的人EAhy-926用0. 25%的胰蛋白酶1ml消化1~3min后,轻轻吹打制成细胞悬液,每周传代2~3次;取对数生长期的细胞消化后以1× 105/ml,接种于96孔板中培养,待细胞处于增殖期后分组实验.
2. 4细胞的分组及给药方法取对数生长期的细胞,将其消化,以含10%胎牛血清的DMEM培养液制成细胞悬液以1×105/ml,200μl/孔接种于96孔板或4×105/ml接种于25cm培养瓶中,37℃,5% CO2培养24h,细胞贴壁,近乎融合,吸弃培养液,用含0. 2%胎牛血清的DMEM培养液静止24h,使细胞同步化至G1期,然后随机分为9组:正常对照组; TNF-α组;低剂清法组;中剂清法组;高剂清法组;全方组;软坚组;活血组;西药组.加入TNF-α及各浓度含药血清,37℃,5%CO2,培养育24h,待测.
2. 5实验方法
2. 5. 1光镜观察细胞的大体形态取对数生长期的细胞消化后以1×105/ml制备成细胞悬液,200μl/孔,种于96孔板,待细胞贴壁后,换用含0. 2%胎牛血清的DMEM孵育24h,使细胞同步化,同时加入各浓度不同含药血清及TNF -α(20ng/ml)的混合液,200μl/孔,孵育24h后,光镜下观察细胞的大体形态变化[5].
2. 5. 2电镜观察细胞超微结构
2. 5. 2. 1前固定①取对数生长期的细胞消化后种于25cm2培养瓶中,待细胞贴壁后,换用含0. 2%胎牛血清的DMEM孵育24h,使细胞同步化,同时加入各浓度不同含药血清及TNF-α(20ng/ml)的混合液孵育24h,用0. 25%胰蛋白酶将其消化,离心800r/min,5min,收集细胞;②加入固定液1ml,重悬,4℃静置10 min;③4℃离心800r/min,5min,去上清,尽量除净;④加入固定液1ml,重悬,4℃静置30min;⑤4℃离心r/min,5min,去上清;⑥加入0. 1M二甲砷酸钠缓冲液1ml,重悬,4℃静置1h;⑦4℃离心800r/min,5min,去上清;⑧重复操作步骤⑥两次、⑦一次;⑨4℃保存,每周换一次0. 1M二甲砷酸钠缓冲液.
2. 5. 2. 2后固定①离心800r/min,5 min,去上清;②加入1ml 1%锇酸,轻混匀,4℃静置1h;③离心800r/min,5 min,去上清;④加入1ml 0. 1M二甲砷酸钠缓冲液,混匀,4℃静置15min;⑤离心800r/min,5min,去上清;⑥重复操作步骤④、⑤.
2. 5. 2. 3脱水①依次加入30%、50%、70%冷乙醇,混匀,4℃静置5 min,离心800 r/min,5 min,去上清;②依次加入80%、90%冷乙醇,混匀,室温静置5min,离心800r/min,5min,去上清;③加入100%常温乙醇,混匀,室温静置3min,离心800r/min,5min,去上清;④重复操作步骤③;⑤加入环氧丙烷渗透,室温静置15h,离心800 r/min,5min,去上清;⑥重复操作步骤⑤;⑦1∶1不完全包埋液,室温渗透1h.
2. 5. 2. 4包埋①离心800 r/min,5min,去上清;②将细胞全部转入胶囊中,加入完全包埋液;③离心800 r/min,5min,使细胞沉在胶囊底部;④加上标签,35℃温箱6h; ⑤42℃温箱6h;⑥60℃温箱6h.
2. 5. 2. 4切片观察700及2500倍下观察细胞超微结构的改变.
3 结果
3. 1光镜下细胞大体形态变化正常对照组内皮细胞为单层,数量多,饱满,互不重叠,呈铺石状镶嵌排列,边界清楚; TNF-α损伤组细胞数量少,细胞间隙增宽,细胞收缩,胞膜皱缩,细胞边界不清; TNF-α与含药血清共同处理的细胞,各组损伤均较少,细胞数量多,细胞间隙变窄,形态趋于正常,活血组细胞数量相对较少,见图1~4.

图1 光镜下正常对照组细胞形态(100x)

图2 光镜下清法组细胞形态(100X)
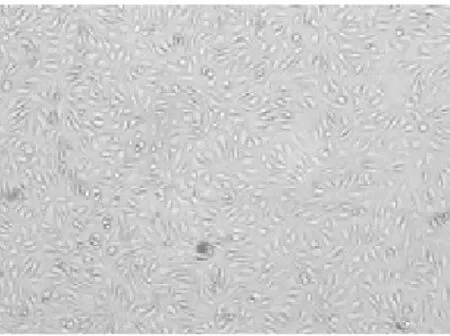
图3 光镜下TNF-α损伤组细胞形态(100X)

图4 光镜下活血组细胞形态(100X)
3. 2电镜下细胞结构的改变①体外正常培养的血管内皮细胞,胞膜完整,连续,双层结构,表面可见微绒毛;细胞核圆形或椭圆形,染色质均匀,无固缩;内质网无扩张,线粒体未见肿胀.②TNF-α损伤组,内皮细胞损伤明显,胞膜破损,不连续,欠完整;核膜双层结构消失,核膜扩张,表面微绒毛减少;细胞核固缩、变形,甚至消失,核内多个核仁,核染色质不均匀、聚集明显;内质网扩张,线粒体肿胀、变性,胞浆内出现大量大小不等的空泡;镜下见大量坏死的细胞碎片及凋亡小体.③TNF-α与含药血清共同处理的内皮细胞,其损害较单纯TNF-α损伤组的细胞小,细胞膜较连续完整;细胞核变形较轻,核染色质较均匀,聚集较少,核仁清晰可见;内质网及线粒体未见明显扩张及肿胀、变性,胞浆内空泡明显缩小或减少;镜下很少见坏死细胞碎片,未见凋亡小体.其中在TNF-α损伤实验同时加入含药血清的全方组、高、中、低剂清法组、软坚组、西药组较损伤组、活血组对细胞器的损伤最少,细胞的超微结构与正常对照组比较没有明显差异(细胞膜较连续完整;细胞核变形较轻,核染色质较均匀,聚集较少,核仁清晰可见;内质网及线粒体未见明显扩张及肿胀、变性,胞浆内空泡明显缩小或减少).活血组对细胞器的损伤较多,细胞的超微结构损伤较大(内皮细胞损伤较明显,胞膜不连续,欠完整;部分核膜双层结构消失,核膜扩张,表面微绒毛减少;部分细胞核固缩、变形,甚至消失,核内多个核仁,核染色质不均匀、聚集明显;内质网扩张,线粒体肿胀、变性,胞浆内出现少量空泡;镜下可见少量坏死的细胞碎片及凋亡小体).10%低剂清法组、10%中剂清法组、10%高剂清法三组细胞的超微结构未见明显差异.见图5~22.
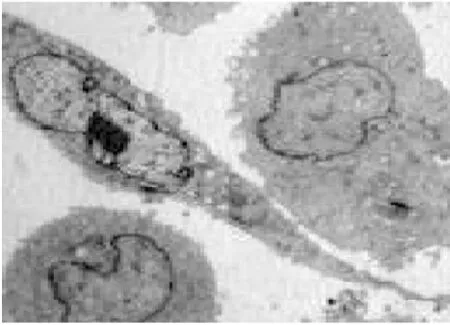
图5 电镜下正常对照组细胞形态(700x)
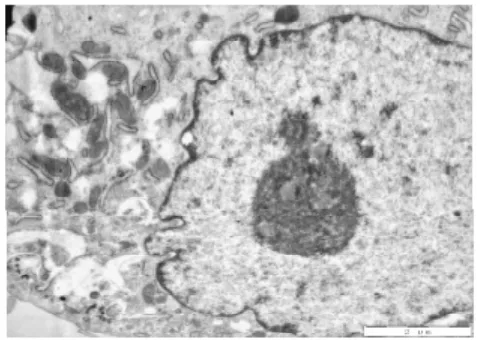
图6 电镜下正常对照组细胞形态(2500x)

图7 电镜下TNF-α损伤组细胞形态(700X)
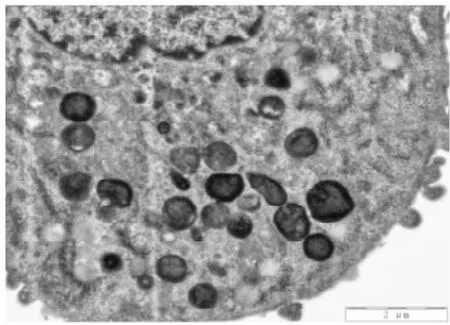
图8 电镜下TNF-α损伤组细胞形态(2500X)
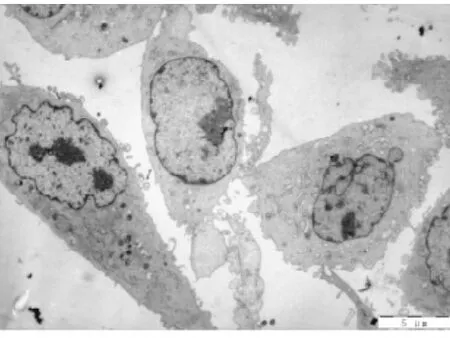
图9 电镜下低清法组细胞形态(700X)
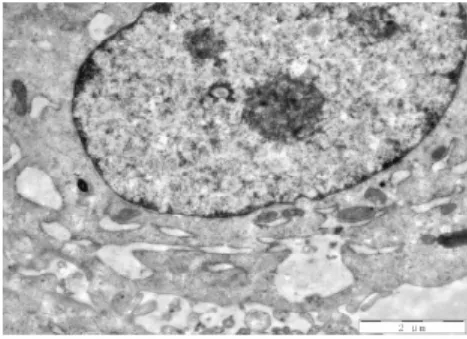
图10 电镜下低清法组细胞形态(2500X)

图11 电镜下中清法组细胞形态(700X)
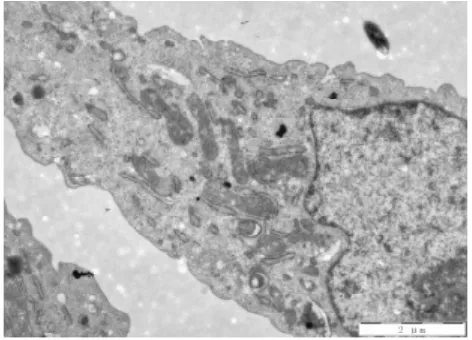
图12 电镜下中清法组细胞形态(2500X)
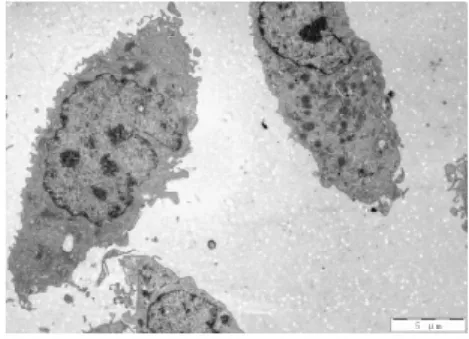
图13 电镜下高清法组细胞形态(700X)

图14 电镜下高清法组细胞形态(2500X)
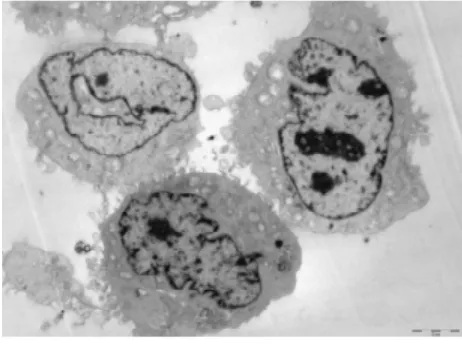
图15 电镜下全方组细胞形态(700X)
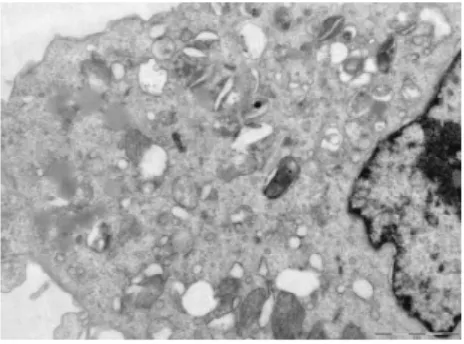
图16 电镜下全方组细胞形态(2500X)
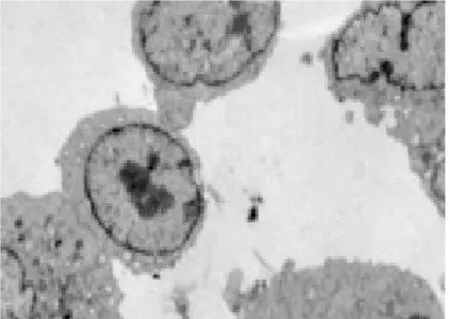
图17 电镜下活血组细胞形态(700X)
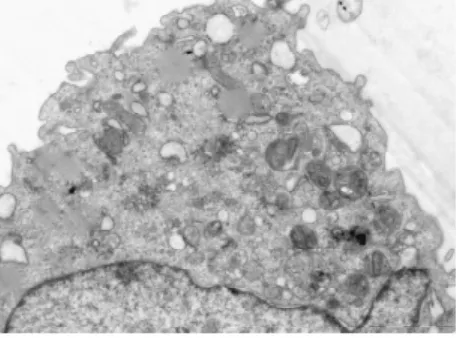
图18 电镜下活血组细胞形态(2500X)
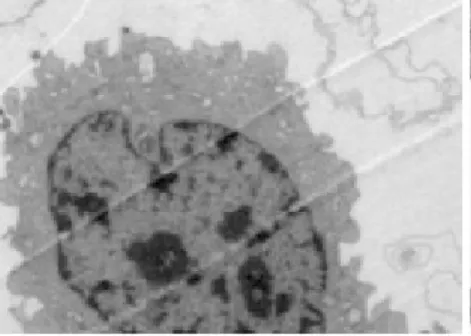
图19 电镜下软坚组细胞形态(700X)
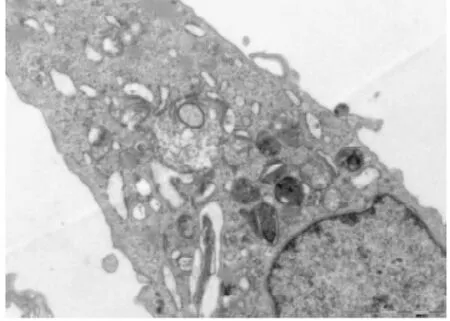
图20 电镜下软坚组细胞形态(2500X)

图21 电镜下西药组细胞形态(700X)

图22 电镜下西药组细胞形态(2500X)
4 讨论
ASO属中医“脉痹”、“脱疽”范畴,多认为是由于饮食不节、脏腑亏虚、外邪侵袭导致湿热痰浊瘀血互结,脉络闭阻而成.传统治疗往往采用活血祛瘀消痰之法,各项研究也较集中在活血化瘀领域,较易忽视痰瘀皆为邪气所致,所谓“虚邪贼风”总是疾病之起因,而邪被认为是导致各种脉管病的致病因子.由全国脉管病泰斗奚九一教授提出的“因邪致瘀”理论,首倡以软坚清法为主治疗ASO,疗效满意[7].赵凯教授在此基础上提出“毒滞脉络”,提出治疗ASO法贵清通[8],临床运用清脉饮治疗动脉硬化相关疾病取得良好疗效.
现代研究表明,在AS的整个发生发展过程中,血管内皮细胞损伤导致的内皮功能障碍不仅是AS的一个始动环节,还是导致其不断进展的重要因素[9].血管内皮细胞(vascular endothelial cell,VEC)是循环血液与血管平滑肌间的机械屏障,也是人体最大、最重要的内分泌器官.血管内皮细胞在各种刺激下产生促炎因子,在促炎因子作用下引起内皮损伤.因此,在预防和治疗动脉粥样硬化过程中,预防内皮细胞损伤的作用研究显得尤为重要.本研究采用体外培养EAhy-926细胞细胞,探讨清脉饮含药血清对TNF-α诱导的EAhy-926细胞超微结构的影响.
TNF-α由活化的巨噬细胞、内皮细胞和平滑肌细胞合成,在细胞因子级联反应中刺激其它细胞因子的合成,并且参与促进黏附分子的表达、炎症细胞的募集和激活,是炎症反应的关键调节因子之一,还可通过影响脂质代谢而促进AS[10-11].当TNF-α诱导血管内皮细胞损伤后,内皮细胞的损伤又促进白细胞介素-1和TNF-α释放,同时TNF-α对血管内皮细胞再次产生细胞毒作用,进一步导致血管内皮细胞的损伤,从而形成恶性循环[12].TNF-α是炎症反应的关键调节因子之一,可从多种炎症细胞中释放,在动脉粥样硬化形成和发展过程中起着关键的作用;可抑制一氧化氮合酶的生成、诱导血管内皮细胞凋亡、促进细胞的老化及刺激血管内皮细胞表达粘附分子,导致内皮细胞功能障碍,促使血栓形成[13-14];并且可以刺激炎症因子的产生,直接发挥促炎作用[13-15].故在动脉粥样硬化发生发展中TNF-α起着关键的作用[3].TNF-α是通过对内皮细胞的损伤,促进动脉粥样硬化的发生.因此,抑制TNF -α对内皮细胞的刺激作用,改善和恢复血管内皮功能已经成为AS防治的重要目标之一.
实验结果显示,光镜下,TNF-α与含药血清共同处理的细胞,各组损伤均较少,细胞数量多,细胞间隙变窄,形态趋于正常,活血组细胞数量相对较少;电镜下,全方组、高、中、低剂清法组、软坚组、西药组较损伤组、活血组对细胞器的损伤最少,细胞的超微结构与正常对照组比较没有明显差异(细胞膜较连续完整;细胞核变形较轻,核染色质较均匀,聚集较少,核仁清晰可见;内质网及线粒体未见明显扩张及肿胀、变性,胞浆内空泡明显缩小或减少),而活血组对细胞器的损伤较多,细胞的超微结构损伤较大(内皮细胞损伤较明显,胞膜不连续,欠完整;部分核膜双层结构消失,核膜扩张,表面微绒毛减少;部分细胞核固缩、变形,甚至消失,核内多个核仁,核染色质不均匀、聚集明显;内质网扩张,线粒体肿胀、变性,胞浆内出现少量空泡;镜下可见少量坏死的细胞碎片及凋亡小体.).低剂清法组、中剂清法组、高剂清法三组细胞的超微结构未见明显差异.证实了中医不同治法含药血清对TNF-α损伤的EAhy-926细胞有一定的保护作用,其机制可能与抑制TNF-α炎症反应有关,其可能是治疗动脉粥样硬化的作用机制之一.
参考文献
[1]Ross R,Glomset F,Kariya B,et al.A platelet dependent serum factor that stimulates the proliferation of arterial smooth muscle cells in vitro[J].Pr Natl Acad Sci USA,1974,71: 1207-1210.
[2]Ross R.Atherosclerosis-an inflammatory disease[J].N Engl J Med,1999,31(1): 115-126.
[3]喻卓,陈鹏,杨桂梅,等.20(R)-人参皂苷Rg3对肿瘤坏死因子-α诱导血管内皮细胞损伤的保护作用[J].岭南心血管病杂志,2011,17(3): 199.
[4]Olkkonen VW,Lehto M.Oxysterols and oxysterol binding proteins: role in lipid metabolism and atherosclerosis[J].Ann Med,2004,36(8): 562 -572.
[5]张伟芳,黄鑫,赵凯.清脉饮及其拆方含药血清对TNF-α损伤的Ealy -926细胞的保护作用[J].宁夏医科大学学报,2013,6(3): 635.
[6]陈奇.中药药理实验方法[M].北京:人民卫生出版社,1994: 206.[7]王健,奚九一,赵兆琳.软坚清脉方对肢体动脉硬化性闭塞主证的临床研究[J].中国中西医结合外科杂志,2004,10(2): 67.
[8]陈凯伟,钱月慧,黄鑫,等,清脉饮及其拆方对动脉粥样硬化闭塞症兔主动脉I-kB及NF-kB mRNA表达的变化的影响[J].宁夏医科大学学报,2014,7(3): 720.
[9]缪薇,朱榆红.动脉粥样硬化发病机制和药物干预的研究现状[J].临床医学,2009,16(3): 401.
[10]居峰,吴剑,吴文宏,等.高甘油三酯血清对人脐静脉内皮细胞的损伤作用[J].实验与研究,2011,8(12): 27.
[11]金惠铭,刘清行,曹翔,等.TNF-α引起的微血管内皮细胞功能障碍及其细胞分子机制[J].微循环学杂志,2000,10(3): 5.
[12]林蓉,刘俊田,甘伟杰.槲皮素TNF-α损伤的血管内皮细胞的保护作用[J].中药材,2004,27(8): 598.
[13]Kleemann R,ZadelaarS,KooistraT.Cytokines and atherosclerosis: a comprehensive review of studies in mice[J].Cardiovasc Res,2008,79(3): 360-376.
[14]Zhang H,Park Y,Wu J,et al.Role of TNF-alpha in vascular dysfunction[J].C lin Sci(Lond),2009,116(3): 2129-2130.
[15]Popa C,NeteaMG,van Riel PL,et al.The role of TNF alpha in chronic inflammatory conditions,intermediarym etabolism and cardiovascular risk[J].J Lipid Res,2007,48(4): 751-762.
收稿日期:( 2014. 12. 10)
通信作者:赵凯(1969-),男(满族),北京人,教授,主任医师,医学博士,硕士研究生导师.主要从事中西医结合临床、教学工作,以及风湿性疾病、周围血管病和内分泌代谢性疾病的临床及基础研究,E-mail: exkl@163. com
作者简介:康浩浩(1988-),男,在读硕士研究生,主要从事风湿性疾病、动脉粥样硬化的研究.
基金项目:国家自然科学基金(81160432).
【文章编号】1007-8517(2015)05-0019-04
【文献标志码】A
【中图分类号】R285. 5

