猪卵泡期中等卵泡发育和闭锁的相关基因表达及激素水平分析
张家庆,高彬文,王献伟,马 强,高 原,任巧玲,白献晓,邢宝松*
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002; 2.河南省畜牧总站 河南 郑州 450008;3.新县畜牧局,河南 新县 465550)
猪卵泡期中等卵泡发育和闭锁的相关基因表达及激素水平分析
张家庆1,高彬文1,王献伟2,马 强1,高 原3,任巧玲1,白献晓1,邢宝松1*
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002; 2.河南省畜牧总站 河南 郑州 450008;3.新县畜牧局,河南 新县 465550)
研究猪卵泡期内有腔卵泡发育和闭锁中颗粒细胞自噬与凋亡、卵泡内调控因子、类固醇激素及相关酶类的变化,为提高排卵前卵泡发育数量提供理论依据。从猪卵泡期卵巢中分离3~5 mm有腔卵泡,根据发育变化分为健康卵泡、早期闭锁和晚期闭锁3类,应用HE染色观察内部形态结构变化,应用酶免法检测卵泡液中雌二醇(E2)和孕酮(P4)的浓度变化,采用Real-time PCR方法检测自噬相关基因(Becline、LC3B、ATG3、ATG5 、ATG7)、凋亡相关基因(Caspase-3、Bim、Bcl-2 和Bax)、类固醇合成酶基因(CYP11A1、3βHSD、CYP17A1、CYP19A3)、激素受体和卵泡内关键调控基因(FSHR、ERα、CART、SMAD4)在不同类型卵泡中的表达变化。结果表明,健康卵泡中颗粒细胞层完整,有少量凋亡细胞,早期和晚期闭锁卵泡中颗粒细胞层分散,且凋亡细胞明显增多。早期和晚期闭锁卵泡中P4/E2显著高于健康卵泡,自噬和凋亡相关基因的表达水平在早期和晚期闭锁的卵泡中显著高于健康卵泡,类固醇合成酶基因CYP11A1和3βHSD的表达量在早期和晚期闭锁卵泡中显著高于健康卵泡,CYP17A1、CYP19A3、FSHR、ERα和SMAD4的表达量在早期和晚期闭锁卵泡中显著低于健康卵泡,而CART的表达量则呈现相反的趋势。由此可见,颗粒细胞自噬和凋亡是卵泡闭锁的主要诱因,而类固醇合成酶基因CYP11A1和3βHSD通过提高卵泡液中孕酮的水平加速了卵泡闭锁的进程。
猪; 有腔卵泡; 卵泡发育; 卵泡闭锁
能繁母猪是猪场生产的基础,其繁殖力的高低对于猪场效益具有至关重要的作用。母猪的排卵数常被视为潜在的产仔数,而排卵数量多少取决于卵泡的初始征集数量和终末闭锁数量。研究表明,小母猪在初生后10 d左右两侧卵巢上约有500万个原始卵泡;而在其能繁时期,至多1 600个卵泡能发育至成熟排卵,其余卵泡均在发育过程中闭锁退化消失[1]。从猪卵泡期开始,约有50个卵泡被征集启动生长,而最后发育至成熟并排卵的数量只有12~20个[2-3]。卵泡闭锁能够发生在卵泡生长和发育的不同时段,但绝大多数卵泡在发育至直径6 mm之前闭锁退化消失[4-5]。卵泡的生长和发育是一个复杂的生物学过程,受到多种因素共同调控,包括类固醇激素、各种代谢酶类、局部生长因子等。前人研究表明,类固醇激素如雌激素(E2)和孕激素(P4)等,在卵泡发育和闭锁过程中具有重要的调控作用[6]。E2能促进卵泡内颗粒细胞增殖,抑制卵泡内颗粒细胞凋亡和促进卵泡成熟排卵;P4 能够促进卵泡内颗粒细胞凋亡和加快卵泡闭锁退化。细胞自噬又称Ⅱ型程序性细胞死亡,最近研究表明,凋亡和自噬共同存在于卵泡发育和闭锁过程中,且两者之间存在交互调控作用[7]。目前,在猪卵泡期有腔卵泡(3~5 mm)发育过程中,卵泡内类固醇激素及合成酶类之间的变化与卵泡内颗粒细胞自噬与凋亡及内部调控因子之间的密切关系迄今鲜见报道。基于此,本研究对不同类型的中等有腔卵泡(健康卵泡、早期闭锁、晚期闭锁)类固醇激素及合成酶变化与颗粒细胞自噬和凋亡及关键调控因子之间的关系进行了分析,以期为提高动物繁殖效率提供理论基础。
1 材料和方法
1.1 试验材料
本试验样品采自新乡市辉县屠宰场,所用卵巢来自10头体质量为120~140 kg的商品母猪。母猪屠宰后立刻取下整个子宫,然后根据卵巢发育变化(卵泡直径大小、黄体发育变化等)选择处于卵泡期内的发育良好的卵巢,放入已加入双抗(含青霉素、链霉素各 500 IU/mL)的37 ℃生理盐水中,保温瓶存放,1~3 h内带回实验室进行后续操作。
1.2 试验方法
1.2.1 卵泡的分离与鉴定 在超净工作台内,使用生理盐水将卵巢清洗2~3次后,置于盛有适量生理盐水的平皿中,用眼科剪刀将卵巢周围多余组织进行清除,然后使用小剪刀或手术刀片沿卵巢纵轴切开,再借助眼科剪刀或注射器针头分离不同大小卵泡。卵泡分离以后,在带有目测微尺的显微镜下挑选边缘整齐且无破损的中等卵泡(3~5 mm)。将卵泡按照形态结构分为以下3种类型:健康卵泡、早期闭锁卵泡和晚期闭锁卵泡[8-10]。
1.2.2 颗粒细胞与卵泡液的收集 为了获得单个卵泡内的颗粒细胞和卵泡液,卵泡分离经初步鉴定后,分别将单个卵泡置于细胞专用分离管中(分离管中上部具有网筛,可用于分离颗粒细胞和卵泡液,同时将卵泡内外膜等组织滞留在网筛之上),使用眼科镊轻轻将卵泡壁撕破,然后低速离心(2 000~3 000 r/min)2 min即可,再将卵泡壁组织去除进行高速离心分离颗粒细胞核卵泡液,分离之后分别将颗粒细胞和卵泡液置于-80 ℃冰箱中保存。
1.2.3 生殖激素的测定 采用武汉伊莱瑞特生物科技有限公司所生产的猪孕酮和雌激素ELISA检测试剂盒,测定前对每个卵泡中分离的卵泡液使用生理盐水进行50倍稀释,然后分别测定单个分离的卵泡液中E2和P4的质量浓度。
1.2.4 RNA提取和Real-time PCR 为获得单个卵泡内颗粒细胞RNA样品,利用凯杰生物技术有限公司的微量RNA提取试剂盒对单个卵泡内的颗粒细胞样品进行RNA的提取。采用宝生物工程有限公司的反转录和定量试剂盒进行反转录和定量PCR操作,具体操作方法按照说明书进行操作。本研究中所用引物序列由上海生工生物技术有限公司合成,引物详细信息见表1。

表1 Real-time PCR所用引物
1.3 数据分析
以GAPDH为内参照,采用2-△△Ct方法计算各目的基因的相对表达量,具体计算方法参照已发表文献[11],采用SPSS 17.0软件one-way ANOVA方法对不同类型卵泡内各基因的mRNA水平及卵泡内激素质量浓度的变化进行差异显著性检验,以平均值±标准差表示,P<0.05为显著性差异。
2 结果与分析
2.1 不同类型猪有腔卵泡形态学观察及其E2和P4质量浓度的变化
不同类型猪有腔卵泡的形态学观察见图1,健康卵泡中颗粒细胞层完整,颗粒细胞之间及与卵泡壁结合紧密,细胞核染色均匀且无脱落现象,存在极少凋亡细胞(图1A)。在早期闭锁卵泡中,颗粒细胞层之间松散,细胞之间及与细胞壁结合有轻微脱落现象,细胞核染色较深且有轻微脱落现象(图1B)。晚期闭锁卵泡中,部分颗粒细胞脱落到泡腔中,细胞核染色较深,核膜皱缩,凋亡现象明显(图1C)。健康卵泡液中E2的水平显著高于早期闭锁和晚期闭锁卵泡(图2A);P4的水平则呈现出相反的趋势(图2B),即健康卵泡液中的P4水平显著低于早期和晚期闭锁卵泡。当卵泡出现早期闭锁时,卵泡液中E2的水平开始下降,而P4的水平开始增加,P4/E2随着有腔卵泡闭锁程度的增加而升高 (图2C)。

A:健康卵泡; B:早期闭锁卵泡; C:晚期闭锁卵泡(500 μm)图1 不同类型猪有腔卵泡HE染色的形态学特征
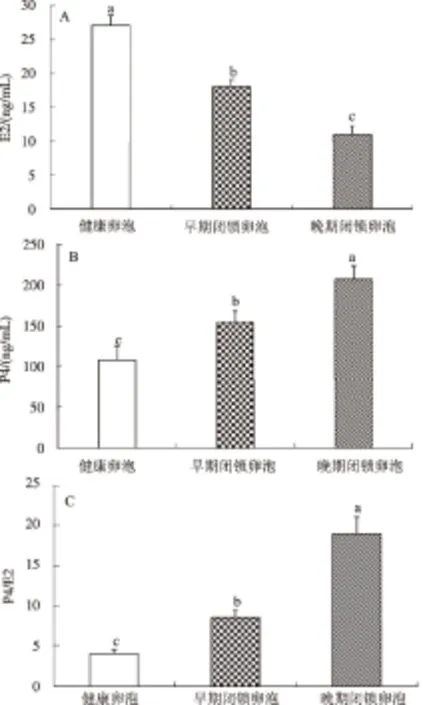
不同字母表示同一指标在不同类型有腔卵泡中差异显著(P<0.05),下同
2.2 不同类型猪有腔卵泡中类固醇激素合成酶和激素受体基因的表达变化
从图3可以看出,与健康卵泡相比,随着卵泡闭锁程度的加深,FSHR和ERα的表达水平在早期闭锁和晚期闭锁卵泡中显著降低;CYP11A1和3βHSD的表达水平在健康卵泡中较低,但随着卵泡闭锁程度的加深,两者的表达水平在早期和晚期闭锁卵泡中均显著升高;CYP17A1和CYP19A3的表达水平在健康卵泡中较高,但随着卵泡闭锁程度的加深,两者的表达水平在早期和晚期闭锁卵泡中均显著下降。
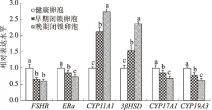
图3 不同类型猪有腔卵泡中类固醇合成酶和
2.3 不同类型猪有腔卵泡中自噬和凋亡相关基因表达变化
由图4可知,自噬相关基因(Becline、LC3B、ATG3、ATG5和ATG7)mRNA的表达水平在健康卵泡中相对较低,但随着卵泡闭锁程度的加深,自噬相关基因的表达水平均显著升高,其中自噬标志性分子LC3B的表达水平在早期和晚期闭锁卵泡中的表达水平高于其他自噬标志分子。从图5可以看出,凋亡相关基因(Caspase-3、Bim)mRNA的表达水平在健康卵泡中相对较低,而在早期和晚期闭锁卵泡中显著升高;而Bcl-2与Bax相对表达量的比值则呈现出相反的趋势。
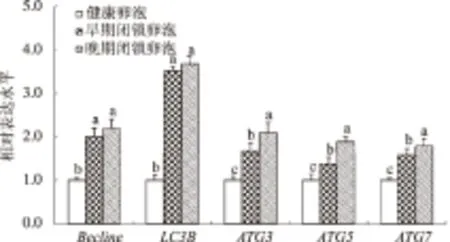
图4 不同类型猪有腔卵泡中自噬相关基因表达水平

图5 不同类型猪有腔卵泡中凋亡相关基因表达水平
2.4 不同类型猪有腔卵泡中SMAD4和CART表达变化
如图6所示,SMAD4 mRNA的表达水平在健康卵泡中较高,而在早期和晚期闭锁的卵泡中表达量显著下降;CARTmRNA的表达水平在健康卵泡中较低,而在早期和晚期闭锁的卵泡中其表达水平显著升高。
3 结论与讨论
卵泡液中E2和P4的质量浓度水平变化能够表明卵泡内颗粒细胞的生理状态,P4/E2与细胞内核酶的活性呈现正相关[12-13]。众多研究表明,利用两者之间的比值能够更加客观地评价卵泡闭锁的程度[14-15]。本研究结果表明,两者之间的比值与自噬及凋亡相关基因的表达水平呈现出相同的趋势,利用两者的比值可在一定程度上评判中等有腔卵泡的闭锁程度。胆固醇是体内各种类固醇激素合成的重要原料,它在体内经胆固醇侧裂酶代谢后可转化为孕烯醇酮,而由胆固醇合成的孕烯醇酮是合成其类固醇激素如雌激素、孕激素等的前体物质。研究表明,类固醇激素在有腔卵泡的生长和闭锁过程中起着核心调控作用[6]。本研究中CYP11A1和3βHSD在健康卵泡中的表达量相对较低,而在早期和晚期闭锁卵泡中呈现显著升高趋势,这与Sanne等[16]的研究结果相一致,他们发现CYP11A1和3βHSD是孕酮合成的主要关键酶类。CYP17A1和CYP19A3在健康卵泡中表达较高,而在早期和晚期闭锁卵泡中呈现下降趋势,这与前人研究结果相吻合。先前研究表明,CYP17A1是合成雄激素的主要酶类,而CYP19A3可利用雄烯二酮或睾酮合成雌激素[17]。此外,FSHR和ERα的表达水平在健康卵泡中较高,而在早期和晚期闭锁卵泡中呈现下降趋势,这也说明了闭锁卵泡中相关激素受体的表达水平与相关酶类的合成水平相一致,共同促使卵泡发生闭锁。
SMAD4是哺乳动物中唯一的一种共介导型Smads蛋白,它在TGF-β超家族信号转导中起非常关键的作用,其缺失会使该信号通路中断,使细胞外界信号信息无法传递[18]。Guéripel等[19]研究表明,促性腺激素主要促使SMAD4表达,进而增强TGF-β/BMP通路的调控作用。Wang等[20]研究发现,干扰内源性SMAD4可降低FSH介导的颗粒细胞增殖和类固醇激素的生成。CART是一种神经肽物质,研究已证实,在一定浓度范围内其能阻止牛卵泡的正常发育,导致卵泡发育迟缓,是诱发卵泡闭锁的一个重要因子[21]。Jones等[22]研究表明,CART能有效抑制牛卵泡颗粒细胞雌激素的分泌。本研究中,SMAD4在健康卵泡中的表达量显著高于早期和晚期闭锁卵泡,而CART在健康卵泡中的表达量则显著低于早期和晚期闭锁卵泡,这些差异说明SMAD4对卵泡的发育有促进作用,而CART对猪有腔卵泡的发育有抑制作用,推测很可能是SMAD4促进了颗粒细胞的增殖和雌激素的分泌,而CART起到相反的作用。
细胞的死亡方式包括凋亡、自噬和坏死3种类型,其中Ⅰ型细胞程序性死亡为凋亡,自噬为Ⅱ型程序性死亡。自噬和凋亡共同参与调控有腔卵泡的发育和闭锁,并且在卵泡中颗粒细胞是发生凋亡和自噬的主要细胞[23]。当前研究发现,与健康卵泡相比,自噬相关基因(Becline、LC3B、ATG3、ATG5、ATG7)在早期和晚期闭锁卵泡中的表达量均显著上升,与此同时凋亡相关基因(Caspase-3和Bim)的表达量在闭锁卵泡中同样呈现出显著上升的趋势,并且Bcl-2/Bax在闭锁卵泡中呈现出显著下降的趋势,自噬和凋亡相关基因的表达量与P4/E2呈现出相同的表达趋势,这些结果表明,在卵泡闭锁过程中生殖激素和自噬及凋亡相关基因共同参与调控早期和晚期卵泡的闭锁。
综上所述,卵泡的闭锁是一个极其复杂的生物学过程,受到动物机体内分泌和卵泡内相关因子的多种调控机制干预。本研究通过分析不同类型卵泡中生殖激素的质量浓度变化、相关激素合成酶的表达水平、自噬与凋亡相关基因的表达量以及卵泡内重要调控基因的表达变化,为提高多胎动物排卵前卵泡发育数量和产仔数量提供了理论依据。
[1] Manabe N,Goto Y,Matsuda-Minehata F,etal.Regulation mechanism of selective atresia in porcine follicles:Regulation of granulosa cell apoptosis during atresia[J].The Journal of Reproduction and Development,2004,50(5):493-514.
[2] Hunter M G,Robinson R S,Mann G E,etal.Endocrine and paracrine control of follicular development and ovulation rate in farm species[J].Animal Reproduction Science,2004,82/83:461-477.
[3] Paradis F,Novak S,Murdoch G K,etal.Temporal regulation ofBMP2,BMP6,BMP15,GDF9,BMPR1A,BMPR1B,BMPR2 andTGFBR1 mRNA expression in the oocyte,granulosa and theca cells of developing preovulatory follicles in the pig[J].Reproduction,2009,138(1):115-129.
[4] Grant S A,Hunter M G,Foxcroft G R.Morphological and biochemical characteristics during ovarian follicular development in the pig[J].Journal of Reproduction and Fertility,1989,86(1):171-183.
[5] Foxcroft G R,Hunter M G.Basic physiology of follicular maturation in the pig[J].Journal of Reproduction and Fertility,1985,33:1-19.
[6] Hsueh A J,Billig H,Tsafriri A.Ovarian follicle atresia:A hormonally controlled apoptotic process[J].Endocrine Reviews,1994,15(6):707-724.
[7] Choi J Y,Jo M W,Lee E Y,etal.The role of autophagy in follicular development and atresia in rat granulosa cells[J].Fertility and Sterility,2010,93(8):2532-2537.
[8] Alonso-Pozos I,Rosales-Torres A M,valos-Rodríguez A,etal.Mechanism of granulosa cell death during follicular atresia depends on follicular size[J].Theriogenology,2003,60(6):1071-1081.
[9] Jolly P D,Smith P R,Heath D A,etal.Morphological evidence of apoptosis and the prevalence of apoptotic versus mitotic cells in the membrana granulosa of ovarian follicles during spontaneous and induced atresia in ewes[J].Biology of Reproduction,1997,56(4):837-846.
[10] Rodgers R J,Irving-Rodgers H F.Morphological classification of bovine ovarian follicles[J].Reproduction,2010,139(2):309-318.
[11] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[12] Guthrie H D,Grimes R W,Cooper B S,etal.Follicular atresia in pigs:Measurement and physiology[J].Journal of Animal Science,1995,73(9):2834-2844.
[13] Manabe N,Imai Y,Ohno H,etal.Apoptosis occurs in granulosa cells but not cumulus cells in the atretic antral follicles in pig ovaries[J].Experientia,1996,52(7):647-651.
[14] Matsui T,Manabe N,Goto Y,etal.Expression and activity of Apaf1 and caspase-9 in granulosa cells during follicular atresia in pig ovaries[J].Reproduction,2003,126(1):113-120.
[15] Nakayama M,Manabe N,Inoue N,etal.Changes in the expression of tumor necrosis factor (TNF) alpha,TNFalpha receptor(TNFR) 2,and TNFR-associated factor 2 in granulosa cells during atresia in pig ovaries[J].Biology of Reproduction,2003,68(2):530-535.
[16] Sanne J L,Krueger K E.Expression of cytochrome P450 side-chain cleavage enzyme and 3 β-hydroxysteroid dehydrogenase in the rat central nervous system:A study by polymerase chain reaction and in situ hybridization[J].Journal of Neurochemistry,1995,65(2):528-536.
[17] Murray A A,Swales A K,Smith R E,etal.Follicular growth and oocyte competence in theinvitrocultured mouse follicle:Effects of gonadotrophins and steroids[J].Molecular Human Reproduction,2008,14(2):75-83.
[18] 王伟.BMP/Smad信号通路对猪卵泡颗粒细胞的影响[D].南京:南京农业大学,2010.
[19] Guéripel X,Benahmed M,Gougeon A.Sequential gonadotropin treatment of immature mice leads to amplification of transforming growth factor β action,via upregulation of receptor-type 1,Smad 2 and 4,and downregulation of Smad 6[J].Biology of Reproduction,2004,70(3):640-648.
[20] Wang W,Chen X,Li X,etal.Interference RNA-based silencing of endogenousSMAD4 in porcine granulosa cells resulted in decreased FSH-mediated granulosa cells proliferation and steroidogenesis[J].Reproduction,2011,141(5):643-651.
[21] Sen A,Bettegowda A,Jimenez-Krassel F,etal.Cocaine- and amphetamine-regulated transcript regulation of follicle-stimulating hormone signal transduction in bovine granulosa cells[J].Endocrinology,2007,148(9):4400-4410.
[22] Jones D C,Kuhar M J.Cocaine-amphetamine-regulated transcript expression in the rat nucleus accumbens is regulated by adenylyl cyclase and the cyclic adenosine 5′-monophosphate/protein kinase a second messenger system[J].The Journal of Pharmacology and Experimental Therapeutics,2006,317(1):454-461.
[23] 吴春丽,郭燕君,徐海琦,等.自噬与哺乳动物卵泡闭锁[J].中国细胞生物学学报,2013(9):1397-1404.
Analysis of Gene Expression and Hormone Levels Related with Medium Follicular Development and Atresia during Pig Follicular Phase
ZHANG Jiaqing1,GAO Binwen1,WANG Xianwei2,MA Qiang1,GAO Yuan3, REN Qiaoling1,BAI Xianxiao1,XING Baosong1*
(1.Institute of Animal Husbandry and Veterinary Science,Henan Academy of Agricultural Sciences, Zhengzhou 450002,China; 2.Henan Provincial Animal Husbandry General Station,Zhengzhou 450008,China; 3.Xinxian Animal Husbandry Bureau,Xinxian 465550,China)
The aim of this study was to analyze the changes of autophagy and apoptosis,intraovarian regulatory factors,steroid hormones and steroidogenic enzymes in antral follicle development and atresia during porcine follicular phase,so as to provide theoretical basis for increasing the preovulatory follicle numbers.Antral follicles about 3—5 mm in diameter were isolated from porcine ovaries in follicular phase and classified as three groups: healthy follicles,early atretic follicles and progressed atretic follicles.HE staining was used to observe the follicular morphological structure,and enzyme-linked immunoabsorbent assay(ELISA)method was applied to examine the changes of estradiol(E2)and progesterone(P4)concentrations in follicular fluid.The relative expression levels of autophagy related genes (Becline,LC3B,ATG3,ATG5 andATG7),apoptosis related genes(Caspase-3,Bim,Bcl-2 andBax),steroidogenic enzyme genes(CYP11A1,3βHSD,CYP17A1 andCYP19A3),hormone receptor and intraovarian regulatory genes(FSHR,ERα,CARTandSMAD4)in different types of follicles were detected by real-time PCR method.The results showed that there were very few apoptotic cells and intact granulosa cell layer in healthy follicles,and the percentage of the apoptotic cells were remarkably increased in atretic follicles,especially in progressed atretic follicles.The ratio of P4 to E2 was significantly decreased in healthy follicles as compared to early atretic follicles and progressed atretic follicles.The relative expression levels of autophagy and apoptosis related genes were increased in early atretic follicles and progressed atretic follicles compared to healthy follicles.The mRNA levels ofCYP11A1 and 3βHSDwere enhanced in early atretic follicles and progressed atretic follicles compared with healthy follicles.The relative expression levels ofFSHRandERαin early atretic follicles and progressed atretic follicles were significantly lower than that of healthy follicles.The mRNA levels ofSMAD4 in healthy follicles were significantly higher than that of early atretic follicles and progressed atretic follicles,and the relative expression levels ofCARTshowed the reverse change trend.Apoptosis and autophagy were the main cause of follicular at resia,whereas steroidogenesis enzyme genes(CYP11A1 and 3βHSD) accelerated atretic progression by increasing progesterone levels.
swine; antral follicles; follicular development; follicular atresia
2016-05-20
河南省科技攻关项目(162102110036)
张家庆(1982-),男,河北沧州人,助理研究员,博士,主要从事猪遗传育种与繁殖研究工作。 E-mail:zjq8650612@163.com
*通讯作者:邢宝松(1969-),男,河南新密人,副研究员,博士,主要从事猪遗传育种研究工作。E-mail:baosong@126.com
S814
A
1004-3268(2016)11-0110-06

