吴茱萸碱诱导人胃癌SGC7901细胞凋亡及机制研究
张 弦金晓滢
吴茱萸碱诱导人胃癌SGC7901细胞凋亡及机制研究
张 弦1金晓滢2
目的观察吴茱萸碱对胃癌SGC7901细胞的抑制作用,探讨其可能的分子机制。方法体外培养人胃癌SGC7901细胞,用不同浓度的吴茱萸碱作用于SGC7901细胞24h。MTT比色法观察吴茱萸碱对SGC7901细胞增殖活性的影响;倒置相差显微镜及荧光电镜观察细胞凋亡状态;流式细胞仪检测SGC7901细胞凋亡情况;用RT-PCR检测不同浓度的吴茱萸碱干预24h后SGC7901细胞Survivin和Caspase-3mRNA表达。结果吴茱萸碱能抑制SGC7901细胞增殖,呈剂量依赖性;倒置相差显微镜及荧光电镜下均观察到典型的细胞凋亡状态;吴茱萸碱可诱导SGC7901细胞凋亡,且随剂量增加作用增强;随吴茱萸碱浓度的增加,细胞内Survivin基因表达强度逐渐降低,Caspase-3表达强度逐渐增强。结论吴茱萸碱能抑制人胃癌SGC7901细胞增殖并诱导其凋亡,SGC7901细胞中Survivin mRNA表达水平显著降低,从而可能下调其对Caspase-3的抑制作用,使细胞凋亡增加。
人胃癌SGC7901细胞;吴茱萸碱;凋亡;Survivin;Caspase-3
吴茱萸碱为芸香科植物吴茱萸近成熟干燥果实,其主要化学成分为挥发油类及生物碱类,其中吴茱萸碱为主要活性物质。近年来,吴茱萸碱的抗肿瘤活性被陆续报道,但作用机制仍有待深入研究。凋亡是在基因调控下的细胞程序化死亡。正常细胞的增殖、分化和凋亡存在一种平衡,故诱导凋亡是肿瘤治疗的一条重要途径。本文采用不同浓度的吴茱萸碱体外干预SGC7901胃癌细胞,观察其对胃癌的抑制增殖及诱导凋亡作用,并对其机制作初步研究。
1 材料与方法
1.1 药品及细胞 吴茱萸碱标准品购自Sigma公司;人胃癌细胞株SGC7901购自中国科学院细胞库。
1.2 试 剂 RPMI-1640培养基购自Gibco公司,噻唑蓝购自Sigma公司;Annexin V-FITC凋亡检测试剂盒购自Becman Coulter公司。
1.3 方 法 将SGC7901细胞株接种于无菌培养瓶中,加入含10%胎牛血清的RPMI-1640培养基中,在37℃、5%CO2,饱和湿度培养箱中培养。细胞单层贴壁培养,每2~4天传代1次。细胞传代时用0.25%胰酶,在37℃条件下消化2~3min,适量培养基吹打成细胞悬液后接种。
1.3.1 MTT法检测不同浓度吴茱萸碱对SGC7901细胞的抑制作用[1]取生长状态好,处于对数生长期的细胞系,常规胰酶消化后培养液吹打成细胞悬液。血球计数板计数后将细胞密度调整为(4~5)×104/mL的细胞悬液。孔板每孔加入细胞悬液100μL,培养液100μL,调零孔加入200μL培养液。细胞贴壁后,实验组加入不同浓度的吴茱萸碱,使其终浓度分别为3μmol/L、6μmol/L、12μmol/L、24μmol/L、48μmol/L,对照组则加等量不含药物的培养液。每个剂量5个平行孔。于24h后取96孔培养板,每孔加入新鲜配制的浓度为5g/L的MTT 20μL。继续培养3h后取出培养板,小心吸弃培养基,每孔加DMSO 150μL,轻轻震荡10min后,用酶联仪于490nm处测出各孔吸光度值,按下式计算细胞抑制率:细胞抑制率=(1-给药孔平均OD值/对照孔平均OD值)×100%。实验重复3次。
1.3.2 细胞凋亡形态学观察
1.3.2.1 倒置相差显微镜下观察形态学变化[2]取对数生长期人胃癌细胞,胰蛋白酶消化后,调整细胞浓度为1.2×104/mL,以每孔2mL细胞悬液接种于6孔板(各孔内预先放置无菌盖玻片1张),十字晃动使细胞分布均匀,置于37℃、5%CO2的培养箱中培养。待细胞进入对数生长期后,弃去旧培养液,各孔加入含 0μmol/L、3μmol/L、6μmol/L、12μmol/L、24μmol/L、48μmol/L吴茱萸碱培养液2mL,置于37℃、5%CO2的培箱中,于24h后倒置相差显微镜下观察形态学变化。
1.3.2.2 荧光电镜下观察形态学变化(Hochest染色)
将1.2×104个细胞接种于6孔板,每孔2mL,过夜,待细胞贴壁,弃去培养基,加入含0μmol/L、3μmol/L、6μmol/L、12μmol/L、24μmol/L、48μmol/L吴茱萸碱培养基,继续培养24h,收集培养基留作备用,0.25%胰酶EDTA消化,加入收集培养基吹打成细胞悬液,1000rpm离心5min,留少许上清重悬沉淀,4%多聚甲醛室温固定5min,PBS离心洗涤2次,每次3min,留少许上清约100μL,加入10μL Hochest染液室温避光染30min,再用PBS洗两遍,滴1滴抗荧光淬灭封片液于载玻片上,盖玻片封片,尽量避免气泡产生。荧光显微镜下观察,拍照。每个样品随机计数500个细胞,计算凋亡细胞百分率。
1.3.3 流式细胞仪检测细胞凋亡 分别消化收集以0μmol/L、3μmol/L、6μmol/L、12μmol/L、24μmol/L、48μmol/L药物处理24h的胃癌细胞。收集细胞后,调整浓度至1×106/mL,3000rpm离心5min,吸弃上清,保留细胞,PBS重悬细胞离心2次,加入预冷的结合缓冲液100μL重悬细胞,置冰浴,加入5μL Annexin V/FITC和10μL PI于细胞悬液中,轻轻混匀,将试管至于室温避光染色15min,补加400μL结合缓冲液混悬细胞,流式细胞仪检测,分析细胞凋亡百分比。
1.3.4 RT-PCR检测凋亡调节基因mRNA表达
1.3.4.1 总RNA抽提 收集细胞于1.5mL Ennerdorf管(无RNA酶、无菌),加入1mL Trizol,充分混匀后,室温静置15min。加200μL氯仿,充分混匀,4℃,15000rpm,离心8min。取上清(约500μL),至1.5mL Eppendorf管(同上),加500μL异丙醇,混匀,4℃,15000rpm,20min。弃上清,用75%乙醇1mL冲洗沉淀,高速离心5min。弃上清,RNA沉淀于空气中干燥(2~3min)。将干燥后的RNA溶解于DEPC处理水中。将总RNA作适当稀释(DEPC水)后,分光光度计测OD260/OD280的比值,并定量。定量公式:RNA浓度(μg/mL)=OD260值×40×稀释倍数(本实验为400倍)。结果显示OD260/OD280比值在1.8~2.0之间,表示RNA无降解。
1.3.4.2 逆转录PCR反应 按下列顺序在1.5mL离心管中加入下列反应物(体积为12.5μL,总RNA体积与DEPC水的总体积是8μL,其中RNA的量是2μg):DEPC水,RNA酶抑制剂(50U/μL)0.5μL,随机引物(50pM/μL)2μL,RNA。在65℃水浴处理5min。室温放置10min,高速(高于5000g)离心5s。按下列顺序加在1.5mL离心管入下列反应物(加入之后总体积为20μL):RNA酶抑制剂(50U/μL)0.5μL,5× buffer(Promega)4μL,dNTP MIX(10mM/each)2μL,DTT 2μL,M-MLV(200U/μL)1μL,水浴37℃下反应1h,90℃处理5~10min,冰浴5min,高速离心5s,所得cDNA作PCR。引物序列由上海捷兰生物技术有限公司设计并合成,序列见表1。PCR反应所加成分(20μL体系):H2O 12.1μL,10pM Primer1 0.2μL,10pM Primer2 0.2μL,20x sybr 0.5μL,2.5mM dNTP 0.4μL,25mM Mg2+2.4μL,10xbuffer 2μL,5u/μL Taq 酶0.2μL,模板2μL。反应条件为:(1)94℃ 2min;(2)94℃ 40s,50~65℃ 40s,72℃ 1min,35个循环;(3)72℃ 5min。经PCR扩增后的产物,1.2%琼脂糖凝胶电泳,在凝胶成像仪上照相并进行密度扫描分析,重复5次。以各PCR产物密度/GADPH来表示各检测指标mRNA的相对含量,进行半定量分析[3-4]。

表1 引物序列及长度
2 结 果
表2 吴茱萸碱对SGC7901细胞生长的抑制率(±s)
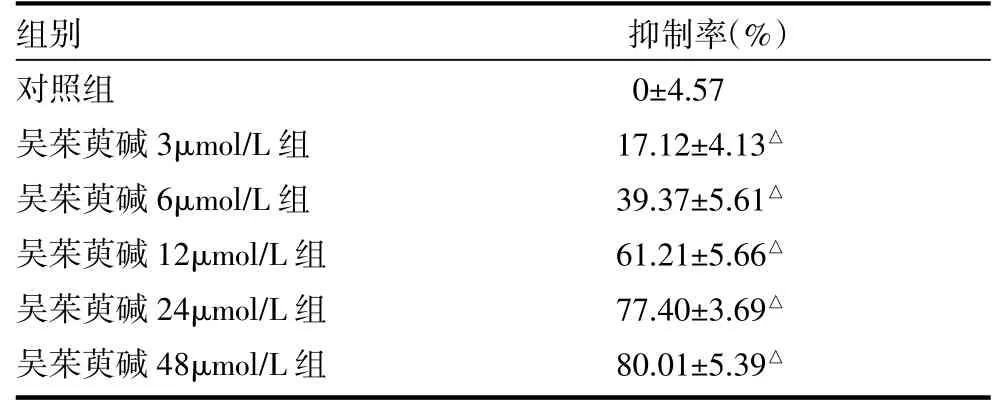
表2 吴茱萸碱对SGC7901细胞生长的抑制率(±s)
注:与对照组比较,△P<0.05
2.1 不同浓度的吴茱萸碱对SGC7901细胞的生长抑制作用 在3~48umol/L浓度范围内,吴茱萸碱作用24h后,对SGC7901细胞的增殖有显著的抑制作用(P<0.05),并且随着吴茱萸碱浓度的增加,对细胞的抑制率也逐渐增加(见表2),可见吴茱萸碱以剂量依赖方式抑制SGC7901细胞生长。
2.2 细胞凋亡形态学观察 相差倒置显微镜观察发现:正常情况下细胞生长良好,形状不规则,呈梭形或多角形,并可融合形成集落,生长有巢状现象,细胞核大,核异型,核质比高,可见异常核分裂相。不同浓度的作用于癌细胞后可见悬浮细胞增多,细胞浆混浊,细胞胞体缩小、变圆、皱缩、核固缩、碎裂,细胞折光性减弱,细胞内出现颗粒样物质,培养液中有较多的细胞碎片(见插页图1)。
荧光显微镜观察发现:不同浓度吴茱萸碱作用24h后,0mmol/L吴茱萸碱作用组染色质分布均匀,呈弥散均匀蓝白色荧光;而随着浓度增加,可见细胞体积缩小,胞质浓缩,胞核固缩,染色质边集,核碎裂,染色质分割成块,细胞核成致密浓染的颗粒状荧光和形成凋亡小体等典型的凋亡细胞形态改变。3、6μmol/L吴茱萸碱作用组部分细胞染色质呈浓染的块状或颗粒状,聚集于核周边或裂解成碎片,并出现凋亡小体;12、24、48μmol/L吴茱萸作用组较多细胞胞内染色质分布不均,形成荧光斑点,呈凋亡特征性(见插页图2)。
2.3 流式细胞仪检测及细胞凋亡率比较 Annexin V-PI双染色法检测显示随着吴茱萸碱浓度的增加,SGC7901细胞的早期凋亡率逐渐增加(见表3,插页图3)。
表3 吴茱萸碱诱导SGC7901细胞凋亡的作用(±s)
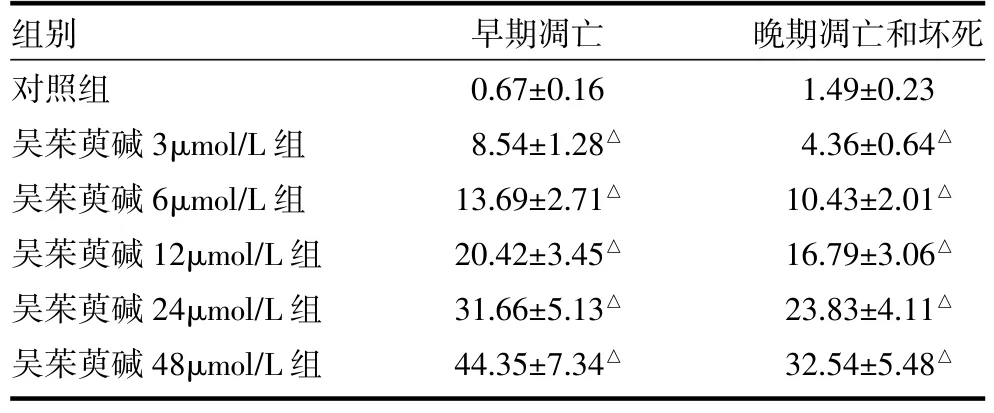
表3 吴茱萸碱诱导SGC7901细胞凋亡的作用(±s)
注:与对照组比较,△P<0.05
组别对照组吴茱萸碱3μmol/L组吴茱萸碱6μmol/L组吴茱萸碱12μmol/L组吴茱萸碱24μmol/L组吴茱萸碱48μmol/L组早期凋亡0.67±0.16 8.54±1.28△13.69±2.71△20.42±3.45△31.66±5.13△44.35±7.34△晚期凋亡和坏死1.49±0.23 4.36±0.64△10.43±2.01△16.79±3.06△23.83±4.11△32.54±5.48△
2.4 吴茱萸碱对胃癌SGC7901细胞Survivin、Caspase-3基因表达的影响 RT-PCR产物电泳后,SGC7901细胞对照组可见明亮的Survivin扩增条带,半定量分析Survivin基因表达强度发现,与对照组比较,吴茱萸碱各组随吴茱萸碱浓度的增加,Survivin基因表达强度逐渐降低(见插页图4)。
与SGC7901细胞对照组caspase-3mRNA表达水平比较,3μmol/L、6μmol/L、12μmol/L、24μmol/L、48μmol/L吴茱萸碱作用24h后,caspase-3 mRNA表达强度逐渐增加(见图5插页)。
3 讨论
本研究观察了从传统中药吴茱萸中得到的天然活性成分吴茱萸碱对SGC7901增殖的影响,实验证明,吴茱萸碱对SGC7901细胞增殖有抑制作用,其抑制作用随着吴茱萸碱浓度的增加而增强,通过倒置相差显微镜及荧光电镜下观察,随着吴茱萸碱浓度增加,可见SGC7901细胞体积缩小,胞质浓缩,胞核固缩,染色质边集,核碎裂,染色质分割成块,细胞核成致密浓染的颗粒状荧光和形成凋亡小体等典型的凋亡细胞形态改变。
Annexin V-PI双染色法检测显示0~48μmol/L处理胃癌细胞后,凋亡及坏死细胞数明显增多,并且有浓度依赖性,而凋亡率变化比坏死更显著,说明在该浓度范围内诱导胃癌细胞凋亡效应要强于引起细胞坏死的作用,证实吴茱萸碱诱导细胞凋亡是杀伤胃癌细胞的作用机制之一。近年发现IAPs在抑制细胞凋亡过程中发挥重要作用,Survivin作为IAP基因家族成员之一,主要表达于细胞有丝分裂周期中S期及G2/M期[5],广泛表达于各种肿瘤组织中,而在正常组织中不表达或低表达,显示其在癌组织中处于失控的表达状态[6],胃癌组织Survivin表达与胃癌凋亡指数呈负相关。本研究结果表明,在胃癌细胞SGC7901中Survivin基因表达明显,随着吴茱萸碱浓度的增加,Survivin mRNA表达逐渐降低,提示吴茱萸碱可能下调Survivin mRNA的表达。caspases是特异水解天冬氨酸羧基侧肽链的半胱胺酸铵蛋白酶,它们在细胞中是一系列静止的酶原,一旦被激活,效应caspases就引起一系列的水解反应,最终导致细胞死亡。目前普遍认为caspase-3是哺乳动物细胞凋亡中的关键蛋白酶,是细胞凋亡两途径线粒体通路和死亡受体通路共同的效应剂,它单独或协同参与水解许多与凋亡有关的蛋白质,它的活化必然引起caspase-3级联反应,引起细胞凋亡[7-8]。本研究结果显示,SGC7901中caspase-3mRNA的表达水平随着吴茱萸碱浓度的增加而逐渐增加。经过吴茱萸碱的诱导作用,SGC7901细胞中Survivin mRNA表达水平显著降低,从而可能下调其对终末效应蛋白caspase-3的直接或间接抑制作用,使细胞凋亡增加。
吴茱萸碱诱导胃癌SGC-7901细胞凋亡,是其对该细胞体外抑制增殖作用的重要分子机制。除促进Survivin表达,下调caspase-3凋亡通路外,还可能还涉及其他的机制,有待进一步研究。本研究中不同浓度吴茱萸碱均作用于SGC7901细胞24h,后续可继续研究不同作用时间与吴茱萸碱抑制作用之间的关系。
[1]王学清,王贺玲,李岩,等.白藜芦醇对胃癌细胞SGC7901增殖与凋亡的影响[J].世界华人消化杂志,2007,15(4):340-345.
[2]孙雪平,李冠武,傅玉才,等.白藜芦醇对人食管癌EC109细胞的生长抑制及诱导凋亡作用[J].癌变.畸变.突变,2007,19(4):272-275.
[3]赵立杰,李岩.小白菊内酯对胃癌BGC823细胞凋亡表型的影响[J].现代肿瘤医学,2009,17(4):621-624.c
[4]杨征,张斌,米磊.白黎芦醇对人口腔鳞癌KB细胞增殖和凋亡的影响及其机制[J].辽宁中医杂志,2011,38(4):740-742.
[5] Carter BZ,Milella M,Altieri DC,et al.Cytokine-regulated expression of Survivin in myeloid leukemia[J].Blood,2001,97(9):2784-2790.
[6]Altieri DC.Survivin,cancer networks and pathway-directed drug discovery[J].Nat Rev Cancer,2008,8(1):61-70.
[7]Xiao BY,Mao SJ,Li XD.Variations in the composition of Fructus Evodiae after processing with Radix Glycyrrhizae extract[J].Chin允Integr Med,2012,18(10):782-787.
[8]Shalini S,Dorstyn L,Dawar S,et al.Old,new and emerging functions of caspases[J].Cell Death Differ,2015,22(4):526-539.
(收稿:2015-08-20 修回:2015-10-10)
Effect of Evodiamine on Apoptosis of Gastric Cancer Cell SGC7901 and the Primary Mechanism
ZHANGXian1,允IN Xiaoying2. 1 Department of Traditional Chinese Medicine,Women's Hospital,Zhejiang University School of Medicine,Hangzhou(310000),China;2 Department of Traditional Chinese Medicine,the Second Afflicted Hospital,Zhejiang University School of Medicine,Hangzhou(310000),China
ObjectiveTo investigate the anti-tumor effect of evodiamine on apoptosis of human gastric cancer cell SGC7901 and to identify the underlying molecular mechanism.MethodsGastric cancer cell SGC7901 were cultured in vitro and treated by evodiamine of 0-48μmol/L concentrations for 24h.Inhibition on the proliferation of SGC7901 cells was assessed by MTT assay.The morphology of SGC7901 cells treated was observed by optical microscope.Gene transcription of survivin and caspase-3 in SGC7901 cells was also examined by RT-PCR.ResultsThe proliferation of SGC7901 cells was inhibited by evodiamine in a dose-dependent manner.Characteristic apoptosis was confirmed by optical microscope,and Hoechst 33258 staining analysis indicated that evodiamine caused typical characteristics of apoptotic programmed cell death.Flow cytometric analysis demonstrated that evodiamine caused a dose-dependent apoptosis of SGC7901 cells.The transcription of survivin gene showed decreasing tendency,and the caspase-3 gene showed increasing tendency when treated by 0-48μmol/L evodiamine for 24 h.ConclusionEvodiamine can inhibit the proliferation of SGC7901 cells and promot its apoptosis.Evodiamine down-regulated survivin mRNA levels and up-regulated the expression of caspase-3,and activated the activities of caspase-3 in the cells and eventually induced apoptosis in SGC7901 cells.
human gastric cancer cell SGC7901;evodiamine;apoptosis;survivin;caspase-3
1浙江大学医学院附属妇产科医院中医科(杭州 310000);2浙江大学医学院附属第二医院中医科(杭州 310000)
张弦,Tel:13958015698
——以吴茱萸为例

