新型GPR40激动剂的合成及其生物活性
黄 晶, 郭 彬, 周先礼
(1. 西南交通大学 生命科学与工程学院,四川 成都 610031; 2. 中国科学院 上海药物研究所,上海 201203)
·研究论文·

通信联系人: 周先礼,教授, E-mail: xxbiochem@163.com
新型GPR40激动剂的合成及其生物活性
黄晶1,2, 郭彬2, 周先礼1*
(1. 西南交通大学 生命科学与工程学院,四川 成都610031; 2. 中国科学院 上海药物研究所,上海201203)
摘要:以丁炔二醇为起始原料,用叔丁基二甲基氯硅烷进行单保护后,与2-(6-羟基-2,3-二氢苯并呋喃)乙酸甲酯经Mitsunobu反应制得2-{6-[4-(叔丁基二甲硅烷氧基)丁-2炔基氧基]-2,3-二氢苯并呋喃}乙酸甲酯(3); 3脱除保护后与苯酚衍生物发生Mitsunobu反应,随后经水解合成了6个结构新颖的苯并二氢呋喃衍生物(7a~7f),其结构经1H NMR,13C NMR和HR-EI-MS表征。GPR40激动活性测试结果表明:7a~7f对GPR40均有激动作用,其中7e和7f激动活性最强,EC50分别为0.593 μmol·L-1和0.596 μmol·L-1。
关键词:丁炔二醇; GRP40激动剂; 苯并二氢呋喃衍生物; 合成; 生物活性
全球二型糖尿病(T2DM)患者的数量正在飞速增长,根据国际糖尿病联合会的统计和分析,T2DM患者的数量预计将从2010年的2.85亿增长到2030年的4.38亿[1]。在中国T2DM患者的数量也已攀升到了0.92亿,而且还有1.5亿的潜在患者[2]。面对如此庞大的患者数量,市场上现有的药物远远不能满足需求,并且早期一些治疗糖尿病的药物(如磺酰脲类)往往还伴随着体重增加和低血糖等副作用[3-4]
GPR40(G protein-coupled receptor 40)是一种具有7个跨膜α螺旋结构的G蛋白偶联受体,主要分布于胰腺β细胞、肠道K和L细胞。它能被游离的中长链脂肪酸激活,促使细胞内钙离子浓度升高,进而促进胰岛素释放[5]。加上其调节胰岛素的分泌是血糖依赖型的,因此低血糖风险很低或没有[6]。
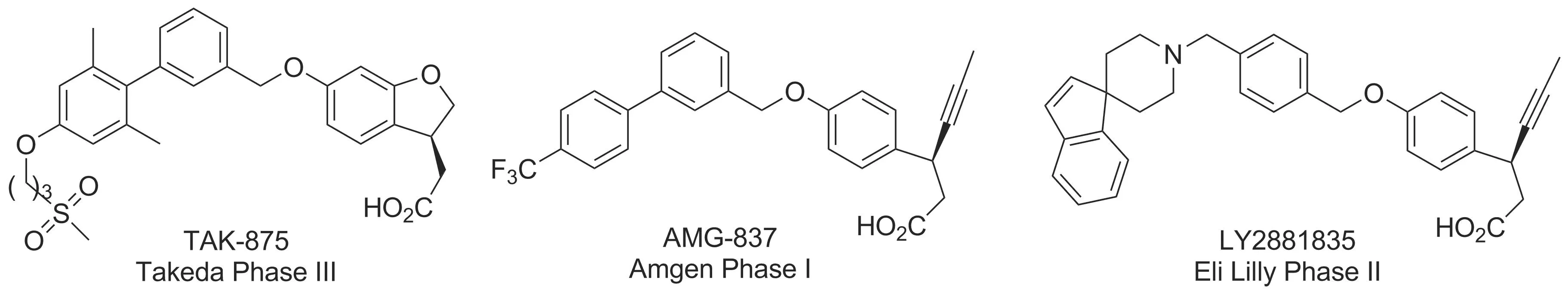
Chart 1

Scheme 1
目前,已有一些GPR40激动剂进入临床研究(Chart 1),其中由日本Takeda公司研发的TAK-875进入到3期临床,但因为潜在的肝毒性于2013年12月终止研究[7]。Amgen公司的AMG-837和Eli Lilly公司的LY2881835也因为安全性问题相继暂停研究[7]。通过对这些化合物分子结构的研究,我们发现它们均含有一个苄氧结构,而有文献报道指出该结构在肝微粒体中会被代谢为苯甲醛或苯甲酸[8-9],这可能正是引发他们安全性问题的原因。
鉴于此,本文拟用氧炔氧替换苄氧结构,以期获得具有高效激动活性且无毒副作用的化合物。以丁炔二醇为起始原料,用叔丁基二甲基氯硅烷进行单保护后,与2-(6-羟基-2,3-二氢苯并呋喃)乙酸甲酯(2)经Mitsunobu反应制得2-{6-[4-(叔丁基二甲硅烷氧基)丁-2炔基氧基]-2,3-二氢苯并呋喃}乙酸甲酯(3); 3脱除保护后与苯酚衍生物(5a~5f)发生Mitsunobu反应,随后经水解反应合成了6个新型的苯并二氢呋喃衍生物(7a~7f, Scheme 1),其结构经1H NMR,13C NMR和HR-EI-MS表征。并测试了其GPR40激动活性。
1实验部分
1.1 仪器与试剂
X-4型显微熔点仪(温度未校正);Bruker AVANCE-400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Thermo-DFS型质谱仪。
参考文献2[10]方法合成;柱层析硅胶,200~300目,青岛海洋化工厂;其余所用试剂均为化学纯或分析纯。
1.2 合成
(1) 1的合成
将2-丁炔-1,4-二醇15.0 g(174 mmol)溶于四氢呋喃150 mL中,搅拌下加入三乙胺48.7 mL,冰浴冷却至5 ℃以下,缓慢滴加叔丁基二甲基氯硅烷(TBSCl)26.2 g(174 mmol)的四氢呋喃(50 mL)溶液,滴毕;撤去冰浴,于室温反应10 h[TLC监测(展开剂:A=PE/EA=5/1,Rf≈0.4)]。加水100 mL稀释,用乙酸乙酯(2×50 mL)萃取,合并萃取液,用饱和食盐水洗涤,无水硫酸钠干燥,蒸除溶剂后经硅胶柱层析(洗脱剂:A=5/1)纯化得黄色油状液体1 14.6 g,收率41%;1H NMR(CDCl3)δ: 4.34(td,J=1.8 Hz, 0.8 Hz, 2H), 4.29(dt,J=2.6 Hz, 1.3 Hz, 2H), 0.90(s, 9H), 0.11(s, 6H); EI-MSm/z: 200[M+]。
(2) 3的合成
在反应瓶中依次加入甲苯100 mL, 1 5.0 g(24.5 mmol), 2 5.4 g(25.7 mmol)和三正丁基膦7.9 g,搅拌5 min,氩气保护,加入偶氮二甲酰二哌啶(ADDP)9.9 g,于室温反应14 h[TLC监测(展开剂:A=5/1)]。依次用水和饱和食盐水洗涤,无水硫酸钠干燥,蒸除溶剂后经硅胶柱层析(洗脱剂:A=10/1)纯化得无色油状液体3 5.15 g,收率53.9%;1H NMR(CDCl3)δ: 7.08(dd,J=8.0 Hz, 0.5 Hz, 1H), 6.54~6.48(m, 2H), 4.84~4.77(m, 1H), 4.72(t,J=1.7 Hz, 2H), 4.40(t,J=1.8 Hz, 2H), 4.32(ddd,J=9.2 Hz, 6.1 Hz, 3.3 Hz, 1H), 3.90~3.81(m, 1H), 3.77(s, 3H), 2.80(dd,J=16.5 Hz, 5.5 Hz, 1H), 2.61(dd,J=16.5 Hz, 9.3 Hz, 1H), 0.94(s, 9H), 0.14(s, 6H); EI-MSm/z: 390[M+]。
(3) 4的合成
将3 5.1 g(13.1 mmol)溶于四氢呋喃80 mL中,冰浴冷却至5 ℃以下,滴加1 mol·L-1TBAF的四氢呋喃(26 mL)溶液,滴毕;于室温反应1 h[TLC监测(展开剂:A=2/1)]。加水80 mL,用乙酸乙酯(2×50 mL)萃取,合并萃取液,用饱和食盐水洗涤,无水硫酸钠干燥,蒸除溶剂得淡棕色固体4 3.5 g,收率97%;1H NMR(CDCl3)δ: 7.09(d,J=7.7 Hz, 1H), 6.53~6.48(m, 2H), 4.81(t,J=9.0 Hz, 1H), 4.72(d,J=1.6 Hz, 2H), 4.35(t,J=1.6 Hz, 2H), 4.32(dd,J=9.2 Hz, 6.1 Hz, 1H), 3.90~3.81(m, 1H), 3.77(s, 3H), 2.80(dd,J=16.5 Hz, 5.5 Hz, 1H), 2.65~2.52(m, 1H); EI-MSm/z: 276[M+]。
(4) 6a~6f的合成通法
在反应瓶中依次加入甲苯10 mL, 4 200 mg(0.72 mmol), 5a~5f 0.94 mmol和三丁基膦233 mg,氩气保护下加入ADDP 291 mg,于室温反应5 h[TLC监测(展开剂:A=5/1)]。蒸除溶剂后经硅胶柱层析(洗脱剂:A=5/1)纯化得无色液体或淡黄色液体6a~6f,收率分别为73%, 85%, 71%, 75%, 80%和88%。
(5) 7a~7f的合成通法
将6a~6f0.5 mmol溶于甲醇10 mL中,加入2 mol·L-1NaOH溶液1 mL,于室温反应4 h[TLC监测(展开剂:A=5/1)]。滴加1 mol·L-1盐酸至pH≈3,加水20 mL,用乙酸乙酯(2×10 mL)萃取,合并萃取液,用饱和食盐水洗涤,无水硫酸钠干燥,蒸除溶剂后经硅胶柱层析(洗脱剂:DCM/MeOH=15/1)纯化得7a~7f。
7a: 白色固体,收率81%, m.p.137~140 ℃;1H NMRδ:12.36(s, 1H), 7.80~7.73(m, 2H), 7.15~7.08(m, 3H), 6.40(dt,J=3.9 Hz, 2.2 Hz, 2H), 4.99(s, 2H), 4.80(s, 2H), 4.70(t,J=9.1 Hz, 1H), 4.20(dd,J=9.0 Hz, 6.9 Hz, 1H), 3.69(ddd,J=15.0 Hz, 8.8 Hz, 6.3 Hz, 1H), 2.71(dd,J=16.6 Hz, 5.5 Hz, 1H), 2.50~2.46(m, 1H);13C NMRδ: 173.08, 160.58, 160.50, 157.92, 134.08(overlap), 124.53, 122.47, 118.97, 115.86(overlap), 106.79, 103.53, 96.72, 83.31, 81.48, 77.16, 55.92, 55.58, 39.04, 37.04; HR-EI-MSm/z: Calcd for C21H17NO5[M+]363.110 1, found 363.110 6。
7b: 白色固体,收率92%, m.p.84~86 ℃;1H NMRδ: 12.37(s, 1H), 7.34(d,J=7.4 Hz, 1H), 7.32~7.27(m, 1H), 7.08(t,J=7.8 Hz, 2H), 7.00(t,J=7.4 Hz, 1H), 6.40(dd,J=6.0 Hz, 2.2 Hz, 2H), 4.94(s, 2H), 4.78(s, 2H), 4.68(t,J=9.0 Hz, 1H), 4.19(dd,J=8.9 Hz, 6.9 Hz, 1H), 3.82(s, 2H), 3.71~3.63(m, 1H), 2.70(dd,J=16.6 Hz, 5.5 Hz, 1H), 2.48(dd,J=7.9 Hz, 6.1 Hz, 2H);13C NMRδ: 173.57, 161.07, 158.43, 155.10, 129.97, 129.72, 125.01, 122.95, 121.87, 120.00, 119.12, 113.12, 107.21, 97.26, 83.29, 82.63, 77.62, 56.53, 56.16, 39.52, 37.50, 18.35; HR-ESI-MSm/z: Calcd for C22H19NO5Na{[M+Na]+}400.115 5, found 400.115 5。
7c: 白色固体,收率86%, m.p.92~95 ℃;1H NMRδ: 12.37(s, 1H), 7.31 (q,J=7.9 Hz, 1H), 7.10(d,J=8.6 Hz, 1H), 6.87~6.75(m, 3H), 6.42(d,J=5.9 Hz, 2H), 4.89(s, 2H), 4.80(s, 2H), 4.70(t,J=9.0 Hz, 1H), 4.20(dd,J=10.0 Hz, 5.1 Hz, 1H), 3.72~3.66(m, 1H), 2.71(dd,J=16.6 Hz, 5.5 Hz, 1H), 2.54~2.50(m, 1H);13C NMRδ: 173.09, 162.83(d,J=242.8 Hz), 160.62, 158.60(d,J=11.1 Hz), 157.97, 130.61(d,J=10.2 Hz), 124.53, 122.48, 111.10, 107.82(d,J=21.0 Hz), 106.70, 102.40(d,J=25.0 Hz), 96.75, 82.83, 81.91, 77.15, 55.87, 55.63, 39.04, 37.04; HR-EI-MSm/z: Calcd for C20H17O5F[M+]356.105 5, found 356.105 6。
7d: 白色固体,收率87%, m.p.59~61 ℃;1H NMRδ: 12.36(s, 1H), 7.29(t,J=8.2 Hz, 2H), 7.11(d,J=8.7 Hz, 1H), 6.74(td,J=8.4 Hz, 2.2 Hz, 2H), 6.64(t,J=2.2 Hz, 1H), 6.61(dd,J=5.2 Hz, 2.6 Hz, 2H), 6.57(dd,J=8.1 Hz, 2.0 Hz, 1H), 6.44~6.40(m, 2H), 4.86(s, 2H), 4.79(s, 2H), 4.70(t,J=9.0 Hz, 1H), 4.20(dd,J=8.9, 7.0 Hz, 1H), 3.74(s, 3H), 3.72~3.65(m, 1H), 2.71(dd,J=16.6 Hz, 5.5 Hz, 1H), 2.48(m, 1H);13C NMRδ: 173.59, 161.16, 161.12, 159.03, 158.51, 158.03, 157.97, 130.95(overlap), 125.06, 122.98, 111.73, 111.13, 110.49, 109.74, 107.18, 106.08, 105.30, 97.25, 83.15, 82.61, 77.66, 56.18, 55.74, 39.54, 37.53; HR-ESI-MSm/z: Calcd for C27H24O7Na{[M+Na]+}483.141 4, found 483.142 2。
7e: 白色固体,收率79%, m.p.115~116 ℃;1H NMRδ: 12.36(s, 1H), 7.86(d,J=8.1 Hz, 2H), 7.79(d,J=8.3 Hz, 2H), 7.42(t,J=7.9 Hz, 1H), 7.36~7.28(m, 2H), 7.09~7.01(m, 2H), 6.40(d,J=6.4 Hz, 2H), 4.97(s, 2H), 4.81(s, 2H), 4.67(t,J=9.1 Hz, 1H), 4.18(dd,J=8.8 Hz, 7.1 Hz, 1H), 3.70~3.61(m, 1H), 2.68(dd,J=16.6 Hz, 5.5 Hz, 1H), 2.49~2.43(m, 1H);13C NMRδ: 173.06, 160.61, 158.00, 157.71, 143.87, 140.04, 130.17, 127.82(overlap), 125.68, 125.65, 125.40, 124.52, 123.23, 122.44, 119.99, 115.01, 113.32, 106.64, 96.75, 82.74, 82.30, 77.13, 55.66, 55.57, 39.74, 37.01; HR-EI-MSm/z: Calcd for C27H21O5F3[M+]482.133 6, found 482.134 0。
7f: 白色固体,收率75%, m.p.109~112 ℃;1H NMRδ: 12.39(s, 1H), 7.37~7.31(m, 1H), 7.12~7.07(m, 1H), 6.94~6.91(m, 1H), 6.72~6.69(m, 2H), 6.68(s, 2H), 6.44~6.38(m, 2H), 4.88(s, 2H), 4.78(s, 2H), 4.70(t,J=9.1 Hz, 1H), 4.20(dd,J=9.0 Hz, 6.9 Hz, 1H), 3.75(s, 3H), 3.69(dt,J=21.4 Hz, 7.6 Hz, 1H), 2.71(dd,J=16.7 Hz, 5.5 Hz, 1H), 2.50(dd,J=16.6 Hz, 9.2 Hz, 1H), 1.96(s, 6H);13C NMRδ: 173.58, 161.08, 158.48, 158.37, 157.63, 142.15, 137.00(overlap), 134.12, 129.92, 125.01, 122.91, 122.73, 116.01, 113.65, 113.00(overlap), 107.07, 97.17, 82.92, 82.86, 77.62, 56.13, 55.82, 55.31, 39.50, 37.49, 21.12(overlap); HR-ESI-MSm/z: Calcd for C29H28O6Na{[M+Na]+}495.177 8, found 495.179 2。
1.3 GPR40激动活性测试
通过建立共转GPR40和Gα16的细胞系,使得GPR40受体被激活后能引起Gα16蛋白的活化,进而激活磷脂酶C(PLC)产生三磷酸肌醇(IP3)和甘油二酯(DAG), IP3可与细胞内内质网和线粒体上的IP3受体结合,从而引起胞内钙的释放。因此,测定胞内钙的变化可以作为检测GPR40活化状态的方法。按文献[11]方法测试:将稳定表达GPR40/Gα16的HEK293细胞种于96孔板,培养过夜。吸去培液,加入新鲜配制的染料40 μL/孔,于37 ℃培养箱内恒温孵育45 min。将染料吸尽弃去,用新鲜配制的钙缓冲液洗一遍,换上50 μL钙缓冲液。用钙缓冲液将待测化合物稀释至10 mmol·L-1并混匀。用Flextation仪检测,第15 s开始由仪器自动加入25 μL预先配制的待测药物,读取525 nm处荧光值,并通过软件GraphPad Prism处理求得化合物对GPR40的EC50值,重复两次实验取平均值。阳性对照为GPR40内源性配体二十二碳六烯酸(DHA)。
2结果与讨论
2.1 GPR40激动活性
7a~7f的GPR40激动活性测试结果见表1。由表1可见,7a~7f对GPR40都有不同程度的激动活性,其中当Ar为单取代苯环(7a~7c)时,激动活性虽然均强于阳性化合物DHA,但仍整体较弱;而当引入单取代的二苯醚基团(7d)时, 活性有了明显的提高,是DHA的五倍多;当Ar基团为单取代或多取代的联苯(7e和7f)时, 活性有了进一步的提升,EC50分别为0.593 μmol·L-1和0.596 μmol·L-1,表明Ar的大小对活性有较大的影响。

表1 7a~7f的GPR40激动活性
3结论
通过引入氧-丁炔-氧基团替换GPR40激动剂中常见的苄氧基团,并对左边的片段进行结构改造,合成了6个结构新颖的苯并二氢呋喃衍生物(7a~7f),从结构上消除了苄氧代谢引起毒副作用的可能,其中7e和7f的活性最强,远高于阳性对照DHA,并且7e和7f的联苯基团上可修饰空间较大,具有进一步研究的价值。
[1]Hu F B. Globalization of Diabetes:The role of diet, lifestyle,and genes[J].Diabetes Care,2011,34(6):1249-1257.
[2]Zhao D, Zhao F, Li Y,etal. Projected and observed diabetes epidemics in China and beyond[J].Current Cardiology Reports,2012,14(1):106-111.
[3]Ahren B. Islet G protein-coupled receptors as potential targets for treatment of type 2 diabetes[J].Nat Rev Drug Discov,2009,8(5):369-385.
[4]Tanaka H, Yoshida S, Minoura H,etal. Novel GPR40 agonist AS2575959 exhibits glucose metabolism improvement and synergistic effect with sitagliptin on insulin and incretin secretion[J].Life Sciences,2014,94(2):115-121.
[5]Mancini A D, Poitout V. The fatty acid receptor FFA1/GPR40 a decade later:How much do we know?[J].Trends in Endocrinology & Metabolism,2003,24(8):398-407.
[6]Edfalk S, Steneberg P, Edlund H. Gpr40 is expressed in enteroendocrine cells and mediates free fatty acid stimulation of incretin secretion[J].Diabetes,2008,57(9):2280-2287.
[7]Defossa E, Wagner M. Recent developments in the discovery of FFA1 receptor agonists as novel oral treatment for type 2 diabetes mellitus[J].Bioorg Med Chem Lett,2014,24(14):2991-3000.
[8]Negoro N, Sasaki S, Mikami S,etal. Optimization of (2,3-dihydro-1-benzofuran-3-yl) acetic acids:Discovery of a non-free fatty acid-like,highly bioavailable G protein-coupled receptor 40/free fatty acid receptor 1 agonist as a glucose-dependent insulinotropic agent[J].Journal of Medicinal Chemistry,2012,55(8):3960-3974.
[9]Takano R, Yoshida M, Inoue M,etal. Discovery of DS-1558:A potent and orally bioavailable GPR40 agonist[J].ACS Medicinal Chemistry Letters,2015,6(3):266-270.
[10]Yamano M, Goto M, Kajiwara T,etal. Production method of optically active dihydrobenzofuran derivatives:WO 2 012 111 849A1[P].2012.
[11]Xu Y, Xie X. Glucagon receptor mediates calcium signaling by coupling to G alpha q/11 and G alpha i/o in HEK293 cells[J].Journal of receptor and signal transduction research,2009,29(6):318-325.
Synthesis and Biological Activities of Novel GPR40 Agonists
HUANG Jing1,2,GUO Bin2,ZHOU Xian-li1*
(1. School of Life Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China;
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China)
Abstract:Methyl 2-{6-[4-(tert-butyldimethylsilyloxy)but-2-ynyloxy]-2,3-dihydrobenzofuran-3-yl}acetate(3) was prepared by protection of 2-butyne-1,4-diol with tert-butyldimethylsilyl chloride, then Mitsunobu reaction with methyl 2-(6-hydroxy-2,3-dihydrobenzofuran-3-yl)acetate. Six novel benzo-dihydrofuran derivatives(7a~7f) were synthesized by deprotection, Mitsunobu reaction with phenol derivatives and hydrolysis from 3. The structures were characterized by1H NMR,13C NMR and HR-EI-MS. The activities of 7a~7f were tested in GPR40-transfected HEK293 cells. The results showed that 7a~7f all exhibited agonistic activities on GPR40, 7e and 7f were the most potent componds, with the EC50of 0.593 μmol·L-1and 0.596 μmol·L-1, respectively.
Keywords:2-butyne-1,4-diol; GPR40 agonist; benzo-dihydrofuran derivative; synthesis; biological activity
中图分类号:O626.5; R914.5
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.01.15057
作者简介:黄晶(1990-),男,汉族,湖南岳阳人,硕士研究生,主要从事药物化学研究。 E-mail: hj0706@163.com
基金项目:国家自然科学基金资助项目(2140222)
收稿日期:2015-02-10;
修订日期:2016-11-03

