(Z)-2-(2-三苯甲基氨基噻唑-4-基)-2-[1,5-二(二苯甲氧基)-4-吡啶酮-2-基甲氧基亚胺]乙酸的合成工艺改进
陶匀亮, 杨玉社, 汪海东,3*
(1.常州大学 石油化工学院,江苏 常州 213164; 2. 中国科学院 上海药物研究所,上海 201203;
3.嘉兴学院 生物与化学工程学院,浙江 嘉兴 314000)

(Z)-2-(2-三苯甲基氨基噻唑-4-基)-2-[1,5-二(二苯甲氧基)-4-吡啶酮-2-基甲氧基亚胺]乙酸的合成工艺改进
陶匀亮1, 杨玉社2, 汪海东1,3*
(1.常州大学 石油化工学院,江苏 常州213164; 2. 中国科学院 上海药物研究所,上海201203;
3.嘉兴学院 生物与化学工程学院,浙江 嘉兴314000)
摘要:以5-羟基-2-羟甲基-4-吡喃酮为原料,经羟基保护、迈克尔加成、亲核取代、Mitsunobu反应、肼解及缩合等反应合成了BAL30072关键中间体——(Z)-2-(2-三苯甲基氨基噻唑-4-基)-2-(1,5-二(二苯甲氧基)-4-吡啶酮-2-基甲氧基亚胺)乙酸, 总收率23%,其结构经1H NMR和MS确证。该合成工艺已放大到公斤级规模。 2. 文稿内容应按如下顺序安排:中文和英文标题、作者姓名与单位、邮政编码、
关键词:曲酸; BAL30072; 革兰氏阴性菌; 中间体; 合成; 工艺改进 (3~8个),正文(图题和表题要求中文和英文对照)、
BAL30072是由巴塞利亚制药公司(Basilea)研发的一种含铁载体的新型单环β-内酰胺抗生素,正处于Ⅰ期临床试验,其独特的抗菌机制使其对多药耐药的鲍曼不动杆菌、大肠杆菌、绿脓杆菌及阴沟杆菌等革兰氏阴性菌均十分有效[1-3]。是目前全球少数几个进入临床研究的具有抗多药耐药革兰氏阴性菌活性的候选药物之一,有望成为
治疗由多药耐药革兰氏阴性菌引起的感染性疾病的一线用药。(Z)-2-(2-三苯甲基氨基噻唑-4-基)-2-[1,5-二(二苯甲氧基)-4-吡啶酮-2-基甲氧基亚胺]乙酸(1)是合成BAL30072的关键中间体,1再经缩合和脱保护即可获得BAL30072[4]。
到目前为止,合成1的路线鲜有报道。2008年Malcolm等[4]以5-羟基-2-羟甲基-4-吡喃酮(2)
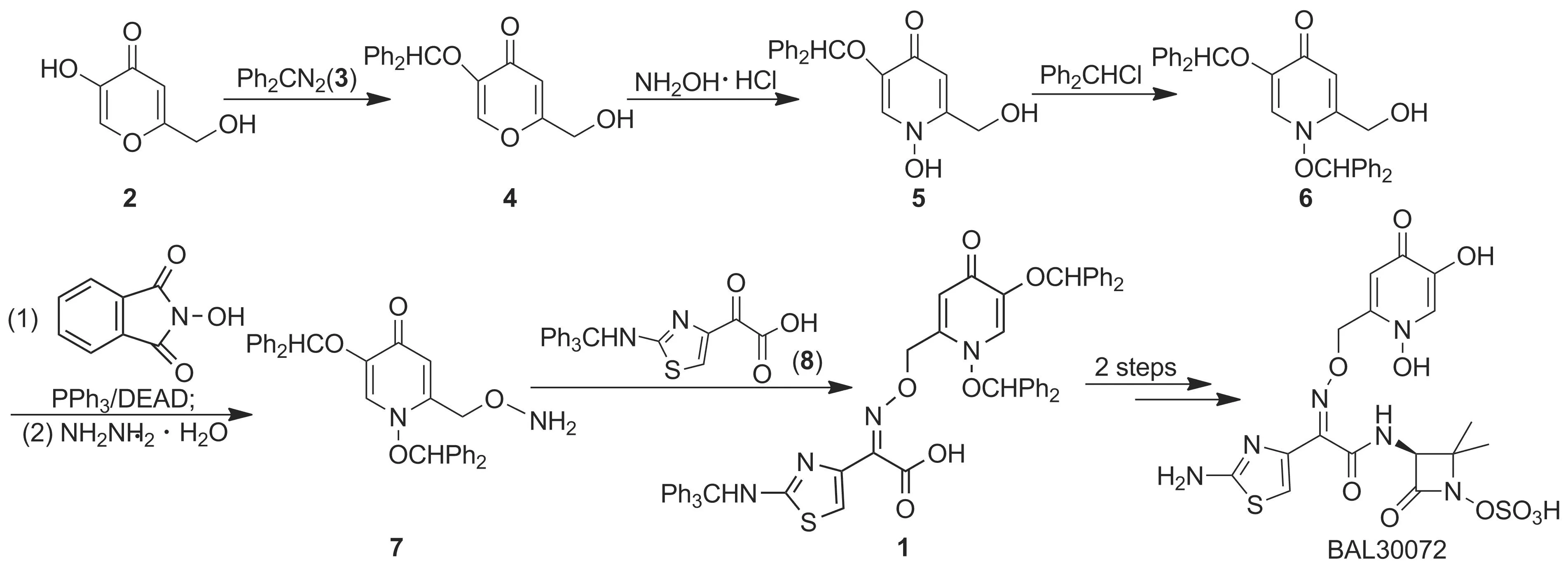
Scheme 1
为起始原料合成1。该合成方法使用高毒性溶剂苯,收率较低,后处理复杂,不利于工业化生产。
为了快速大量制备BAL30072,本文对上述合成路线进行了深入研究和优化。以2为原料,经酚羟基保护、迈克尔加成、亲核取代、Mitsunobu反应及水合肼肼解制得2-氨基氧基甲基-1,5-二(二苯甲氧基)-4-吡啶酮(7); 7与2-三苯甲基氨基噻唑-4-基乙醛酸(8)经缩合反应合成1(Scheme 1),总收率23%,其结构经1H NMR和MS确证。
该方法避免了高毒性溶剂苯的使用,减少了原料用量,简化了后处理操作,总收率从10%提高至23%,适合工业化生产。目前,该合成工艺已放大到公斤级规模。
1实验部分
1.1 试剂与仪器
X-4型数字显微熔点仪(温度未校正);Varian-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Trace DSQ FINNIGSN型质谱仪;Agilent 1100型高效液相色谱仪[色谱柱:LATISIL ODS C18柱(4.6 mm×250 mm, 5 μm);流动相:V(乙腈) ∶V(0.3%三氟乙酸)=(80 ∶20);检测波长210 nm;柱温25 ℃]。
二苯基重氮甲烷(3)[6]和8[7]按文献方法合成;其余所用试剂均为分析纯。
1.2 合成
(1) 5-二苯甲氧基-2-羟甲基-4-吡喃酮(4)的合成
将2 100.0 g(0.7 mol)溶于乙醇(1 L)中,搅拌下加入3 135.0 g(0.7 mol),于40 ℃反应17 h(TLC监测)。冷却至室温,减压浓缩,残余物依次用石油醚和水洗涤,于40 ℃真空干燥得白色固体4 168.4 g,收率77.6%, m.p.126~128 ℃;1H NMRδ: 7.45(s, 1H), 7.41~7.28(m, 10H), 6.48(s, 1H), 6.34 (s, 1H), 4.39(d,J=6.5 Hz, 2H), 2.88(t,J=6.6 Hz, 1H); ESI-MSm/z: 331.0{[M+Na]+}。
(2) 1-羟基-2-羟甲基-5-二苯甲氧基-4-吡啶酮(5)的合成
将4 150.0 g(0.486 mol)加入乙醇600 mL和水600 mL的混合溶液中,搅拌下加入盐酸羟胺236.4 g(3.402 mol)和三水合乙酸钠462.9 g,于60 ℃反应18 h(TLC监测)。冷却至室温,抽滤,滤饼分别用水和乙醇洗涤,于40 ℃真空干燥得白色固体5 69.2 g,收率44%, m.p.222~224 ℃;1H NMR(DMSO-d6)δ: 10.71(s, 1H), 7.97(s, 1H), 7.55~7.23(m, 10H), 6.94(s, 1H), 6.65(s, 1H), 5.49(d,J=6.8 Hz, 1H), 4.39(d,J=3.2 Hz, 2H); ESI-MSm/z: 323.9{[M+H]+}。
(3) 1,5-二(二苯甲氧基)-2-羟甲基-4-吡啶酮(6)的合成
将5 60.0 g(0.186 mol)悬浮于二甲基亚砜600 mL中,搅拌下升温至110 ℃使其溶解,冷却至室温,依次加入碳酸钾38.5 g,碘化钠41.8 g和二苯基氯甲烷51 mL (0.279 mol),于室温反应17 h(TLC监测)。倒入2 L冰水中,析出固体,过滤,滤饼用乙酸乙酯和石油醚混合溶液(V/V=2/1)洗涤,于40 ℃真空干燥得灰白色固体6 90.6 g,收率99.7%, m.p.123~125 ℃;1H NMR (DMSO-d6)δ: 7.60(s, 1H), 7.41~7.22(m, 20H), 6.41(s, 1H), 6.33(s, 1H), 6.02(s, 1H), 5.49(t,J=6.0 Hz, 1H), 4.11(d,J=5.8 Hz, 2H); ESI-MSm/z: 489.9{[M+H]+}。
(4) 7的合成
将6 80.0 g (0.163 mol)溶于二甲基亚砜300 mL和四氢呋喃500 mL中,依次加入N-羟基邻苯二甲酰亚胺32.0 g和三苯基膦64.0 g,冰浴冷却下,缓慢滴加偶氮二甲酸二乙酯(DEAD)38.4 mL,滴毕,于室温反应1 h(TLC监测)。加水200 mL,用乙酸乙酯(4×100 mL)萃取,合并萃取液,分别用饱和碳酸钾溶液(4×100 mL)、水和饱和氯化钠溶液洗涤,无水硫酸钠干燥,减压蒸除乙酸乙酯得油状物A。
将A溶于乙醇500 mL中,加入85%水合肼8 mL (0.163 mol),搅拌下回流(75 ℃)反应2 h(TLC监测)。冷却至室温,减压蒸干,加入二氯甲烷300 mL,搅拌,抽滤,滤液分别用水(3×100 mL)和饱和氯化钠溶液洗涤,无水硫酸钠干燥,减压蒸除溶剂,用二氯甲烷和石油醚重结晶得白色固体7 65.0 g,收率78.8%, m.p.141~143 ℃;1H NMRδ: 7.42~ 7.36(m, 5H), 7.33~7.27(m, 10H), 7.23~7.19(m, 5H), 6.76(s, 1H), 6.38(s, 1H), 6.07(s, 1H), 5.92(s, 1H), 4.32(s, 2H); ESI-MSm/z: 527.0{[M+Na]+}。
(5) 1的合成
将7 60.0 g (0.119 mol)溶于乙醇400 mL和二氯甲烷200 mL中,加入8 49.3 g(0.119 mol),搅拌下于室温反应10 h(TLC监测)。过滤,滤饼用二氯甲烷/石油醚(V/V=1/1)洗涤,于40 ℃真空干燥得白色固体1 91.1 g,收率85%, m.p.162~164 ℃,纯度99.1%;1H NMR(DMSO-d6)δ: 8.84(s, 1H), 7.63 (s, 1H), 7.39~7.20(m, 35H), 6.85(s, 1H), 6.35(s, 1H), 6.32(s, 1H), 5.95(s, 1H), 4.72(s, 2H); ESI-MSm/z: 900.9{[M+H]+}; HR-ESI-MSm/z: Calcd for C56H44N4O6S{[M+Na]+}923.287 9, found 923.286 3。
2结果与讨论
2.1 合成
(1) 4的合成
在4的合成中,文献[5]方法采用n(2) ∶n(3)为1.0 ∶1.5进行投料,反应后剩余大量3,浓缩至干后得油状物,需要用高毒试剂苯结晶,再用石油醚和水搅洗。本文考察了2和3的投料比对反应后处理的影响。实验结果表明:当n(2)∶n(3)=1 ∶1时,3反应完全后,直接减压蒸除溶剂析出固体,用石油醚和水洗涤即可高收率地制得4,无需用苯纯化结晶。该方法简化了操作并避免了高毒溶剂的使用,同时收率从56.8%提高至77.6%。
(2) 5的合成
在5的合成中,文献[5]方法采用A=n(4) ∶n(盐酸羟胺) ∶n(三水合乙酸钠)=1 ∶10 ∶10。实验发现当逐步减少盐酸羟胺和三水合乙酸钠的用量,A=1 ∶7 ∶7时也能获得相同收率(44%);继续减少盐酸羟胺和三水合乙酸钠的用量,当A=1 ∶6 ∶6时,收率降低为40%。因此选择A=1 ∶7 ∶7为较佳投料比。既减少了原料的使用量,节省了资源,也降低了污染排放量。
(3) 7的合成
在7的合成中,文献[5]方法先通过6与N-羟基邻苯二甲酰亚胺进行Mitsunobu反应,反应后会产生大量三苯氧膦,且三苯氧膦和产物的极性非常相近,导致难以重结晶,需要通过柱色谱分离纯化后再用水合肼肼解得到。由于需要柱色谱纯化,使得该路线不利于工业化生产,为大量制得BAL30072用于后续的研究造成困难。本文在Mitsunobu反应过程中严格控制原料中水分,使其尽可能保持干燥,同时细化了后处理方式:用乙酸乙酯萃取后,有机相用饱和碳酸钾溶液洗去残余的N-羟基邻苯二甲酰亚胺,减压浓缩后直接肼解,得到比三苯氧膦极性大的产物,浓缩后通过二氯甲烷和石油醚重结晶即可高收率地获得7,从而解决了Mitsunobu反应带来的后处理需要柱色谱纯化的问题。
3结论
以5-羟基-2-羟甲基-4-吡喃酮为原料,经6步反应合成了BAL30072关键中间体——(Z)-2-(2-三苯甲基氨基噻唑-4-基)-2-[1,5-二(二苯甲氧基)-4-吡啶酮-2-基甲氧基亚胺]乙酸,总收率23%。该工艺合成路线条件温和,无需柱色谱纯化,操作简便,适合工业化生产。同时该合成方法为工业中应对使用Mitsunobu反应带来的后处理困难提供了新的思路和方法。
参考文献4. 文稿正文中所引应是作者亲自阅读过、最主要且发表在正式出版物上的。待发表的文献及私人通信,不作为参考文献著录。正文中所引参考文献的编号应同文末的文献序号一致并附上方括号置于引用处右上角。日文文献应在刊名后注明“(日)”字样。参考文献书写格式如下: 。文后请附第一
[1]Mushtaq S, Warner M, Livermore D. Activity of the siderophore sulfactam BAL30072 against multiresistant non-fermenters[J]. J Antimicrob Chemother,2010,65:266-270.
[2]Mollmann U, Heinisch L, Bauernfeind A,etal. Siderophores as drug delivery agents:Application of the “Trojan Horse” strategy[J]. Biometals,2009,22:615-624.
[3]Malcolm G, Clothilde D, Eric D.InVitroproperties of BAL30072 a novel siderophor sulfactam with activity against multiresistant gram negative bacilli[J]. Antimicrobial Agents and Chemotherapy,2010,54(6):2291-2302.
[4]Malcolm G, Eric D. Combination medicaments for treating bacterial infections:WO 200 811 681[P].2008.
[5]Yoshiyuki Z, Nobuo I. Cephalosporin compounds pro-cesses for their preparation and antibacterial agents:US 4 883 879A[P].1989.
[6]吕茜茜,周晓靓,王荣先. 二苯基重氮甲烷的合成工艺改进[J].化学试剂,2008,30(2):147.
[7]Glinka T, Hecker S, Rodny D. Oxamazin antibiotics:WO 2 014 164 526[P].2014.

《合成化学》征稿简则节选
一. 来稿要求及注意事项
1. 文稿应论点明确、文字精炼、数据可靠。
3. 文稿中的缩略词及代号应在文中第一次出现处加括号写明整个词组或注明其含义。
(1) 期刊:[序号]作者.文献题名[J].刊名,年,卷(期):起页码-止页码.
(2) 专著:[序号]作者.书名[M].其他责任者(如编者、译者).版次(第1版不标注),卷(册),出版地:出版社名,出版年:页码.
(3) 专利:[序号]专利申请者.题名:[P].专利国别(或地区),专利号,年份.
(4) 学位论文:[序号]作者.文献题名[D].学校地点:授予学位单位全称,年份.
(5) 会议论文:[序号]编者.会议文集名称[C].会议地点,年份.出版地:出版者,出版年:页码.
(6) 标准:[序号]标准编号,标准名称[S].
二. 其它
1. 来稿“文责自负”,编辑部对稿件有删改权和出版使用权。请勿一稿两投。稿件发表周期一般在12个月以内,若作者要求提前发表,请在收到审稿结果时说明。校清样时,全体作者与本刊签署《论文著作权转让书》。来稿一经发表,即赠送该期期刊两册,并付一次性稿酬。
2. 联系方式: 四川省成都市武侯区人民南路四段九号,中国科学院成都有机化学有限公司,《合成化学》编辑部,邮编: 610041,电话: 028-85255007,网站: http:∥hchxcioc.com,邮箱: hchx@cioc.ac.cn
·研究简报·
通信联系人: 汪海东,教授,硕士生导师, Tel. 0763-83646686, E-mail: whdoctor@163.com
Process Improvement on the Synthesis of (Z)-2-(2-tritylaminothiazol-
4-yl)-2-(1,5-dibenzhydryloxy-4-pyridon-2-ylmethoxyimino)acetic Acid
TAO Yun-liang1, YANG Yu-she2, WANG Hai-dong1,3*
(1. School of Petrochemical Engineering, Changzhou University, Changzhou 213164, China;
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. College of Biological, Chemical Sciences and Engineering, Jiaxing University, Jiaxing 314000, China)
Abstract:The key intermediate of BAL30072, (Z)-2-(2-tritylaminothiazol-4-yl)-2-[(1,5-dibenz-hydryloxy)-4-pyridon-2-ylmethoxyimino]acetic acid with overall yield of 23%, was synthesized by protection of phenolic hydroxyl group, Michael addition, nucleophilic substitution, Mitsunobu reaction, hydrazinolysis, condensation reaction and so on, using kojic acid as the starting material. The structure was confirmed by1H NMR and MS.
Keywords:kojic acid; BAL30072; gram-negative bacteria; intermediate; synthesis; process improvement
中图分类号:O626.41; R914.5 、中文和英文(包括研究目的、研究背景、研究方法、结果与讨论等内容)及
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.01.15044
作者简介:陶匀亮(1990-),男,汉族,浙江温岭人,硕士研究生,主要从事药物及中间体的合成研究。 E-mail: tyliang322@163.com (姓名、出生年、性别、民族、籍贯、职称、学位、简历或研究方向);基金资助情况(项目批准号);通讯联系人的姓名、职称、联系电话、E-mail。
收稿日期:2015-03-05;
修订日期:2015-10-07

