夹竹桃内生真菌J14次生代谢产物的分离和抑菌活性
苗 智, 马养民, 孔 阳, 许 倩, 屈子睿
(陕西科技大学 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021)
夹竹桃内生真菌J14次生代谢产物的分离和抑菌活性
苗 智, 马养民*, 孔 阳, 许 倩, 屈子睿
(陕西科技大学 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021)
为进一步开发、利用和保护夹竹桃植物资源,对从秦岭山区夹竹桃茎中分离得到活性较高的内生真菌J14进行鉴定,并对其次生代谢产物的化学成分进行研究。采用形态学特征和ITS序列分析对菌株J14进行鉴定,利用硅胶柱色谱、Sephadex LH-20柱色谱、重结晶等方法对该菌株的发酵产物进行分离、纯化,根据化合物的理化性质和1H-NMR、13C-NMR数据鉴定其结构,利用金黄色葡萄球菌、乳酸链球菌、大肠杆菌、绿脓杆菌以及小麦赤霉病菌、番茄灰霉病菌、烟草枯萎病菌、白菜黑斑病菌对所得化合物进行抑菌活性测试。结果表明:经形态学特征和ITS序列分析,鉴定菌株J14为链格孢霉(Alternariasp. SPS-04)。从其发酵产物中分离得到8个化合物,分别鉴定为交链孢甲醚(1)、交链孢酚(2)、malformin A1(3)、胸腺嘧啶(4)、尿嘧啶(5)、黄嘌呤(6)、赤藓醇(7)和甘露醇(8)。化合物3、4、5、6、7首次从链格孢属真菌发酵产物中得到。化合物1对金黄色葡萄球菌的最小抑菌浓度为1.95 μg/mL,对番茄灰霉病菌的最小抑菌浓度为3.91 μg/mL。
内生真菌; 夹竹桃; 链格孢属; 次生代谢产物; 抑菌活性
内生真菌是指生活史的全部阶段或者某一阶段生活在植物组织内,对植物组织没有造成明显病害的真菌[1]。研究表明,植物内生真菌能够产生多种次生代谢产物,具有促进植物生长[2]、抗菌[3-4]、抗氧化[5]、抗肿瘤[6-8]等作用。利用植物内生真菌代替宿主植物生产活性成分,可以增加药物来源、缓解植物资源短缺的压力等。因此,研究植物内生真菌中的活性成分具有十分重要的意义。
夹竹桃(Neriumindicum)属于夹竹桃科夹竹桃属植物[9]。原产印度、伊朗等东南亚地区,在我国栽培历史悠久,遍及南北城乡各地。主要功能为祛痰定喘、强心利尿、祛瘀、镇痛。现代临床医学运用该药治疗跌打损伤、心力衰竭、癫痫、喘息咳嗽、斑秃、经闭[10]。目前,国内外对夹竹桃的研究报道多集中于其植物化学成分上的研究,对其内生真菌代谢产物的研究报道甚少。为了节约和保护夹竹桃植物资源,增加和发现药物来源,笔者对夹竹桃内生真菌展开研究,以夹竹桃茎中分离得到的真菌链格孢霉(编号为J14)为研究对象,对其进行固态发酵,从其发酵产物中分离得到8个化合物,并对所得化合物进行抑菌活性测试,以期为进一步开发和利用夹竹桃内生真菌奠定基础。
1 材料与方法
1.1 材料
1.1.1 夹竹桃内生真菌 从秦岭地区的夹竹桃茎中分离得到菌株J14,在4 ℃下用PDA斜面培养基保存于实验室。
1.1.2 测试菌 革兰氏阳性菌:金黄色葡萄球菌(Staphylococcusaureus),乳酸链球菌(Streptococcuslactis);革兰氏阴性菌:大肠杆菌(Enterococcuscoli),绿脓杆菌(Pseudomonasaeruginosa)。植物病原菌真菌:小麦赤霉病菌(Fusariumgraminearum),番茄灰霉病菌(Botrytiscinerea),烟草枯萎病菌(Tobaccowiltpathogens),白菜黑斑病菌(Cabbageshadinggerms)。以上测试菌均保存于实验室。
1.1.3 培养基 马铃薯葡萄糖(PDA)培养基:20%马铃薯浸汁 1000 mL,葡萄糖 20 g,琼脂 20 g,自然pH;察氏液体培养基:蔗糖 30 g,NaNO33 g,KCl 0.5 g,FeSO40.01 g,K2HPO41 g,MgSO4·7H2O 0.5 g,H2O 1000 mL,自然pH;牛肉膏蛋白胨液体培养基:牛肉膏 5 g,蛋白胨 10 g,NaCl 5 g,H2O 1000 mL,pH 7.2。以上所用试剂均为国产分析纯试剂。
1.1.4 仪器 YX280B 手提式压力蒸汽灭菌锅(上海三申医疗器械有限公司),SW-CJ-1FD 超净工作台(上海博迅实业有限公司医疗设备厂),HZQ-Q 全温数显振荡器(金坛市瑞华仪器厂),DH5000B 电热恒温培养箱(天津市泰斯特仪器有限公司),柱色谱硅胶200 ~ 300 目(青岛海洋化工厂分厂),薄层色谱硅胶G(青岛海浪硅胶干燥剂厂),柱色谱凝胶Sephadex LH-20(上海浩然生物技术有限公司),RE52CS-1 旋转蒸发仪(上海亚荣生化仪器厂),BS224S 电子天平(北京赛多利斯科学仪器系统有限公司),XT-5 显微熔点测定仪(未校准,北京市科仪电光仪器厂),Bruker avance Ⅲ-400 Hz 超导核磁共振仪(瑞士布鲁克公司),其余试剂均为国产分析纯。
1.2 菌种鉴定
1.2.1 形态学鉴定 将菌株J14接种于PDA培养基上,在28℃下培养5 d,观察记录菌落生长状态,并用显微镜观察孢子及分生孢子梗的形态等特征,以此作为依据进行鉴定[11]。
1.2.2 分子生物学鉴定 将菌株J14接种于PDA斜面培养基,在28℃下培养3 d至孢子成熟,利用CTAB法提取菌丝体基因组DNA。以提取到的基因组DNA为模板,通过引物ITS1和ITS4扩增目标菌株的18S rDNA的ITS区[12]。将测序获得的ITS序列通过BLAST比对,根据同源性相似度差异,利用Clustal X软件进行多序列匹配排列,采用软件MEGA 5.0(邻接法NJ)构建系统发育进化树,对菌株J14与数据库中登陆的近源菌株系统发育进化树关系进行分析。
1.3 固态发酵和代谢产物的分离
1.3.1 固态发酵 菌株J14经过活化后,从PDA培养基上用打孔器制成直径为6 mm的菌饼,按照1个菌饼接种于100 mL察氏液体培养基的比例,在28℃,120 r/min 振荡培养5 d制备成种子培养液。在发酵瓶(480 mL)中加入大米50 g,无糖察氏培养基60 mL,在121℃下灭菌25 min,然后按照10%的接种量将种子液接种于上述培养基中,在28℃下静置培养25 d[13]。
1.3.2 代谢产物的分离 将粉碎、阴干的发酵产物用乙酸乙酯提取,提取液经减压蒸馏得到浸膏460 g。采用硅胶柱色谱对浸膏进行分离,以石油醚、乙酸乙酯、乙酸乙酯-甲醇、甲醇为溶剂进行梯度洗脱,得到4个部分(Fr.1 ~ 4)。对Fr.2(96.93 g)以石油醚、石油醚-乙酸乙酯、乙酸乙酯、乙酸乙酯-甲醇、甲醇为溶剂进行洗脱,经过硅胶柱色谱、Sephadex LH-20柱色谱分离,再经过重结晶纯化,分别得到化合物1(75 mg)、化合物2(108 mg)、化合物3(30 mg)、化合物4(145 mg)、化合物5(90 mg)、化合物6(30 mg)、化合物7(88 mg)。对Fr.3(133.83 g)的洗脱液进一步分离得到化合物8(1.81 g)。所有化合物经过1H-NMR和13C-NMR分析确定其结构。
1.4 抑菌活性测试
根据最小抑菌浓度法,将待测化合物溶解于DMSO溶剂中,配成质量浓度为1 mg/mL的溶液。将牛肉膏蛋白胨液体培养基或PDA培养基(不加琼脂),按每孔100 μL加入到96孔板中,再向第1个孔中加入上述样品溶液100 μL混合均匀,再从第1孔中吸取100 μL于第2孔中混合均匀,再从第2孔中吸取100 μL于第3孔中混合均匀,连续稀释至第10孔,从第10孔中取出100 μL弃去,第11孔和第12孔分别留作牛肉膏蛋白胨液体培养基和DMSO溶剂阴性对照。第1 ~ 10孔中化合物的质量浓度依次为500 μg/mL、250 μg/mL、125 μg/mL、62.5 μg/mL、31.3 μg/mL、15.6 μg/mL、7.81 μg/mL、3.91 μg/mL、1.95 μg/mL和0.98 μg/mL。用无菌水将斜面培养基上生长良好的指示菌冲洗下来,用牛肉膏蛋白胨液体培养基或PDA培养基(不加琼脂)配制成浓度为106CFU/mL的菌悬液,向每孔中加入100 μL指示菌菌悬液。选用青霉素钠作为革兰氏阳性菌的阳性对照,硫酸链霉素作为革兰氏阴性菌的阳性对照,酮康唑作为植物病原菌真菌的阳性对照。上述每组进行3次平行试验。将细菌试验组的96孔板置于37 ℃培养24 h、植物病原菌真菌试验组的96孔板置于28℃培养48 h后观察并记录结果[14]。
该序列与链格孢霉(Alternariasp. SPS-04)的ITS序列(序列号为KM250374.1)同源性为99%,综合形态学特征和ITS序列分析基础上的菌株J14系统发育进化树分析(图2)将菌株J14鉴定为链格孢霉。
2 结果与分析
2.1 菌株J14的鉴定
菌株J14形态初期为白色,随后变墨绿色,后期为黑色,菌落呈绒毛状,培养基背面无染色;显微镜下能够明显观察到菌丝呈暗至黑色,有隔膜,分生孢子梗较短,分生孢子呈纺锤状或倒棒状,顶端延长成喙状,一般为褐色,且孢子密集易散落,因此初步确定菌株J14为链格孢属真菌(图1)。经PCR扩增后获得的菌株J14的ITS序列长1315 bp(GenBank中的序列号为KP003986.1,基因序列为:

该序列与链格孢霉(Alternariasp. SPS-04)的ITS序列(序列号为KM250374.1)同源性为99%,综合形态学特征和ITS序列分析基础上的菌株J14系统发育进化树分析(图2)将菌株J14鉴定为链格孢霉。
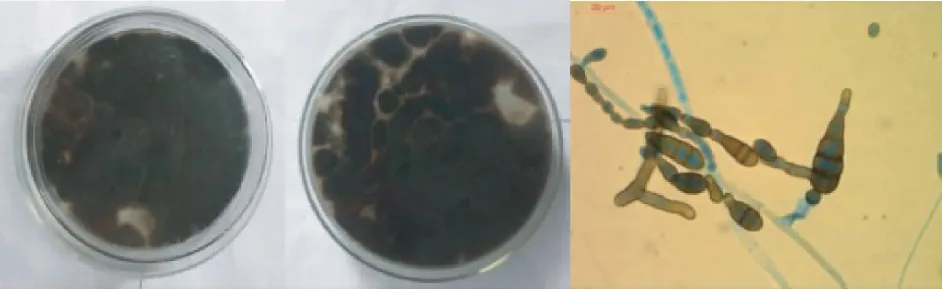
图1 夹竹桃内生真菌J14的形态学特征
Fig.1 Morphological features of the fungus strain J14 ofN.indicum

图2 基于ITS序列基础上的夹竹桃内生真菌J14 系统发育进化树
Fig.2 Phylogenetic tree of the fungus strain J14 ofN.indicumbased on ITS sequence
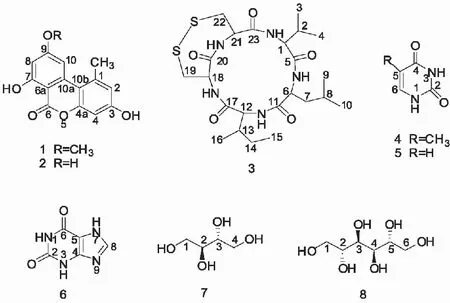
图3 8种夹竹桃内生真菌J14次生代谢化合物的化 学结构
Fig.3 Chemical structures of the eight compounds isolated from the fungus strain J14 ofN.indicum
2.2 代谢产物结构鉴定
从菌株J14固体发酵产物中分离得到8个化合物,分别为交链孢甲醚(1)、交链孢酚(2)、malformin A1(3)、胸腺嘧啶(4)、尿嘧啶(5)、黄嘌呤(6)、赤藓醇(7)、甘露醇(8)。其结构式见图3。
化合物1:淡紫色粉末(甲醇),mp 277 ~ 278℃。
1H-NMR (400 MHz, DMSO-d6) δ:11.84 (s, 1H, 7-OH), 10.40 (s, 1H, 3-OH), 7.24 (d, J= 1.7 Hz, 1H, 10-H), 6.74 (d, J= 2.2 Hz, 1H, 2-H), 6.66 (d, J= 2.4 Hz, 1H, 4-H), 6.63 (d, J=1.9 Hz, 1H, 8-H), 3.92 (s, 3H, 9-OCH3), 2.74 (s, 3H, 1-CH3)。13C-NMR (100 MHz, DMSO-d6) δ:166.13 (6-C), 164.66 (9-C), 164.10 (7-C), 158.54 (3-C), 152.60 (4a-C), 138.44 (1-C), 137.75 (10a-C), 117.57 (2-C), 108.77 (10b-C), 103.39 (10-C), 101.59 (4-C), 99.15 (8-C), 98.44 (6a-C), 55.81 (9-OCH3), 25.00 (1-CH3)。经与文献[15]对照核磁数据,确定化合物1为交链孢甲醚(alternariol methyl ether)。
化合物2:白色粉末(甲醇),mp 320 ~ 321℃。1H-NMR (400 MHz, DMSO-d6) δ:11.78 (s, 1H, 7-OH), 10.91 (s, 1H, 9-OH), 10.34 (s, 1H, 3-OH), 7.25 (d,J= 1.2 Hz, 1H, 10-H), 6.72 (d,J= 2.1 Hz, 1H, 2-H), 6.64 (d,J= 2.3 Hz, 1H, 4-H), 6.37 (d, J= 1.5 Hz, 1H, 8-H), 2.71 (s, 3H, 1-CH3)。13C-NMR (100 MHz, DMSO-d6) δ:165.36 (6-C), 164.65 (9-C), 164.01 (7-C), 158.37 (3-C), 152.57 (4a-C), 138.29 (1-C), 138.07 (10a-C), 117.47 (2-C), 108.90 (10b-C), 104.25 (10-C),101.55 (4-C), 100.81 (8-C), 97.35 (6a-C), 25.22 (1-CH3)。经与文献[16]对照核磁数据,确定化合物2为交链孢酚(alternariol)。
化合物3:白色晶体(甲醇),mp > 350℃。1H-NMR (400 MHz, DMSO-d6) δ:8.88 (d,J= 3.9 Hz, 1H, 18-NH), 8.63 (d,J= 6.7 Hz, 1H, 12-NH), 8.00 (d,J= 8.8 Hz, 1H, 1-NH), 7.40 (d, J= 9.2 Hz, 1H, 6-NH), 7.12 (d,J= 11.0 Hz, 1H, 21-NH), 4.73 (td,J= 10.9, 4.4 Hz, 1H, 21-H), 4.48 (td,J= 9.2, 6.3 Hz, 1H, 6-H), 4.00 (d,J= 3.5 Hz, 1H, 1-H), 3.97 - 3.91 (m, 1H, 18-H), 3.88 (dd, J= 10.4, 6.8 Hz, 1H, 12-H), 3.52 (dd, J= 14.9, 3.1 Hz, 1H, 19-Hb), 3.27 - 3.22 (m, 1H, 22-Hb), 3.18 (m, 2H, 19,22-Ha), 2.05 (m, 1H, 2-H), 1.71 (m, 1H, 13-H), 1.62 - 1.49 (m, 2H, 8-H, 14-Hb), 1.42 (m, 1H, 7-Hb), 1.38 - 1.29 (m, 1H, 7-Ha), 1.19 -1.10 (m, 1H, 14-Ha), 0.90 (d,J= 6.6 Hz, 3H, 9-H), 0.87 (d,J= 6.6 Hz, 3H, 10-H), 0.83 (d,J= 6.9 Hz, 9H, 3,4,15-H), 0.79 (d,J= 6.8 Hz, 3H, 16-H)。13C-NMR (100 MHz, DMSO-d6) δ:173.96 (20-C), 172.98 (11-C), 172.74 (17-C), 170.53 (5-C), 169.71 (23-C), 58.77 (1-C), 57.97 (12-C), 52.87 (21-C), 52.35 (18-C), 50.31 (6-C), 46.18 (19-C), 45.16 (22-C), 40.82 (7-C), 33.97 (13-C), 26.81 (2-C), 24.70 (14-C), 24.44 (8-C), 22.67 (9-C), 21.73 (10-C), 19.64 (3-C), 18.65 (4-C), 14.88 (16-C), 9.94 (15-C)。经与文献[17]对照核磁数据,确定化合物3为malformin A1。
化合物4:白色粉末(甲醇),mp 310 ~ 312℃。1H-NMR (400 MHz, DMSO-d6) δ:11.04 (s, 1H, 3-H), 10.62 (s, 1H, 1-H), 7.26 (d,J= 5.3 Hz, 1H, 6-H), 1.72 (s, 3H, 5-CH3)。13C-NMR (100 MHz, DMSO-d6)δ:164.90 (4-C), 151.46 (2-C), 137.70 (6-C), 107.62 (5-C), 11.79 (7-C)。经与文献[18]对照核磁数据,确定化合物4为胸腺嘧啶(thymine)。
化合物5:白色粉末(甲醇),mp 335 ~ 337℃。1H-NMR (400 MHz, DMSO-d6) δ:11.04 (s, 1H, 3-H), 10.84 (s, 1H, 1-H), 7.40 (dd, J= 7.5, 5.9 Hz, 1H, 6-H), 5.45 (d,J= 7.6 Hz, 1H, 5-H)。13C-NMR (100 MHz, DMSO-d6) δ:164.31 (4-C), 151.49 (2-C), 142.18 (6-C), 100.18 (5-C)。经与文献[19]对照核磁数据,确定化合物5为尿嘧啶(uracil)。
化合物6:白色粉末(甲醇),mp > 350℃。1H-NMR (400 MHz, DMSO-d6) δ:13.34 (s, 1H, 7-H), 11.54 (s, 1H, 1-H), 10.86 (s, 1H, 3-H), 7.94 (s, 1H, 8-H)。13C-NMR (100 MHz, DMSO-d6) δ:155.43 (6-C), 151.35 (2-C), 148.94 (4-C), 140.62 (8-C), 106.50 (5-C)。经与文献[20]对照核磁数据,确定化合物6为黄嘌呤(xanthine)。
化合物7:白色晶体(甲醇),mp 125 ~ 126℃。1H-NMR (400 MHz, D2O) δ:3.63 (dd,J= 11.1, 1.5 Hz, 2H, 2,3-H), 3.50 (m, 4H, 1,4-H)。13C-NMR (100 MHz, D2O) δ:71.30 (2,3-C), 62.01 (1,4-C)。经与文献[21]对照核磁数据,确定化合物7为赤藓醇(erythritol)。
化合物8:白色晶体(甲醇),mp 167 ~ 169℃。1H-NMR (400 MHz, DMSO-d6) δ:4.44 (d,J= 5.1 Hz, 2H, 3,4-OH), 4.36 (t,J= 4.9 Hz, 2H, 1,6-OH), 4.16 (d,J= 7.0 Hz, 2H, 2,5-OH), 3.61 (m, 2H), 3.54 (t,J= 7.6 Hz, 2H), 3.45 (m,2H), 3.37 (m,2H)。13C-NMR (100 MHz, DMSO-d6) δ:71.24 (2,5-C), 69.58 (3,4-C), 63.82 (1,6-C)。经与文献[22]对照核磁数据,确定化合物8为甘露醇(mannitol)。
2.3 化合物的抑菌活性
利用金黄色葡萄球菌、乳酸链球菌、大肠杆菌、绿脓杆菌以及小麦赤霉病菌、番茄灰霉病菌、烟草枯萎病菌、白菜黑斑病菌对所得8个化合物进行抑菌活性测试可知(表),设置的牛肉膏蛋白胨液体培养基或PDA培养基(不加琼脂)和DMSO溶剂阴性对照组中测试菌株均正常生长。
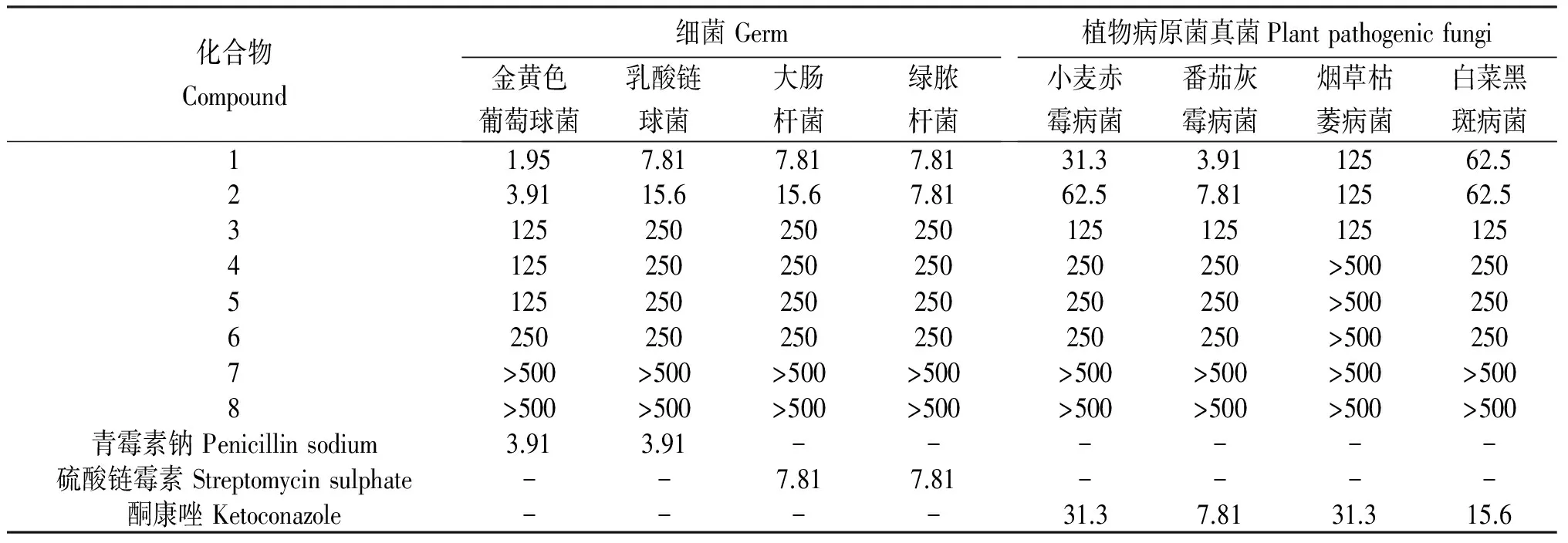
表 8种夹竹桃内生真菌J14次生代谢化合物的最小抑菌浓度
注:青霉素钠作为阳性菌的阳性对照,硫酸链霉素作为阴性菌的阳性对照,酮康唑作为植物病原菌真菌的阳性对照,-为未设置试验。
Note: Penicillin sodium, streptomycin sulfate and ketoconazole are used as positive CK, negative CK and plant pathogens fungus respectively. - means that the experiments are not set.
从表可知,化合物 1(交链孢甲醚)和化合物 2(交链孢酚)对金黄色葡萄球菌、乳酸链球菌、大肠杆菌、绿脓杆菌以及小麦赤霉病菌、番茄灰霉病菌均有良好的抑菌活性,其活性和阳性对照结果相当。其中,化合物1对金黄色葡萄球菌的最小抑菌浓度为1.95 μg/mL,对番茄灰霉病菌的最小抑菌浓度为3.91 μg/mL,皆优于阳性对照。
3 结论与展望
从夹竹桃茎中分离得到的内生真菌J14,经形态学特征和ITS序列分析,鉴定其为链格孢霉(Alternariasp. SPS-04),从其发酵产物中分离得到8个化合物,分别为交链孢甲醚(1)、交链孢酚(2)、malformin A1(3)、胸腺嘧啶(4)、尿嘧啶(5)、黄嘌呤(6)、赤藓醇(7)和甘露醇(8)。由此说明,夹竹桃内生真菌的次生代谢产物繁多。化合物 1(交链孢甲醚)和化合物 2(交链孢酚)对金黄色葡萄球菌、乳酸链球菌、大肠杆菌、绿脓杆菌以及小麦赤霉病菌、番茄灰霉病菌的抑菌活性良好。因此,化合物 1(交链孢甲醚)和化合物 2(交链孢酚)可成为良好的抗菌药物。
基于此研究,链格孢霉菌为抗菌药物提供了新的来源。笔者将继续对夹竹桃内生真菌J14(链格孢霉)的次生代谢产物进行研究,以期得到抑菌效果更好或者结构新颖的化合物。此外,还将对夹竹桃其他部位的内生真菌进行分离,并筛选活性较强的一系列内生真菌,对其次生代谢产物进行系统的研究,从而进一步开发和利用夹竹桃内生真菌。
[1] 华永丽,欧阳少,林陈美,等.药用植物内生真菌研究进展[J].世界科学技术-中医药现代化,2008,10(4):105-111.
[2] 袁志林,戴传超,史 央,等.内生真菌B3促进水稻生长的机理研究[J].江苏农业科学,2004(2):10-13.
[3] 倪志伟,李国红,赵沛基,等.云南美登木内生真菌Chaetom iumglobosum LY50'菌株的抗菌活性成分研究[J].天然产物研究与开发,2008,20(1):33-36.
[4] Gu W, Ge H M, Song Y C, et al. Cytotoxic benzo[j]fluoranthene metabolites from Hypoxylon truncatum IFB-18, an endophyte of Artemisia annua[J]. Journal of Natural Products, 2007, 70(1):114-117.
[5] Strobel G, Ford E, Worapong J, et al. Isopestacin, an isobenzofuranone from Pestalotiopsis microspora, possessing antifungal and antioxidant activities[J]. Phytochemistry, 2002, 60(2):179-183.
[6] 杨显志,张玲琪,郭 波,等.一株产长春新碱内生真菌的初步研究[J].中草药, 2004, 35(1):79-81.
[7] Eyberger A L, Dondapati R, Porter J R. Endophyte fungal isolates from Podophyllum peltatum produce podophyllotoxin[J]. Journal of Natural Products, 2006, 69(8):1121-1124.
[8] Li X, Tian Y, Yang S X, et al. Cytotoxic azaphilone alkaloids from Chaetomium globosum TY1[J]. Bioorganic & Medicinal Chemistry Letters, 2013, 23(10):2945-2947.
[9] 石华建. 夹竹桃[J]. 生物学通报, 2007, 42(7):18.
[10] 邢晓娟.夹竹桃的药理作用与临床应用[J].现代医药卫生, 2007, 23(16):2466.
[11] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社, 1979.
[12] 曹永军,程 萍,喻国辉,等.利用ITS1和ITS4通用引物扩增香蕉枯萎病菌核酸片段鉴定其生理小种[J].热带作物学报, 2010, 31(7):1098-1102.
[13] Roopesh K, Ramachandran S, Nampoothiri K, et al. Comparison of Phytase production on wheat bran and oilcakes in solid-state fermentation by Mucor racemosus[J]. Bioresource Technology, 2006, 97(3):506-511.
[14] 刘 果.三尖杉内生真菌次生代谢产物及抑菌活性的研究[D].西安:陕西科技大学,2013.
[15] Tan N, Tao Y, Pan J, et al. Isolation, structure elucidation, and mutagenicity of four alternariol derivatives produced by the Mangrove endophytic fungus No. 2240[J]. Chemistry of Natural Compounds, 2008, 44(3):296-300.
[16] 吴少华,陈有为,李治滢,等.滇牡丹内生真菌Alternaria sp. PR-14的代谢产物研究[J].天然产物研究与开发, 2011, 23(5):850-852.
[17] 王发左,朱天骄,张 敏,等. 海洋真菌Rhizopus sp. 2-PDA-61化学成分的研究[J].天然产物研究与开发, 2011, 23(2):199-201.
[18] 胡晓兰,徐文峰,卢 轩,等.植物内生真菌Fusariums sp.LC-1次级代谢产物的研究[J].中国药学杂志, 2013,48(1):17-21.
[19] 徐俞悦,程 琳,杨天枫,等.雷斯青霉菌次生代谢产物研究[J].中药材, 2014, 37(12):2204-2206.
[20] 苗翠苹,胡 娟,翟英哲,等.滇牡丹内生真菌PR20的鉴定及次生代谢产物的研究[J].天然产物研究与开发, 2012, 24(10):1339-1342.
[21] 李 帆,周本宏,闫兴国.狭叶荨麻地上部分化学成分的研究[J].中国医院药学杂志, 2008, 28(11):873-874.
[22] 杨秀芳,徐小娜,张弘弛,等.无花果植物内生真菌FS11次生代谢产物化学成分的分离与鉴定[J].时珍国医国药, 2012, 23(6):1369-1371.
(责任编辑: 孙小岚)
Isolation and Secondary metobalities Antibucterial activity of J14,An Endophytic Fungus inNeriumindicum
MIAO Zhi, MA Yangmin*, KONG Yang, XU Qian, QU Zirui
(KeyLaboratoryofAuxiliaryChemistry&TechnologyforChemicalIndustry,MinistryofEducation,ShaanxiUniversityofScienceandTechnology,Xi’an,Shaanxi710021,China)
To exploit and protect resources ofN.indicum, the fungus strain J14 which was isolated fromN.indicumin Qinling Mountain with higher antimicrobial activities was identified and secondary metobalities of J14 was studued. The strain J14 was identified according to its morphological characteristics and ITS sequence. The secondary metabolities from J14 were isolated by silica gel column, Sephadex LH-20 column chromatography, recrystallization, and so on. Their structures were determined by their physicochemical properties, 1H-NMR and 13C-NMR data. Antimicrobial activities of all compounds were tested againstStaphylococcusaureus,Streptococcuslactis,Enterococcuscoli,Pseudomonasaeruginosa,Fusariumgraminearum,Botrytiscinerea,Tobaccowiltpathogens,Cabbageshadinggerms. Results: The strain J14 was defined asAlternariasp. SPS-04. Eight compounds from fermentation of J14 were identified as alternariol methyl ether(1), alternariol(2), malformin A1(3), thymine(4), uracil(5), xanthine(6), erythritol(7) and mannitol(8). Compounds 3,4,5,6,7 were firstly obtained from fermentation of the genusAlternaria. Compounds 1 showed a MIC value of 1.95 μg/mL againstS.aureusand showed a MIC value of 3.91 μg/mL againstB.cinerea.
endophytic fungus;Neriumindicum;Alternariasp.; secondary metabolites; antimicrobial activities
2015-05-21; 2015-12-03修回
高等学校博士学科点专项科研基金项目“药用植物内生真菌中抗菌活性代谢产物研究”(20116125110001);陕西省自然科学基础研究计划项目“植物内生真菌溜曲霉中吲哚二酮哌嗪类代谢产物的研究”(2014JZ003);陕西省教育厅自然科学专项项目“蝙蝠葛茎叶抗植物病原菌活性物质基础的研究”(2013JK0726)
苗 智(1991-),男,在读硕士,研究方向:天然产物化学。E-mail:pokemon001@126.com
*通讯作者:马养民(1963-),男,教授,博士生导师,从事天然产物化学研究。E-mail:mym63@sina.com
1001-3601(2016)01-0024-0088-05
R932; O629
A

