EdCC通过MEK-ERK信号通路减轻小鼠心肌缺血再灌注损伤*
蒋 智, 贾中申, 吴玥婷, 韦 方,△
(1贵州省人民医院心内科,贵州省心血管病研究所,贵州 贵阳 550002;2贵州医科大学,贵州 贵阳 550004)
EdCC通过MEK-ERK信号通路减轻小鼠心肌缺血再灌注损伤*
蒋智1,贾中申2,吴玥婷1,韦方1,2△
(1贵州省人民医院心内科,贵州省心血管病研究所,贵州 贵阳 550002;2贵州医科大学,贵州 贵阳 550004)
[摘要]目的: 研究子宫内膜干细胞(endometrial stem cells,EnSCs)来源细胞因子“鸡尾酒”(EnSC-derived cytokine cocktail,EdCC)对心肌缺血再灌注损伤的影响及MEK-ERK信号通路的作用。方法: 建立小鼠心肌缺血再灌注损伤模型,用TTC/Evans blue染色评估心梗面积,TUNEL染色检测细胞凋亡,Western blot检测ERK1/2磷酸化水平和cleaved caspase-3表达。结果: EnSCs具有间充质干细胞特性,表达CD90,不表达CD34和CD45。EdCC的表皮生长因子(EGF)含量为(6 811±312)ng/g蛋白。经尾静脉注射EdCC可显著升高心肌ERK1/2磷酸化水平,明显降低梗死面积,减少梗死周边区凋亡细胞数目,抑制capase-3活化。MEK1特异性阻断剂PD98059(5 mg/kg)抑制EdCC介导的ERK1/2磷酸化,并抵消上述心肌保护效应。EGF受体特异性阻断剂AG-1487(6 mg/kg)只能部分抵消EdCC的心肌保护作用,而单纯注射EGF不能缩小梗死面积。结论: EdCC通过激活MEK1-ERK1/2信号通路减轻心肌缺血再灌注损伤,EGF受体是该通路重要组成部分。该结果对目前成体干细胞移植治疗模式——从细胞转移到细胞因子,具有重要的理论意义。
[关键词]子宫内膜干细胞来源细胞因子“鸡尾酒”; MEK-ERK信号通路; 心肌梗死; 缺血再灌注损伤
急性心肌梗死已成为我国最主要的致死原因[1],心梗面积的大小和患者的临床预后息息相关[2]。尽管早期再灌注治疗是降低心梗面积最有效的方法,但再灌注后缺血心肌的功能障碍和结构损伤不能立即恢复反而进一步加重,该现象被称为缺血再灌注损伤[3],严重削弱了再灌注治疗的获益。随着介入技术的发展及再灌注治疗的广泛应用,如何保护缺血心肌已成为急性心肌梗死再灌注治疗亟待解决的问题[4]。
临床研究证明干细胞移植治疗心肌梗死安全有效[5]。成体干细胞移植通过释放多种细胞因子保护细胞凋亡、促进组织修复及再生,即“旁分泌效应”[6]。子宫内膜干细胞(endometrial stem cells,EnSCs)具有无创获取、增殖速度快、传代稳定、低免疫源性、无伦理道德问题等优势,适宜异体移植,是目前"现货"干细胞治疗策略极具潜力的种子细胞[7]。我们的前期研究发现EnSCs移植可通过旁分泌效应保护大鼠心肌细胞,减少心梗面积,改善心梗后心功能[8]。EnSCs表达表皮生长因子(epidermal growth factor,EGF)。EGF与EGF受体(EGF recetotor,EGFR)特异性结合可激活ERK信号通路,是保护心肌缺血再灌注损伤的重要信号通路[9]。有研究报道EGF可减轻大鼠小肠缺血再灌注损伤[10],多种细胞因子与EGFR有交叉反应,共同激活ERK信号通路[11]。因此,我们提取EnSCs分泌的多种抗凋亡及促血管新生细胞因子,称之为EnSC来源细胞因子“鸡尾酒”(EnSC-derived cytokine cocktail,EdCC)。我们推测EdCC可激活ERK信号通路减轻心肌缺血再灌注损伤。为验证这一假说,我们建立小鼠心肌缺血再灌注损伤模型,研究EdCC对心肌梗死面积、细胞凋亡及ERK信号通路的影响。
材料和方法
1细胞、动物、实验试剂及耗材
人EnSCs细胞株购自杭州易文赛生物技术有限公司。8~12周龄雄性昆明小鼠,体重25~30 g,由贵州医科大学实验动物中心提供。胎牛血清、DMEM/F12细胞培养液和PBS(HyClone);25 cm2细胞培养瓶(Corning);PD98059和AG-1487(Selleck);Captisol(MedChem Express);重组人EGF(Peprotech);超滤离心管(Millipore);异氟烷(上海玉研科学仪器有限公司);冠状动脉结扎线(Sharpoint);TTC(Sigma);Evans blue和多聚甲醛(凯信);EGF ELISA试剂盒(Elabscience);TUNEL试剂盒(Invitrogen);OCT包埋剂(TaKaRa);蛋白定量试剂盒、ECL显色液(Pierce);兔抗小鼠p-ERK1/2(Thr202/Tyr204)、兔抗小鼠ERK1/2和兔抗小鼠cleaved caspase-3抗体(CST);兔抗小鼠β-actin和HRP偶联羊抗兔IgG(中杉金桥)。
2主要方法
2.1EnSCs的培养液氮冻存的细胞株用37 ℃水浴快速溶解后用含10%胎牛血清的DMEM/F12细胞培养液洗去冻存液,接种于25 cm2培养瓶,于37 ℃、5% CO2培养箱中培养,24 h后更换培养液,以后每3 d换液,生长融合达70%左右时进行传代培养。
2.2EdCC的制备和储存将8×105EnSCs种入25 cm2培养瓶,24 h后用PBS反复洗去含血清培养基,加入3 mL无血清DMEM/F12培养液,于37 ℃、5% CO2培养箱中培养,24 h后吸出无血清培养液,5 000 r/min离心15 min,弃沉淀取上清,用Millipore超滤离心管截留上清液中分子量>10 kd的蛋白,于-80 ℃冰箱储存。
2.4小鼠心肌缺血再灌注损伤模型小鼠用异氟烷吸入麻醉,用6-0圆针丝线于肺动脉下方2~3 mm处用活结结扎左冠状动脉前降支,即开始缺血,将活结线头预留3~5 mm在胸腔外,5 min后经尾静脉注射药物,30 min后适当用力拉活结线头将活结松开,即开始再灌注,实验流程见图1。对照组注射200 μL无血清DMEM/F12;EdCC组注射100 μg EdCC(用无血清DMEM/F12稀释成200 μL);EdCC+PD98059组注射100 μg EdCC和5 mg/kg PD98059(用无血清DMEM/F12稀释成200 μL,含12.5%丙二醇);EdCC+丙二醇组注射100 μg EdCC(用无血清DMEM/F12稀释成200 μL,含丙二醇12.5%);丙二醇组注射200 μL无血清DMEM/F12(含丙二醇12.5%);EdCC+AG-1487组注射100 μg EdCC和6 mg/kg AG-1487(溶于100 mmol/L captisol);EGF组注射1 ng EGF(用DMEM/F12稀释成200 μL)。
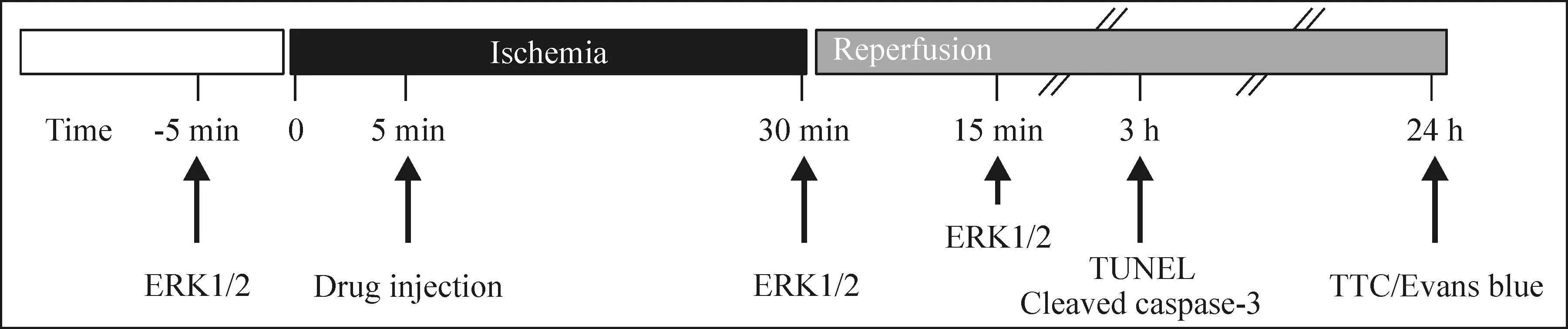
Figure 1.The experimental schedule.
图1实验流程
2.5TTC/Evans blue染色脱颈椎法处死小鼠,将原先松开的冠状动脉前降支线结再次结扎,从升主动脉逆行注入2% Evans blue染液,然后剪下心脏用PBS洗去多余染液,保鲜膜包裹后放入-20 ℃冰箱冷冻15 min,取出后垂直左室长轴将心脏切成1 mm薄片,然后2% TTC避光染色20 min,4%多聚甲醛溶液固定20 min,压平,蘸干,拍照。
2.6梗死面积的计算用Image-Pro软件计算梗死面积。心脏左室横截面为左室面积(left ventricle,LV),非Evan’s blue蓝染区域为危险区(area at risk,AAR),白色区域为梗死区(infarct area,IA)。梗死面积用IA/AAR表示,危险区面积用AAR/LV表示。
2.7冰冻切片脱颈椎法处死小鼠,经主动脉逆行灌注10 mL冰PBS,剪下心脏用滤纸吸去多余水分、分离多余结缔组织,用10%、20%、30%蔗糖溶液脱水,OCT包埋,液氮速冻,以7 μm切片留样。
2.8TUNEL染色冰冻切片于常温放置解冻,晾干,4%多聚甲醛溶液固定10 min,PBS洗3次,0.2% Triton X-100穿膜5 min,PBS洗3次,加混合好的TUNEL染液在37 ℃下孵育60 min,PBS洗3次,浸入含1 mg/L Hoechst的PBS溶液中5 min,PBS洗3次,封片。用荧光显微镜观察,每个切面取梗死周边区5个高倍镜视野,用Image Pro软件计数TUNEL阳性细胞数。
2.9Western blot实验小鼠脱颈椎处死后立即经主动脉逆行灌注10 mL冰PBS,仅保留冠脉结扎线以下左室心肌组织。心肌组织用锡箔纸包裹,液氮速冻,砸碎后加蛋白裂解液及蛋白酶抑制剂,冰上裂解30 min,期间反复震荡混匀,离心后取上清行BCA法蛋白定量,准备蛋白样品。用10%SDS-PAGE分离蛋白后,转膜,用5%的脱脂牛奶封闭1 h,加 I 抗4 ℃孵育过夜,PBS-T洗3次,加HRP偶联 II 抗于室温孵育2 h,PBS-T洗3次,加ECL液曝光、显影、定影。用扫描仪扫描曝光胶片,用Bandscan软件分析条带像素灰度值。
3统计学处理
由式(2)可知,log2(fk(r)/ek(r))相当于是对规则覆盖样例个数fk(r)加的权值,它均衡了不同类之间的样例个数差异对规则的影响。较大的R值说明该规则作出正确预测数显著地大于随机猜测的结果。例如,由于r1覆盖45个样例,则正类的期望频数为e+(r1)=45×(80/180)=20,而负类的期望频数为e_(r1)=45×(100/180)=25。因此,r1的似然比为
用SPSS 16.0统计学软件进行统计学分析,所有数据用均数±标准差(mean±SD)表示。2组数据比较用t检验,3组以上数据用单因素方差分析,两两比较用Bonferroni检验,以P<0.05为差异有统计学意义。
结果
1体外培养EnSCs的形态
体外培养的EnSCs贴壁生长,呈纺锤形,融合后形成旋涡样结构。经流式细胞术分析,EnSCs表达间充质干细胞表面标志CD90,不表达CD34和CD45等造血细胞来源表面标志,见图2。

Figure 2.The EnSCs presented mesenchymal characteristics. A: phase-contrast microscopic view of normal cultured EnSCs with 30% confluent (×200); B: phase-contrast microscopic view of normal cultured EnSCs with 100% confluent (×100); C: flow cytometric analysis of the cell surface marker of EnSCs.
图2EnSCs具有间充质干细胞特性
2体外培养EnSCs的EGF表达水平
ELISA检测EnSCs上清液中EGF的浓度为(573.8±21.8) ng/L,经计算EdCC理论上EGF含量为每100 μg EdCC含EGF (782.5±29.7) pg,实际检测100 μg EdCC中EGF含量为(681.1±31.2) pg,说明Millipore蛋白超滤技术可截留近90%EnSCs上清液中的EGF蛋白。
3EdCC促进心肌ERK1/2磷酸化
EGF通过与EGFR结合激活下游信号通路促进ERK1/2磷酸化[12],是减轻心肌缺血再灌注损伤的重要信号通路,我们推测富含EGF的EdCC可促进心肌ERK1/2磷酸化。为验证该猜想,我们把小鼠分为对照组和EdCC组,于缺血前5 min、缺血30 min和再灌注15 min时提取心脏组织蛋白,用Western blot检测ERK1/2磷酸化(图3)。结果显示, EdCC组缺血30 min及再灌注15 min时ERK1/2磷酸化水平较对照组升高,提示EdCC激活心脏ERK1/2信号通路。
4EdCC介导的ERK1/2磷酸化可被PD98059阻断
EGF介导的ERK1/2磷酸化的上游信号因子为ERK激酶1(MEK1)[12],于是我们用MEK1的特异性阻断剂PD98059阻断ERK1/2的上游信号。EdCC组ERK1/2磷酸化水平在再灌注15 min时较对照组和EdCC+PD98059组均升高(P<0.01),提示EdCC通过MEK1激活ERK1/2,见图4。

Figure 3.EdCC increased myocardial ERK1/2 phosphorylation. A representative image of Western blot for determining phosphorylated ERK1/2 and total ERK1/2.
图3EdCC提高心肌ERK1/2磷酸化水平
5EdCC通过MEK1-ERK信号通路减轻心肌缺血再灌注损伤
我们进一步研究MEK1-ERK信号通路在EdCC心肌保护效应中的作用。再灌注24 h,各组危险区面积无统计学显著性。EdCC组梗死面积为35.9%±7.5%,较对照组缩小24%(P<0.01),提示EdCC减轻心肌缺血再灌注损伤;EdCC+PD98059组梗死面积为44.2%±7.5%,较EdCC组明显扩大(P<0.05),提示阻断MEK1-ERK信号通路抵消EdCC的心肌保护效应,见图5。

Figure 4.EdCC activated myocardial MEK1-ERK signaling pathway. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsEdCC group.
图4EdCC激活心肌MEK1-ERK信号通路
6EdCC通过MEK1-ERK信号通路抑制细胞凋亡
为进一步说明MEK1-ERK信号通路对细胞凋亡的影响,我们把小鼠分为对照组、EdCC组、EdCC+PD98059组和EdCC+丙二醇组,再灌注3 h后处死小鼠,做心脏冰冻切片,用TUNEL染色计数凋亡细胞,提取心肌蛋白用Western blot检测caspase-3活化水平。Ed-CC组梗死周边区凋亡细胞数量为每个高倍镜视野15.1±5.3,较对照组减少37%(P<0.01);EdCC组cleaved caspase-3表达水平为0.160±0.034,较对照组减少86%(P<0.01),提示EdCC抑制细胞凋亡;PD98059阻断MEK1-ERK信号通路可抵消上述效应,见图6。

Figure 5.MEK1-ERK signaling pathway mediated the myocardial protective effect of EdCC. A: the representative images of TTC/Evans blue staining of mouse heart; B: the quantitative analysis of AAR/LV; C: the quantitative analysis of IA/AAR. Mean±SD.n=11~12.**P<0.01vscontrol group;##P<0.05vsEdCC group.
图5MEK1-ERK信号通路介导EdCC的心肌保护效应
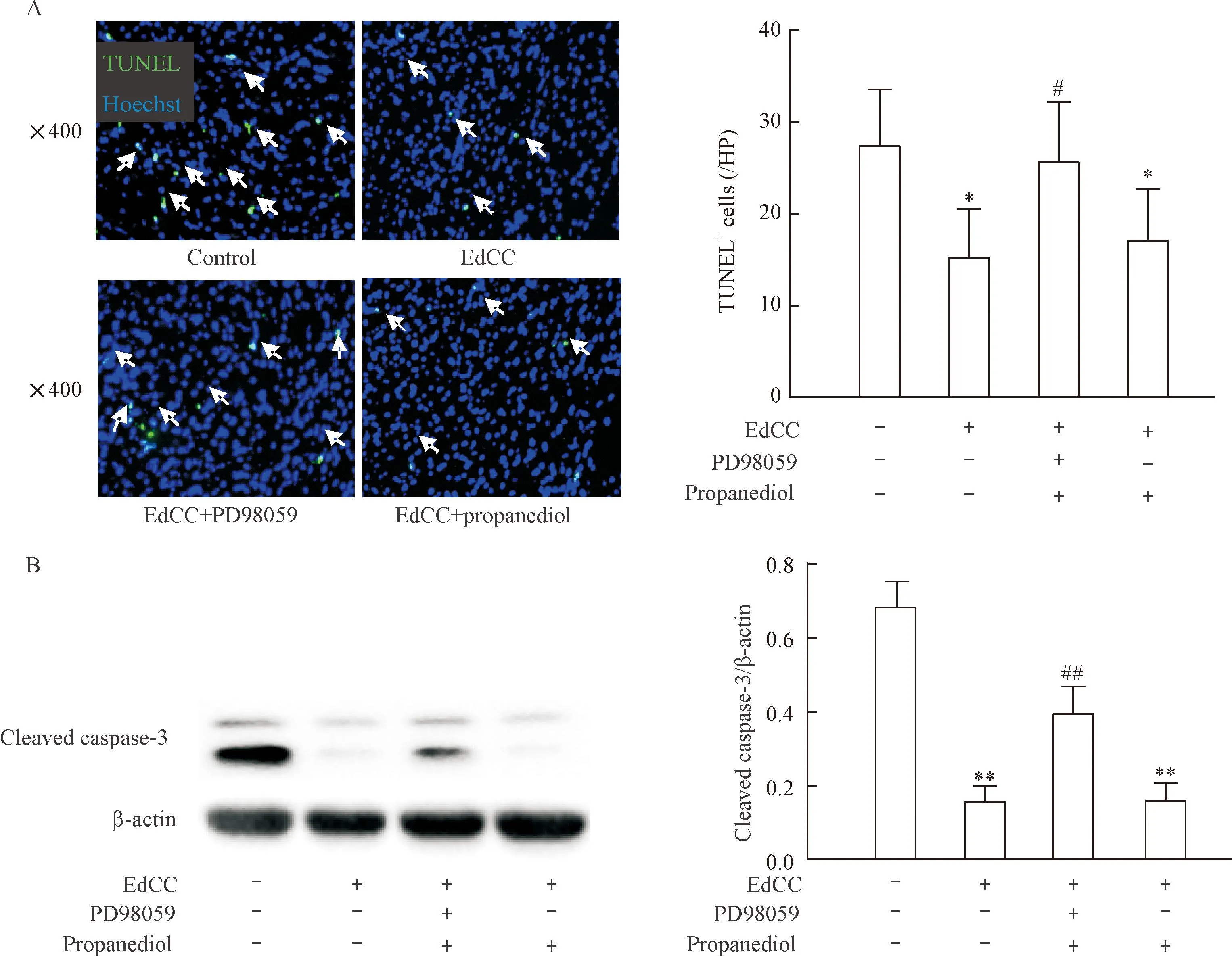
Figure 6.EdCC inhibited cell apoptosis (A) and activation of caspase-3 (B) through MEK1-ERK signaling pathway. Mean±SD.n=6~8.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsEdCC group.
图6EdCC通过MEK1-ERK信号通路抑制细胞凋亡和caspase-3活化
7EGFR部分参与EdCC的心肌保护作用
再灌注24 h各组危险区面积无统计学显著性。EdCC+AG-1487组的梗死面积均值较EdCC组大,较对照组小,但差异均无统计学显著性。AG-1487是EGFR选择性抑制剂,说明抑制EGFR可部分抵消EdCC的心肌保护效应。1 ng EGF不能缩小梗死面积,提示EdCC所含EGF水平没有明显心肌保护作用,见图7。
讨论
心肌缺血再灌注损伤占最终心梗面积的50%[13],如存活心肌无法代偿损伤心肌的收缩力,将发展成充血性心力衰竭。目前学术界已逐渐达成共识,心脏是终末分化器官,无论自然或疾病状态其自我增殖修复的能力微乎其微[14]。干细胞移植、基因疗法等促进心肌再生的治疗方法临床试验疗效甚微[5],或因多种潜在风险仍处于动物研究阶段[15]。因此,致力寻找具有心肌保护效应的药物并探索其信号转导途径,从分子机制理解心肌细胞坏死与存活并设计治疗靶点以减少心肌细胞坏死、缩小梗死面积显然具有十分重要的意义。
心肌对缺血再灌注损伤的反应分为两阶段。在缺血期,部分心肌细胞因急性缺氧坏死,存活心肌细胞出现酸中毒、水肿、钠钙离子超载等病理生理改变;在再灌注期,存活的心肌细胞因迅速恢复能供反而出现更加严重的损伤[3]。我们的前期研究发现EnSCs移植减少大鼠持续冠脉结扎导致的心肌细胞凋亡并缩小梗死面积[8],为契合临床情况,充分利用EdCC的治疗效果,我们在结扎小鼠冠脉5 min后即注射EdCC,30 min后再灌注,24 h后TTC/Evans blue结果显示梗死面积较对照组减少24%。Western blot结果显示EdCC组心脏ERK1/2磷酸化不仅在再灌注后15 min还在缺血30 min时显著升高,提示EdCC不仅减轻缺血再灌注损伤,还可能减少缺血期心肌细胞因急性缺血所致坏死。缺血再灌注损伤引起心肌细胞凋亡约占所有心肌细胞死亡的80%[13],抑制凋亡可以显著降低梗死面积[16]。我们研究发现EdCC显著减少梗死周边区凋亡细胞数量并抑制caspase-3活化,从细胞和蛋白水平说明EdCC的抗凋亡作用。PD98059溶于丙二醇用于静脉注射,我们通过对比EdCC组、EdCC+PD98059和EdCC+丙二醇组的梗死面积、凋亡细胞数量和cleaved caspase-3的表达水平排除了丙二醇对实验结果的干扰。
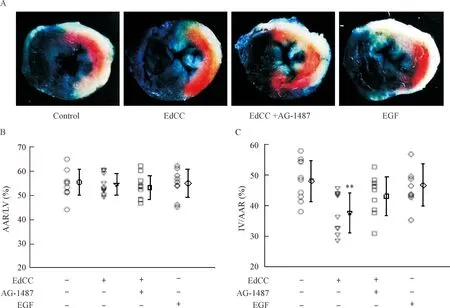
Figure 7.EGFR partially contributed to the myocardial protective effect of EdCC. A: the representative images of TTC/Evans blue staining; B: the quantitative analysis of AAR/LV; C: the quantitative analysis of IA/AAR. Mean±SD.n=9~10.**P<0.01vscontrol group.
图7EGFR部分参与EdCC的心肌保护效应
尽管EdCC所含EGF相对其它细胞因子丰度较高,但EGF(1 ng)并不能缩小梗死面积,而EGFR选择性抑制剂AG-1487可部分抵消EdCC的心肌保护效应,说明EGFR及其下游MEK1-ERK1/2是关键信号通路,EGF并非关键效应分子。更高浓度的EGF是否可通过该信号通路保护心肌缺血再灌注损伤尚无报道。EnSCs还表达TGF、HGF、FGF、Ang I、PDGF等多种细胞因子,可能在EGFR水平及受体后信号转导水平有交叉反应并最终汇聚至MEK1-ERK1/2[11]。我们认为EdCC的保护效应不能完全归因于单一细胞因子,而是多种细胞因子的“鸡尾酒”效应。EdCC对其它信号通路的激活或抑制也可能十分重要。Millipore蛋白超滤技术还可浓缩EnSCs培养液中富含miRNA的外体[17],miRNA也可能参与了EdCC的心肌保护效应。
EnSCs是极具潜力的“现货”干细胞产品的种子细胞,我们的前期研究发现EnSCs通过旁分泌效应保护心肌细胞并改善心梗后心功能[8]。我们首次提出用注射EdCC代替EnSCs移植,证明了EdCC可保护小鼠心肌缺血再灌注损伤,MEK1-ERK信号通路是关键机制,其中EGFR是重要组成部分。EdCC的应用可避免EnSCs移植潜在的心律失常[18]、肿瘤形成[19]及血栓栓塞[20]等风险,其应用前景较EnSCs可能更为广阔。该研究结果对目前成体干细胞治疗模式从细胞转移到细胞因子具有重要的理论意义。
[参考文献]
[1]王文, 朱曼璐, 王拥军, 等. 《中国心血管病报告2012》概要[J]. 中国循环杂志, 2013, 28(6): 408-412.
[2]Geltman EM. Infarct size as a determinant of acute and long-term prognosis[J]. Cardiol Clin, 1984, 2(1): 95-103.
[3]奚群英, 祝宝华. 细胞膜钠钙交换蛋白与心肌缺血/再灌注损伤[J]. 中国病理生理杂志, 2006, 22(12): 2476-2479.
[4]Hausenloy DJ, Yellon DM. Targeting myocardial reperfusion injury:the search continues[J]. N Engl J Med, 2015, 373(11): 1073-1075.
[5]Fisher SA, Brunskill SJ, Doree C, et al. Stem cell therapy for chronic ischaemic heart disease and congestive heart failure[J]. Cochrane Database Syst Rev, 2014, 4: CD007888.
[6]朱峰, 文辉才, 郭光华. 干细胞旁分泌效应在ALI/ARDS治疗中的研究进展[J]. 中国病理生理杂志, 2012, 28(4): 755-759.
[7]Massasa EE, Taylor HS. Use of endometrial stem cells in regenerative medicine[J]. Regen Med, 2012, 7(2): 133-135.
[8]Jiang Z, Hu X, Yu H, et al. Human endometrial stem cells confer enhanced myocardial salvage and regeneration by paracrine mechanisms[J]. J Cell Mol Med, 2013, 17(10): 1247-1260.
[9]方军, 吴黎明, 陈良龙. RISK信号通路在心肌预处理及后处理中的作用[J]. 中国病理生理杂志, 2009, 10(10): 2062-2067.
[10]Arda-Pirincci P, Bolkent S. The role of epidermal growth factor in prevention of oxidative injury and apoptosis induced by intestinal ischemia/reperfusion in rats[J]. Acta Histochem, 2014, 116(1): 167-175.
[11]Ockenga W, Kühne S, Bocksberger S, et al. Epidermal growth factor receptor transactivation is required for mitogen-activated protein kinase activation by muscarinic acetylcholine receptors in HaCaT keratinocytes[J]. Int J Mol Sci, 2014, 15(11): 21433-21454.
[12]Endres NF, Barros T, Cantor AJ, et al. Emerging concepts in the regulation of the EGF receptor and other receptor tyrosine kinases[J]. Trends Biochem Sci, 2014, 39(10): 437-446.
[13]Anversa P, Cheng W, Liu Y, et al. Apoptosis and myocardial infarction[J]. Basic Res Cardiol, 1998, 93(Suppl 3): 8-12.
[14]van Berlo JH, Molkentin JD. An emerging consensus on cardiac regeneration[J]. Nat Med, 2014, 20(12): 1386-1393.
[15]郭晓令, 刘庆, 王婵, 等. 重编程诱导多功能干细胞的研究进展[J]. 中国病理生理杂志, 2014, 7(7): 1218-1222.
[16]王茜, 邓凤君, 林焕冰, 等. cAMP信号分子在缺血后适应心肌保护机制中的作用[J]. 中国病理生理杂志, 2011, 8(8): 1496-1501.
[17]Das S, Halushka MK. Extracellular vesicle microRNA transfer in cardiovascular disease[J]. Cardiovasc Pathol, 2015, 24(4): 199-206.
[18]Chang MG, Tung L, Sekar RB, et al. Proarrhythmic potential of mesenchymal stem cell transplantation revealed in aninvitrococulture model[J]. Circulation, 2006, 113(15): 1832-1841.
[19]Fong CY, Gauthaman K, Bongso A. Teratomas from pluripotent stem cells: A clinical hurdle[J]. J Cell Biochem, 2010, 111(4): 769-781.
[20]Gleeson BM, Martin K, Ali MT, et al. Bone marrow-derived mesenchymal stem cells have innate procoagulant activity and cause microvascular obstruction following intracoronary delivery:amelioration by antithrombin therapy[J]. Stem Cells, 2015, 33(9): 2726-2737.
(责任编辑: 林白霜, 余小慧)
EdCC reduces myocardial ischemia-reperfusion injury via MEK-ERK signaling pathwayJIANG Zhi1, JIA Zhong-shen2, WU Yue-ting1, WEI Fang1, 2
(1DepartmentofCardiology,GuizhouProvincialPeople'sHospital,GuizhouProvincialCardiovascularDiseaseInstitute,Guiyang550002,China;2GuizhouMedicalUniversity,Guiyang550004,China.E-mail:weifanggzsy@qq.com)
[ABSTRACT]AIM: To investigate the myocardial protective effect of endometrial stem cell (EnSC)-derived cytokine cocktail (EdCC) on myocardial ischemic reperfusion injury and the MEK-ERK signaling pathway. METHODS: A mouse model of myocardial ischemic reperfusion injury was established. Infarct area, cell apoptosis, and expression of cleaved caspase-3 and phosphorylatied ERK1/2 were determined by TTC/Evans blue staining, TUNEL assay and Western blot, respectively. RESULTS: The mesenchymal characteristics were observed in the EnSCs with expressing CD90 and in absence of CD34 and CD45. EdCC contained (6 811±312) ng/g epidermal growth factor (EGF) protein. The phosphorylation of ERK1/2 markedly increased after injection of EdCC, but was abolished by MEK1 inhibitor PD98059 (5 mg/kg). EdCC decreased the infarct area and apoptotic cell number in the border zone and inhibited caspase-3 activation. However, the effects were abolished by MEK1 specific inhibitor PD98059. EGF did not decrease the infarct area, but the EGF receptor antagonist AG-1487 (6 mg/kg) partly abolished the myocardial protective effect of EdCC. CONCLUSION: EdCC protects the myocardium from ischemic reperfusion injury via activating MEK1-ERK signaling pathway, indicating an essential role in the transmission of stem cell therapy from the cell transplantation to cytokine based strategy.
[KEY WORDS]Endometrial stem cell-derived cytokine cocktail; MEK-ERK signaling pathway; Myocardial infarction; Ischemia-eperfusion injury
doi:10.3969/j.issn.1000- 4718.2016.02.005
[中图分类号]R363;R542.2+2;Q255
[文献标志码]A
通讯作者△Tel: 0851-85603809; E-mail: weifanggzsy@qq.com
*[基金项目]国家自然科学基金地区科学基金资助项目(No. 81460050); 贵州省科技厅科学技术基金(黔科合J字[2014]2112号); 贵州省卫生厅科学技术基金资助项目 (No.gzwkj2013-1-006)
[收稿日期]2015- 09- 14[修回日期] 2015- 11- 16
[文章编号]1000- 4718(2016)02- 0221- 07

