CaSR在淫羊藿苷诱导的胚胎干细胞向心肌细胞分化中的作用*
孙 健, 白淑芝, 李 爽, 许晓义, 袁 辉, 魏 韬, 徐长庆, 栾海蓉△
(1牡丹江医学院,黑龙江 牡丹江 157011;2哈尔滨医科大学病理生理教研室,黑龙江 哈尔滨 150081)
CaSR在淫羊藿苷诱导的胚胎干细胞向心肌细胞分化中的作用*
孙健1,白淑芝2,李爽1,许晓义1,袁辉1,魏韬1,徐长庆2,栾海蓉1△
(1牡丹江医学院,黑龙江 牡丹江 157011;2哈尔滨医科大学病理生理教研室,黑龙江 哈尔滨 150081)
[摘要]目的: 观察钙敏感受体(calcium sensing receptor,CaSR)对淫羊藿苷(ICA)诱导小鼠胚胎干细胞向心肌细胞分化的影响。方法: 129小鼠ES-D3细胞经直接悬浮法形成拟胚体(EBs),应用ICA定向诱导,透射电镜观察分化细胞的超微结构;免疫荧光和Western blot分别检测细胞有无α-辅肌动蛋白(α-actinin)和肌钙蛋白I(cTnI)的表达;流式细胞术检测细胞分化率;Western blot检测心肌特异转录因子NKx2.5、GATA-4和CaSR的蛋白表达。结果: ICA诱导2 d后,可见自发性收缩的细胞簇;随着诱导分化时间的延长,α-actinin和cTnI蛋白的表达逐渐增多;CaSR、NKx2.5和GATA-4蛋白在分化早期表达最多,持续表达至晚期;电镜观察分化细胞中可见连接结构、肌丝;CaSR激动剂新霉素能够增加早期EBs中CaSR、NKx2.5和GATA-4的表达,CaSR抑制剂NPS2390能够阻断上述作用。结论: CaSR在胚胎干细胞分化的心肌细胞中有表达,CaSR活化可通过增加NKx2.5和GATA-4的表达促进心肌细胞的分化。
[关键词]钙敏感受体; 淫羊藿苷; 细胞分化; 心肌细胞
由于成熟的心肌细胞缺乏再生能力,一旦损伤只能由瘢痕替代,严重影响心脏的功能甚至导致心力衰竭。胚胎干细胞(embryonic stem cells,ESCs)具有增殖和分化的全能性[1],是一种很有实用价值的、理想的心肌细胞移植疗法的有效来源。揭示促进ESCs向心肌细胞定向分化并提高转化率是亟待解决的问题。
本课题组前期研究表明,钙敏感受体(calcium sensing receptor,CaSR)在小鼠胚胎干细胞(mouse embryonic stem cells,mESCs)有表达,其活化可以增加细胞内钙离子浓度[2]。但其对胚胎干细胞向心肌细胞定向分化的影响及机制,迄今尚不清楚。淫羊藿苷(icariin,ICA)是一个新型的生物反应调节剂和分化剂,有研究报道在体外淫羊藿苷可诱导小鼠胚胎干细胞向心肌细胞分化[3-4]。因此,本文以mESCs为观察对象,通过淫羊藿苷诱导,对上述尚未解决的问题开展研究。
材料和方法
1材料
小鼠胚胎干细胞株129小鼠ES-D3细胞株CRL-11632购于ATCC;胎牛血清购自Gibco;小鼠白血病抑制因子购自Chemicon;CaSR、 FITC荧光标记 II 抗购自Sigma;Fluo-3/Am购自Invitrogen;心肌肌钙蛋白I(cardiac troponin I,cTnI)和α-辅肌动蛋白(α-actinin)抗体购自Santa Cruz。
2方法
2.1ES-D3的培养及向心肌细胞的诱导分化小鼠ES-D3复苏,第2天换液。2 d后,加入0.25%胰酶-EDTA消化传代,传代后选择生长状态较好的ESCs克隆充分消化离心后用分化培养基进行重悬,计数后接种于10 cm的细胞培养皿中,每个皿接种10 mL细胞悬液,放置37 ℃、5% CO2培养箱中培养2 d,制备拟胚体(embryoid bodies,EBs)。胚体悬浮培养5 d后,按每孔10个胚体数量接种于6孔板进行胚体贴壁培养及诱导,每板分别设ICA组及实验组各3孔,培养并每天观察。
2.2免疫荧光分析预冷0.1 mol/L PBS冲洗各组细胞,4%多聚甲醛固定30 min,1%山羊血清封闭30 min;分别用抗CaSR、cTnI和α-actinin抗体(1∶50)孵育,4 ℃过夜,阴性对照用0.1 mol/L PBS代替 I 抗;0.1 mol/L PBS冲洗3次;FITC标记的IgG(1∶50)37 ℃孵育1 h;PBS冲洗3次,核用DAPI复染。荧光显微镜观察并拍照。
2.3Western blot法检测钙敏感受体和心肌特异转录因子Nkx2.5、GATA-4的表达将待提取蛋白的细胞吸去培养液,置于冰上,预冷PBS清洗3次;吸去PBS,加入适量RIPA裂解液,冰上孵育30 min,BCA蛋白浓度测定试剂盒测定蛋白浓度,SDS-PAGE分离蛋白,电压100 V;电流300 mA,冰浴中转膜90 min。加入 I 抗,室温振荡孵育1 h,4 ℃过夜。洗膜后TBST稀释各相应 II 抗,室温振荡孵育1 h;碱性磷酸酶法显色,凝胶成像系统下拍照。
2.4电镜技术取贴壁培养早期(贴壁后5 d)、中期(贴壁后10 d)、晚期(贴壁后17 d)的细胞,预冷PBS悬浮后2 000 r/min离心10 min,使细胞形成团块。2.5% 戊二醛4 ℃固定细胞2 h,常规脱水、透明、包埋、染色后制成50~70 nm的超薄切片,透射电镜下观察各细胞超微结构的变化,拍照。
2.5流式细胞术mESCs诱导分化的第12天,1%多聚甲醛固定后,预冷的0.1 mol/L PBS冲洗EBs 3次,使之分离成单细胞的悬浮液。cTnI(1∶100)孵育4 ℃过夜,FITC标记抗兔IgG 37 ℃ 1 h,流式细胞术检测cTnI表达阳性的心肌细胞所占的百分比。
3统计学处理
数据用均数±标准差(mean±SD) 表示,统计学处理使用SPSS 17.0统计软件, 采用单因素方差分析比较均数间差异,多重比较应用Bonferroni校正的t检验,以P<0.05 为差异有统计学意义。
结果
1mESCs的诱导分化
生长在琼脂上未分化的单个mESCs较小,呈圆形。悬浮培养 2 d后,mESCs聚集成EBs,呈立体球形结构。随着培养时间的延长,EBs进一步成熟,体积增大,边界较光滑,中间细胞密度相对较大,颜色较深。5 d后将EBs转移到明胶铺被的培养皿贴壁生长。2~3 d可见自发性节律性收缩的细胞群,跳动频率约20~60 beats/min,分化中期可达70~100 beats/min,1个EBs可包含1个或者多个收缩中心,表明心肌细胞已经分化;高倍镜下可观察到纤维状的细胞群,见图1。
2ICA诱导mESCs分化的心肌细胞超微结构
透射电镜下可看到分化细胞胞浆内内质网发达,合成功能增强,含有丰富的线粒体、粗面内质网等细胞器外,可以看到大量成束的肌丝,细胞间的桥粒和紧密联接等连接结构,见图2。

Figure 1.The differentiation of mouse embryonic stem cells (mESCs) into cardiomyocytes. A: undifferentiated mESCs in agar (×200); B: 2 days EBs in suspension method (×100); C: 4 d EBs in suspension method (×100); D: beating cells of cardiac clusters derived from EBs with ICA induction (×200, rectangular frames refereed to the contracting areas).
图1小鼠ES细胞分化为心肌细胞的形态学变化

Figure 2.The ultrastructural alteration of differentiation cells under transmission electronic microscope. A: the bundles of myofilaments were observed in the cytoplasm; B: the arrow indicates the closely connected (rectangular frame refereed to desmosome).
图2透射电镜下分化细胞的超微结构变化
3心肌特异性蛋白α-actinin和cTnI在ICA诱导的mESCs分化的心肌细胞的表达
免疫荧光原位检测心肌特异性结构蛋白α-actinin和cTnI的表达,结果显示EBs内表达大量α-actinin或cTnI,FITC可被激发出绿色荧光,DAPI可将细胞核染成蓝色,当用PBS代替 I 抗时,没有阳性染色,见图3。

Figure 3.The expression of cardiac-specific proteins in mESC-derived cardiomyocytes (mESC-CMs) was detected by immunofluorescence (×200).
图3通过免疫荧光检测心肌特异性蛋白在mESC-CMs的表达
Western blot结果显示在贴壁培养的第1天(d1)α-actinin表达量较低,而cTnI几乎不表达。随着分化时间的推移,α-actinin和cTnI表达逐渐升高,其中在分化第9天(d9)显著增强,在分化第13天(d13)达到较高水平,之后变化不大,见图4。
4心肌CaSR蛋白和特异性转录因子GATA-4、Nkx2.5的表达
EBs进行贴壁培养后第 1 d(即分化d1),心肌CaSR蛋白和特异性转录因子Nkx2.5、GATA4均有表达,继续贴壁培养,三者的表达均相应增加。结果还发现在mESCs分化为心肌细胞过程中,CaSR、Nkx2.5和GATA-4表达具有一定的规律性,都是在d5达到高峰,之后略有下降,见图5。
5CaSR活化对mESCs向心肌细胞分化的影响
流式细胞术检测结果显示,在ICA组、0.4 mmol/L新霉素和0.01 mmol/L NPS2390组,cTnI阳性细胞分别占总数的(14.97±0.80)%、(25.82±2.41)%和(10.26±0.16)%,经过Bonferroni法进行校正检验后发现各组间差异具有统计学显著性(P<0.05),见图6。
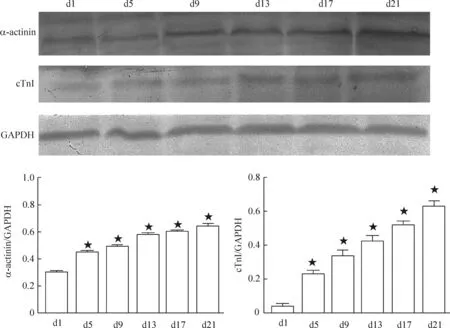
Figure 4.The expression of α-actinin and cTnI in the differentiated cells by Western blot. Mean±SD.n=3.★P<0.05vsd1 group.
图4Western blot检测诱导分化细胞的α-actinin和cTnI蛋白表达

Figure 5.The expression of Nkx2.5, GATA-4 and CaSR in differentiated cells by Western blot.Mean±SD.n=3.★P<0.05vsd1 group.
图5Western blot检测诱导分化细胞Nkx2.5、GATA-4 和CaSR蛋白的表达
6CaSR活化对Nkx2.5和GATA4蛋白表达的影响
Western blot结果表明,用CaSR的激动剂0.4 mmol/L新霉素处理24 h后,GATA-4 和Nkx2.5蛋白的表达均较对照组增多(P<0.05);而抑制剂NPS2390对其具有抑制作用,阻断了激动剂的作用,见图7。
讨论
心肌细胞是终末分化细胞,不可再生,细胞移植可以用来修复损伤或死亡的心肌细胞,以改善心脏功能,是一种潜在的很有实用价值的治疗措施[5]。ESCs是具有多向分化潜能的全能干细胞,在培养过程中能分化成包括自发性搏动心肌细胞在内的3个胚层的所有体细胞[6]。提高ESCs向心肌细胞的定向分化率并揭示其机制,日益受到心血管领域科学工作者的关注。
体外诱导mESCs定向分化为心肌细胞主要是通过形成EBs的方法,本实验采用直接悬浮法,同时选择传统中药ICA做诱导剂,可以形成大量的EBs为后续实验提供便利。有研究发现在ESCs向心肌细胞分化的过程中,心肌细胞特异性肌小节蛋白依次表达,其中出现较早的是辅肌动蛋白,出现较晚的是肌钙蛋白。其中心肌肌钙蛋白Ⅰ是心室和心房细胞中典型的蛋白,在较晚期才有少量表达,这与早期胚胎内心肌发育过程一致。本实验采用免疫荧光法检测α-actinin和cTnI的表达情况,结果显示mESCs诱导分化的细胞中α-actinin和cTnI呈阳性表达;Western blot检测结果显示,在整个心肌诱导分化过程中,α-actinin表达量都保持在较高水平,并且晚期明显高于早期;而cTnI在分化的早期表达较少,在分化中晚期逐渐升高。这与前人的研究成果相似[4, 7]。说明在诱导分化过程中,随分化进程的进展心肌特异性结构蛋白的合成逐渐增多,符合胚胎心脏发育的规律。同时本实验电镜超微结构的结果显示随着诱导分化进程的发展,细胞内出现大量与心肌细胞功能相适应的细胞器,如线粒体、内质网、高尔基体、糖原等(结果未显示)。分化至晚期阶段,细胞质内可以看到大量成束的肌丝,新生的“Z线”及细胞间的桥粒和紧密联接等连接结构,此时肌丝具有肌节的功能,电镜超微结构的结果进一步说明诱导mESCs分化细胞的结构与正常心肌细胞的结构相似。

Figure 6.The effect of CaSR activation on differentiation of mouse embryonic stem cells into cardiomyocytes. Expression of cardiac-specific marker protein cTnI expression in the EBs by flow cytometry. The red dots indicate cTnI-positive cells (in R2 region). The X-axis and Y-axis corresponded to the fluorescence intensity and the number of cells per channel (events), respectively.
图6CaSR活化对小鼠胚胎干细胞向心肌细胞分化的影响
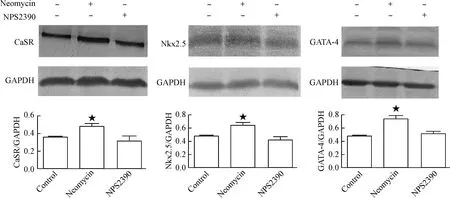
Figure 7.The effect of CaSR activation on GATA-4 and Nkx2.5 expression.n=3.★P<0.05vscontrol group.
图7CaSR活化对GATA-4和Nkx2.5表达的影响
ESCs分化为心肌细胞是一个复杂的过程,需要多种信号活动的协调[8]。大量转录因子均参与了心脏发育过程的调控, 如GATA-4、 Nkx2.5、Pitx2等。其中Nkx2.5、GATA-4是影响心脏发育2个最为重要的转录因子,且二者具有协同作用,调控着众多下游基因的准确表达。本实验中采用Western blot法检测了ICA诱导mESCs分化不同时段二者蛋白的表达,结果显示在细胞分化早期即在贴壁诱导1 d都有表达,5 d达到高峰,在依次检测的各个时点,表达虽然有下降,但仍保持着高表达状态。由此可以证明,心肌特异性转录因子Nkx2.5和GATA-4在mESCs向心肌细胞分化早期即有表达,从而激活其它如ANF、心脏α-actinin等基因的表达,促进心肌细胞的继续分化和完善。
本实验应用Western blot 检测CaSR在分化不同时点的表达。实验结果显示,与Nkx2.5和GATA-4的表达情况类似,在分化第 5天 CaSR蛋白表达最高,其它时点表达量有所降低,但仍保持较高水平。因此判断CaSR在mESCs向心肌细胞分化早期发挥其作用。
细胞内钙离子信号调节许多细胞功能和器官发育。已有文献报道,细胞内Ca2+通过CaSR在多种细胞的分化和增殖中发挥重要作用[9-11]。为了观察CaSR活性改变对mESCs向心肌细胞分化的影响,本研究根据分化细胞不同时点CaSR蛋白的表达情况,选择了在贴壁培养的1 d分别加入CaSR激动剂新霉素和抑制剂NPS-2390作为干扰因素,探讨CaSR在mESCs向心肌细胞分化中的作用。本实验发现,和ICA组相比,新霉素能显著增加心肌细胞跳动率、cTnI阳性细胞的百分比及早期分化细胞中CaSR、Nkx2.5和GATA-4蛋白的表达,但上述效应可以被NPS-2390抑制。这些结果提示CaSR激活能促进mESCs向心肌细胞的分化,并且是通过促进转录因子Nkx2.5和GATA-4表达而实现的。
总而言之,本部分研究说明在mESCs向心肌细胞分化的过程,激活CaSR可以通过促进转录因子Nkx2.5和GATA-4表达而促进定向转化,为如何提高ESCs细胞定向诱导分化为心肌细胞的分化率,提供了一个有价值的理论依据。
[参考文献]
[1]Terrovitis JV, Smith RR, Marbán E. Assessment and optimization of cell engraftment after transplantation into the heart [J]. Circ Res, 2010, 106(3): 479-494.
[2]孙健,于金凤,栾海荣,等. 小鼠胚胎干细胞钙敏感受体的表达和其对细胞增殖的影响[J]. 中国病理生理杂志, 2014, 30(4):651-657.
[3]Zhou L, Zheng B, Tang L, et al. Involvement of PIKE in icariin induced cardiomyocyte differentiation from murine embryonic stem cells[J]. Pharmazie, 2014, 69(3):198-202.
[4]Sun X, Sun X, Jin X, et al. Icariin induces mouse embryonic stem cell differentiation into beating functional cardiomyocytes[J]. Mol Cell Biochem, 2011, 349(1-2):117-123.
[5]Hassink RJ, Brutel de la Rivière A, Mummery CL, et al. Transplantation of cells for cardiac repair[J]. J Am Coll Cardiol, 2003, 41(5):711-717.
[6]Pera MF, Reubinoff B, Trounson A. Human embryonic stem cells[J]. J Cell Sci, 2000,113 ( Pt 1):5-10.
[7]孙晓冬,董韬,于宏伟,等. 淫羊藿苷体外诱导小鼠胚胎干细胞分化为心肌细胞[J]. 解剖科学进展, 2011, 17(2):124-127.
[8]MacLellan WR, Schneider MD.Genetic dissection of cardiac growth control pathways[J]. Annu Rev Physiol, 2000, 62:289-319.
[9]Brown EM, MacLeod RJ. Extracellular calcium sensing and extracellular calcium signaling[J]. Physiol Rev, 2001, 81(1):239-297.
[10]Lin KI, Chattopadhyay N, Bai M. Elevated extracellular calcium can prevent apoptosis via the calcium-sensing receptor[J]. Biochem Biophys Res Commun, 1998, 249(2):325-331.
[11]Ba J, Friedman PA. Calcium-sensing receptor regulation of renal mineral ion transport[J]. Cell Calcium, 2004, 35(3):229-237.
(责任编辑: 陈妙玲, 余小慧)
Roles of calcium sensing receptor in icariin-induced differentiation of mouse embryonic stem cells to cardiomyocyteSUN Jian1, BAI Shu-zhi2, LI Shuang1, XU Xiao-yi1, YUAN Hui1, WEI Tao1, XU Chang-qing2, LUAN Hai-rong1
(1MudanjiangMedicalCollege,Mudanjiang157011,China;2DepartmentofPathophysiology,HarbinMedicalUniversity,Harbin150081,China.E-mail:vivian7835@163.com)
[ABSTRACT]AIM: To study the effect of calcium sensing receptor (CaSR) on icariin (ICA) induced mouse embryonic stem cells (mESCs) to differentiate into cardiomyocytesinvitro. METHODS: mESCs were cultured to embryoid bodies (EBs) by direct suspension method and the differentiation of EBs into cardiomyocytes was induced by ICA. The expression of cardiac specific proteins α-actinin and cardiac troponin-I (cTnI) was analyzed by Western blot and immunofluorescence. The differentiation rate was determined by flow cytometry. The ultrastructure of the derived cardiomyocytes was further characterized by transmission electron microscopy. The expression of cardiac-specific transcription factors Nkx2.5 and GATA-4,as well as CaSR was detected by Western blot. RESULTS: After induction with ICA, the positive characteristics of myocardial cells appeared in the EBs cultured for 2 d. The expression of cardiac-specific sarcomeric protein actinin (α-actinin) and cTnI showed an overall upward trend by Western blot in different phases of ICA induced differentiation. The expression of CaSR, Nkx2.5 and GATA-4 was the highest at an early stage of ICA-induced differentiation. Neomycin (an activator of CaSR) up-regulated CaSR, NKx2.5 and GATA-4 expression in the EBs at early stage of ICA-induced differentiation, all of which were reversed by NPS2390 (an inhibitor of CaSR).CONCLUSION: CaSR is functionally expressed in mESC-derived cardiomyocytes, and activation of CaSR is involved in the differentiation of mESCs into cardiomyocytes by facilitating the expression of NKx2.5 and GATA-4.
[KEY WORDS]Calcium sensing receptors; Icariin; Cell differentiation; Cardiomyocyte
doi:10.3969/j.issn.1000- 4718.2016.02.007
[中图分类号]R363.2
[文献标志码]A
通讯作者△Tel: 0453-6582302; E-mail: vivian7835@163.com
*[基金项目]国家自然科学基金资助项目(No.81300163; No.81200160);黑龙江省教育厅科学技术研究项目(No.12531749; No.12531731);牡丹江医学院科学研究项目(No.IS201308)
[收稿日期]2015- 07- 27[修回日期] 2015- 11- 11
[文章编号]1000- 4718(2016)02- 0234- 06

