层状双金属氢氧化物用于催化水氧化的研究进展
王瑞瑞,赵有璟,邵明飞,项顼,段雪
(北京化工大学化工资源有效利用国家重点实验室,北京 100029)
层状双金属氢氧化物用于催化水氧化的研究进展
王瑞瑞,赵有璟,邵明飞,项顼,段雪
(北京化工大学化工资源有效利用国家重点实验室,北京 100029)
摘要:通过太阳能光解水制取能源(如氢气)是开发清洁能源的重要途径之一,而水分解的半反应——水氧化过程是整体水分解的重要环节与限速步。发展高效、稳定、易获取的水氧化催化剂是实现有效水分解的关键。层状双金属氢氧化物(layered double hydroxides, LDHs)由于其独特的二维层状结构与灵活调变的化学组成,近年来作为水氧化反应催化剂受到研究者越来越多的关注。除用于电化学水氧化的催化剂外,LDHs在光(电)催化水氧化方面也表现出独特的优势。研究者正致力于LDHs基高效水氧化催化剂的研究,取得了很好的进展。主要综述了LDHs及其复合结构在催化水氧化方面的最新研究进展,以期为水氧化催化剂的结构设计与性能增强提供新的思路。
关键词:层状双金属氢氧化物;水滑石;催化剂;氧化;电化学;光电化学
2015-11-26收到初稿,2015-12-14收到修改稿。
联系人:项顼。第一作者:王瑞瑞(1989—),女,硕士研究生。
Received date: 2015-11-26.
引 言
随着传统化石燃料(煤、石油、天然气等)的不断消耗,人们对能源的需求持续增长,能源问题逐渐成为制约人类社会发展的重要问题。与此同时,大量使用传统化石燃料造成的环境污染也已经到了不容忽视的地步。鉴于此,世界各国都在积极寻找绿色、可再生的新能源,包括太阳能、生物质能、风能、地热能和海洋能等[1-2]。其中,太阳能由于其总量巨大、安全性高、成本低、分布范围广等优点而被重点关注。水分解是产生清洁能源的途径之一,分解产物只有O2和H2,对环境零污染,而O2和H2可作为燃料电池的原料,所以水分解可以保证能源利用过程的绿色、环保。目前研究较多的水分解过程主要有电化学水分解和光(电)化学水分解。通过电化学或光电化学分解水的方法实际上实现了电能和化学能、太阳能和化学能之间的转换,通过这个过程可以实现氢能源的可持续生产,并以此驱动燃料电池等能源器件[3-4]。
本文主要介绍近年来LDHs及其复合材料用于催化水氧化方面的研究进展,对LDHs在电化学水氧化和光(电)化学水氧化方面的应用分别做了详细介绍,着重阐述了水氧化催化剂的结构设计思路与催化性能增强机制。
1 催化水分解
1.1 电催化水分解机理
氢能被认为是21世纪最有潜力的二次能源,然而,无论是电解水制氢还是燃料电池,从氢能制备到利用,如何节约能耗、降低成本、最大限度地提高效率与产率始终是技术难题。水电解过程中的能耗大、效率低的主要原因之一是析氧过电位较高,并且电极的稳定性差也是一直以来亟待解决的问题,因此高效的电催化析氧阳极的开发至关重要。自从20世纪六七十年代,科研工作者们就开始寻求一种合适的析氧材料。从阳极材料研究之初,贵金属及其氧化物一直是备受青睐的材料。Pt 系催化剂具有较强的耐腐蚀性、导电性和优良的电催化性能,但由于价格昂贵,机械强度低,Pt 经常作为负载材料,与其他材料一起作为催化阳极,如 Pt/C[5]、Pt/Ti[6-7]等。
除了贵金属,Ni、Co、Fe、Zr、Nb、Mn 等过渡金属在碱性介质中具有较高的阳极析氧催化活性。20世纪六七十年代,金属及合金阳极的表面氧化层逐渐引起人们的关注,随后科研工作者们纷纷研究金属氧化物作为活性阳极,如 MnO2、Fe2O3等[8-10]。MnO2是价格低廉且活性好的催化材料,Jaakko 等[11]研究了多种氧电极催化材料,对比发现MnO2具有较强的催化活性。蒋太祥等[12]将MnO2与稀土混合制备出一种新型的氧电极,该电极性能稳定可靠,相同电极电位下,电流密度从原来的20 mV·cm-2提高至60 mV·cm-2。
一般地,认为O2在钙钛矿型氧化物表面的析氧机理[13]为

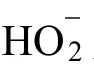
MO键能理论显示,随着过渡金属的d电子数目的增加,钙钛矿型氧化物表面形成的Mz-OH键能会降低,一般地,Cr>Mn>Fe>Co>Ni[16]。这个趋势是与Mz-OH中占据的反键轨道数有关。因此含Mn、Fe类型的钙钛矿型氧化物表面覆盖的OH自由基会较多。
通常不同类型的氧化物的析氧反应机理不同,但各种反应机理之间也存在着一定的共性,即析氧反应的活性点都是高价态的金属阳离子,且都存在OH-的电化学吸附步骤。
在电化学水分解中,有效的电催化剂需要满足Nernst电势(E)要求。由于水分解体系可以分为两个半反应:产氧反应H2O/O2和产氢反应H2O/H2。除了Nernst电势所需要的电势外,为了达到一定的催化作用还需要一些电势,这些额外的电势被称为过电势,过电势是限制转化为催化电流效率的关键因素。
1.2 光催化水分解机理
太阳能分解水产生清洁能源(氢气),具有无污染的优势。在催化剂表面发生的该过程涉及电子-空穴分离、转移、参与反应等多个步骤(图1)。半导体光催化材料的价带(VB)电子通过光激发跃迁到导带(CB),在VB留下空穴[图1步骤(i)]。然后,电子、空穴发生分离并迁移到催化剂表面,参与氢气生成反应(HER)和氧气生成反应(OER)[图1步骤(ii)]。电子和空穴也会发生复合[图1步骤(ⅲ)],不能被有效利用,使光解水效率降低。因此,高性能的光催化材料需要有适当的带隙值与能带结,即导带位置(CBM)和价带位置(VBM),从而能有效吸收、利用太阳能,并实现电子、空穴有效分离和参与反应。光催化材料还应具有高的电荷载流子密度及快速的表面反应动力学[17]。

图1 光催化材料表面太阳光驱动水分解过程[17]Fig. 1 Schematic illustration of solar-driven water splitting over photocatalyst[17]
1972年,Fujishima等[18]报道了光辅助电解水过程,介绍了光辅助电解水的电化学电池的设计思路,即通常在进行电解水反应时需要阳极和阴极之间的电势差达到1.23 V以上,而这个电势差相对应的光波长约为1000 nm,因此,将光能有效地应用到电解水体系中,利用可见光实现水的分解将成为可能。基于以上思想,他们设计了一种电化学电池,具体结构如图2所示。当光照射在TiO2电极片上时,外电路检测出了从对电极(铂黑电极)至TiO2电极有电流通过,这说明TiO2电极上有氧化反应发生(析氧),而在铂黑电极上有还原反应发生(析氢),即在不施加外加电势时,仅在光的照射下,该电化学电池可使水发生裂解反应。从这之后的40多年,许多科学家对光电催化裂解水体系中的新材料的开发以及太阳光裂解水效率的提升进行了深入研究,获得了很多发现。Bard等[19-20]致力于设计基于半导体的光电催化体系;Grätzel等[21-22]对光电化学电池的构建进行了一系列研究。

图2 由TiO2电极片与铂黑电极组成的光电化学池[18]Fig. 2 Photoelectrochemical cell constructed by TiO2electrode and platinum black electrode[18]1—TiO2electrode;2—platinum black electrode;3—membrane;4—fixed resistance;5—voltmeter
目前,光电催化水分解的光电化学电池已演化成以下3种[23]:①在图3(a)中,光电化学电池的外加电势由太阳能电池提供,因此这种类型的光电化学电池的唯一能量来源为太阳光,不需要其他额外能量即可进行水分解反应,并且阴极材料也不需要使用导带底低于水的还原电势的半导体,因为太阳能电池可提供足够高的外加电势用以弥补该电势差,从而扩大了可使用的半导体的范围;②在图3(b)中,由于不采用图3(a)中的太阳能电池提供外加电势,该电池结构中同时存在光阳极和光阴极,利用光阳、阴电极之间的能带位置差以提供全部或部分的偏压,使水分解反应得以进行;③在图3(c)中,光阳极和光阴极被串联起来,此电池结构类似于多质结的太阳能电池板,即光首先照射到带隙更大的半导体材料上,透过该半导体材料的光的波长正好可以被另一电极的半导体材料所吸收。图3(c)所示的电池结构还进行了变化(图4):将不同带隙的半导体材料直接接触在一起构成电池,这种光电化学电池不需要导线连接两个光电极即可实现光电催化水分解反应,为构建独立、简单、低价的光能-化学能转化设备提供了借鉴[24]。

图3 3种典型的光电催化水分解反应器[23]Fig. 3 Three types of photoelectrochemical water splitting reactors[23]
光电催化水分解的工作原理如图5所示,该体系由阳极和阴极两个电极和电解液构成[25]。为了使水分解,两个电极之间的电势差必须达到1.23 V以上,这是由水分解反应的Gibbs自由能(ΔG = 237.2 kJ·mol-1)通过Nernst方程转化得到的。光电催化体系中的阴极通常为铂对电极,阳极为具有光响应的材料(半导体材料),以n型半导体为例,存在于价带中的电子在吸收了大于或等于半导体带隙的光子后,被激发跃迁至导带成为光生电子(e-),同时在价带中留下光生空穴(h+)。光生空穴向半导体表面移动,参与水的氧化反应,如式(5)所示;导带上聚集的光生电子和价带上的光生空穴使半导体中产生内部电场,从而使光生电子向半导体内部移动,迁移至外部电路并转移至阴极,参与水的还原反应,如式(6)所示

图4 光催化分解水的“无线结构”装置[24]Fig. 4 Scheme of wireless photochemical water splitting setup[24]

图5 光电催化水分解电荷转移示意[25]Fig. 5 Scheme of charge transfer in photoelectrochemical water splitting[25]

其中水氧化的半反应需要同时转移4个电子,因此是控制光电催化水分解过程的关键步骤。同时,光电催化体系包含半导体对光的吸收、光生载流子的分离、与电解质的接触面积等涉及物理和化学等多个学科的过程,因此调控光电催化反应的进程存在难度。
1.3 催化水分解的瓶颈及主要解决方法
通过水的分解获取清洁能源氢气是缓解人类能源紧缺的重要途径, 而水的氧化作为该反应的瓶颈限制着水分解的实现。在电化学水分解中,找到有效的满足Nernst电势(E)要求的电催化剂至关重要;而在光(电)化学水分解中,水的光解主要分为3 个步骤:光子的捕获、电子的转移以及质子的还原与水的氧化,能够像光合系统中的放氧中心一样,在光照的条件下催化氧化水得到氧气的高效催化剂对于水的光解过程非常关键。
水的氧化反应是吸热反应,热力学不能自发进行,而且在pH = 0时,水的氧化电位E0(O2/H2O) = 1.23 V。由于涉及4e-和4H+的转移及O—O 键的形成,而使得过程变得复杂,并且催化过程中产生的不稳定高价金属氧代中间体也为反应机理的研究增加了难度。出于对清洁和可再生能源的迫切需求和人类模仿自然反应的本能愿望,越来越多的科研工作者投入到水催化氧化的研究中。自1982 年[26]首例具有催化活性的均相水氧化催化剂“blue dimmer”(双核联吡啶钌配合物)被报道以来,出现了很多种催化剂:①金属配合物组成的分子催化剂,如含Ru、Ir、Mn、Co、Fe和Cu的配合物。②无碳分子催化剂。由于传统的水氧化催化剂具有不稳定的缺陷,2010年Hill等[27]发明了可溶的无碳分子催化剂与金属形成配合物来进行水的氧化,如[Co4(H2O)2(PW9O34)2]10-,不仅有很好的催化效果(O2的TOF ≥5 s-1,pH = 8),稳定性也得到了很大的提高。2012年[28]报道了一种新的基于杂多酸分子并与同构或异构催化剂的优点结合起来的水氧化催化剂。2013年[29]制备了混合价的多金属氧酸盐分子催化剂K7[CoⅢCoⅡ(H2O)W11O39],其利用可见光,对水的氧化表现出了优异的性能及良好的稳定。2014年,Hill等[30]又制备出了无碳含钴基的分子催化剂Na10[Co4(H2O)2(VW9O34)2]·35H2O,其TOF 高达1×103s-1,具有非常高的催化活性。③无机金属氧化物、复合金属氧化物、氢氧化物等催化剂。如Smith等[31]通过光化学金属有机沉积的方法制备了非晶(混合)金属氧化物,可以有效地控制混合金属的组成,如a-Fe100-y-zCoyNizOx,其催化活性要比相应的氧化物高很多。Xiang等[32]利用金属氧化物SnO2和TiO2与染料[Ru(bpy)2(dpbpy)]2+, 以及水氧化催化剂[{Ru4O4(OH)2(H2O)4}(γ-SiW10O36)2]10-构成了三元体系作为光阳极,这种构造不仅增加了电子空穴的转移速率,也使得光吸收利用增强,从很大程度上提高了水氧化催化的能力。Matt等[33]将多金属氧酸盐POM与杂环金属铱(Ⅲ)利用共价键形成复合物Ir(Ⅲ)-POM,这种结构的设计可提高寿命、增加电子空穴的分离,进而增强活性。Fielden 等[34]研究了用多金属氧酸盐POM(如水氧催化剂及光敏剂等)处理后的金属氧化物TiO2作为光阳极,在中性或弱酸性的条件下,可进行水的催化氧化反应。这也第一次证实了多金属氧酸盐表面固定化的光阳极复合物可用于可见光水氧化催化的反应中,而且性能会大幅提高。Arindam等[35]用简单水热的方法通过控制材料的结晶度、改变溶剂和反应时间制备了无定形的钴铁氧化物(CoFeOx),可作为光化学和电化学氧化水和氧气还原反应的多功能催化剂,催化活性要明显优于NiFe2O4、CoO或Fe2O3。Qi 等[36]研究了多孔NiFe氧化物的水氧化催化活性,同样得到了很好的效果。达到10.2 mA·cm-2电流密度的电势为387 mV,TOF为432 h-1。Hu 等[37]利用电沉积的方法得到了FeNiOx,这种方法可以很好地控制两者的相对含量,并能更好地利用太阳能。
利用单晶半导体作为光阳极进行水分解的研究也备受关注。单晶半导体如Si、InP具有合适的能带结构,能利用可见光、电子-空穴不易复合等优点。将它们作为光阳极用于水分解,其产生的光电压能抑制电子-空穴复合,改善析氧反应缓慢动力学。同时,配合高效水氧化催化剂,提高水分解效率。较常用的催化剂是贵金属及其氧化物,如Ir/IrOx、RuOx等;Co-Pi催化剂;过渡金属 (Ni、Co、Fe、Mn) 的氧化物等[38]。
在各种光催化剂中,TiO2由于良好的化学稳定性、低成本和无毒等特点,成为半导体光催化领域的重要研究对象之一。但是常规制备的 TiO2存在晶粒尺寸大、比表面积小及分散性差等缺点,而且TiO2仅能吸收太阳光的紫外波段(只占总能量的约5%)。因此,改善其光吸收性质,提高太阳能利用率显得尤为重要。对材料进行掺杂、负载等表面修饰手段可以使吸收带移至可见光波段;或者调控结构,使其对可见光响应。Li等[39]构造了Sub-10 nm的金红石型TiO2颗粒,通过增加表面/亚表面缺陷数量,减弱体缺陷的不利影响。缺陷不仅使TiO2价带顶向上移动,导致带隙变窄,而且能促进电荷载流子分离。另外,缺陷导致的Ti3+可增加材料对可见光吸收。这些调控使得Sub-10 nm的TiO2显示出高得多的可见光催化产氢活性。这为设计光催化剂提供了新思路。
总之,与析氢反应(HER)相比,析氧反应(OER)是多质子耦合的多电子转移反应,是一个动力学缓慢的过程。且受到高活化能的限制,需要较高的过电势,这会导致大量的能量消耗,严重限制了系统的整体效率和工业化应用。光(电)催化剂用来修饰电极,能降低活化能、提高转化率。而光电催化剂的性能会制约整个体系的性能,如能量效率、寿命、成本等,这使得它成为光电化学能量转化的一个关键组分。因此要实现太阳光能转化和存储的规模化应用,就需要开发高效、持久、低廉而且可持续的催化剂。
2 层状双金属氢氧化物
层状双金属氢氧化物(layered double hydroxides,LDHs)又名水滑石类化合物,包括水滑石(hydrotalcite)和类水滑石(hydrotalcite-like) 化合物,是具有层状晶体结构的复合氢氧化物[40-42]。LDHs的化学式为:[MⅠ1-xMⅡx(OH)2]x+(An-)x/n·mH2O,其中MⅠ= Mg2+,Ni2+,Fe2+,Co2+,Mn2+等,MⅡ= Al3+,Fe3+,Ti4+等,An-为层间阴离子,m为层间水分子数,其结构如图6所示[43-45]。层板上的金属离子与氧形成的八面体通过共边形成互相平行的单元层,其中MⅠ(低价金属离子) 在一定范围内被半径相近的MⅡ(高价金属离子) 同晶取代而使得层板带正电荷,这些正电荷被位于层间的An-平衡。由于LDHs 层板组成的多样性、层间阴离子的可交换性以及与其他材料特别是有机和生物材料的相容性等,使得这类材料具有丰富的物理化学性能(如酸碱催化、氧化还原性能、光电功能等)[46-47]。

图6 层状双金属氢氧化物结构Fig.6 Structure scheme of layered double hydroxides
随着现代分析技术和测试手段的发展,人们对LDHs 结构和性能的研究不断深入。近年来,基于超分子化学与组装等概念,有关LDHs 的研究发展迅速,在前体制备、结构表征、超分子结构模型建立、插层组装动力学和机理、组装体功能开发等诸多方面取得了许多成果,许多具有特定功能的LDHs材料如NiZn-LDH[48]、NiFe-LDH[49]、CoFe-LDH[50]、CoNi-LDH[51]等被发展出来。由于LDHs组分可调,阳离子可在主体层板上高度分散,过渡金属类水滑石的电化学/电子性能通常会增强,如层板含有Zn、Co、Fe、Ni等元素[52-54]。Gennequin 等[55]报道了基于CoMgAl-LDHs前体的复合金属氧化物,其在甲苯转化CO2的氧化反应中表现出优异的催化活性,甲苯的转化率高达100%,CO2及H2O的选择性高达100%。
一直以来,人们认为LDHs本身不具有光催化性能。直至2009 年,García等[56]报道合成了不同层板金属比例的ZnCr-、ZnTi-、ZnCe-LDHs, 研究其在可见光条件下的光解水产氧的性能。研究发现,Zn/Cr为4:2的ZnCr-LDHs 具有最高的光催化活性, 180 min产氧量约为1.6 mmol, 在波长为410 nm单色光光源下测定其表观量子产率高达60.9%。经过一系列研究,发现通过对LDHs的结构改性与修饰,改变其理化性质可增强催化活性[57]。通过焙烧形成复合氧化物、层板掺杂等方法可改变材料的带隙能结构,增强光活性[58]。
3 LDHs在催化水氧化中的应用
层状双金属氢氧化物(LDHs)除了具有特殊的层状结构外,还有组分可调的特征,阳离子活性成分在其层板上的多功能组合,赋予了它独特的催化性能。尽管目前已有许多关于水滑石材料作为催化剂催化氧气析出的报道,但它们大都需要与其他材料复合,在这些条件下牺牲金属离子会相应减少,形成金属沉积在水滑石表面,从而减弱了水滑石的催化活性和重复利用性。Hwang等[59]成功地合成了混合价新相ZnCo-LDH及其剥离出的纳米片。新制备的ZnCo-LDH超级电容器性能可作为电极。剥离得到的ZnCo-LDH纳米片具有正的表面电荷,可以与阴离子聚合构成新的LDH/聚阴离子复合产物。另外,ZnCo-LDH煅烧后的ZnCo2O4-ZnO纳米复合材料,因为这两种金属氧化物分别具有显著光催化活性和氧化还原能力,可作为光催化剂或氧化还原反应的多相催化剂。
基于LDHs层板金属阳离子以原子水平高度分散及层间阴离子以一定方式有序排列的结构特点,利用LDHs材料作为单一前体,经层板剥离、晶格限域、插层组装及阵列化等途径可以制备出活性位高度分散、组成可调的催化材料。因此,近年来针对LDHs材料在催化化学中的应用研究非常活跃,并且在电化学水氧化和光催化领域出现了很多具有代表性的工作。
3.1 LDHs用于电化学水氧化
Zhao等[60]经过探索,通过共沉淀法制备出的ZnCo-LDH,显示出了高的电催化氧化水的活性和对乙醇氧化的选择性。另外,该材料在这两个催化过程中均不需要添加任何牺牲剂和贵金属。这一结果也促使了对其他含量丰富的双金属或多金属催化和电催化材料的探索。

图7 ZnCo-LDH的XRD图和扫描电镜[61]Fig.7 XRD patterns and SEM images of ZnCo-LDH[61]
LDHs材料被认为是有前景的活性电催化剂,但它们大多是以粉末或颗粒的形式制备的,需要进行烦琐的后续处理,如通过组装工序或使用某些黏合剂进行涂层或将粉末固定到一种导电性基底上。因此,为了实现在实际应用中重复利用时,催化剂本身的高活性和耐用性得以保持,就需要一种包含活性LDH材料的电极。Xiang等[61]制备的锌-钴层状双氧氧化物(ZnCo-LDH)(图7、图8),是在室温下使用电沉积方法直接生长在柔性的Ni箔基底上的。该ZnCo-LDH薄膜含有取向生长的纳米墙结构,对碱性条件下水的氧化反应显示出极好的催化活性和耐久性。其具有高活性的关键因素在于相互连接的二维(2D) LDH纳米片是垂直生长在导电基片上的,因而致使那些有利于催化反应的活性位点大量暴露出来。该催化剂氧化水的催化能力要比钴基电催化剂高出很多。LDH直接生长到电极表面使得催化剂基底正反两面的连接更加牢固,使得它有望在实际应用中作为一种可工程应用的WOC。
Xu等[62]采用微波辅助法合成了ZnCo-LDH纳米片。ZnCo-LDH纳米片除了表现出对OER较高的活性外,过电势为0.54 V时,电流密度约为15 mA·cm-2,这要比ZnCo-LDH纳米颗粒高出很多,也具有更好的稳定性。ZnCo-LDH纳米片的结构一方面可以暴露出更多的催化活性位点,另一方面可以促进电子的转移、提高导电性,这都是其催化活性较强的重要因素。另外,这种合成的程序相对简单,只涉及金属前体和脲,不考虑表面活性剂对电催化性能的干扰,这样一个简单有效的方法可以扩展到实际的大规模生产中。
将活性物质转化为具体的宏观结构是在追求高电催化活性的关键,Sun等[63]制备的Ni-Fe的三维(3D)结构的层状双氢氧化物(NiFe-LDH)(图9)显著降低了起始电位(约230 mV),降低了Tafel斜率(50 mV·dec-1),增强了电流密度(1.5 V的电压下,电流密度达到200 mA·cm-2),并且在电化学析氧反应表现出较好的稳定性。

图8 ZnCo-LDH的的电化学水氧化性能[61]Fig.8 Electrochemical water oxidation performance of ZnCo-LDH[61]

图9 三维结构NiFe-LDH的示意图与扫描电镜图[63]Fig.9 Three-dimensional structure and SEM images of NiFe-LDH[63]
Li等[64]设计的镍铁层状双氢氧化物(NiFe-LDH)是通过插入钼酸盐离子得到的超薄纳米片。这种材料在1 mol·L-1的KOH溶液中,OER电流密度比普通的NiFe-LDH纳米片高出3倍,电流密度达到10 mA·cm-2的过电势为280 mV。这种超薄的厚度有利于利用电化学活性位点,进而提高性能。而且这些超薄纳米片也可以直接生长在镍片上。
尺寸、结晶度和阴离子插层都是决定LDH对OER活性的重要影响因素。Sun等[65]研究了NiFe-LDH,使用简单的煅烧和老化步骤,研究了LDH结晶度和阴离子插层对OER性能的影响。结果发现,NiFe-LDH不好的结晶度和增加尺寸会导致OER活性减小,减小LDH的层间距也会导致OER活性度的降低。基于此,通过插入NO3-在室温下合成的NiFe-LDH,其起始电位为240 mV,Tafel斜率值为33.6 mV·dec-1,表现出了很好的电催化性能。
Wei等[66]制备了含Fe的双层金属氢氧化物(MFe-LDH,M = Ni,Co和Li)分层纳米阵列(图10),其表现出高效率的水、肼氧化反应的电化学性能,超薄MFe-LDH纳米片(横向长度200~300 nm;厚度8~12 nm)垂直生长于基片表面,是在数百秒内(<300 s)阴极电位下制备的。这样获得的NiFe-LDH纳米薄片阵列在析氧反应(OER)中具有很好的性能,达到10 mA·cm-2电流密度的过电势为224 mV,并且稳定性增强,经过20 h持续的OER反应,电流密度没有减弱,而且NiFe-LDH表面几乎没有变化,这些要优于以前报道的电氧化催化剂以及效果很好的Ir/C催化剂。

图10 MFe-LDH生长示意图(a)、MFe-LDH生长前后的图片(b)及MFe-LDH(M=Ni,Co和Li)的XRD图(c)[66]Fig. 10 Schematic diagram of growth process of MFe-LDH(a), photos before and after growth(b) and XRD pattern of MFe-LDH (M = Ni, Co, and Li)(c)[66]
Li等[67]以钴镍氢氧化物为前体,加入碘作为氧化剂合成了具有核-壳结构的钴镍层状双氢氧化物(CoNi-LDHs),这种独特的核-壳形态可能是由于在Co(Ⅲ)的氢氧化物在中心富集而产生的。将CoNi-LDHs沉积在FTO玻璃板制备复合电极。在中性pH的磷酸钾电解质条件下,进行水氧化反应表现出了低的过电势(490 mV)和高的电流密度(电压1.4 VNHE下,1 mA·cm-2),比CoCo-LDHs电催化性能要好。
Hu等[68]制备了超薄钴锰纳米片层状双氢氧化物(CoMn-LDH)(图11)是一种高活性和稳定的氧析出的催化剂。该催化剂的合成是在室温下用共沉淀法得到的,其过程要有N2保护,然后加入过氧化氢将Mn(Ⅱ)氧化成Mn(Ⅲ),通过滴加NaOH溶液将pH调节至约10。制备得到的CoMn-LDH,其转换频率(TOF)是Co和Mn氧化物和氢氧化物的20倍,并且比IrO2催化剂的TOF要高出9倍。

图11 CoMn-LDH的结构以及XRD和TEM形貌图[68]Fig. 11 Structure,XRD patterns and TEM images of CoMn-LDH[68]
一些非晶材料也可以很好地应用于水氧化催化。Guo等[69]通过共沉淀物的方法制备了非晶NiZn双氢氧化物纳米笼的电催化剂,对析氧反应(OER)具有高效的催化活性。实验探究了元素含量对电催化活性的影响,发现Ni2.7Zn(OH)x的组成效果最好,在1 mol·L-1的KOH电解质溶液里,电流密度达到10 A·g-1时的过电位仅为0.20 V。研究发现这种非晶纳米空心结构可使得大量表面活性原子暴露,从而增加催化活性。非晶态Ni-Zn双氢氧化物材料是一个高性能的OER电催化剂,并表现出比IrO2高的电化学催化活性。

图12 多级纳米片结构NiCoFe-LDH的制备过程[70]Fig. 12 Preparation process of hierarchical nanosheet structured NiCoFe-LDH[70]

图13 NiFeMn-LDH的结构(a)和各种催化剂(NiFeMn-LDH, NiFe-LDH, NiMn-LDH和Ir/C)的极化曲线(b)[72]Fig.13 Structural scheme of ternary NiFeMn-LDH(a), polarization curves of three LDH catalysts (NiFeMn-LDH, NiFe-LDH and NiMn-LDH and commercial Ir/C catalyst)(b)[72]
Sun等[70]制备了NiCoFe-LDH,如图12所示,它是垂直于Co基上生长的多层次的纳米片结构,具有高效的催化水氧化能力,较小的过电势(约233 mV), 低的Tafel斜率 (约53 mV·dec-1), 较大的电流密度(257 mV下电流密度为80 mA·cm-2)以及较好的电化学稳定性。
Yang等[71]通过控制三价和二价离子的比率,合成了三元过渡金属的层状氢氧化物的超薄纳米片。他们主要是将Co引入到双过渡金属LDH中,构成三元过渡金属层状氢氧化物,如FeNiCo-LDH。Co的加入使得电子结构发生改变、增加了表面积和电子导电性。这种材料展示出了高的OER性能,低的过电势(0.2 V)和低的Tafel斜率42 mV·dec-1。
Sun等[72]将Mn引入LDH层板中,一步合成具有层状结构的三元NiFeMn-LDH(图13)。Mn4+掺入LDH层内改变了电子结构,使得材料带隙变窄。三元LDH显示出优异的析氧活性,达到20 mA·cm-2电流密度的电势仅为289 mV,Tafel斜率为47 mV·dec-1,其性能显著优于NiFe-LDH和商业化的Ir/C催化剂,并且具有高稳定性。
Han等[73]采用剥离-水热方法,在NiFe-LDH中插入钼酸根离子合成出NiFeMo-LDH超薄纳米片(图14),这种超薄片状结构提供了更多电化学活性位点,析氧电流密度比普通NiFe-LDH纳米片高出三倍。而且这些超薄纳米片还可直接生长在镍片上,同样具有高的电催化活性。
各种LDH催化剂的电化学水氧化性能见表1。
3.2 LDH/碳复合结构用于电化学水氧化
LDH材料应用于电化学水氧化的研究有很多,但是LDH这种材料也存在着不足,如容易团聚、活性中心数目减少等,为了提高水滑石的活性中心数目、改善水滑石的分散度,引入碳材料是解决方案之一。目前研究较多的主要是碳纳米管、石墨烯以及量子点。

图14 NiFeMo-LDH的结构(a)及NiFeMo LDH、NiFe LDH 和 β-Ni(OH)2的XRD图(b)[73]Fig.14 Crystal structure of NiFeMo-LDH(a) and XRD patterns of NiFeMo-LDH, NiFe-LDH and β-Ni(OH)2(b)[73]
碳纳米管,因其具有大的比表面、高的长径比、优异的电化学性能、良好的化学稳定性等特殊性能,可以来制备功能化水滑石/碳纳米管复合材料,以弥补LDH材料的不足。Dai等[74]设计了NiFe-LDH将其生长在碳纳米管上(图15),发现NiFe-LDH本身具有较高的OER电催化活性,而复合了C纳米管以后,其底层CNT网络增强了电子传输,从而促进了NiFe-LDH/C纳米管在OER反应中的活性,提高了电催化性能,如1 mol·L-1KOH溶液中,过电势300 mV时,其TOF值为0.56 s-1,这一数值要比之前报道过的混合NiFe氧化物的TOF值(同样条件下,报道过的最高的NiFe氧化物的TOF为0.21 s-1)高出约3倍。除了高OER活性,NiFe-LDH/CNT催化剂在碱性溶液中也显示出了良好的稳定性。
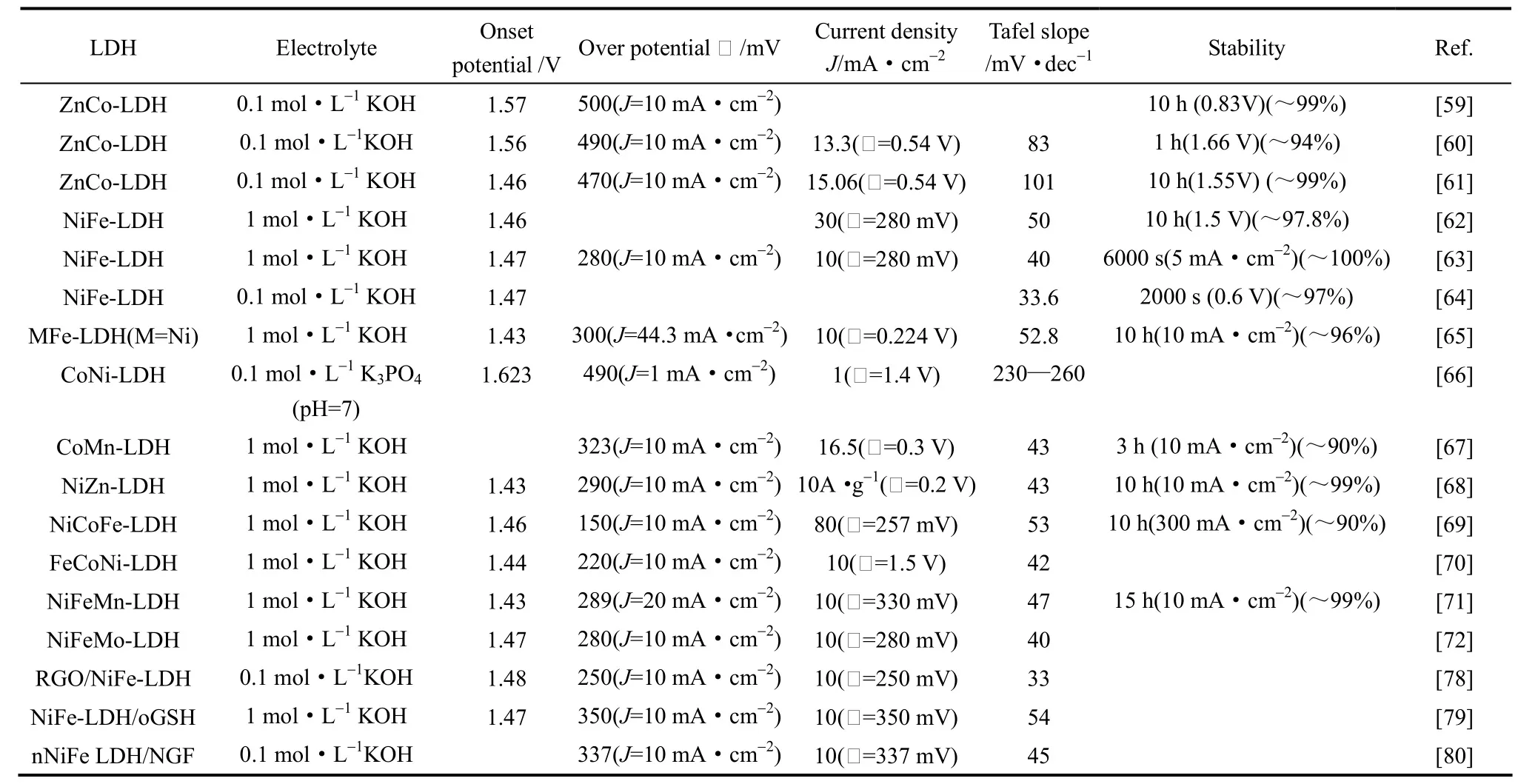
表1 各种LDH催化剂的电化学水氧化性能Table 1 Electrochemical properties of various LDH water oxidation catalysts

图15 NiFe-LDH/CNT的TEM形貌图、XRD及结构[74]Fig.15 TEM images, XRD pattern and structure of NiFe-LDH/CNT[74]
石墨烯可以作为良好的光生电子的受体,通过与石墨烯复合可以有效抑制光生电子-空穴的复合,因而为提高催化剂的光催化效率提供了另一种有效的方法。Gunjakar等[75]通过自组装将带正电的ZnCr-LDHs二维(2D)纳米片与带负电的石墨烯2D纳米片组装成具有孔隙的堆叠结构。该复合物对可见光水氧化催化产氧具有优异的催化活性,其产氧速率达到 1.20 mmol·g-1·h-1。
Wei等[76]创造了一个简单的能响应可见光的NiTi-LDH/RGO复合光催化剂的制备方法,将NiTi-LDH纳米片通过原位增长的方法负载在氧化石墨烯(RGO)的表面,构造了一种响应可见光的光催化剂(图16)。结果NiTi-LDH/RGO 的复合显示优良的光催化活性,水分解成氧气的速度达1.968 mmol·g-1·h-1和在500 nm处量子效率高达61.2%。NiTi-LDH 纳米片(直径:100~200 nm)均匀地分散在RGO的表面。紫外线-可见光吸收说明RGO的引入增强了催化剂的可见光吸收范围。此外,光致发光(PL)测量表明更有效地分离了电子-空穴对;电子自旋共振(ESR)和拉曼散射光谱能够证明,电子是从NiTi-LDH转移到RGO,从很大程度上提高载流子迁移率。该材料的光催化活性与原始NiTi-LDH相比有了很大的提高。该材料的制备与研究,为实现LDH/碳材料更好地利用太阳能提供了借鉴。
Lee等[77]将电化学中一种高效的非贵金属的析氧反应(OER)和光电化学分解水的催化剂——氧化石墨烯与NiFe-LDH复合,可以通过简单的溶剂水热法制得NiFe-LDH/RGO(图17)。NiFe-LDH均匀沉积在高导电性和高表面积的RGO层。在电化学分解水中,NiFe-LDH/RGO显示出比NiFe-LDH 及IrO2更优异的OER性能。

图16 可见光照射下NiTi-LDH/RGO的电荷分离和转移[76]Fig. 16 Charge separation and transfer of NiTi-LDH/RGO under visible light[76]

图17 NiFe-LDH/RGO 的合成以及析氧反应[77]Fig.17 Scheme of synthesis and oxygen evolution reaction of NiFe-LDH/RGO[77]

图18 LDH/G/Ni 的合成方法[78]Fig.18 Scheme of synthesis route of LDH/G/Ni[78]
Zhang等[78]在Ni基底上引入超薄石墨烯调节NiFe-LDH的生长行为和催化性能(表示为LDH/G/ Ni)(图18)。这种新颖的LDH/G/Ni复合材料表现出了很好的OER催化性能,其起始电位为240 mV,并大大降低了Tafel斜率44 mV·dec-1。其主要原因在于掺入的石墨烯具有高表面积和优异的电子转移性能,可以有效地提高LDH的导电性和分散度。另外石墨烯层还可以在Ni基底和水滑石前体溶液之间充当屏障,适当地抑制LDH随后的生长,而且Ni的丰富价态(Ni0、Ni2+、Ni3+)更有利于产生OER较低的起始电位。
Xia等[79]通过简便方法制备了还原氧化石墨烯与LDH(RGO/NiFe-LDH)的复合材料(图19),先将氧化石墨烯超声剥离,然后将其加入醋酸镍、硝酸铁(镍/铁摩尔比5:1)和N,N-二甲基甲酰胺(DMF)的混合溶液中,NiFe-LDH生长在GO纳米片上,再通过水热反应进行还原处理,即得到RGO/NiFe-LDH复合材料。将其用于电催化水氧化,在0.1 mol·L-1的KOH溶液里,达到10 mA·cm-2电流密度的过电势为250 mV,且稳定性较高。

图19 RGO/NiFe-LDH的形成[79]Fig. 19 Scheme of formation process of RGO/NiFe-LDH composite.[79]
Zhu等[80]将氧化石墨烯/单壁碳纳米管混合引入NiFe-LDH进行电催化水分解的研究。单层石墨烯(GO)/单壁碳纳米管(CNT)混合物(GSHS)具有三维自分散结构、电荷传导网络、较强的C—C键、更大的表面积及低的缺陷密度。将NiFe-LDH与轻度氧化的GSHs(oGSHs)进行耦合(图20),利用oGSHs丰富的功能基团和缺陷位点,通过共沉淀原位生长NiFe-LDH,得到了NiFe-LDH/oGSH电催化剂。该催化剂具有等级孔结构、更多的反应活性位点,更好的电荷传递能力,表现出超高的OER催化活性。
Tang等[81]设计了一种新型复合材料—纳米镍铁水滑石(nNiFe-LDHs)/氮掺杂石墨烯(NGF),nNiFe-LDHs在NGF上原位生长(图21)。氮掺杂与石墨烯拓扑产生的缺陷有利于吸附和固定金属阳离子,而介孔结构使nNiFe-LDH能够高度分散在石墨烯骨架里。这种结构具有多孔道、贯通的电荷传递网络、紧密的界面耦合,使活性位点充分暴露。在碱性条件下,在析氧反应中表现出高的催化性能:Tafel斜率 45 mV·dec-1,达到10 mA·cm-2电流密度的过电势为337 mV。

图20 LDH/oGSH的形成[80]Fig.20 Synthesis of LDH/oGSH electrocatalysts with a dual-sized distribution of LDH plates through moderate oxidation and in situ coprecipitation[80]

图21 nNiFe-LDH/NGF复合材料的结构(a)及nNiFe-LDH/NGF的透射电镜图(b)[81]Fig.21 Scheme of spatially confined hybrids (carbon atoms are indicated in green and nitrogen in red)(a), and crosssectional TEM image of sheet of nNiFe LDH/NGF electrocatalyst[81]
除了碳纳米管和石墨烯之外,量子点与LDH构成复合材料以增加催化性能的方法,也引起了越来越多人的关注。Tang等[82]使用碳量子点(CQDs,约5 nm),与超薄NiFe-LDH组成复合材料。由此产生的CQD/ NiFe-LDH,具有高电催化活性(图22)(在1 mol·L-1的KOH中,达到10 mA·cm-2电流密度的过电势为235 mV),并且具有很好的稳定性。这几乎超过以前所有报道的关于镍铁化合物和性能最好的钙钛矿型的催化剂。

图22 不同电极的析氧极化曲线(1 mol·L-1KOH)[82]Fig.22 Oxygen evolution polarization curves of different electrodes(1 mol·L-1KOH)[82]
3.3 LDHs用于光(电)化学水氧化
在热力学和动力学上,水氧化产氧是光催化水解过程中比较艰难的一步,而LDH在光(电)催化水氧化领域是一种极具潜力的催化剂[83]。基于LDHs的复合金属氧化物光催化材料以其较长的使用寿命和极好的催化活性,广泛应用于多相光催化反应中。Zhang 等[84]经由ZnAl-LDHs 前体,在高温条件下得到了稳定的ZnO/ZnAl2O4纳米复合材料,并观察到了ZnO与ZnAl2O4在界面处形成的异质结构。此结构可有效分离所产生的光生电子-空穴对,进而提高光催化活性。当LDH与半导体复合时,由于LDH对可见光的吸收作用,还可以提升半导体对光的利用率,如Zhao等[85]将TiO6与LDH复合,使得光催化活性增强。
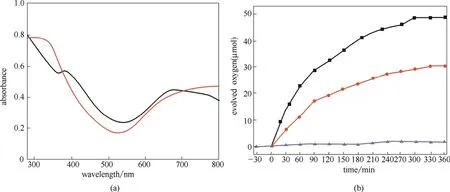
图23 NiTi-LDH(黑色线)和 CuTi-LDH(红色线)的紫外吸收图(a)及催化水氧化反应的产氧量NiTi-LDH(黑色线)、CuTi-LDH(红色线)、TiO2(蓝色线)(b)[86]Fig.23 UV-vis absorption spectra of NiTi-LDH (black line) and CuTi-LDH LDH (red line)(a), and oxygen amount evolved on water oxidation catalysts NiTi-LDH (black line), CuTi-LDH (red line) and TiO2(blue line)(b)[86]

图24 ZCT的制备过程以及催化水氧化性能[91]Fig .24 Preparation and catalytic water oxidation performance of ZCT[91]
Lee等[86]报道了一种新的Ti嵌入式的LDH,如NiTi-LDH和CuTi-LDH,这种材料与单纯的TiO2相比,表现出了良好的光催化水氧化的能力(图23)。具体原因主要在于,一方面,MTi-LDH不仅对可见光吸收增强,而且在红外区有吸收,扩展了光吸收范围;另一方面,MTi-LDH较大的比表面积也有利于光催化活性的增强。
Wei等[87]对MⅡMⅢ-LDHs (MⅡ= Mg, Co, Ni, and Zn; MⅢ= Al and Ga)的能带结构和态密度(DOS)进行了计算,结果表明,Co和Ni基水滑石可以吸收可见光并可作为水氧化催化剂。这些水滑石的DOS显示出了光生空穴位于羟基的氧原子处,这有利于水分子的氧化,所有被计算的水滑石的能带显示,CoAl-LDH、NiAl-LDH、ZnAl-LDH 和NiGa-LDH对氧化水都具有一个驱动力(Edf= 0.836 eV,0.426 eV,0.667 eV,0.965 eV)。CoAl-LDH、NiAl-LDH、ZnAl-LDH和NiGa-LDH析氧的热力学机制研究表明,只有CoAl-LDH可以克服过电位,通过驱动力提供的光生空穴分解水(0.653 eV),这也是通过实验研究进一步验证的:利用CoAl-LDH 能达到973 μmol·h-1·g-1的氧气生产率。
基于以上研究,Wei等[88]将CoAl-LDH与TiO2空心球复合为核壳结构,由于CoAl-LDH的带隙仅为2.2 eV对可见光有吸收,从而弥补了TiO2仅对紫外光有吸收的不足,同时利用LDH与TiO2的能带位置差异成功地提升了TiO2中的光生电荷的分离,因此CoAl-LDH与TiO2复合后的光催化剂的光催化水氧化反应产率较TiO2空心球催化剂显著提高。
除此之外,LDH自身也可作为光电催化水氧化体系中的光阳极材料,Lee等[89]报道了在FTO导电玻璃基底上直接原位生长ZnCr-LDH,作为具有可见光响应的光阳极,其制备方法方便快捷,在FTO基底上首先电沉积金属锌,然后浸入硝酸铬溶液反应1 min,即得到ZnCr-LDH材料。
Garcia等[90]还发现,ZnM-LDH (M =Ce、Ti和Cr)都具有光催化水氧化的能力,而其中最好的是ZnCr-LDH(410 nm下O2生成的量子产率为60.9%)并且Cr的浓度是影响光催化活性的重要因素。
Hwan等[91]将二维纳米片状的ZnCr-LDH与二维的TiO2纳米片组成复合材料(ZCT)(图24),来进行光条件下水的氧化,复合后的ZCT不仅使得光吸收范围增加,也使得光生电子空穴的复合得到了很好的抑制,进而提升了光催化活性。在水氧化反应中,利用ZCT的O2生成速率为1.18 mmol·h-1·g-1,而报道过的利用ZnCr-LDH最好的O2生成速率为0.67 mmol·h-1·g-1。除此之外,反应过程中ZCT也具有很好的化学稳定性。
Wei等[92]采用反相微乳液法制备得到的镍钛层状双氢氧化物(NiTi-LDH)纳米片,具有30~60 nm的横向尺寸。该材料对于光解水产氧,具有优异的光催化性能(2148 μmol·g-1·h-1)。在单色光照射下,量子收率在400 nm和650 nm达到65.0%和20.0%。
Shao等[93]合成了含有氧化锌为核心和纳米阵列层状金属氢氧化物(LDH)纳米片为外壳的复合材料ZnO@ CoNi-LDH,见图25。光电化学分解水的行为比ZnO系光电极,光电流密度以及稳定性显著提高。这主要归因于这种壳核结构有利于光生电子-空穴的分离,从而提高整体的电催化活性。

图25 ZnO@LDH核壳纳米线阵列构造的示意图[93]Fig .25 Structure sheme of ZnO@LDH core-shell nanowire array[93]
Xiang等[94]采用简单的光辅助电沉积改性法在TiO2光阳极表面沉积双金属氢氧化物的同时修饰了磷酸根,构建了LDH@TiO2的核-壳结构。TiO2光阳极与表面修饰了磷酸根的Ni、Cr的双金属氢氧化物薄层形成具有核-壳结构的光阳极后,其光电流起始电位向负方向移动了约200 mV。这是由于在经过改性后,光阳极表面的光生电子-空穴复合与O2还原反应同时被抑制,使光生空穴和电子在表面得以分离,从而让到达光阳极表面的空穴的氧化效率在电势为1.0~1.8 V (RHE)时一直保持100%(图26)。
在光电催化水氧化反应过程中,光电流的损失主要有3个途径:体相内电荷复合导致的电流损失(Jbr)、光阳极表面电荷复合导致的电流损失(Jsr)、以及氧化产物(O2)在光阳极表面与光生电子反应导致的电流损失(Jor)。光电流的损失会导致水氧化电流(Jox)的降低,特别是在外加电势较低时。在TiO2沉积了含Ni、Cr双金属氢氧化物并修饰了磷酸根后(NiCr-Pi),其光电流起始电位发生了显著的负移,并且在较低的外加电势下就获得了较高的氧化效率。这种性能的提升来自于表面的NiCr-Pi薄层同时抑制了光阳极表面电子-空穴的复合以及O2还原反应,使得达到光阳极表面的空穴能有效地参与氧化反应。这其中修饰在光阳极表面的磷酸根作为一种质子接受电解质,可以快速地与光阳极/电解液界面上的质子结合,并且对水氧化反应中的PCET过程有促进作用。
最近,Xiang等[95]将CoAl-LDH与BiVO4光阳极进行复合,从而对光阳极的表面水氧化动力学和对光的利用率两方面进行改善,最终提升光阳极的光电催化水氧化性能。在设计高效半导体光阳极的手段中,与电解水催化剂复合以提高光阳极表面水氧化反应动力学是一种常见的方法,将LDH水氧化催化剂复合到光阳极表面,一方面能够改善光生电荷分离;另一方面,某些LDH具有可见光响应性质,因此将具有可见光响应的LDH与光阳极复合后还可提升光阳极对光的利用率。

图26 在相同PEC水氧化条件下电极材料的氧化效率比较(a)及NiCr-TiO2-Pi在水氧化过程中载流子转移和水氧化过程(b)[94]Fig.26 Oxidation efficiency (fox) of different photoanodes under the same PEC water oxidation conditions(a), and scheme of charge transfer and water oxidation processes on core/shell photoanode NiCr-Pi (blue semi-circle): phosphated NiCr-hydroxide overlayer. PAE: proton-accepting electrolyte[94]

图27 LDH修饰BiVO4光阳极的光电流曲线(虚线:暗条件下的电流-电势曲线)[95]Fig.27 Current-voltage curves of different photoanodes under illumination (solid line) and in dark (dashed line)[95]
该复合光阳极表现出较BiVO4光阳极更优异的光电催化水氧化反应性能(图27),前者的光电流起始电位较后者向负方向移动了约540 mV,较目前与被广泛采用的Co-Pi催化剂复合后的BiVO4光阳极的起始电位负移值更多,这种性能的提升得益于宽、窄带隙材料相结合的设计,使得波长不同的光可先后被带隙不同的材料所吸收,从而达到增强对光的吸收和利用的目的。另外,CoAl-LDH作为水氧化催化剂加速表面水氧化反应的同时(图28),还由于其纳米墙阵列构型缩短了光生空穴的扩散距离,进一步抑制了光阳极表面的光生电荷复合。

图28 CoAl-LDH@BiVO4光电催化水氧化示意[95]Fig.28 Schematic illustration of photoelectrochemical water oxidation on CoAl-LDH@BiVO4photoanode[95]
3 结 论
在过去的十几年间,LDH由于其独特的化学组成和层状结构,在催化领域展现出广阔的应用前景,各种组成、结构不同的LDH水氧化活性催化材料被合成出来,LDH与其他功能材料复合则表现出增强的电、光(电)催化性能,拓展了LDH基材料在能源转换与高效利用方面的应用。将LDH的光活性与催化作用相耦合,发展功能集成的光(电)催化水分解或二氧化碳还原电极材料与化工微器件将是今后研究的一个重要方向;另外,如何更好地提高LDH基复合材料的催化活性、增强其稳定性也将是今后研究的重点之一。将水分解(氧化和还原)反应产生的活性氧和氢物种直接用于耦合其他氧化和还原反应,发展原子经济反应与实现能源高效利用,也将引起人们更多的关注。相信在不久的将来,可以很好地利用LDHs这一催化材料,来实现水分解过程的高效化,并很好地与其他反应有机结合,从而推动清洁能源制取及能源高效利用领域的快速发展。
References
[1] LEWIS N S, NOCERA D G. Powering the planet: chemical challenges in solar energy utilization [J]. Proc. Natl. Acad. Sci. USA, 2006, 103: 15729-15735.
[2] NOCERA D G. The artificial leaf [J]. Acc. Chem. Res., 2012, 45: 767-776.
[3] MEDA L, ABBONDANZA L. Materials for photo-electrochemical water splitting [J]. Rev. Adv. Sci. Eng. ,2013, 2: 200-207.
[4] RAN J, ZHANG J, YU J G. Earth-abundant cocatalysts for semiconductorbased photocatalytic water splitting [J]. Chem. Soc. Rev. ,2014, 43: 7787-7812.
[5] YANG Y F, ZHOU Y H, Chat C S. Electrochemical reduction of oxygen on small palladiun particles supported on carbon in alkaline solution [J]. Elecrrochimica Acta,1995, 40(16): 2579-2586.
[6] 张玉萍,鞠鹤,武宏让,等.铂钛不溶性阳极研制 [J]. 表面技术, 2002, 31(4): 37-39. ZHANG Y P, HE J, WU H R, et al. Preparation of Pt/Ti insoluble anodes [J]. Surface Technology, 2002, 31(4): 37-39.
[7] 张玉萍,鞠鹤,武宏让,等.铂复合电极研究进展 [J].表面技术,2005, 34(5): 16-18. ZHANG Y P, HE J, WU H R, et al. Advancement of platinum composite electrode [J]. Surface Technology, 2005, 34(5): 16-18.
[8] MUNICHANDRAIAH N. Physicochemical properties of electrodeposited β-lead dioxide : effect of deposition current density [J]. Appl. Electrochem., 1992, 22(1): 825 -829.
[9] 孙凤梅,潘建跃,罗启富,等. PbO2阳极材料的研究进展 [J]. 兵器材料科学与工程,2004, 27 (1): 68-72. SUN F M, PAN J Y, LUO Q F, et al. Advancement of PbO2anodes materials [J]. Ordnance Material Science and Engineering, 2004, 27 (1): 68-72.
[10] 黄庆华,李振亚,王为.电池用氧电极催化剂的研究现状 [J].电源技术,2003,27:241-244. HUANG Q H, LI Z Y, WANG W. State-of-art of research on electrocatalyst for oxygen electrode in battery [J]. Chinese Journal of Power Sources, 2003, 27:241-244.
[11] JAAKKO L, JUHANI K, MARKKU J L, et al. Preparation of air electrodes and long run tests [J]. J. Electrochem. Soc., 1991, 138: 905-908.
[12] 蒋太祥, 史鹏飞, 李君.铝空气电池氧电极催化剂的工艺研究 [J].电源技术, 1994, 2: 23. JIANG T X, SHI P F, LI J. Study on oxygen electrode catalyst for aluminum-air batteries [J]. Chinese Journal of Power Sources, 1994, 2: 23.
[13] BOCKRIS J O M, TAKAAKL O. Mechanism of oxygen evolution on perovskites [J]. J. Phys. Chem., 1983, 87: 2960-2971.
[14] Kobussen A G C, Broers G H L. The oxygen evolution on La0.5Ba0.5CoO3: theoretical impedance behaviour for a multi-step mechanism involving two adsorbates[J]. J. Electroanal. Chem., 1981, 126: 221-240.
[15] TSWEM S D, JOE H B. Morphology and electrochemical activity of Ru-Ti-Sn ternary-oxide electrodes in 1M NaCl solution [J]. J. Electrochem. Soc., 1993, 38(15): 2239-2246.
[16] GILEADI E, KIROWA E E, PENCINER J. Interfacial Electrochemistry: an Experimental Approach [M]. Reading, MA, United States: Addison-Wesley Publishing Co., Inc., 1975: 438.
[17] ZHANG P, WANG T, GONG J L. Mechanistic understanding of the plasmonic enhancement for solar water splitting [J]. Adv. Mater., 2015, 27: 5328-5342.
[18] FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode [J]. Nature, 1972, 238(5358): 37-38.
[19] BARD A J. Photoelectrochemistry [J]. Science, 1980, 207: 139-144.
[20] CHEMELEWSKI W D, LEE H C, LIN J F, et al. Amorphous FeOOH oxygen evolution reaction catalyst for photoelectrochemical water splitting [J]. J. Am. Chem. Soc., 2014, 136: 2843-2850.
[21] GRATZEL M. Photoelectrochemical cells [J]. Nature, 2001, 414: 338-344.
[22] TILLEY S D, CORNUZ M, SIVULA K, et al. Light-induced water splitting with hematite: improved nanostructure and iridium oxide catalysis [J]. Angew. Chem. Int. Ed., 2010, 49: 6405-6408.
[23] SUN J, ZHONG D K, GAMELIN D R. Composite photoanodes for photoelectrochemical solar water splitting [J]. Energy Environ. Sci., 2010, 3: 1252-1261.
[24] REECE S Y, HAMEL J A, SUNG K, et al. Wireless solar water splitting using silicon-based semiconductors and earth-abundant catalysts [J]. Science, 2011, 334: 645-648.
[25] GAN J, LU X, TONG Y. Towards highly efficient photoanodes: boosting sunlight-driven semiconductor nanomaterials for water oxidation [J]. Nanoscale, 2014, 6: 7142-7164.
[26] SUSAN W G, GEORGE J S, THOMAS J M. Catalytic oxidation of water by an oxo-bridged ruthenium dimer [J]. J. Am. Chem. Soc., 1982, 104 (14): 4029-4030.
[27] YIN Q S, JEFFREY M T, CLAIRE B, et al. A fast soluble carbon-free molecular water oxidation catalyst based on abundant metals [J]. Science, 2010, 328: 342-345.
[28] LV H J, GELETII Y V, ZHAO C C, et al. Polyoxometalate wateroxidation catalysts and the production of green fuel [J]. Chem. Soc. Rev., 2012, 41: 7572-7589.
[29] SONG F Y, DING Y, MA B C, et al. K7[CoIIICoII(H2O)W11O39]: a molecular mixed-valence keggin polyoxometalate catalyst of high stability and efficiency for visible light-driven water oxidation [J]. Energy Environ. Sci., 2013, 6: 1170-1184.
[30] LV H J, SONG J, YURII V G et al. An exceptionally fast homogeneous carbon-free cobalt-based water oxidation catalyst polyoxometalate catalyst of high stability and efficiency for visible light-driven water oxidation [J]. J. Am. Chem. Soc., 2014, 136: 9268-9271.
[31] RODNEY D L S, MATHIEU S P, RANDAL D F, et al. Photochemical route for accessing amorphous metal oxide materials for water oxidation catalysis [J]. Science, 2013, 340: 60-63.
[32] XIANG X, FIELDEN J, WILLIAM R C, et al. Electron transfer dynamics in semiconductor-chromophore -polyoxometalate catalyst photoanodes [J]. J. Phys. Chem. C, 2013, 117: 918-926.
[33] MATT B, XIANG X, ALEXEY L, et al. Long lived charge separation in iridium(Ⅲ)-photosensitized polyoxometalates: synthesis, photophysical and computational studies of organometallic-redox tunable oxide assemblies [J]. Chem. Sci., 2013, 4: 1737-1745.
[34] FIELDEN J, SUMLINER J M, HAN N, et al. Water splitting with polyoxometalate-treated photoanodes: enhancing performance through sensitizer design [J]. Chem. Sci., 2015, 6: 5531-5543.
[35] ARINDAM I, PRASHANTH W M, NASTARAN R, et al. Unification of catalytic water oxidation and oxygen reduction reactions: amorphous beat crystalline cobalt iron oxides [J].J. Am. Chem. Soc., 2014, 136: 17530-17536.
[36] QI J, ZHANG W, XIANG R, et al. Porous nickel-iron oxide as a highly efficient electrocatalyst for oxygen evolution reaction [J]. Adv. Sci., 2015, 2: 1500199.
[37] CARLOS G M, MATTHEW T M, ASWANI Y, et al. An optically transparent iron nickel oxide catalyst for solar water splitting [J]. J. Am. Chem. Soc., 2015, 137: 9927-9936.
[38] WANG T, GONG J L. Single-crystal semiconductors with narrow band gaps for solar water splitting [J]. Angew. Chem. Int. Ed., 2015, 54: 10718-10732.
[39] LI L D, YAN J Q, WANG T, et al. Sub-10 nm rutile titanium dioxide nanoparticles for efficient visible-light-driven photocatalytic hydrogen production [J]. Nature Commun., 2015, 6: 5881.
[40] LI K, WANG G, LI D, et al. Intercalation assembly method and intercalation process control of layered intercalated functional materials [J].Chinese Journal of Chemical Engineering, 2013, 21(4): 453-462.
[41] DAVID G E, DUAN X. Preparation of layered double hydroxides and their applications as additives in polymers, as precursors to magnetic materials and in biology and medicine [J]. Chem. Commun., 2006: 485-496.
[42] WANG Q, DERMOT O. Recent advances in the synthesis and application of layered double hydroxide (LDH) nanosheets [J]. Chem. Rev., 2012, 112, 4124 -4155 .
[43] 安哲, 何静, 段雪. 层状材料及催化 [J]. 中国科学: 化学, 2012, 42(4): 390-405. AN Z, HE J, DUAN X. Layered double hydroxide and catalyst [J]. Scientia Sinica Chimica, 2012, 42(4): 390-405. DOI: 10.1360/ 032011-846.
[44] 安哲, 何静, 段雪. 基于层状前驱体制备活性位高分散催化材料[J]. 催化学报, 2013, 34: 225-234. AN Z, HE J, DUAN X. Catalysts with catalytic sites highly dispersed from layered double hydroxide as precursors [J]. Chin. J. Catal., 2013, 34: 225-234.
[45] 闫东鹏, 陆军, 段雪. 层状复合金属氢氧化物: 主客体结构研究进展 [J]. 中国科学: 化学, 2013, 43(1): 1-14. YAN D P, LU J, DUAN X. Layered double hydroxide: research progress of host-guest structure [J]. Scientia Sinica Chimica , 2013, 43(1): 1-14. DOI: 10.1360 /03 2012-463.
[46] YAN D P, LU J, WEI M, et al. Recent advances in photofunctional guest/layered double hydroxide host composite systems and their applications: experimental and theoretical perspectives [J]. J. Mater. Chem., 2011, 21: 13128-13139.
[47] HE S, AN Z, WEI M, et al. Layered double hydroxide-based catalysts: nanostructure design and catalytic performance [J]. Chem. Commun., 2013, 49: 5912-5920.
[48] GONG M, LI Y, ZHANG L, et al. Ultrafast high-capacity NiZn battery with NiAlCo-layered double hydroxide [J]. Energy Environ. Sci., 2014, 7: 2025-2032.
[49] CARLOS G M, MATTHEW T M, ASWANI Y, et al. An optically transparent iron nickel oxide catalyst for solar water splitting [J]. J. Am. Chem. Soc., 2015, 137: 9927-9936.
[50] GONZALO A J, CARRASCO E C, JORGE R, et al. Alkoxide-intercalated CoFe-layered doublehydroxides as precursors of colloidal nanosheet suspensions: structural, magnetic and electrochemical properties [J]. J. Mater. Chem. C, 2014, 2, 3723-3731.
[51] LIANG H, MENG F, MIGUEL C A, et al. Hydrothermal continuous flow synthesis and exfoliation of NiCo layered double hydroxide nanosheets for enhanced oxygen evolution catalysis. [J]. Nano Lett., 2015, 15: 1421-1427.
[52] YANG Q, LI T, LU Z, et al. Hierarchical construction of an ultrathin layered double hydroxide nanoarray for highly-efficient oxygen evolution reaction [J]. Nanoscale, 2014, 6: 11789-11794.
[53] ZHANG Y, CUI B, ZHAO C, et al. Co-Ni layered double hydroxides for water oxidation in neutral electrolyte [J]. Phys. Chem. Chem. Phys., 2013, 15: 7363 -7369.
[54] SHAO M F, WEI M, DAVID G E, et al. Magnetic-field-assisted assembly of CoFe layered double hydroxide ultrathin films with enhanced electrochemical behavior and magnetic anisotropy [J]. Chem. Commun., 2011, 47: 3171-3173.
[55] GENNEQUIN C, KOUASSI S, TIDAHY L, et al. Co-Mg-Al oxides issued of hydrotalcite precursors for total oxidation of volatile organic compounds. Identification and toxicological impact of the by-products [J]. C R Chimie, 2010, 13: 494-501.
[56] SLIVA C G, BOUIZI Y, FORNES V, et al. Layered double hydroxides as highly efficient photocatalysts for visible light oxygen generation from water [J]. J. Am. Chem. Soc., 2009, 131: 13833-13839.
[57] WANG H, TANG C, ZHANG Q. Towards superior oxygen evolution through graphene barriers between metal substrates and hydroxide catalysts [J]. J. Mater. Chem. A, 2015, 3: 16183-16189.
[58] ZHAO X, ZHANG F, XU S, et al. From layered double hydroxides to ZnO-based mixed metal oxides by thermal decomposition: transformation mechanism and UV-blocking prosperities of the product [J]. Chem. Mater., 2010, 22: 3933-3942.
[59] MYONG A W, MIN S S, TAE W K, et al. Mixed valence Zn-Co-layered double hydroxides and their exfoliated nanosheets with electrode functionality [J]. J. Mater. Chem., 2011, 21: 4286-4292.
[60] ZHAO X, ANANDARUP G, TEWODROS A. Efficient noble metal-free (electro)catalysis of water and alcohol oxidations by zinc-cobalt layered double hydroxide [J]. J. Am. Chem. Soc., 2013, 135: 17242-17245.
[61] LI Y, ZHANG L, XIANG X, et al. Engineering of ZnCo-layered double hydroxide nanowalls toward high-efficiency electrochemical water oxidation [J]. J. Mater. Chem. A, 2014, 2: 13250-13258.
[62] QIAO C, ZHANG Y, ZHU Y, et al. One-step synthesis of zinc-cobalt layered double hydroxide (Zn-Co-LDH) nanosheets for high efficiency oxygen evolution reaction [J]. J. Mater. Chem. A, 2015, 3: 6878-6883.
[63] LU Z, XU W, ZHU W, et al. Three-dimensional NiFe layered double hydroxide film for high-efficiency oxygen evolution reaction [J].Chem. Commun., 2014, 50: 6479-6482.
[64] HAN N, ZHAO F, LI Y. Ultrathin nickel-iron layered double hydroxide nanosheets intercalated with molybdate anions for electrocatalytic water oxidation [J]. J. Mater. Chem. A, 2015, 3: 16348-16353.
[65] XU Y, HAO Y, ZHANG G, et al. Room-temperature synthetic NiFe layered double hydroxide with different anions intercalation as an excellent oxygen evolution catalyst [J]. RSC Adv., 2015, 5: 55131-55135.
[66] LI Z H, SHAO M F, AN H L, et al. Fast electrosynthesis of Fe-containing layered double hydroxide arrays toward highly efficient electrocatalytic oxidation reactions [J]. Chem. Sci., 2015, 6: 6624-6631.
[67] ZHANG Y, CUI B, ZHAO C, et al. Co-Ni layered double hydroxides for water oxidation in neutral electrolyte [J]. Phys. Chem. Chem. Phys., 2013, 15: 7363-7369.
[68] SONG F, HU X L. Ultrathin cobalt-manganese layered double hydroxide is an efficient oxygen evolution catalyst [J]. J. Am. Chem. Soc., 2014, 136: 16481-16484.
[69] WANG S, NAI S, YANG S, et al. Synthesis of amorphous Ni-Zn double hydroxide nanocages with excellent electrocatalytic activity toward oxygen evolution reaction [J]. ChemNanoMat., 2015, 1: 324-330.
[70] YANG Q, LI T, LU Z, et al. Hierarchical construction of an ultrathin layered double hydroxide nanoarray for highly-efficient oxygen evolution reaction [J]. Nanoscale, 2014, 6: 11789-11794.
[71] LONG X, XIAO S, WANG Z, et al. Co intake mediated formation of ultrathin nanosheets of transition metal LDH-an advanced electrocatalyst for oxygen evolution reaction [J]. Chem. Commun., 2015, 51: 1120-1123.
[72] LU Z Y, QIAN L, TIAN Y, et al. Ternary NiFeMn layered double hydroxides as highly-efficient oxygen evolution catalysts [J]. Chem. Commun., 2016, DOI: 10.1039/c5cc08845c.
[73] HAN N, ZHAO F P, LI Y G. Ultrathin nickel-iron layered double hydroxide nanosheets intercalated with molybdate anions for electrocatalytic water oxidation [J]. J. Mater. Chem. A, 2015, 3: 16348-16353.
[74] GONG M, LI Y, Wang H, et al. An advanced Ni-Fe layered double hydroxide electrocatalyst for water oxidation [J]. J. Am. Chem. Soc., 2013, 135: 8452-8455.
[75] JAYAVANT L G, In Y K, JANG M L, et al. Self-assembly of layered double hydroxide 2D nanoplates with graphene nanosheets: an effective way to improve the photocatalytic activity of 2D nanostructured materials for visible light-induced O2generation [J]. Energy Environ. Sci., 2013, 6: 1008-1017.
[76] LI B, ZHAO Y, ZHANG S, et al. Visible-light -responsive photocatalysts toward water oxidation based on NiTi-Layered double hydroxide/reduced graphene oxide composite materials [J]. ACS Appl. Mater. Interfaces, 2013, 5: 10233-10239.
[77] DUCK H Y, YOON B P, JAE Y K, et al. One-pot synthesis of NiFe layered double hydroxide/reduced graphene oxide composite as an efficient electrocatalyst for electrochemical and photoelectrochemical water oxidation [J]. Journal of Power Sources, 2015, 294: 437 -443.
[78] WANG H, TANG C, ZHANG Q. Towards superior oxygen evolution through graphene barriers between metal substrates and hydroxide catalysts [J]. J. Mater. Chem. A, 2015, 3: 16183-16189.
[79] XIA D C, ZHOU L, QIAO S, et al. Graphene/Ni-Fe layered double-hydroxide composite as highly active electrocatalyst for water oxidation [J]. Materials Research Bulletin 2016, 74: 441-446.
[80] ZHU X L, TANG C, WANG H F, et al. Dual-sized NiFe layered double hydroxides in situ grown on oxygen-decorated self-dispersal nanocarbon as enhanced water oxidation catalysts [J]. J. Mater. Chem. A, 2015, 3: 24540-24546.
[81] TANG C, WANG H S, WANG H F, et al. Spatially confined hybridization of nanometer-sized NiFe hydroxides into nitrogen-doped graphene frameworks leading to superior oxygen evolution reactivity [J]. Adv. Mater., 2015, 27: 4516-4522.
[82] TANG D, LIU J, WU X, et al. Carbon quantum Dot/NiFe layered double-hydroxide composite as a highly efficient electrocatalyst for water oxidation [J]. ACS Appl. Mater. Interfaces, 2014, 6: 7918-7925.
[83] LENA T, SAMANTHA L Y, JAMES K R, et al. Nickel-iron oxyhydroxide oxygen-evolution electrocatalysts: the role of intentional and incidental iron incorporation [J]. J. Am. Chem. Soc., 2014, 136: 6744-6753.
[84] SHAO M, ZHANG R, LI Z, et al. Layered double hydroxides toward electrochemical energy storage and conversion: design, synthesis and applications [J]. Chem. Commun., 2015, 51: 15880-15893
[85] ZHAO Y F, CHEN P Y, ZHANG B S, et al .Highly dispersed TiO6units in a layered double hydroxide for water?splitting [J]. Chem. Eur. J., 2012, 18: 11949-11958.
[86] YEOB L, JUNG H C, HYUNG J J, et al. Titanium-embedded layered double hydroxides as highly efficient water oxidation photocatalysts under visible light [J]. Energy Environ. Sci., 2011, 4: 914-920.
[87] XU S M, PAN T, DOU Y B, et al. Theoretical and experimental study on MIIMIII-Layered double hydroxides as efficient photocatalysts toward oxygen evolution from water [J]. J. Phys. Chem. C, 2015, 119: 18823-18834.
[88] DOU Y, ZHANG S, PAN T, et al. TiO2@layered double hydroxide core-shell nanospheres with largely enhanced photocatalytic activity toward O2generation [J]. Adv. Funct. Mater., 2015, 25: 2243-2249.
[89] CHO S, JANG J W, PARK Y B, et al. An exceptionally facile method to produce layered double hydroxides on a conducting substrate and their application for solar water splitting without an external bias [J]. Energy Environ. Sci., 2014, 7: 2301-2307.
[90] CLAUDIA G S, YOUNES B, VICENTE F, et al. Layered doublehydroxides as highly efficient photocatalysts for visible light oxygen generation from water [J]. J. Am. Chem. Soc., 2009, 131: 13833-13839.
[91] JAYAVANT L G, TAE W K, HYO N K, et al. Mesoporous layer-by-layer ordered nanohybrids of layered double hydroxide and layered metal oxide: highly active visible light photocatalysts with improved chemical stability [J]. J. Am. Chem. Soc., 2011, 133: 14998-15007.
[92] ZHAO Y, LI B, WANG Q, et al. NiTi-layered double hydroxides nanosheets as efficient photocatalysts for oxygen evolution from water using visible light [J]. Chem. Sci., 2014, 5: 951-958.
[93] SHAO M F, NING F, WEI M, et al. Hierarchical nanowire arrays based on ZnO core-layered double hydroxide shell for largely enhanced photoelectrochemical water splitting [J]. Adv. Funct. Mater., 2014, 24: 580-586.
[94] HE W H, YANG Y, WANG L, et al. Photoelectrochemical water oxidation efficiency of a core/shell array photoanode enhanced by a dual suppression strategy [J]. ChemSusChem., 2015, 8: 1568 -1576.
[95] HE W H, WANG R R, ZHANG L, et al. Enhanced photoelectrochemical water oxidation on a BiVO4photoanode modified with multifunctional layered double hydroxide nanowalls [J]. J. Mater. Chem. A, 2015, 3: 17977-17982.
Foundation item: supported by the National Basic Research Program of China (2014CB932104), the National Natural Science Foundation of China (21376020) and the Natural Science Foundation of Beijing (2152022).
Recent progresses in water oxidation over layered double hydroxide catalysts
WANG Ruirui, ZHAO Youjing, SHAO Mingfei, XIANG Xu, DUAN Xue
(State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, China)
Abstract:Obtaining fuels (e.g. hydrogen) from solar water splitting is one of the important pathways to develop clean energy. The water oxidation of half-reaction of water splitting is an important and speed-limited step in overall water splitting. To develop efficient, stable, and easy-made water oxidation catalysts (WOCs) is the key to achieve sufficient water splitting. Layered double hydroxides (LDHs) have received extensive attention in catalytic water oxidation because of its adjustable chemical compositions and unique two-dimensional layered structure. Besides acting as electrochemical water oxidation catalysts, LDHs also exhibit advantages in photo-(photoelectro-)chemical water oxidation. The progress in the LDHs and their composites as WOCs is summarized. It is expected that this review could provide inspiring ideas and helpful guidelines in the structural design of high-efficiency water oxidation catalysts.
Key words:layered double hydroxide; hydrotalcite; catalyst; oxidation; electrochemistry; photoelectrochemistry
Corresponding author:Dr. XIANG Xu, xiangxu@mail.buct.edu.cn
基金项目:国家重点基础研究发展计划项目(2014CB932104);国家自然科学基金项目(21376020);北京市自然科学基金项目(2152022);中央高校基本科研业务费专项资金资助(YS1406)。
中图分类号:TQ 139.2
文献标志码:A
文章编号:0438—1157(2016)01—0054—19
DOI:10.11949/j.issn.0438-1157.20151766

