乙醇在MIL-101上的吸附相平衡及其吸附机理
余颖,孙雪娇,颜健,肖静,奚红霞,李忠
(华南理工大学化学与化工学院,广东 广州 510640)
乙醇在MIL-101上的吸附相平衡及其吸附机理
余颖,孙雪娇,颜健,肖静,奚红霞,李忠
(华南理工大学化学与化工学院,广东 广州 510640)
摘要:主要研究了MIL-101材料对乙醇的吸附性能和吸附机理。采用水热合成法制备了MIL-101(Cr),并分别应用N2静态吸附、X射线粉末衍射(PXRD)、傅里叶红外光谱(FTIR)等分析手段对MIL-101晶形结构、孔隙结构参数进行分析表征。应用静态吸附法测定乙醇和水蒸气在不同温度下的吸附等温线,并讨论乙醇吸附在MIL-101(Cr) 4种吸附位的机理,根据吸附等温线估算出乙醇和水蒸气在MIL-101上的等量吸附热,并测试了乙醇在MIL-101上的吸附循环性能。研究表明,在298 K下,MIL-101的乙醇吸附容量为20.3 mmol·g-1,远高于传统吸附材料。在低压下MIL-101对乙醇的吸附量高于水蒸气的吸附量,这是由于乙醇的偶极矩和分子动力学直径均比水大,使得乙醇分子在孔道中受到更大吸附力场作用;在低吸附量范围,乙醇在MIL-101上的等量吸附热要高于水蒸气的等量吸附热。在较高吸附压力条件下,主要发生多层吸附或孔填充,受吸附剂的孔容限制效应,尺寸越大的分子被吸附的物质的量会越少,由于乙醇的动力学直径(0.45 nm)大于水分子的动力学直径(0.268 nm),所以在较高吸附压力下乙醇在MIL-101上吸附量要小于水蒸气的吸附量。多次吸附脱附等温线测试显示MIL-101具有良好的乙醇吸附循环性能。
关键词:MIL-101(Cr);乙醇;水蒸气;吸附平衡;吸附;吸附热
2015-07-03收到初稿,2015-07-28收到修改稿。
联系人:李忠。第一作者:余颖(1990—),女,硕士研究生。
Received date: 2015-07-03.
引 言
随着全球能源危机问题日趋严重,能源的优化利用成为了各个国家的关注重点。吸附式热泵(adsorption heat pumps,AHPs)作为一种可以利用低品位能源实现制冷和加热目的的节能装置,受到了广泛关注。传统的蒸汽压缩式制冷系统不仅需要消耗大量的电能,而且其制冷剂氟氯烃类化合物(CFCs)污染大气环境,破坏臭氧层[1-2]。而吸附式制冷系统以低品位热能为动力,结合吸附剂对吸附质的吸附和脱附作用,促使吸附质冷凝和蒸发,从而产生热和冷,实现加热和制冷目的,比传统的制冷系统更加环境友好和高效节能。
影响吸附式热泵性能的关键因素是吸附剂/吸附质组成的工质对。传统的工质对有活性炭/甲醇、活性炭/氨、沸石/水、硅胶/水、CaCl2/氨[3-6]。然而,这些工质对存在一定的不足,如氨和甲醇有毒性、甲醇在工作状态下会逐渐发生热分解,虽然水是一种优良的吸附制冷工质,却因其在零度时结冰而不能实现0℃以下的吸附制冷,而使用乙醇可以克服这一不足。El-Sharkawy等[7]测量了乙醇在活性炭材料Maxsorb Ⅲ上的吸附等温线,发现Maxsorb Ⅲ/乙醇工质对在热源和散热器分别为350和303 K时的冷却效率可达到420 kJ·mol-1。可见,乙醇具有安全性、热稳定性、无腐蚀性,能够实现0℃以下的吸附制冷,与其他吸附剂匹配可达到较为理想的制冷效果,是在热泵应用领域的理想工质之一。除了吸附质外,吸附材料的性能对吸附式热泵效率起到至关重要的作用。
目前研究较多的吸附剂主要是活性炭和沸石,但这些传统的吸附剂最主要的缺点是吸附量不高,例如,活性炭和沸石的乙醇吸附量仅为9.8和2.9 mmol·g-1[8-9],因而人们一直在寻找性能优异的新型吸附剂作为替代。近年来,一类被称为金属-有机骨架材料(metal-organic frameworks,MOFs)的多孔材料发展迅速,它是一种通过金属簇和有机配体自由组装而成的新型多孔材料,具有超高的比表面积(高达6000 m2·g-1[10-11])和孔隙率,并且其孔结构可调。这些优异的性能使得MOFs具有广阔的潜在应用价值,如多相催化[12]、药物传递[13]、传感技术[14],特别是气体吸附和储存[15-18]。MOFs材料用于吸附制冷技术的研究也逐渐被报道。Al-Dadah课题组[19]比较了HKUST-1(Cu-BTC)和传统吸附材料硅胶对水蒸气的吸附性能,结果表明:HKUST-1对水蒸气的吸附量比硅胶材料增加了93.20%,而提高材料对制冷剂的吸附量,将有助于提高制冷剂的流动速率和制冷能力。MIL-100(Fe)在298 K下的水吸附量高达0.7 g·g-1[20]。Küsgens等[21]报道MIL-101在298 K下的水蒸气吸附量可以达1.28 cm3·g-1,Gérard Férey课题组[22]制备的MIL-101 在303 K下的水吸附量更高达1.61g·g-1,是传统材料水吸附量的2.5~5.0倍,如沸石NaX的水吸附量仅为0.336 g·g-1,硅磷酸铝SAPO为0.330 g·g-1[23],硅胶为0.327 g·g-1[24]。这表明MOFs材料无论作为除湿材料还是在热泵领域都有很好的潜在应用前景。Nguyen课题组[25]报道了其制备的系列RO-MOF中,RO-MOFf对乙醇吸附量可达3.00 mol·mol-1(298 K)。Denayer课题组[26]报道了HKUST-1对乙醇的饱和吸附量达0.760 cm3·g-1(323 K下),Rezk等[27]进行的实验研究了6种 MOFs材料吸附乙醇的性能,并与传统硅胶材料进行比较,发现其中的MIL-101(Cr)显示出很高的乙醇吸附容量,展示出此材料在热泵领域潜在很好应用前景,但作者仍未阐明MOFs吸附乙醇的机理。
本文主要研究MIL-101(Cr)对乙醇的吸附性能及吸附机理。主要涉及应用水热合成法制备孔隙结构发达的MIL-101(Cr),对MIL-101(Cr)的孔隙结构和晶体结构进行表征。测定了不同温度下乙醇和水蒸汽在MIL-101上的吸附等温线,分析和讨论了乙醇在MIL-101上吸附的吸附位点和吸附过程机理,最后对比了乙醇和水在MIL-101上的吸附行为,计算和比较了两者在低压下的等量吸附热,为其潜在的工业应用提供依据。
1 实验材料和方法
1.1 主要试剂和材料
九水硝酸铬[Cr(NO3)3·9H2O,纯度≥99.0%, Alfa Aesar公司];对苯二甲酸(C4H8O4,纯度≥99.0%,Alfa Aesar公司);氢氟酸(HF,纯度≥40.0%,广州化学试剂厂);N,N-二甲基甲酰胺[HCON(CH3)2,纯度≥99.5%,广东光华科技股份有限公司];无水乙醇(C2H6O,纯度≥99.7%,天津市富宇精细化工有限公司);氟化铵(NH4F,纯度≥96.0%,广东光华科技股份有限公司)。
1.2 MIL-101的制备
本文选择水热法合成材料,具体合成步骤如下。
(1)MIL-101的合成:将4.0 g九水硝酸铬和1.64 g对苯二甲酸、48 ml去离子水混合装入高压反应釜内衬中,在313 K水浴中搅拌10 min使混合液混合均匀,随后缓慢滴加0.5 ml氢氟酸于混合液中,然后将其密封放入程序升温炉中进行程序升温。设定升温程序为:溶液以5 K·min-1的升温速率从室温加热至 493 K,并保持8 h,之后再以0.4 K·min-1的降温速率将溶液降至308 K。
(2)MIL-101的纯化:将明显析出的对苯二甲酸晶体弃去,将混合液置于313 K水浴中缓慢滴入20 ml N,N-二甲基甲酰胺(DMF)后继续振荡混合1 h,取出混合液用G1砂芯漏斗过滤,取滤液离心获得产物,然后依次经过乙醇洗、氟化铵溶液洗、水洗后再次离心过滤,最后将产物放入423 K烘箱中烘干备用。
(3)最后,将上述产物在423 K条件下抽真空8 h,即得到纯化后的MIL-101。
1.3 材料的表征
1.3.1 X射线粉末衍射(PXRD) 采用德国Bruker公司D8 ADVANCE型衍射仪对样品进行物相表征。其光源为铜靶Kα(l=0.15432 nm),单色器是石墨。在40 kV的管电压,40 mA的管电流下进行。在5°~50°区间内步长为0.02°,扫描速度为每步17.7 s。
1.3.2 傅里叶变换红外光谱测试(FTIR) 采用德国Bruker公司Vector33型测试仪,测试波长范围为4000~400 cm-1。
1.3.3 比表面积及孔隙结构分析 采用Micromeritics ASAP 2020物理吸附仪对样品进行比表面积和孔隙结构的测定。样品预处理条件为:在423 K真空干燥箱中对样品干燥处理12 h,然后取出,再将样品置于ASAP-2020装置上进行活化处理,活化条件为423 K,处理8 h。此后,再将样品在77 K下进行静态法N2吸附-脱附等温线的测定。然后根据N2吸附等温线,求得BET和Langmuir比表面积。通过t-plot模型分析可得材料的微孔孔容。利用DFT数学模型可得到全孔分布,包括微孔、中孔和大孔。
1.4 乙醇吸附等温线测定
采用美国Micromertics公司三站全功能型多用吸附仪3Flex进行测定。具体实验操作步骤如下:首先称取约50 mg样品,将其置于423 K下真空预处理 8 h,然后将真空脱气好的样品移至蒸汽吸附室,并设定吸附温度和吸附压力范围,然后开始测定,得到乙醇在MIL-101上的吸附等温线(298、308和318 K),选择测试的压力范围是在0~10 kPa。
1.5 水吸附等温线测定
采用美国Quantachrome Instruments公司水蒸气吸附仪AQUADYNE DVS进行测定。此装置由气流控制室、加湿室和微天平室组成,精确度达±1.0 mg+0.001%,湿度探针精确度达±0.8% RH(293 K)至±1.8% RH(343 K)。吸附等温线测试基于“静态重量法”等温吸附原理。具体操作步骤如下:称取约50 mg样品,将其置于423 K下真空预处理8 h,然后取样品置于天平上,并设定吸附温度,选择吸附气体的压力范围,然后开始测定,得到水蒸气在MIL-101上的吸附等温线(298、308和318 K),选择的压力范围是在0~10 kPa。
2 实验结果与讨论
2.1 MIL-101的PXRD表征

图1 MIL-101(Cr)的PXRD图谱Fig.1 Powder XRD pattern of MIL-101
图1示出了本文合成的MIL-101的PXRD谱图。由图中可以看出,合成的MIL-101的主要特征衍射峰出现在2θ=3.29°、5.88°、8.44°、9.06°、10.34°和16.53°,其衍射峰位置和文献报道的MIL-101的特征峰位置一致[28]。
2.2 MIL-101的FTIR分析
图2是本文合成的MIL-101的红外光谱分析图。其中较为明显的是MIL-101中BDC的羧基反对称和对称振动峰,分别位于1539和1401 cm−1[29],而原始的H2BDC中BDC的羧基反对称和对称振动峰分别位于1681和1285 cm−1[30],这是由于H2BDC与金属离子发生了配位,羧基基团发生去质子化,导致特征峰发生偏移,说明MIL-101已成功合成。
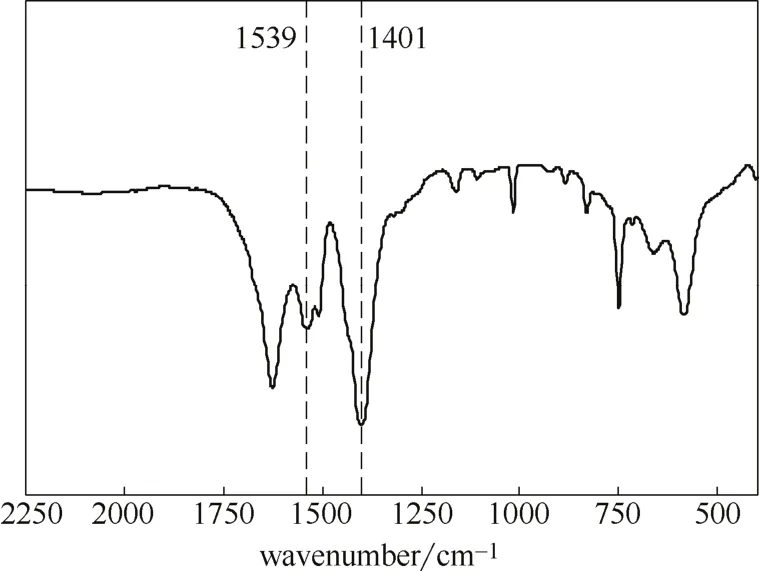
图2 MIL-101的红外光谱分析图谱Fig.2 FTIR spectra of MIL-101
2.3 MIL-101的孔隙结构
图3示出了MIL-101对N2的吸附脱附等温线(77 K)。由图可知,在较低的相对压力下,样品对N2的吸附量随相对压力的增加而急剧升高,同时在相对压力为0.2处出现二次吸附,这主要是由于MIL-101存在两种不同的笼状结构。表1列出了由N2吸附脱附等温线计算得到的MIL-101的孔隙结构参数,其BET比表面积为2936 m2·g-1。

图3 MIL-101在77 K下的N2吸附脱附等温线Fig.3 Nitrogen adsorption/desorption isotherms at 77 K of MIL-101

表1 MIL-101孔隙结构参数Table 1 Pore structure parameters of MIL-101
2.4 乙醇在MIL-101上的吸附等温线
图4示出了不同温度下乙醇在MIL-101上的吸附等温线。在低压区域,随着压力的增大,乙醇的吸附量急剧增大,等温线呈现很陡的变化,说明此时MIL-101对乙醇有较强的吸附作用力。随着温度的升高,乙醇的平衡吸附量均逐渐下降,这说明乙醇的吸附以物理吸附为主。令人感兴趣的是:乙醇在MIL-101上的吸附等温线出现明显的三次转折吸附现象,这主要是由于乙醇与MIL-101骨架材料的各吸附位间作用力的差异比较明显所致,本文将在下文作进一步分析阐述。

图4 乙醇在MIL-101上的吸附等温线Fig.4 Adsorption isotherms of ethanol on MIL-101 at different temperatures
2.5 乙醇在MIL-101上的吸附机理
MIL-101的最小单元是由3个铬八面体所组成的三聚体与对苯二甲酸连接所形成的正四面体结构,这些正四面体结构再由共用氧原子连接,在空间中构成更大的笼状结构。MIL-101有两种笼结构,一种是由12个五元环和4个六元环构成的较大的51264笼,其内部尺寸为3.4 nm。另一种是由12个五元环构成的较小的512笼,其内部尺寸为2.7 nm。其中五元环和六元环的窗口直径分别为1.17和1.6 nm[35]。
本课题组[36]的前期工作通过GCMC模拟方法得出MIL-101的质心密度图后,分析出MIL-101上存在的4种吸附位,如图5所示。MIL-101对乙醇分子的吸附位主要有以下4种:正四面体ST小笼(Ⅰ),五边形窗口孔(连通51264大笼和512小笼)(Ⅱ),512小笼的笼壁(Ⅲ)和51264大笼的笼壁(Ⅳ)。

图5 MIL-101材料上的吸附位及其与乙醇的作用力形式Fig.5 Adsorption sites and adsorption interactions of ethanol on MIL-101 (Red arrow is interactions between ethanol and supertetrahedral cages, purple arrow is interactions between ethanol and 512cages, blue arrow is intermolecular interactions of ethanol, green ball is ethanol)
在不同的压力范围内,压力对吸附量的影响也有所不同。第一次吸附主要发生在低压下正四面体ST小笼(Ⅰ)中的不饱和金属位与乙醇分子之间的吸附,乙醇通过静电作用力优先吸附在正四面体ST小笼的不饱和金属位上[如图5(b)中红色箭头所示]。此作用较强,呈单层吸附,以图4中298 K下乙醇在MIL-101上的吸附等温线为例,在0~0.5 kPa压力范围,随压力的增大吸附量急剧增大,不饱和金属位的吸附也趋近饱和,与此同时,乙醇开始吸附于五元环窗口位(Ⅱ)、512小笼的笼壁(Ⅲ)和51264大笼的笼壁(Ⅳ),由于在Ⅱ、Ⅲ、Ⅳ这3个吸附位上主要发生吸附质与有机配体的相互作用,这些作用力差别很小,吸附几乎同时进行,但此吸附力弱于乙醇与不饱和金属位之间的作用力,使得乙醇吸附量随压力增大的增幅变缓,因此乙醇的吸附等温线在低压单层吸附区出现明显的第1次转折;随着压力的增加,无论是吸附在不饱和金属位的乙醇分子,还是在Ⅱ、Ⅲ、Ⅳ这3个吸附位上的乙醇分子,都会通过氢键作用力吸附更多的乙醇分子形成分子团簇,随着分子团簇的增大,就会发生乙醇分子在分子团簇间孔隙中的填充,乙醇在分子间色散力[37]的作用下填充512小笼,使吸附量出现急剧上升,相应地,乙醇在MIL-101上的吸附等温线也发生急剧升高的转折,以图2中298 K下的乙醇吸附等温线为例,此转折发生在压力约1.7 kPa左右。随着压力继续升高,乙醇分子完成了在512小笼中分子团束间的孔隙中填充的同时,吸附于51264大笼的笼壁(Ⅳ)上的乙醇也开始通过氢键作用力和色散力吸附更多的乙醇分子,从而形成分子团束,随着分子团束的增大,51264大笼中就会发生乙醇分子在分子团束间的孔隙中填充,促使吸附量再次出现急剧上升,相应地,乙醇在MIL-101上的吸附等温线也发生急剧升高的转折,以图4中298 K下的乙醇吸附等温线为例,在压力约2.3 kPa处开始出现吸附量急剧增大的转折。总地说来,在整个压力范围内,乙醇在MIL-101上的吸附等温线反映出了四次吸附的机制,第1次是乙醇吸附在正四面体ST 小笼的不饱和金属位上为主,第2次是乙醇吸附在五元环窗口位、512小笼和 51264大笼的笼壁上,第3次是乙醇开始填充 512小笼中,第4次吸附是对应于乙醇在512小笼填充完后,开始在51264大笼中的继续填充。这4种不同的吸附机理导致乙醇在MIL-101上的吸附等温线呈现出三次转折吸附现象。
表2对比了几种传统吸附材料和MOFs对乙醇的吸附容量。表中数据表明:MIL-101的乙醇吸附能力明显超过BAC活性炭、MCM-41分子筛和H-ZSM5以及HKUST-1(Cu-BTC)。可见,MIL-101在热泵应用中具有很好发展潜力。
2.6 乙醇和水蒸气在MIL-101上的吸附等温线的比较
图6示出了水蒸气在MIL-101上的吸附等温线[39]。与图4中的乙醇在MIL-101上的吸附等温线相比,发现在低压条件下,MIL-101对乙醇的吸附量要远高于对水蒸气的吸附量,而在较高压力下,其对水蒸气的吸附容量要远高于对乙醇的吸附容量。其原因如下:(1)在低压条件下,MIL-101(Cr)中的不饱和金属位属极性表面同时也是亲水中心[21],水(偶极矩为1.85 D,1 D=3.33564×10-30C·m)和乙醇(偶极矩为16.9 D)都能与不饱和金属位形成较强的吸附。此外,由于乙醇的动力学直径(0.45 nm)大于水分子的动力学直径(0.268 nm),乙醇分子会受到来自孔道周围更强的叠加力场的吸附[40]。这就使得在低压条件下MIL-101对乙醇吸附容量比水更高。(2)在较高吸附压力下,无论是水还是乙醇分子都会发生多层吸附或孔填充[21],因此,当孔容一定时,由于吸附剂的孔容限制效应,会使得大尺寸的分子被吸附的物质的量小,导致其吸附容量相对较小。由于乙醇的动力学直径(0.45 nm)大于水分子的动力学直径(0.268 nm),所以乙醇在MIL-101上的高压吸附量会小于水,Sun等[41]研究系列直链烷烃在MIL-101@GO上的吸附机理时,也发现类似的现象。
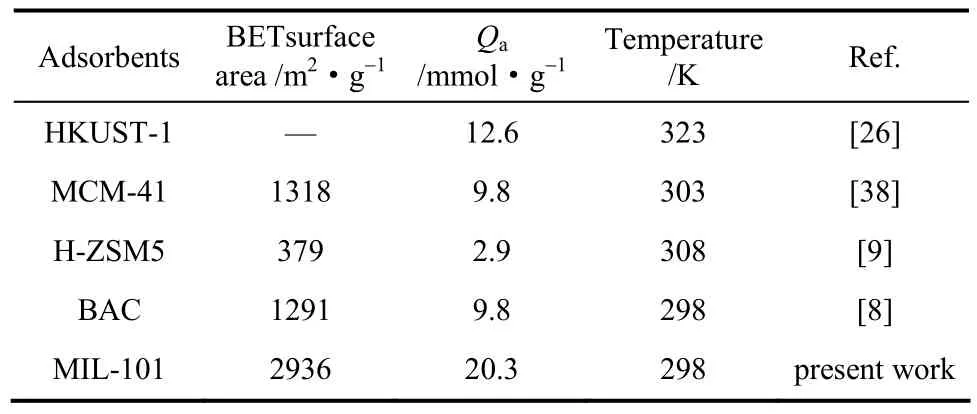
表2 乙醇在MIL-101材料和其他吸附材料上的吸附容量的比较Table 2 Ethanol adsorption capacities of MIL-101 and some other adsorbents reported from literatures

图6 不同温度下水在MIL-101上的吸附等温线Fig.6 Adsorption isotherms of water on MIL-101 at different temperatures
2.7 乙醇和水蒸气在MIL-101上的等量吸附热
等量吸附热(ΔHs)是指在材料有一定吸附量状态下,当再有无限小量的气相分子被吸附后所释放出来的热量[42],是评价吸附剂与吸附质之间亲和力的重要参数之一。根据在不同温度下吸附质在吸附剂上的吸附等温线,等量吸附热(ΔHs)可以由Clausiuse-Clapeyron方程(1)得出[43]
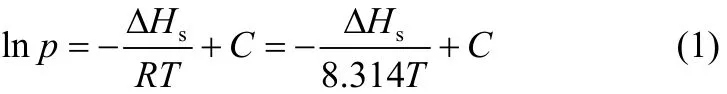
式中,ΔHs为吸附质在吸附剂上的等量吸附热,kJ·mol-1;R为理想气体常数,8.314 kJ·mol-1·K-1;T为吸附温度,K;C为积分常数;p为绝对压力,Pa。

图7 低压下乙醇、水蒸气在MIL-101上吸附的lnp-T-1拟合线Fig.7 Plots of lnp versus T-1for water vapor adsorption on MIL-101 at low pressure
通过不同温度下吸附质在MIL-101上的吸附等温线,利用式(1),就可以算出吸附质在MIL-101上的等量吸附热。以乙醇在MIL-101上的吸附为例,根据图4中不同温度下乙醇在MIL-101上的吸附等温线,绘出平行于x轴的等量吸附线,根据式(1)作出相应的lnp-1/T线性关系图,如图7(a)所示,从直线的斜率得到拟合线的斜率对应于式(1)中的-DHs/ R,DHs可以由斜率-DHs/ R直接求出,然后,就可以求出不同吸附量条件下的乙醇等量吸附热。用类似的方法,也可以根据图6中不同温度下水蒸气在MIL-101上的吸附等温线,求出不同吸附量条件下的水蒸气的等量吸附热,如图7 (b) 所示。
图8示出了在低压下乙醇和水在MIL-101上的等量吸附热。它表明在低吸附量范围,乙醇的等量吸附热略高于水的等量吸附热,且均随着压力的增加而逐渐下降。这是由于在低压状态下,主要发生单层吸附,此时主要由静电作用力主导,极性分子水(偶极矩为1.85 D)和乙醇(偶极矩为16.9 D)都能与不饱和金属位形成较强的吸附作用力,另外,乙醇的动力学直径(0.45 nm)大于水分子的动力学直径(0.268 nm),乙醇分子会受到来自孔道周围更强的叠加力场的吸附,作用力越强,每单位摩尔质量分子吸附时放出的热量越高。

图8 低压下乙醇和水蒸气在MIL-101的等量吸附热Fig.8 Isoteric heats of ethanol and water vapor adsorption on MIL-101 at low pressure
2.8 乙醇在MIL-101上的吸附-脱附等温线
吸附剂的再生性能是评价吸附剂能否应用于工业吸附过程中的一个重要参数。为了考察乙醇在MIL-101上的吸附循环性能,应用三站全功能型多用吸附仪3Flex测定了下乙醇在MIL-101上4次交替进行吸附脱附过程中的吸附等温线(298 K)。测试前,样品先放入150℃真空脱气站中进一步脱气8 h,然后再进行吸附-脱附等温线的测定。图9示出了298 K下乙醇在MIL-101材料上的吸附-脱附等温线。从图中可以看出,这些吸附等温线与脱附等温线完全重合,表明乙醇在MIL-101上的吸附具有很好的可逆性和稳定性。

图9 乙醇在 MIL-101上的吸附-脱附等温线Fig.9 Adsorption-desorption isotherms of ethanol onMIL-101 at 298 K (4th cycle)
3 结 论
(1)采用水热法制备MIL-101(Cr),对MIL-101晶形结构、孔隙结构参数进行分析表征。制得的MIL-101的BET比表面积可达到2936 m2·g-1,孔容达1.4 cm3·g-1。
(2)应用静态吸附法测定乙醇在不同温度下的吸附等温线,在298 K下,MIL-101(Cr)对乙醇的吸附量可以达到20.3 mmol·g-1。乙醇在MIL-101(Cr)上的吸附可分为四段吸附,先后发生在四面体ST小笼、五元环窗口位和笼壁、小笼内、大笼内。
(3)在低压下MIL-101对乙醇的吸附量高于水蒸气的吸附容量,在高压下则相反。这是由于在低压条件下,极性的水和乙醇都能与MIL-101(Cr)的不饱和金属位形成较强的吸附,但由于乙醇的偶极矩和动力学直径均比水大,使得乙醇分子在孔道中受到更大的范德华色散力,从而使得MIL-101在低压下的乙醇吸附量比水高。较高压力下,水和乙醇分子都会发生多层吸附或孔填充,乙醇分子动力学直径(0.45 nm)大于水分子的动力学直径(0.268 nm),受吸附剂的孔容的限制,乙醇在MIL-101上的高压吸附量小于水蒸气的吸附量。
(4)乙醇在MIL-101上的等量吸附热高于水蒸气的等量吸附热,且随着压力的升高等量吸附热曲线呈下降趋势。
(5)乙醇在MIL-101上具有良好的吸附脱附循环性能。
References
[1] HENNING H-M. Solar assisted air conditioning of buildings—an overview [J]. Applied Thermal Engineering, 2007, 27 (10):1734-1749.
[2] FROEHLICH J F, DOMINIK J C, HENNINGER S K. Advancement of sorption-based heat transformation by a metal coating of highly-stable, hydrophilic aluminium fumarate MOF [J]. RSC Advances, 2014, 4 (46): 24073-24082.
[3] ARISTOV Y I. Optimal adsorbent for adsorptive heat transformers: dynamic considerations [J]. International Journal of Refrigeration-Revue Internationale Du Froid, 2009, 32 (4): 675-686.
[4] SAHA B B, CHAKRABORTY A, KOYAMA S, et al. A new generation cooling device employing CaCl2-in-silica gel-water system [J]. International Journal of Heat and Mass Transfer, 2009, 52 (1/2): 516-524.
[5] TAMAINOT-TELTO Z, METCALF S J, CRITOPH R E, et al. Carbon-ammonia pairs for adsorption refrigeration applications: ice making, air conditioning and heat pumping [J]. International Journal of Refrigeration-Revue Internationale Du Froid, 2009, 32 (6): 1212-1229.
[6] VESELOVSKAYA J V, CRITOPH R E, THORPE R N, et al. Novel ammonia sorbents "porous matrix modified by active salt" for adsorptive heat transformation (Ⅲ): Testing of "BaCl2/vermiculite" composite in a lab-scale adsorption chiller [J]. Applied Thermal Engineering, 2010, 30 (10): 1188-1192.
[7] EL-SHARKAWY I I, SAHA B B, KOYAMA S, et al. Experimental investigation on activated carbon-ethanol pair for solar powered adsorption cooling applications [J]. International Journal of Refrigeration-Revue Internationale Du Froid, 2008, 31 (8): 1407-1413.
[8] ROMERO-ANAYA A J, LILLO-RODENAS M A, LINARES-SOLANO A. Factors governing the adsorption of ethanol on spherical activated carbons [J]. Carbon, 2015, 83: 240-249.
[9] ZHANG Ke, LIVELY R P, NOEL J D, et al. Adsorption of water and ethanol in MFI-type zeolites [J]. Langmuir, 2012, 28 (23): 8664-8673.
[10] FARHA O K, YAZAYDIN A O, ERYAZICI I, et al. De novo synthesis of a metal-organic framework material featuring ultrahigh surface area and gas storage capacities [J]. Nature Chemistry, 2010, 2 (11): 944-948.
[11] FURUKAWA H, KO N, GO Y B, et al. Ultrahigh porosity in metal-organic frameworks [J]. Science, 2010, 329 (5990): 424-428.
[12] YOON M, SRIRAMBALAJI R, KIM K. Homochiral metal-organic frameworks for asymmetric heterogeneous catalysis [J]. Chemical Reviews, 2012, 112 (2): 1196-1231.
[13] HORCAJADA P, GREF R, BAATI T, et al. Metal-organic frameworks in biomedicine [J]. Chemical Reviews, 2012, 112 (2): 1232-1268.
[14] BETARD A, FISCHER R A. Metal-organic framework thin films: from fundamentals to applications [J]. Chemical Reviews, 2012, 112 (2): 1055-1083.
[15] 李亮莎, 王可可, 黄宏亮, 等. 高稳定铪金属-有机骨架材料的合成及二氧化碳捕获性能 [J]. 化工学报, 2014, 65 (5): 1706-1715. LI L S, WANG K K, HUANG H L, et al. Synthesis of exceptional stable Hf-based metal-organic frameworks: characterization, stability and CO2adsorption performance [J]. CIESC Journal, 2014, 65 (5): 1706-1715.
[16] 乔智威, 杨仁党, 王海辉, 等. 面向生物甲烷分离的不同金属配位金属-有机骨架材料的分子设计 [J]. 化工学报, 2014, 65 (5): 1729-1735. QIAO Z W, YANG R D, WANG H H, et al. Molecular design of metal-organic frameworks with different metal ligands for bio-methane separation [J]. CIESC Journal, 2014, 65 (5): 1729-1735.
[17] 王可可, 李亮莎, 黄宏亮, 等. 铪金属-有机骨架材料的孔尺寸调控及其吸附性能 [J]. 化工学报, 2014, 65 (5): 1696-1705. WANG K K, LI L S, HUANG H L, et al. Control of pore size in Hf-based metal-organic frameworks and exploration of their adsorption properties [J]. CIESC Journal, 2014, 65 (5): 1696-1705.
[18] 杨琰, 王莎, 张志娟, 等. 氨气改性的NH3@MIL-53(Cr)吸附CO2和CH4的性能 [J]. 化工学报, 2014, 65 (5): 1759-1763. YANG Y, WANG S, ZHANG Z J, et al. CO2and CH4adsorption performance of modified MIL-53(Cr) via ammonia vapor [J]. CIESC Journal, 2014, 65 (5): 1759-1763.
[19] REZK A, AL-DADAH R, MAHMOUD S, et al. Characterisation of metal organic frameworks for adsorption cooling [J]. International Journal of Heat and Mass Transfer, 2012, 55 (25/26): 7366-7374.
[20] JEREMIAS F, KHUTIA A, HENNINGER S K, et al. MIL-100(Al, Fe) as water adsorbents for heat transformation purposes—a promising application [J]. Journal of Materials Chemistry, 2012, 22 (20): 10148-10151.
[21] KÜSGENS P, ROSE M, SENKOVSKA I, et al. Characterization of metal-organic frameworks by water adsorption [J]. Microporous and Mesoporous Materials, 2009, 120 (3): 325-330.
[22] SEO Y K, YOON J W, LEE J S, et al. Energy-efficient dehumidification over hierachically porous metal-organic frameworks as advanced water adsorbents [J]. Advanced Materials, 2012, 24 (6): 806-810.
[23] SUIB S L. Handbook of zeolite science and technology [J]. Science, 2003, 302 (5649): 1335-1336.
[24] DENOYEL R, BEURROIES I, VINCENT D. Microcalorimetric methods for studying vapour adsorption and wetting of powders [J]. Journal of Thermal Analysis and Calorimetry, 2002, 70 (2): 483-492.
[25] WESTON M H, DELAQUIL A A, SARJEANT A A, et al. Tuning the hydrophobicity of zinc dipyridyl paddlewheel metal-organic frameworks for selective sorption [J]. Crystal Growth & Design, 2013, 13 (7): 2938-2942.
[26] VAN ASSCHE T R C, DUERINCK T, GUTIERREZ SEVILLANO J J, et al. High adsorption capacities and two-step adsorption of polar adsorbates on copper benzene-1,3,5-tricarboxylate metal-organic framework [J]. Journal of Physical Chemistry C, 2013, 117 (35): 18100-18111.
[27] REZK A, AL-DADAH R, MAHMOUD S, et al. Investigation of ethanol/metal organic frameworks for low temperature adsorption cooling applications [J]. Applied Energy, 2013, 112: 1025-1031.
[28] KHUTIA A, RAMMELBERG H U, SCHMIDT T, et al. Water sorption cycle measurements on functionalized MIL-101Cr for heat transformation application [J]. Chemistry of Materials, 2013, 25 (5): 790-798.
[29] MAKSIMCHUK N V, TIMOFEEVA M N, MELGUNOV M S, et al. Heterogeneous selective oxidation catalysts based on coordination polymer MIL-101 and transition metal-substituted polyoxometalates [J]. Journal of Catalysis, 2008, 257 (2): 315-323.
[30] WU T B, ZHANG P, MA J, et al. Catalytic activity of immobilized Ru nanoparticles in a porous metal-organic framework using supercritical fluid [J]. Chinese Journal of Catalysis, 2013, 34 (1): 167-175.
[31] HONG D Y, HWANG Y K, SERRE C, et al. Porous chromium terephthalate MIL-101 with coordinatively unsaturated sites: surface functionalization, encapsulation, sorption and catalysis [J]. Advanced Functional Materials, 2009, 19 (10): 1537-1552.
[32] LI Y W, Yang R T. Hydrogen storage in metal-organic and covalent-organic frameworks by spillover [J]. AIChE Journal, 2008, 54 (1): 269-279.
[33] SENKOVSKA I, KASKEL S. High pressure methane adsorption in the metal-organic frameworks Cu-3(btc)(2), Zn-2(bdc)(2)dabco, and Cr3F(H2O)(2)O(bdc)(3) [J]. Microporous and Mesoporous Materials, 2008, 112 (1/2/3): 108-115.
[34] LIU Y Y, ZENG J L, ZHANG J, et al. Improved hydrogen storage in the modified metal-organic frameworks by hydrogen spillover effect [J]. International Journal of Hydrogen Energy, 2007, 32 (16): 4005-4010.
[35] LEBEDEV O I, MILLANGE F, SERRE C, et al. First direct imaging of giant pores of the metal-organic framework MIL-101 [J]. Chemistry of Materials, 2005, 17 (26): 6525-6527.
[36] LIU D F, Lin Y S, LI Z, et al. Adsorption and separation of CH4/H2in MIL-101s by molecular simulation study [J]. Chemical Engineering Science, 2013, 98: 246-254.
[37] WU Y, LIU D F, CHEN H Y, et al. Enhancement effect of lithium-doping functionalization on methanol adsorption in copper-based metal-organic framework [J]. Chemical Engineering Science, 2015, 123: 1-10.
[38] NGUYEN C, SONWANE C G, BHATIA S K, et al. Adsorption of benzene and ethanol on MCM-41 material [J]. Langmuir, 1998, 14 (17): 4950-4952.
[39] YAN J, YU Y, MA C, et al. Adsorption isotherms and kinetics of water vapor on novel adsorbents MIL-101(Cr)@GO with super-high capacity [J]. Applied Thermal Engineering, 2015, 84: 118-125.
[40] YANG R T. Adsorbents: Fundamentals and Applications [M]. New York: John Wiley & Sons; 2003: 8-13.
[41] SUN X J, XIA Q B, ZHAO Z X, et al. Synthesis and adsorption performance of MIL-101(Cr)/graphite oxide composites with high capacities of n-hexane [J]. Chemical Engineering Journal, 2014, 239: 226-232.
[42] JOVANOVIĆ D. Physical adsorption of gases [J]. Kolloid-Zeitschrift und Zeitschrift für Polymere, 1969, 235 (1): 1214-1225.
[43] SHEN D M, BÜLOW M, SIPERSTEIN F, et al. Comparison of experimental techniques for measuring isosteric heat of adsorption [J]. Adsorption-Journal of the International Adsorption Society, 2000, 6 (4): 275-286.
Foundation item: supported by the National Science Foundation of China (51276065).
Adsorption equilibrium and mechanism of ethanol on MIL-101(Cr)
YU Ying, SUN Xuejiao, YAN Jian, XIAO Jing, XI Hongxia, LI Zhong
(School of Chemistry and Chemical Engineering, South China University of Technology, Guangzhou 510640, Guangdong, China)
Abstract:The adsorption performance and adsorption mechanism of ethanol on MIL-101(Cr) were investigated. MIL-101(Cr) was synthesized using a hydrothermal synthesis method, and characterized using N2adsorption measurements, powder X-ray diffraction, and Fourier transform infrared spectroscopy. The adsorption isotherms of ethanol and water vapor were measured by static adsorption method at different temperatures, and ethanol adsorption mechanisms on four types of adsorptive sites in MIL-101 were discussed. The isosteric heats of ethanol and water adsorption were calculated according to these isotherms. The adsorption and desorption of ethanol on MIL-101 were evaluated. Results show that adsorption capacity of MIL-101(Cr) for ethanol is up to 20.3 mmol·g-1at 298 K, much higher than those of some traditional adsorbents. At low pressure, the adsorption capacity of MIL-101 for ethanol is higher than that for water vapor, which could be ascribed to larger dipole moment and dynamic diameter of ethanol compared to water molecule. In addition, the isosteric heat of ethanol adsorption on MIL-101 is higher than that of water vapor adsorption. At high pressure, multilayer adsorption or cage filling occurs, so the molecule with large dynamic size will fill within MOFs with less moles than that withbook=301,ebook=309small dynamic size due the limitation of pore volume of MOFs. As a consequence, the adsorption capacity of MIL-101 for ethanol is lower than that for water vapor because the dynamic diameter of ethanol (0.45 nm) is larger than that of water molecule (0.268 nm). The ethanol adsorption and desorption isotherms show that ethanol adsorption on MIL-101 is highly reversible.
Key words:MIL-101(Cr); ethanol; water vapor; adsorption equilibrium; adsorption; heat of adsorption
Corresponding author:Prof. LI Zhong, cezhli@scut.edu.cn
基金项目:国家自然科学基金项目(51276065)。
中图分类号:TB 383;O 647
文献标志码:A
文章编号:0438—1157(2016)01—0300—09
DOI:10.11949/j.issn.0438-1157.20151052

