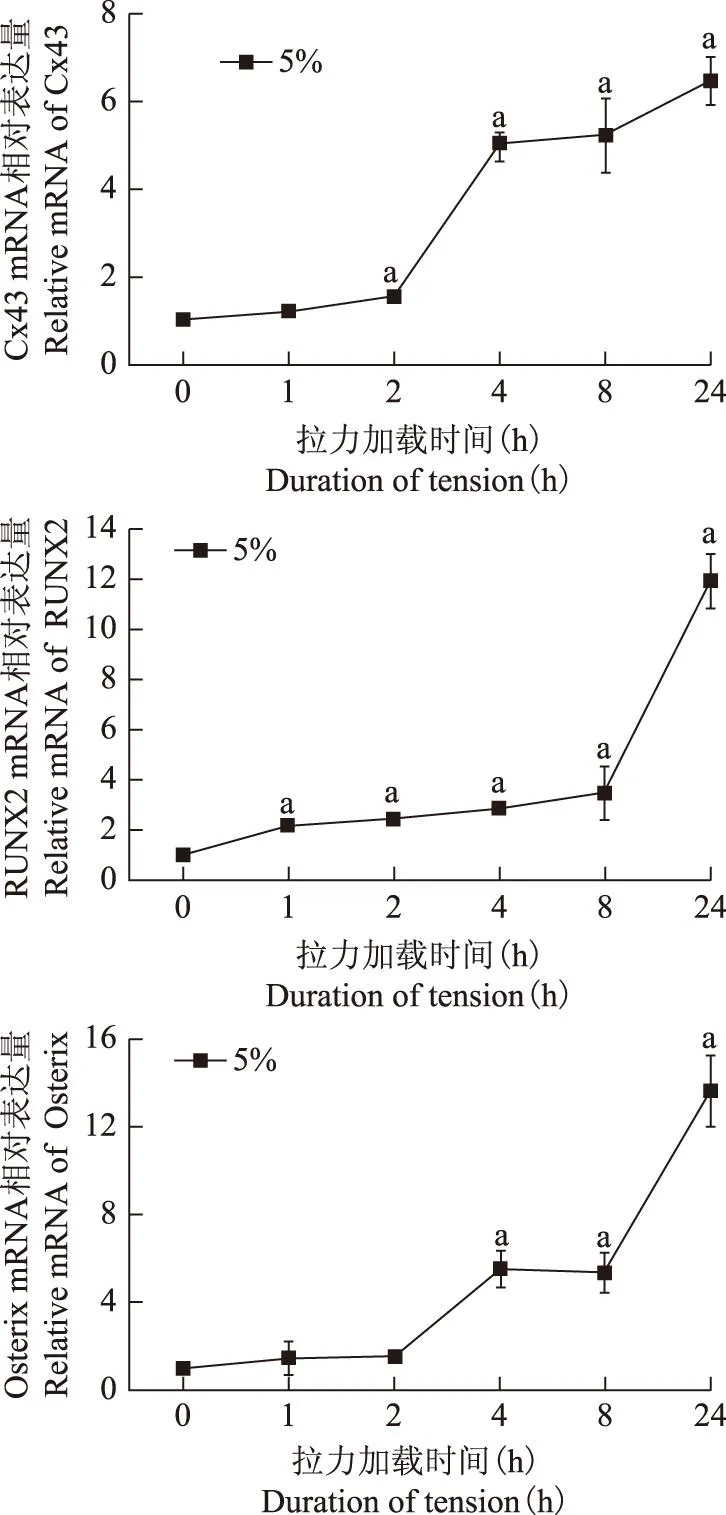
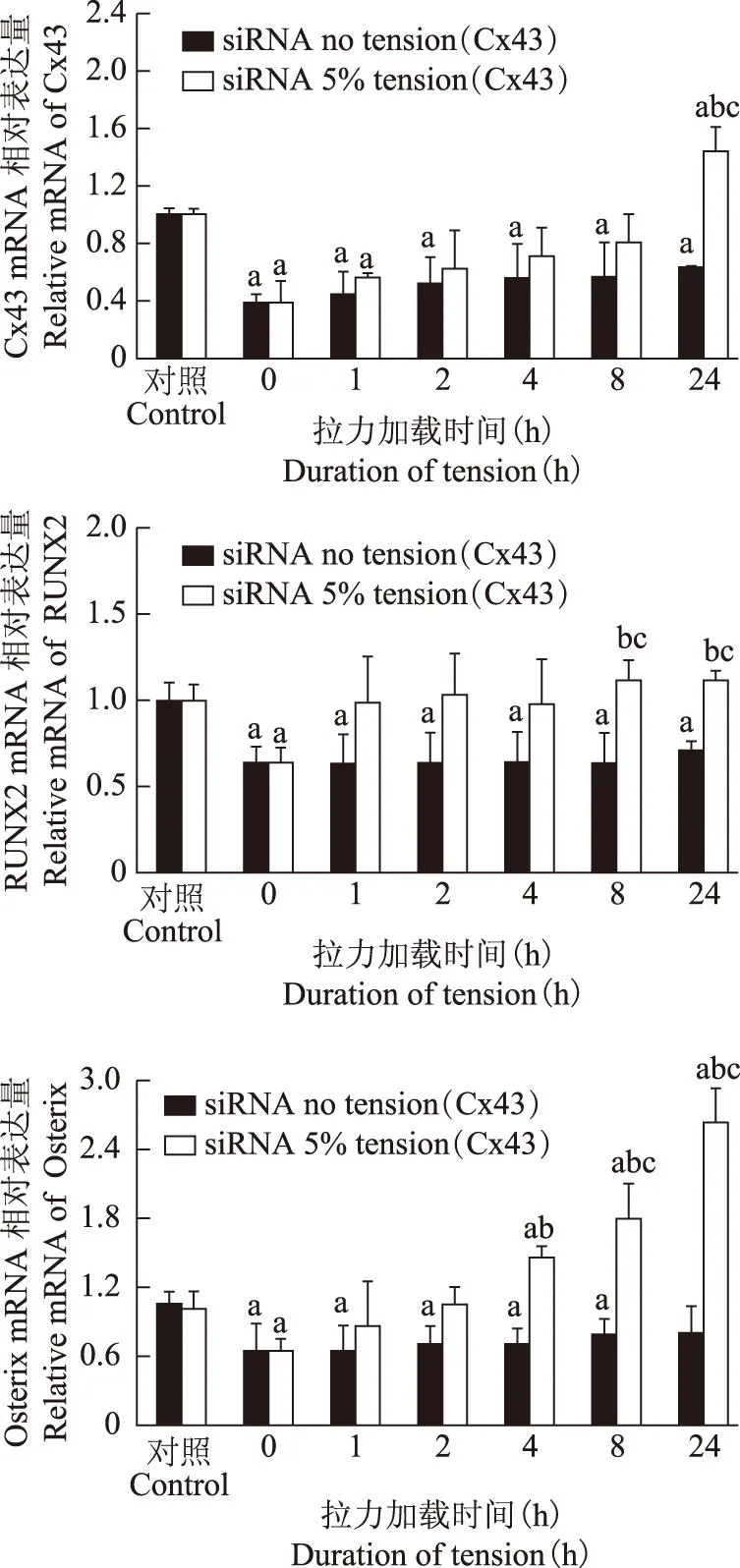
间隙连接蛋白Connexin43对力刺激下人牙周膜细胞成骨相关转录因子表达的影响
李盛楠,张华菁,霍 波,张 丁
1中国医学科学院 北京协和医学院 北京协和医院口腔科,北京 100730 2北京理工大学宇航学院生物力学系,北京 100081
·论著·
间隙连接蛋白Connexin43对力刺激下人牙周膜细胞成骨相关转录因子表达的影响
李盛楠1,张华菁1,霍波2,张丁1
1中国医学科学院北京协和医学院北京协和医院口腔科,北京 1007302北京理工大学宇航学院生物力学系,北京 100081
摘要:目的研究间隙连接蛋白Connexin43(Cx43)在牵张力刺激下对牙周膜成纤维细胞成骨相关转录因子表达的影响。方法对体外培养的人牙周膜成纤维细胞(hPDLFs)施加变形量为5%的牵张力,在受力1、2、4、8、24 h后检测成骨相关转录因子Osterix、RUNX2及Cx43 mRNA的表达。分别采用间隙连接的阻断剂18α-GA和基因沉没Cx43的方法阻断Cx43后观察Osteix、RUNX2 mRNA表达的变化。结果对hPDLFs施加牵张力时,hPDLFs内的Cx43、Osterix和RUNX2 mRNA水平随加力时间增加表达均明显增强(P均 关键词:牙周膜细胞;机械力;Connexin 43;成骨转录因子 ActaAcadMedSin,2016,38(1):22-26 在正畸牙移动的相关理论中,关于牙周膜细胞对牙周组织改建的生物学作用已有了较为深入的研究。当外力作用于牙齿时,牙周膜及牙槽骨随着外界应力的变化而不断改建以适应其功能的需要。在改建过程中,机械信号转化为生化信号,并传递到骨改建相关效应细胞,引起牙槽骨的改建并最终引起牙齿的移动。牙周膜细胞是机械力的直接效应细胞,具有成骨样细胞表型,受到机械牵张力作用后首先发生成骨分化,进而形成牙槽骨,并影响破骨细胞的生成,对正畸牙槽骨改建发挥着极其重要的作用[1]。因此,研究牙周膜细胞在机械牵张力作用下的成骨分化过程,对于深入了解正畸牙槽骨改建机制具有重要意义。 间隙连接通道(gap junction,GJs)是一种重要的细胞间交通系统,在骨细胞、成骨细胞、破骨细胞中均能感应并传递力学信号。本课题组前期研究显示,骨细胞的间隙连接蛋白Connexin43(Cx43)在流体剪切力刺激下表达增强,可促进骨细胞向成骨转化[2],提示Cx43对于力学信号的传导起着重要作用。但目前对于机械牵张力作用下牙周膜细胞发生成骨向分化的机制仍不清楚。本研究观察了Cx43在机械牵张力介导的人牙周膜成纤维细胞(human periodontal ligament fibroblasts,hPDLFs)成骨分化中的作用。 材料和方法 材料DMEM培养基(高糖)、胎牛血清(fetal bovine serum,FBS)(Gibco公司,美国),cDNA反转录试剂盒(TransGen生物有限公司,中国),倒置相差显微镜(Leica,德国),基底膜拉伸装置(北京理工大学宇航学院力学实验室研制),梯度PCR仪(Bio-rad公司,德国)。 hPDLFs的体外培养和传代复苏原代hPDLFs(美国Sciencell公司),倒置相差显微镜下观察细胞生长及贴壁情况,待细胞生长至80%融合后传代,取生长良好的第4~6代hPDLFs进行拉力实验。 hPDLFs的体外加力采用周期性拉力法对细胞加载机械力。拉伸基底膜由PDMS (Sylfard184,Dowcorning)胶按照1∶10的比例配置制成。制成的基底膜应用离子溅射仪去离子化,消毒后细胞按每条2.5×105个接种于基底拉伸膜,实验组与对照组同时种板。待细胞融合80%,在无菌条件下固定膜于基底拉伸装置上,置于37 ℃孵箱中,实验组周期性加力(1 cycle/3 min),拉伸应变率为5%,加力时间分别为1、2、4、8、24 h。此加力方式均属于正畸临床轻力范围[3]。 18α-GA阻断hPDLFs的GJs将18α-GA粉末溶解于DMSO中,配制成20 mmol/L的溶液4°C保存备用。使用时,用细胞培养基将该溶液稀释至75 μmol/L。加入含75 μmol/L 18α-GA的细胞培养基,在孵箱中孵育30 min后,对实验组细胞施加不同时间的拉力。由于18α-GA对GJs的阻断作用具有可逆性,所以在机械牵张力细胞加载系统中,培养基里也保持有75 μmol/L的18α-GA含量。同时设置阳性对照组,即加入18α-GA,但未加力。 siRNA干扰技术抑制hPDLFs Cx43的表达将配制好的siRNA转染液(约2 ml)加入hPDLFs的培养瓶中,在5%CO2、饱和湿度、37°C条件的恒温培养箱中孵育8 h。不吸走siRNA转染液,加入2 ml常规细胞培养基(10%FBS和1%双抗),再孵育24 h。吸净培养基,换成正常的基础培养基,孵育24 h。转染成功后的细胞可接种于基底拉伸膜上,用于细胞加力实验。细胞加力实验设置了阴性对照组(scrambled siRNA加力)、阳性对照组(siCx43干扰但未加力)和实验组(siCx43干扰加力),在每个加力时间点均设置了1组对照组,加力0、1、2、4、8、24 h。 实时定量PCR检测采用Trizol法提取细胞总RNA,反转录后取2 μl cDNA放入Bio-rad iQ5机器内,按照实验说明进行逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)。反应程序为:95 ℃预变性10 min;95 ℃变性30 s、95 ℃退火5 s、60 ℃延伸30 s,循环40次。 统计学处理采用SPSS 13.0统计软件,实验重复3次,数据以均数±标准差表示,组间均数比较采用单因素方差分析,P<0.05为差异有统计学意义。 结果 周期性牵张力作用对hPDLFs Cx43 mRNA及成骨相关转录因子表达的影响对hPDLFs施加牵张力时,hPDLFs内的Cx43 mRNA表达水平逐渐上升,至24 h时达到最大(6.4-fold,P=0.014);在加力的24 h 中,RUNX2 表达量在受力1 h时即出现显著变化(P=0.032),其表达量随时间逐渐增加;Osterix表达量在受力4 h后才出现明显增加(P=0.0275),受力24 h表达量增至峰值(13.6-fold)(图1)。 阻断GJs对牵张力作用下hPDLFs的Cx43 mRNA及成骨相关基因表达的影响实时荧光定量PCR结果显示,用间隙连接蛋白阻断剂18α-GA把hPDLFs的GJs阻断后,胞内Cx43 mRNA表达水平受到明显抑制(0.44-fold,P=0.028)。对hPDLFs施加机械牵张力4 h后,Cx43 mRNA水平即恢复到阴性对照组水平(P=0.64),此后表达量继续增加,至24 h时较阴性对照组(P=0.032)和阳性对照组(P=0.041)都明显增加;而进行了GJs阻断却未加力的hPDLFs随时间推移Cx43 mRNA表达量一直受到抑制,24 h时也未达到阴性对照组表达水平。间隙连接阻断后成骨转录因子RUNX2 表达水平也受到明显抑制(0.59-fold,P=0.029),随加力刺激时间增加表达量逐渐恢复,受力4 h后恢复至阴性对照组水平(P=0.61)。Osterix mRNA表达也受到间隙连接阻断剂的抑制(0.61-fold,P=0.023),但在受力2 h后Osterix mRNA表达水平即恢复至阴性对照组水平(P=0.53)(图2)。 与0 h组比较,aP<0.05 aP<0.05 compared with 0 h 图1周期性拉力对Cx43、RUNX2和Osterix mRNA 表达的影响(n=3) Fig1Effect of cyclic mechanical tension on relative mRNA levels of Cx43,RUNX2,and Osterix in hPDLFs by qPCR normalized to GAPDH(n=3) 与对照组比较,aP<0.05;与0 h组比较,bP<0.05 aP<0.05,compared with control;bP<0.05,compared with 0 h 图2阻断GJs后周期性拉力对Cx43、RUNX2和Osterix mRNA 表达的影响(n=3) Fig2Effect of cyclic mechanical tension on relative mRNA levels of Cx43,RUNX2,and Osterix in hPDLFs blocking gap junctions by qPCR normalized to GAPDH (n=3) 抑制间隙连接蛋白Cx43对hPDLFs中成骨相关转录因子表达的影响对hPDLFs施加siRNA干扰技术后,胞内Cx43 mRNA水平受到明显抑制(0.39-fold,P=0.012)。随后施加机械牵张力刺激,结果显示随加力时间延长Cx43 mRNA水平逐步恢复,8 h后恢复至阴性对照组水平(P=0.44),24 h后表达量比阳性对照组(siRNA,0 h组)和阴性对照组(scrambled siRNA组)都明显增加(P=0.025)。而施加了siRNA技术却未加力的hPDLFs,随时间增加Cx43 mRNA表达量增加,但24 h后仍远低于阴性对照组(P=0.027)。Cx43基因被沉没后,RUNX2 mRNA水平也明显受到抑制(0.64-fold,P=0.023),并且机械刺激后表达量仍在基线上下波动,直至受力8 h后出现较明显的增加(1.2-fold,P=0.014)。Osterix mRNA在Cx43基因被抑制时表达量也明显受到抑制(0.62-fold,P=0.031),施加机械牵张力后表达量随时间延长而增加,在4 h即出现明显增加(P=0.019)(图3)。 讨论 正畸治疗中,牙周膜对牙齿移动、牙槽骨重建起着重要的作用,其中hPDLFs被视为成骨及破骨信号分子传导的直接效应细胞[1,4]。研究显示间隙连接蛋白Cx43是响应机械力、激素和生长因子对骨细胞刺激时的重要调节器[5- 6]。与整合素类似,间隙连接蛋白也是一种跨膜蛋白,它以六聚体的形式组成1个连接子。GJs由相邻细胞的连接子构成跨膜的区域,允许相对分子质量小于1000的分子和离子通过其扩散[7]。骨组织中含量最丰富的间隙连接蛋白是Cx43,其广泛存在于骨细胞的胞质、胞膜和突触中,参与调节了骨细胞的增殖、分化和存活。本课题组以往研究表明,流体剪切力可促进骨细胞中Cx43的表达且通过Cx43调节骨细胞的成骨和破骨相关基因表达[2]。本研究也发现机械牵张力可促进hPDLFs Cx43的表达,与早期体内、外研究结果一致[8- 9]。本研究还发现,在机械牵张力刺激下随加力时间的增加成骨转录因子Osterix和RUNX2表达也明显增加,与以往体内、外研究证明的Osterix和RUNX2表达具有时间依赖性结果一致[10- 12]。而siRNA干扰抑制Cx43基因或是18α-GA阻断GJs后,RUNX2和Osterix基因的表达明显受到抑制,提示间隙连接蛋白Cx43是牵张力作用下hPDLFs中成骨转录因子RUNX2及Osterix的表达调控因子。 与对照组比较,aP<0.05;与0 h组比较,bP<0.05;与未加力组比较,cP<0.05 aP<0.05 compared with control;bP<0.05 compared with 0 h;cP<0.05 compared with siRNA no tension 图3Cx43沉没后周期性拉力对Cx43、RUNX2和Osterix mRNA 表达的影响(n=3) Fig3Silencing Cx43 in hPDLFs under cyclic mechanical tension,relative mRNA levels of Cx43,RUNX2 and Osterix were normalized to GAPDH (n=3) RUNX2可与调节成骨特异性基因表达的启动子成骨细胞特异性元件(osteoblast-specific cis-acting element 2,OSE2)相互结合,是促进成骨的早期转录因子[13]。Osterix是成骨细胞分化和骨形成不可缺少的调节因子[14],其调控许多重要的成骨早晚期表型和功能蛋白表达[15]。在Osx基因剔除小鼠胚胎中,各种成骨分化标志物的表达水平严重降低或缺如,成骨细胞的分化、成熟被完全阻断[16]。Li等[17]研究发现,周期性牵张力刺激Osterix和RUNX2的表达是通过MAPK信号通路介导的。Fujihara等[11]研究结果显示,谷氨酸信号通路也可以调节由机械力刺激牙周膜细胞引起的RUNX2表达增加。本研究结果证实,在机械牵张力作用下,间隙连接蛋白Cx43参与了hPDLFs的成骨转录因子表达,可能在正畸牙槽骨改建中发挥重要作用。但也有文献报道不同的信号通路对细胞生理变化有不同的影响[18-19],关于在机械牵张力作用下hPDLFs成骨分化过程中Cx43与其他信号通路的相互作用尚未见报道。本课题组将继续深入地进行研究,以期为完善正畸临床理论及相关骨生物力学理论作出贡献。 参考文献 [1]Wongkhantee S,Yongchaitrakul T,Pavasant P. Mechanical stress induces osteopontin via ATP/P2Y1 in periodontal cells[J]. J Dent Res,2008,87(6):564- 568. [2]Li X,Liu C,Li P,et al. Connexin 43 is a potential regulator in fluid shear stress-induced signal transduction in osteocytes[J]. J Orthop Res,2013,31(12):1959- 1965. [3]Yamaguchi M,Shimizu N,Shibata Y,et al. Effects of different magnitudes of tension-force on alkaline phosphatase activity in periodontal ligament cells[J]. J Dent Res,1996,75(3):889- 894. [4]Kook SH,Son YO,Hwang JM,et al. Mechanical force inhibits osteoclastogenic potential of human periodontal ligament fibroblasts through OPG production and ERK-mediated signaling[J]. J Cell Biochem,2009,106(6):1010- 1019. [5]Plotkin LI,Manolagas SC,Bellido T. Transduction of cell survival signals by connexin- 43 hemichannels[J]. J Biol Chem,2002,277(10):8648- 8657. [6]Morelli S,Bilbao PS,Katz S,et al. Protein phosphatases:possible bisphosphonate binding sites mediating stimulation of osteoblast proliferation[J]. Arch Biochem Biophys,2011,507(2):248- 253. [7]Laing JG,Chou BC,Steinberg TH. ZO- 1 alters the plasma membrane localization and function of Cx43 in osteoblastic cells[J]. J Cell Sci,2005,118(Pt 10):2167- 2176. [8]Xu C,Fan Z,Shan W,et al. Cyclic stretch influenced expression of membrane connexin 43 in human periodontal ligament cell[J]. Arch Oral Biol,2012,57(12):1602- 1608. [9]Su M,Borke JL,Donahue HJ,et al. Expression of connexin 43 in rat mandibular bone and periodontal ligament (PDL) cells during experimental tooth movement[J]. J Dent Res,1997,76(7):1357- 1366. [10]赵艳红,李洪发,王春玲,等. 机械力作用下人牙周膜细胞Osterix mRNA和蛋白的表达[J]. 华西口腔医学杂志,2010,28(2):214- 218. [11]Fujihara C,Yamada S,Ozaki N,et al. Role of mechanical stress-induced glutamate signaling-associated molecules in cytodifferentiation of periodontal ligament cells[J]. J Biol Chem,2010,285(36):28286- 28297. [12]Kawarizadeh A,Bourauel C,Gotz W,et al. Early responses of periodontal ligament cells to mechanical stimulusinvivo[J]. J Dent Res,2005,84(10):902- 906. [13]Ducy P,Zhang R,Geoffroy V,et al. Osf 2/Cbfa1:a transcriptional activator of osteoblast differentiation[J]. Cell,1997,89(5):747- 754. [14]Ohyama Y,Nifuji A,Maeda Y,et al. Spaciotemporal association and bone morphogenetic protein regulation of sclerostin and osterix expression during embryonic osteogenesis[J]. Endocrinology,2004,145(10):4685- 4692. [15]Nakashima K,Zhou X,Kunkel G,et al. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation[J]. Cell,2002,108(1):17- 29. [16]Kumamoto H,Ooya K. Expression of bone morphogenetic proteins and their associated molecules in ameloblastomas and adenomatoid odontogenic tumors[J]. Oral Dis,2006,12(2):163- 170. [17]Li L,Han M,Li S,et al. Cyclic tensile stress during physiological occlusal force enhances osteogenic differentiation of human periodontal ligament cells via ERK1/2-Elk1 MAPK pathway[J]. DNA Cell Biol,2013,32(9):488- 497. [18]Watkins M,Grimston SK,Norris JY,et al. Osteoblast connexin 43 modulates skeletal architecture by regulating both arms of bone remodeling[J]. Mol Biol Cell,2011,22(8):1240- 1251. [19]Thi MM,Islam S,Suadicani SO,et al. Connexin43 and pannexin1 channels in osteoblasts:who is the “hemichannel”[J]. J Membr Biol,2012,245(7):401- 409. Effect of Connexin43 on Mechanical Tension-stimulated Osteogenic Transcription Factors of Human Periodontal Ligament Fibroblasts LI Sheng-nan1,ZHANG Hua-jing1,HUO Bo2,ZHANG Ding1 1Department of Stomatology,PUMC Hospital,CAMS and PUMC,Beijing100730,China2Department of Biomechanics,School of Aerospace Engineering,Beijing Institute of Technology,Beijing 100081,China Corresponding author:ZHANG DingTel:010- 69151740,E-mail:dingz77@sina.com ABSTRACT:ObjectiveTo investigate the expression and effect of Connexin43 (Cx43) on tensile tension-stimulated osteogenic transcription factors of human periodontal ligament fibroblasts (hPDLFs).MethodsAfter hPDLFs were treated with 5% elongation tension for 1 h,2 h,4 h,8 h,and 24 h,we examined the expressions of Cx43,Osterix,and RUNX2 at the mRNA level. After Cx43 expression was suppressed by siRNA or 18α-GA,the changes The mRNA in hPDLFs of Osterix and RUNX2 were observed. ResultsThe expressions of Cx43,Osterix,and RUNX2 mRNA in hPDLFs increased in a time-dependent fashion following tensile strain (all P<0.05),with the highest level at 5% elongation for 24 h. After Cx43 expression was blocked by two different methods,the increasing expressions of Osterix and RUNX2 were inhibited. Conclusions5% cyclic tension upregulates Cx43 expression and promotes the expression of Osterix and RUNX2 in a time-dependent manner. Cx43 may be involved in the osteogenic response of hPDLFs to mechanical tension. Key words:periodontal ligament cell;mechanical stretch;Connexin43;osteogenic transcription factors (收稿日期:2015- 04- 05) DOI:10.3881/j.issn.1000- 503X.2016.01.004 中图分类号:R783.5 文献标志码:A 文章编号:1000- 503X(2016)01- 0022- 05 通信作者:张丁电话:010- 69151740,电子邮件:dingz77@sina.com 基金项目:国家自然科学基金(31371389)Supported by the National Natural Sciences Foundation of China (31371389)