MiR- 146a高表达对神经胶质细胞BV2炎性反应的影响
赵 娜,申 乐,姜浩武,马 超,黄宇光
1中国医学科学院 北京协和医学院 北京协和医院麻醉科,北京 100730 2中国医学科学院 北京协和医学院 基础医学研究所人体解剖与组织胚胎学系,北京 100005
·论著·
MiR- 146a高表达对神经胶质细胞BV2炎性反应的影响
赵娜1,申乐1,姜浩武2,马超2,黄宇光1
1中国医学科学院北京协和医学院北京协和医院麻醉科,北京 1007302中国医学科学院北京协和医学院基础医学研究所人体解剖与组织胚胎学系,北京 100005
摘要:目的观察高表达MiR- 146a对细菌脂多糖(LPS)诱导后神经胶质细胞BV2炎性反应的影响。方法采用LPS刺激接受MiR- 146a 模拟物转染后的BV2细胞,Real-time PCR检测MiR- 146a转染效率,ELISA检测促炎症因子白细胞介素- 6(IL- 6)和肿瘤坏死因子α(TNFα)的表达水平,Real-time PCR和Western blot法检测TLR4信号通路上肿瘤坏死因子受体相关因子6(TRAF6)和白细胞介素-1受体相关激酶1(IRAK1)的表达水平。结果与正常组比较,采用50 nmol/L的转染浓度对BV2细胞进行MiR- 146a模拟物转染,可明显增加细胞内MiR- 146a含量(t=5.846,P=0.0021);LPS刺激导致BV2细胞激活,可明显增加细胞内IRAK1和TRAF6表达,也可明显诱发细胞分泌更多的IL- 6和TNFα;而与单纯采用LPS刺激相比,用MiR- 146a模拟物转染后再接受LPS刺激作用可明显降低IL- 6(t=5.200,P=0.0003)和TNFα(t=9.812,P<0.0001)的表达水平,同时明显降低细胞内TRAF6分子在基因(t=5.353,P=0.0007)和蛋白(t=6.980,P=0.0009)水平的表达,而非IRAK1的表达。结论MiR- 146a可能是通过调控TLR4信号通路中TRAF6分子的表达,负反馈抑制BV2细胞的炎性反应。
关键词:MiR- 146a;小胶质细胞;神经病理性疼痛;促炎症因子
ActaAcadMedSin,2016,38(1):27-32
微小RNA(microRNA,miRNA,MiR)是近年来生命研究的热点,其可通过抑制mRNA翻译或促进mRNA降解,影响mRNA寿命,从而在转录后水平对基因的表达进行调控,最终影响下游蛋白质分子(如细胞因子等)的表达;绝大多数miRNA主要是抑制基因表达,发挥负反馈调节作用[1- 4]。MiR- 146是第1个被发现在免疫应答中具有调节作用的miRNA,包括MiR- 146a 和MiR- 146b两个成员[5]。体外研究显示,MiR- 146a可通过负反馈调节Toll样受体(Toll like receptor,TLR)亚型TLR4信号通路上的白细胞介素- 1受体相关激酶1 (interleukin- 1 receptor-associated kinase 1,IRAK- 1)及肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6),损害核因子κB(nuclear factor κB,NF-κB)活性,降低NF-κB靶基因的表达[6- 8],从而进一步降低信号通路下游的促炎症因子,如白细胞介素(interleukin,IL)- 6、IL- 8、IL- 1β和肿瘤坏死因子α(tumor necrosis factor,TNFα)表达。本课题组以往采用大鼠双侧坐骨神经慢性结扎损伤(chronic constriction injury,CCI)模型,通过筛查其脊髓标本的基因芯片,发现了几个异常表达的miRNA,其中,MiR- 146a在该模型诱导的神经病理性疼痛中出现了低表达[9]。近年研究发现,神经胶质细胞介导的神经炎症反应与神经病理性疼痛的发生与维持有着密切的关系。本研究观察了细菌脂多糖(lipopolysaccharide,LPS)刺激神经胶质细胞(小胶质细胞)导致TLR4信号通路激活后,外源性干预高表达MiR- 146a对调控TLR4信号通路下游促炎症因子表达的影响。
材料和方法
材料和仪器BV2细胞(小鼠小胶质细胞)、无菌PBS、DMEM高糖培养基、进口胎牛血清、双抗(青霉素+链霉素)、0.05%胰蛋白酶消化液均购自中国医学科学院基础医学研究所基础医学细胞中心,LPS购自美国Sigma公司,转染试剂Lipofectamine®RNAiMAX购自美国Life Technologies公司,MiR- 146a模拟物及阴性对照错义链购自上海吉玛生物公司;RNA提取试剂Trizol、反转录试剂盒及Real-time PCR试剂盒购自日本TAKARA公司;MiR- 146a及内参U6的引物由广州锐博生物科技有限公司设计并合成(茎环法),TRAF6、IRAK1及β-actin引物由上海生工生物工程股份有限公司设计并合成;蛋白质提取试剂及定量检测试剂盒购自上海碧云天公司;Western blot相关试剂(如电泳液、转膜液及抗体稀释液等)购自北京康为世纪生物技术有限公司;小鼠TRAF6、IRAK1及β-actin一抗及相应二抗购自英国Abcam公司;小鼠IL- 6和TNFα的ELISA检测试剂盒购自上海依科赛生物制品有限公司。PCR仪为Bio-Rad CFX96 (美国BioBad公司),Western blot电泳仪为BIO-RAD Mini-PROTEAN®Tetra System(美国BioBad公司),蛋白质定量及ELISA检测所用酶标仪为BIO-RAD iMARKTM Microplate Reader(美国BioBad公司),RNA浓度测定所用的超微量分光光度计为Nanodrop 2000(美国Thermo scientific公司),细胞培养箱为Thermo HERAcell 150i(美国Thermo Scientific公司)。
细胞培养及分组将BV2细胞培养于含有10%胎牛血清、100 U/ml青霉素及100 μg/ml链霉素的DMEM高糖培养基中,置于环境为37℃、5% CO2的培养箱中培养,每隔2~3 d传代1次,传代3次后进行实验。实验分为4组,分别是正常组(N组)、LPS组(L组)、MiR- 146a模拟物转染后LPS刺激组(M+L组)及阴性对照错义链转染后LPS刺激组(NC+L组)。
细胞转染并上调MiR- 146a表达水平取传代3次后的细胞,按照2×105/孔接种于六孔细胞培养板中,在细胞培养箱中培养24 h后,细胞密度大约为50%。按操作说明书进行转染,MiR- 146a 模拟物和错义链转染终浓度为50 nmol/L,转染6 h后更换培养基,继续放入培养箱中培养。MiR- 146a模拟物的序列为:上游:UGAGAACUGAAUUCCAUGGGUU;下游:CCCAUGGAAUUCAGUUCUCAUU。阴性对照错义链的序列为:上游:UUCUCCGAACGUGUCACGUTT;下游:ACGUGACACGUUCGGAGAATT。
LPS刺激转染48 h后更换培养基,加入用基础培养基溶解的LPS,每孔中的终浓度为5 μg/ml,作用4 h后收集标本。
ELISA检测IL- 6和TNFα表达水平收集六孔板中细胞培养基,4℃ 3000 r/min(r=15 cm)离心15 min,取上清液按照ELISA试剂盒操作说明书检测各组IL- 6和TNFα表达水平,显色后在酶标仪450 nm波长检测吸光度,建立标准曲线并计算IL- 6和TNFα浓度数值。
Real-time PCR检测MiR- 146a、TRAF6和IRAK1基因表达水平采用TRIZOL法提取各组细胞总RNA,用分光光度计测定RNA浓度及其质量,然后按照试剂盒说明书进行反转录。PCR反应采用25 μl反应体系,反应条件参照说明书设置,检测MiR- 146a、TRAF6和IRAK1基因表达水平,其中MiR- 146a以U6作为内参对照,TRAF6和IRAK1以β-actin作为内参对照,TRAF6引物序列为:上游:AGTTCCAGGGCATCTGACAC;下游:GTCCACACAACCGTGATAGC。IRAK1引物序列为:上游:CATTCCTGGCACTTGACTCC;下游:C CTGGGCTACTCCTCACACT。β-actin引物序列为:上游:GTGCTATGTTGCTCTAGACTTCG;下游:ATGCCACAG ATTCCATACC。每个样本设置3个复孔;相对定量分析采用2-ΔΔCt法。
Western blot法检测TRAF6和IRAK1蛋白表达水平在LPS刺激作用后,常规提取各组蛋白质并测定浓度。在10%的SDS-PAGE中进行电泳,条件为80V,30 min及110V,75 min,蛋白上样量为40 μg;采用湿转法将蛋白转入PVDF膜中,转膜条件为恒流,300 mA,75 min;5%牛奶封闭1 h;加入一抗(浓度为1∶1000)4℃摇床孵育过夜;常规洗涤,加入相应二抗(1∶2000)孵育1 h后常规洗涤;后加入适量ECL发光液在成像系统中显影,并采用软件Image J进行图像分析。
统计学处理采用GraphPad Prism 6统计软件,实验数据以均数±标准差表示,两两比较采用Student’st检验,P<0.05为差异有统计学意义。
结果
MiR- 146a转染效率采用带有绿色荧光标记的MiR- 146a模拟物进行转染,转染6 h后在激光共聚焦显微镜下观察,可清晰看到单个细胞被转染后,发出绿色荧光的图像(图1A)。转染48 h后Real-time PCR检测结果显示,MiR- 146a模拟物转染后BV2细胞内的MiR- 146a表达水平与其他3组相比明显增高;当与N组比较时,M+L组的MiR- 146a表达量是其31.4倍,差异有统计学意义(t=5.846,P=0.0021)(图1B)。
MiR- 146a模拟物转染对LPS刺激后BV2细胞分泌细胞因子IL- 6和TNFα的影响L组的IL- 6和TNFα水平分别为(637.292±199.350)和(1417.485±256.599)pg/ml,明显高于N组的(50.107±23.990)(t=10.47,P<0.0001)和(107.302±20.96)pg/ml (t=17.55,P<0.0001);M+L组的IL- 6和TNFα水平分别为(323.994±63.153)和(804.840±82.095)pg/ml,明显低于L组(t=5.200,P=0.0003;t=9.812,P<0.0001);NC+L组的IL- 6和TNFα水平分别为(645.389±180.991) 和(1300.397±308.576)pg/ml,与L组差异无统计学意义(t=0.1140,P=0.9113;t=1.341,P=0.2071)。
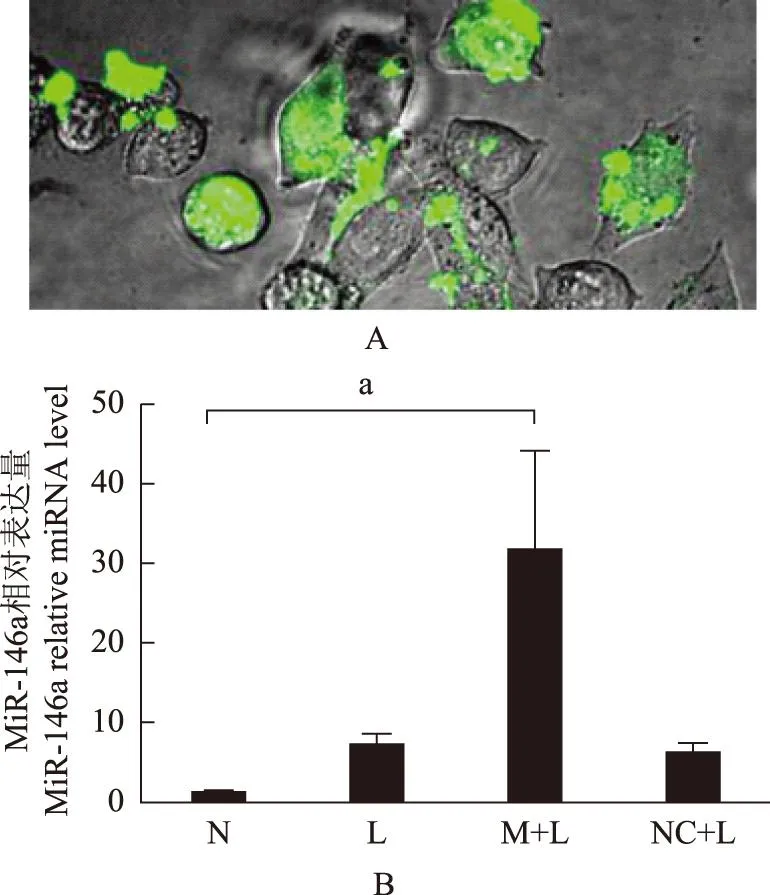
a:t=5.846,P=0.0021
A.采用带荧光标记的MiR- 146a模拟物转染6 h后,被成功转染的BV2细胞在激光共聚焦显微镜下发出绿色荧光(×100);B. MiR- 146a模拟物转染48 h后,采用PCR法检测各组细胞中MiR- 146a的相对表达量
A.the BV2 cells were shown in green when transfected 6 h by MiR- 146a mimics under laser scanning confocal microscope(×100);B.the MiR- 146a relative expression in BV2 cells after transfected 48 h by MiR- 146a mimics
图1MiR- 146a转染效率检测
Fig1The transfection of MiR- 146a mimics
MiR- 146a模拟物转染对LPS刺激后BV2细胞TLR4通路上TRAF6和IRAK1基因及蛋白表达水平的影响M+L组的TRAF6分子在基因水平(t=5.353,P=0.0007)和蛋白水平(t=6.980,P=0.0009)表达较L组明显降低,IRAK1分子在基因(t=1.068,P=0.3166)和蛋白水平(t=2.168,P=0.0824)表达与L组相比差异无统计学意义(图2、3)。
讨论
神经病理性疼痛是一种顽固性的慢性疼痛,传统观念认为其主要是由神经元功能改变所引起的,目前对其机制研究主要集中于神经元,而绝大多数治疗药物也是针对神经元中的分子机制,但并没有取得良好的控制疼痛效果。随着对神经系统研究的深入,胶质细胞在神经病理性疼痛中的作用得到关注,不少研究都揭示胶质细胞参与了神经病理性疼痛的产生及长期维持过程[10- 14]。当神经胶质细胞被激活后,释放出大量神经活性物质、细胞因子和炎性介质,这些物质的释放会引起神经炎症和免疫反应,最终导致神经功能紊乱。所以,尽管目前神经病理性疼痛的发病机制尚不十分清楚,但许多学者认为,神经胶质细胞介导的神经炎症反应与神经病理性疼痛的发生有着密切的关系[15]。
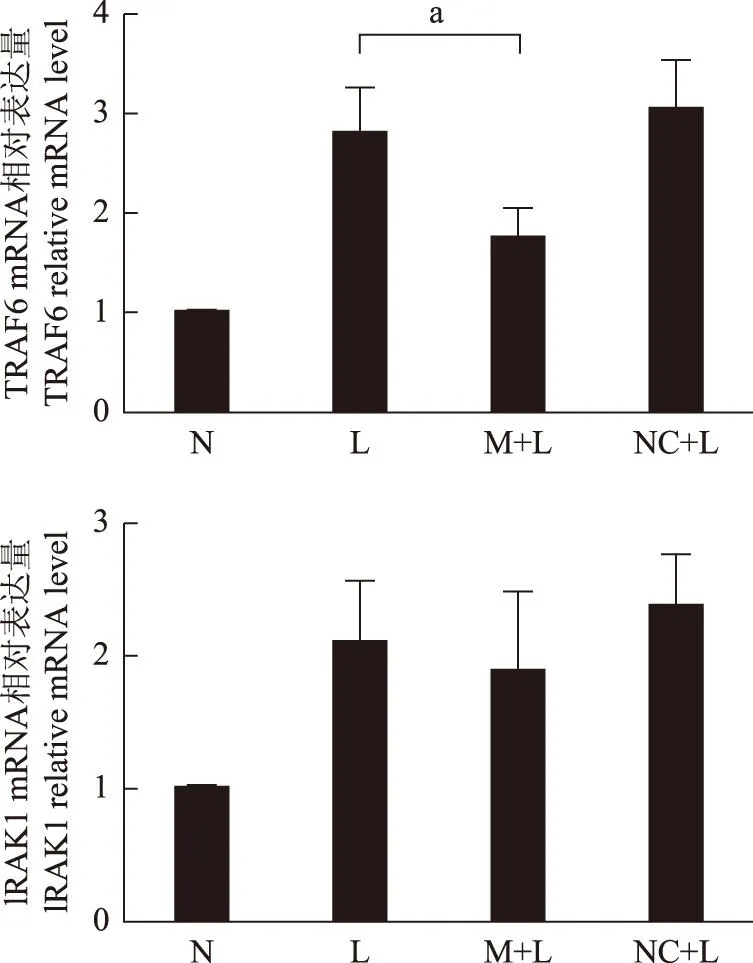
a:t=5.353,P=0.0007
TRAF6:肿瘤坏死因子受体相关因子6;IRAK1:白细胞介素- 1受体相关激酶1
TRAF6:tumor necrosis factor receptor-associated factor 6;IRAK1:interleukin- 1 receptor-associated kinase 1
图2各组TRAF6和IRAK1 mRNA相对表达结果的比较
Fig2Comparison of relative mRNA expression levels of TRAF6 and IRAK1 among all groups

a:t=6.980,P=0.0009
图3各组TRAF6和IRAK1蛋白分子相对表达水平的比较
Fig3Comparison of relative protein expression levels of TRAF6 and IRAK1 among all groups
小胶质细胞约占中枢神经胶质细胞的5%~10%[16]。近年有研究证实,各种神经病理情况导致的小胶质细胞激活,可以产生多种促炎症因子,如IL- 1β、IL- 6和TNFα等,进而参与到神经病理性疼痛的产生与发展[17- 19]。同时也有研究证实,在神经病理性疼痛中,这些细胞因子出现表达上调,而针对这些细胞因子所进行的干预治疗措施,可以改变神经病理性疼痛的产生与维持[20- 25]。
MiR- 146a在疼痛研究领域目前尚未得到广泛关注,针对性研究不多,主要是在关节炎性疼痛患者和动物模型中探讨MiR- 146a的作用机制,结果发现了MiR- 146a的异常表达与有效干预疼痛的效果[26- 28]。本课题组前期研究显示,神经病理性疼痛动物模型中出现了MiR- 146a的异常表达[9]。本研究首先采用合成的MiR- 146a模拟物对BV2细胞进行转染,结果显示转染后BV2细胞内的MiR- 146a表达水平显著提高。随后利用LPS去刺激BV2细胞,结果证实MiR- 146a可明显下调IL- 6和TNFα这两种炎症介质的表达水平。为进一步证实MiR- 146a这一负反馈机制的作用环节,本研究还检测了TLR4信号通路TRAF6和IRAK1分子的表达水平,结果显示在MiR- 146a转染后,TRAF6基因和蛋白表达水平均明显下调,提示MiR- 146a在BV2细胞中的这一负反馈机制可能是通过调控TLR4信号通路中的TRAF6分子达到目的。
综上,本研究结果显示,上调MiR- 146a表达水平可以降低BV2细胞激活后的IL- 6和TNFα表达水平,该作用可能是通过靶向分子TRAF6得以实现,MiR- 146a有望成为治疗神经病理性疼痛的一个新靶点。
参考文献
[1]Denli AM,Tops BB,Plasterk RH,et al. Processing of primary microRNAs by the microprocessor complex[J]. Nature,2004,432(7014):231- 235.
[2]Gregory RI,Yan KP,Amuthan G,et al. The microprocessor complex mediates the genesis of microRNAs[J]. Nature,2004,432(7014):235- 240.
[3]Han J,Lee Y,Yeom KH,et al. The Drosha-DGCR8 complex in primary microRNA processing[J]. Genes,2004,18(24):3016- 3027.
[4]Chen K,Rajewsky N. The evolution of gene regulation by transcription factors and microRNA processing[J]. Nature Rev Genet,2007,8(2):93- 103.
[5]Li L,Chen XP,Li YJ. MicroRNA- 146a and human disease[J]. Scand J Immunol,2010,71(4):227- 231.
[6]Taganov KD,Boldin MP,Chang KJ,et al. NF-kappaB-dependent induction of microRNA miR- 146,an inhibitor targeted to signaling proteins of innate immune responses[J]. Proc Natl Acad Sci,2006,103(33):12481- 12486.
[7]Bhaumik D,Scott GK,Schokrpur S,et al. Expression of microRNA- 146 suppresses NF-kappaB activity with reduction of metastatic potential in breast cancer cells[J]. Oncogene,2008,27(42):5643- 5647.
[8]Pauley KM,Satoh M,Chan AL,et al. Upregulated miR- 146a expression in peripheral blood mononuclear cells from rheumatoid arthritis patients[J]. Arthritis Res Ther,2008,10(4):R101.
[9]Li H,Shen L,Ma C,et al. Differential expression of miRNAs in the nervous system of a rat model of bilateral sciatic nerve chronic constriction injury[J]. Int J Mol Med,2013,32(1):219- 226.
[10]Ji XT,Qian NS,Zhang T,et al. Spinal astrocytic activation contributes to mechanical allodynia in a rat chemotherapy-induced neuropathic pain model[J]. PLoS One,2013,8(4):e60733.
[11]Mika J,Zychowska M,Popiolek-Barczyk K,et al. Importance of glial activation in neuropathic pain[J]. Eur J Pharmacol,2013,716(13):106- 119.
[12]Miller TR,Wetter JB,Jarvis MF,et al. Spinal microglial activation in rat models of neuropathic and osteoarthritic pain:an auto-radiographic study using [3H]PK11195[J]. Eur J Pain,2013,17(5):692- 703.
[13]Crown ED. The role of mitogen activated protein kinase signaling in microglia and neurons in the initiation and maintenance of chronic pain[J].Exp Neurol,2012,234(2):330- 339.
[14]McMahon SB,Cafferty WB,Marchand F. Immune and glial cell factors as pain mediators and modulators[J]. Exp Neurol,2005,192(2):444- 462.
[15]Ji RR,Berta T,Nedergaard M. Glia and pain:Is chronic pain a gliopathy[J]. Pain,2013,154 (Suppl 1):S10- S28.
[16]Moalem G,Tracey DJ. Immune and inflammatory mechanisms in neuropathic pain[J]. Brain Res Rev,2006,51(2):240- 264.
[17]Julius D,Basbaum AI. Molecular mechanisms of nociception[J]. Nature,2001,413(6852):203- 210.
[18]Ji RR,Suter MR. p38 MAPK,microglial signaling,and neuropathic pain[J]. Mol Pain,2007,3:33.
[19]Zhuang ZY,Gerner P,Woolf CJ,et al. ERK is sequentially activated in neurons,microglia,and astrocytes by spinal nerve ligation and contributes to mechanical allodynia in this neuropathic pain model[J]. Pain,2005,114(1- 2):149- 159.
[20]Alexander GM,van Rijn MA,van Hilten JJ,et al. Changes in cerebrospinal fluid levels of pro-inflammatory cytokines in CRPS[J]. Pain,2005,116(3):213- 219.
[21]Backonja MM,Coe CL,Muller DA,et al. Altered cytokine levels in the blood and cerebrospinal fluid of chronic pain patients[J]. J Neuroimmunol,2008,195(1- 2):157- 163.
[22]Sung CS,Wen ZH,Chang WK,et al. Intrathecal interleukin-1beta administration induces thermal hyperalgesia by activating inducible nitric oxide synthase expression in the rat spinal cord[J]. Brain Res,2004,1015(1- 2):145- 153.
[23]Kawasaki Y,Zhang L,Cheng JK,et al. Cytokine mechanisms of central sensitization:distinct and overlapping role of interleukin-1beta,interleukin- 6,and tumor necrosis factor-alpha in regulating synaptic and neuronal activity in the superficial spinal cord[J]. J Neurosci,2008,28(20):5189- 5194.
[24]Ishikawa T,Miyagi M,Kamoda H,et al. Differences between tumor necrosis factor-α receptors types 1 and 2 in the modulation of spinal glial cell activation and mechanical allodynia in a rat sciatic nerve injury model[J]. Spine,2013,38(1):11- 16.
[25]Svensson CI,Schäfers M,Jones TL,et al. Spinal blockade of TNF blocks spinal nerve ligation-induced increases in spinal P-p38[J]. Neurosci Lett,2005,379(3):209- 213.
[26]Yamasaki K,Nakasa T,Miyaki S,et al. Expression of MicroRNA- 146a in osteoarthritis cartilage[J]. Arthritis Rheum,2009,60(4):1035- 1041.
[27]Li X,Gibson G,Kim JS,et al. MicroRNA- 146a is linked to pain-related pathophysiology of osteoarthritis[J]. Gene,2011,480(1- 2):34- 41.
[28]Li X,Kroin JS,Kc R,et al. Altered spinal microRNA- 146a and the microRNA- 183 cluster contribute to osteoarthritic pain in knee joints[J]. J Bone Miner Res,2013,28(12):2512- 2522.
Effect of High MiR- 146a Expression on the Inflammatory Reaction in BV2 Cells
ZHAO Na1,SHEN Le1,JIANG Hao-wu2,MA Chao2,HUANG Yu-guang1
1Department of Anesthesiology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China2Department of Anatomy,Histology and Embryology,Institute of Basic Medical Sciences, CAMS and PUMC,Beijing 100005,China Corresponding author:HUANG Yu-guangTel:010- 69152058,E-mail:garybeijing@163.com
ABSTRACT:ObjectiveTo explore the effect of MiR- 146a regulator function on the inflammatory response in neuroglia cell (microglia).MethodsBV2 cells were transfected by MiR- 146a mimics,and then stimulated by lipopolysaccharide (LPS). MiR- 146a expression was measured by real-time polymerase chain reaction (real-time PCR). Interleukin (IL)- 6 and tumor necrosis factor α (TNFα) were measured by enzyme-linked immunosorbent assay (ELISA). Furthermore,IL- 1 receptor-associated kinase 1 (IRAK1) and TNF receptor-associated factor 6 (TRAF6) were detected by PCR and Western blotting. ResultsCompared to the normal control group,MiR- 146a expression was significantly elevated by transfection with MiR- 146a mimics (t=5.846,P=0.0021). The expression levels of IRAK1,TRAF6,TNFα,and IL- 6 significantly increased in the LPS-stimulated BV2 cells compared to the non-stimulated BV2. The enhancement of MiR- 146a resulted in significantly decreased IL- 6 (t=5.200,P=0.0003) and TNFα (t=9.812,P<0.0001) secretion. The mRNA (t=5.353,P=0.0007) and protein (t=6.980,P=0.0009) levels of TRAF6,but not IRAK1,also significantly decreased. ConclusionMiR- 146a may negatively suppress the inflammatory response of BV2 cells by regulating the expression of IRAF6 molecules in the TLR4 signaling pathway.
Key words:MiR- 146a;microglia;neuropathic pain;pro-inflammatory cytokines
(收稿日期:2015- 02- 12)
DOI:10.3881/j.issn.1000- 503X.2016.01.005
中图分类号:R4
文献标志码:A
文章编号:1000- 503X(2016)01- 0027- 06
通信作者:黄宇光电话:010- 69152058,电子邮件:garybeijing@163.com
基金项目:国家自然科学基金(31070930、81200869)Supported by the National Natural Sciences Foundation of China(31070930,81200869)

