雌激素介导的HSP27在动脉粥样硬化中作用的研究进展
张亚云,林 超,孙 鑫,钱 星,马 志,姚 远,徐 斌,卞慧敏,2
(1. 南京中医药大学药学院,2. 江苏省中药药效与安全性评价重点实验室,江苏 南京 210046)
雌激素介导的HSP27在动脉粥样硬化中作用的研究进展
张亚云1,林超1,孙鑫1,钱星1,马志1,姚远1,徐斌1,卞慧敏1,2
(1. 南京中医药大学药学院,2. 江苏省中药药效与安全性评价重点实验室,江苏 南京210046)
中国图书分类号:R-05;R329.24;R341;R543.5;R977.12
摘要:热休克蛋白27(HSP27)是人体内一种在应激状态下大量表达的蛋白,其对机体一系列生理、病理过程有着重要作用。近年研究表明,雌激素通过多种途径调控HSP27的表达,对动脉起到了完美的“三重保护”作用。血管内皮损伤早期,雌激素通过PI3K/Akt信号通路诱导HSP27磷酸化,磷酸化的HSP27则通过抗氧化、调控凋亡通路、抑制细胞色素C(cyt-C)等作用,抵抗血管内皮细胞(VECs)凋亡;泡沫细胞形成期,雌激素通过刺激雌激素受体β(ERβ)诱导巨噬细胞表达和释放HSP27,后者则与巨噬细胞表面的清道夫受体A(SR-A)结合,阻止低密度脂蛋白(LDL)的摄取和促炎因子的释放;血管平滑肌细胞(VSMCs)增殖、迁移期,雌激素诱导雌激素受体α(ERα)与蛋白磷酸酶2(PP2A)形成复合物,增强PP2A的活性,引起下游HSP27 脱磷酸,抑制VSMCs增殖、迁移。综上,雌激素抗动脉粥样硬化(atherosclerosis,AS)作用与HSP27密切相关,而雌激素替代疗法(MHT)防治绝经女性心血管疾病的副作用不容小觑,故借鉴雌激素的调控机制,研发药物调控HSP27对防治AS有着重要意义。
关键词:热休克蛋白27;磷酸化;雌激素;动脉粥样硬化;内皮细胞;巨噬细胞;平滑肌细胞
热休克蛋白(HSPs)是一组在正常生理状态下低表达,当机体面对代谢和病理性刺激时被选择性上调的蛋白,据分子质量可以分为7个家族:HSP100、HSP90、HSP70、HSP60、HSP40、小分子热休克蛋白家族(sHSPs)、HSP10[1]。其中HSP27属于sHSPs家族,广泛分布于各种细胞和组织,与细胞的生存有关。研究[2-3]发现,雌激素可以通过3种雌激素受体(雌激素受体α(ERα)、雌激素受体β(ERβ)以及G蛋白偶联的雌激素受体(GPER)调控HSP27的表达及磷酸化。而HSP27在动脉粥样硬化(AS)中作为一个保护性蛋白,能有效抵抗♀小鼠AS的发生和发展,包括抵抗AS早期阶段的内膜损伤,抑制泡沫细胞形成及血管平滑肌细胞(VSMCs)增殖和迁移[4-5]。因此,HSP27在AS中活性和表达水平的上调受到雌激素调控,并且参与雌激素在AS中内皮损伤、泡沫细胞形成以及VSMCs增殖和迁移3个阶段的保护效应。本文就雌激素如何通过基因型调节途径和非基因型调节途径介导HSP27在以上3个阶段发挥作用进行综述,阐明雌激素介导HSP27在AS中发挥作用的内在机制,为临床防治更年期女性AS提供新的思路和方向。
1雌激素介导的HSP27在内皮损伤阶段的作用
动脉内膜损伤是AS发生和发展的始动环节[6]。雌激素在AS早期可以通过抑制血管内皮细胞(VECs)的氧化应激性损伤、调节内皮功能障碍及促进VECs增殖等途径来抵抗VECs凋亡。雌激素抵抗凋亡有两条不同途径,一是诱导PI3K/Akt信号通路活化后,使Bad磷酸化;二是保护线粒体的完整性[7]。而诱导HSP27磷酸化的重要途径便是PI3K/Akt信号通路的激活[8]。其中,雌二醇通过激活PI3K/Akt信号通路诱导HSP27磷酸化[9]。HSP27磷酸化后发挥重要的抗凋亡作用:①抗氧化:呈递氧化的蛋白进入蛋白酶体进行降解,同时抑制线粒体内的NADPH氧化酶,降低活性氧(ROS)的水平[10]。②调控凋亡通路:caspase-3是不同信号通路引发凋亡的最终汇聚点,HSP27可以与caspase-3相互作用,抑制其活性[11]。③抑制细胞色素C(cyt-C):HSP27通过抑制Bax来保护线粒体的完整性,进而抑制线粒体中cyt-C的释放。④抵抗坏死:上调谷胱甘肽还原酶(GSH),降低细胞乳酸脱氢酶(LDH)的释放[12],产生抗坏死作用。因此,雌激素在AS早期抗氧化、抑制内皮细胞凋亡与激活HSP27磷酸化密切相关。此外,Vasconsuelo等[14]研究发现,HSP27可以与线粒体中ERβ相互作用,促进ERβ的稳定,使其介导的雌激素信号更有效,即雌激素与HSP27在延缓AS的发展中具有协同效应。
体外实验发现,雌激素可明显诱导HSP27表达以发挥抗凋亡效应。如周琴等[13]研究证实,浓度为10-7mol·L-1雌激素可明显诱导脐静脉内皮细胞(HUVECs)中HSP27的表达。Vasconsuelo等[14]发现使用HSP抑制剂槲皮素或者采取RNA干扰技术降低HSP27的表达后,雌二醇抵抗细胞凋亡的作用明显降低。
综上,雌激素可以在蛋白表达和磷酸化水平上对HSP27进行调节,进而在AS早期发挥抵抗内膜损伤,调节内皮功能障碍的作用,控制早期病变,延缓AS的进程。
2雌激素介导的HSP27对泡沫细胞形成的影响
HSP27为ERβ相关蛋白,在♀ apoE-/-小鼠血清中表达水平比♂高出10倍,且过表达HSP27的♀ apoE-/-小鼠主动脉斑块区面积比♂和正常表达HSP27的apoE-/-小鼠减少31%[5,15]。人类AS斑块研究[16-17]揭示HSP27在斑块区及坏死中心表达下降,提示斑块区HSP27水平的下降可能加速VSMCs的生长和斑块形成。因此,有学者提出HSP27血清水平有潜力作为AS的一个生物学指标。
在AS进程中,血管中积聚的低密度脂蛋白(LDL)被氧化修饰成氧化低密度脂蛋白(ox-LDL)或乙酰低密度脂蛋白(acLDL)后,由巨噬细胞表面的清道夫受体(SR)识别、内吞入胞内,最终引起胆固醇过度蓄积而形成泡沫细胞。研究表明[5,16]雌激素对血脂的调节需要HSP27的参与,它通过刺激ERβ诱导巨噬细胞表达和释放HSP27,后者则与巨噬细胞表面的SR-A结合,阻止脂质的摄取和促炎因子的释放,进而抑制泡沫细胞形成和炎症反应。HSP27作为已知的IKK调节剂可以激活NF-κB,促进p65入核,增加白介素-10(IL-10)的分泌,降低白介素-1β(IL-1β)的分泌和SR-A的表达,进而调节脂质、抑制炎症[18-20]。Voegeli等[21]采用RNA干扰技术沉默HSP27的表达后,发现血管紧张素Ⅱ(AngⅡ)诱导的促炎效应明显增加。
研究发现,雌二醇通过激活PI3K/Akt信号通路和p38MAPK信号通路诱导HSP27磷酸化,而磷酸化的HSP27会增强雌激素和ERβ的相互作用,使HSP27表达上调,最终HSP27过表达会抑制ERβ介导的雌激素信号[22]。研究证实男性主动脉血管损伤后,ERβ的mRNA和蛋白表达被上调[9]。另外,ERβ在主动脉内膜、中层和外膜中占主导,表达与钙化程度有关,是重度AS的标志物[23],故HSP27过表达可能降低由于ERβ高度表达导致AS的风险。
3雌激素介导的HSP27在平滑肌细胞增殖和迁移阶段的作用
动脉VECs损伤、凋亡后,暴露的VSMCs在多种因子刺激下,迁移入内膜进行大量增殖,导致血管内膜增厚。研究表明,雌激素可以通过增加HSP27的表达和降低其磷酸化来抑制VSMCs增殖和迁移。HSP27磷酸化状态的改变会影响其构象和功能。研究发现未磷酸化的HSP27作为肌动蛋白的一个加帽蛋白存在,可抑制肌动蛋白重聚,而HSP27磷酸化后会与肌动蛋白相互作用以阻止其降解,增强纤维状肌动蛋白(F-actin)重聚并促进黏附稳定,进而促进增殖和迁移[10,24],生理状态下HSP27在磷酸化和去磷酸化之间保持动态平衡。Chen等[25]发现,血管紧张素Ⅱ主要通过激活p38MAPK信号通路诱导HSP27磷酸化,致使VSMCs增殖和迁移。Huang等[26]实验表明沉默HSP27的表达后,血小板源生长因子-BB(PDGF-BB)刺激的肌动蛋白重塑被阻断,VSMCs迁移率明显下降。以上表明HSP27磷酸化是生长因子和其他刺激诱导VSMCs增殖和迁移所必须的调控因素。之前研究认为[27]雌激素抑制VSMCs增殖和迁移主要通过经典的基因型调节途径。近期Ueda等[28]研究发现雌激素可以通过快速的非基因型调节途径抑制VSMCs增殖,并且与调节HSP27的磷酸化有关。他们实验证实雌激素抑制VSMCs增殖和迁移需要ERα与一个支架蛋白striatin结合,激活快速非基因型信号通路,诱导ERα和蛋白磷酸酶2(PP2A)形成复合物,增强 PP2A的活性,引起Akt、ERK以及下游的HSP27 脱磷酸,最终达到抑制VSMCs增殖、迁移的作用。
因此,HSP27可能是调节肌动蛋白重塑、细胞增殖和迁移的唯一效应器,VSMCs增殖和迁移作为AS过程中的重要环节,雌激素在此发挥的保护效应可能部分通过非基因型调节途径来降低HSP27磷酸化水平,产生抑制VSMCs增殖、迁移的作用。抑制HSP27磷酸化或者诱导HSP27脱磷酸可以阻断肌动蛋白重塑,从而作为抑制VSMCs增殖、迁移的最终调控点。
4展望
大量研究已经证实雌激素在AS不同阶段具有保护作用,HSP27作为一个分子伴侣早已被发现,而近几年研究发现它在AS中作为一个保护性蛋白,表达和活性受到雌激素的调控,雌激素可以通过激活PI3K/Akt通路诱导HSP27磷酸化,也能通过非基因型途径增强PP2A活性,使其脱磷酸,从而在AS不同阶段产生保护作用。雌激素刺激HSP27的表达增加,则是通过ERβ介导,同时HSP27可以与ERβ结合,作为一个辅抑因子,抑制ERβ介导的信号转导。在AS中雌激素调控的HSP27的作用总结如Fig 1。因此,HSP27在AS中发挥的保护效应受雌激素调控,这种保护效应也可能是雌激素抵抗AS效应的一部分,他们之间形成了相互调控的信号通路,共同抑制AS的进程。
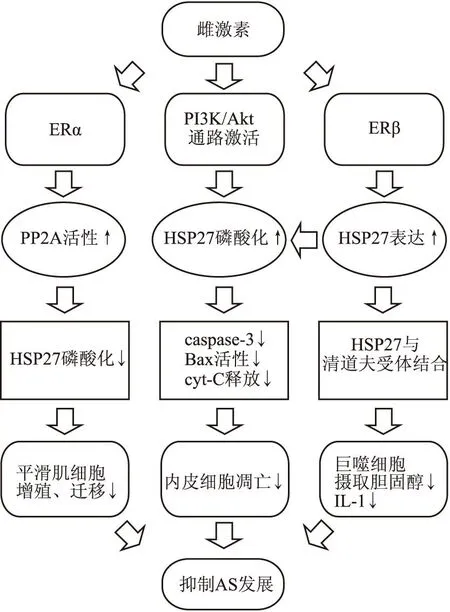
Fig 1 Role of estrogen-mediated HSP27 in atherosclerosis
绝经女性心血管疾病的发生率、死亡率增加,使得雌激素替代疗法(MHT)被发现和应用于临床来防治更年期心血管疾病。然而到20世纪90年代末,MHT防治绝经女性心血管疾病的作用受到质疑,临床调查研究[29]发现 MHT在临近绝经期或绝经后立即开始使用可以缓解更年期症状,延迟心血管疾病的发生,然而对已患AS的女性不能改善其血管病变,甚至会加重AS斑块的不稳定。MHT用于心血管疾病一级和二级预防的随机临床调查数据也显示,此疗法使病人患心血管系统肿瘤和产生不良反应的风险增加[3],表明MHT用于绝经后女性心血管疾病预防和治疗产生的弊大于利。因此,寻找新的治疗策略替换MHT显得尤为重要。HSP27在AS中的保护效应为临床防治心血管疾病提供了新思路,在未来制备外源性重组HSP27有望作为一个新策略替换MHT应用于临床预防和治疗更年期女性心血管疾病。
参考文献:
[1]Jolly C, Morimoto R I. Role of the heat shock response and molecular chaperones in oncogenesis and cell death [J].JNatlCancerInst, 2000, 92(19): 1564-72.
[2]Meyer M R, Haas E, Prossnitz E R, et al. Non-genomic regulation of vascular cell function and growth by estrogen [J].MolCellEndocrinol, 2009, 308(1-2):9-16.
[3]Kostenko S, Moens U. Heat shock protein 27 phosphorylation: kinases, phosphatases, functions and pathology [J].CellMolLifeSci, 2009, 66(20): 3289-307.
[4]Miller H, Poon S, Hibbert B, et al. Modulation of estrogen signaling by the novel interaction of heat shock protein 27, a biomarker for atherosclerosis, and estrogen receptor beta: mechanistic insight into the vascular effects of estrogens [J].ArteriosclerThrombVascBiol, 2005, 25(3): e10-4.
[5]Rayner K, Chen Y X, McNulty M, et al. Extracellular release of the atheroprotective heat shock protein 27 is mediated by estrogen and competitively inhibits acLDL binding to scavenger receptor-A[J].CircRes, 2008, 103(2): 133-41.
[6]殷秋忆, 郭静, 孟庆海, 等. 六味地黄方含药血清对 H2O2致 HUVECs 损伤的保护作用[J]. 中国药理学通报, 2013, 29(12): 1753-7.
[6]Yin Q Y, Guo J, Meng Q H, et al. Effects of Liuweidihuang Formula mediated serum on H2O2-injured human umbilical vascular endothelial cells [J].ChinPharmacolBull, 2013,29(12):1753-7.
[7]Vasconsuelo A, Milanesi L, Boland R. 17β-Estradiol abrogates apoptosis in murine skeletal muscle cells through estrogen receptors: role of the phosphatidylinositol 3-kinase/Akt pathway [J].JEndocrinol, 2008, 196(2):385-97.
[8]Havasi A, Li Z, Wang Z, et al. Hsp27 inhibits Bax activation and apoptosis via a phosphatidylinositol 3-kinase-dependent mechanism[J].JBiolChem, 2008, 283(18): 12305-13.
[9]Hogg M E, Vavra A K, Banerjee M N, et al. The role of estrogen receptor α and β in regulating vascular smooth muscle cell proliferation is based on sex[J].JSurgRes, 2012, 173(1): e1-10.
[10] Arrigo A P. The cellular “networking” of mammalian Hsp27 and its functions in the control of protein folding, redox state and apoptosis[M]//Molecular Aspects of the Stress Response: Chaperones, Membranes and Networks. Springer New York, 2007: 14-26.
[11] Acunzo J, Andrieu C, Baylot V, et al. Hsp27 as a therapeutic target in cancers[J].CurrDrugTargets, 2014, 15(4): 423-31.
[12] Salinthone S, Ba M, Hanson L, et al. Overexpression of human Hsp27 inhibits serum-induced proliferation in airway smooth muscle myocytes and confers resistance to hydrogen peroxide cytotoxicity[J].AmJPhysiolLungCellMolPhysiol, 2007, 293(5): L1194-207.
[13] 周琴, 张青海, 邓华菲, 等. 雌激素对人脐静脉内皮细胞 HSP27 表达的影响 [J]. 临床与病理杂志, 2014, 34(5): 520-4.
[13] Zhou Q, Zhang Q H, Deng H F, et al. Effects of estrogen on the expression of HSP27 in human umbilical vein endothelial cells [J].ChinPatholRes,2014,34(5):520-4.
[14] Vasconsuelo A, Milanesi L, Boland R. Participation of HSP27 in the antiapoptotic action of 17β-estradiol in skeletal muscle cells [J].CellStressChaperones, 2010, 15(2): 183-92.
[15] Rayner K, Sun J, Chen Y X, et al. Heat shock protein 27 protects against atherogenesis via an estrogen-dependent mechanism role of selective estrogen receptor beta modulation[J].ArteriosclerThrombVascBiol, 2009, 29(11): 1751-6.
[16] Shields A M, Panayi G S, Corrigall V M. Resolution-associated molecular patterns (RAMP): RAMParts defending immunological homeostasis[J]?ClinExpImmunol, 2011, 165(3): 292-300.
[17] Cuerrier C M, Chen Y X, Tremblay D, et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions [J].PloSOne, 2013, 8(2): e55867.
[18] Wann A K, Chapple J P, Knight M M. The primary cilium influences interleukin-1β-induced NFκB signalling by regulating IKK activity [J].CellSignal, 2014, 26(8): 1735-42.
[19] Raizman J E, Chen Y X, Seibert T, et al. Heat shock protein-27 attenuates foam cell formation and atherogenesis by down-regulating scavenger receptor-A expression via NF-κB signaling[J].BiochimBiophysActa, 2013, 1831(12): 1721-8.
[20] Chen H, Hewison M, Adams J S. Control of estradiol-directed gene transactivation by an intracellular estrogen-binding protein and an estrogen response element-binding protein [J].MolEndocrinol, 2008, 22(3): 559-69.
[21] Voegeli T S, Currie R W. siRNA knocks down Hsp27 and increases angiotensin II-induced phosphorylated NF-κB p65 levels in aortic smooth muscle cells [J].InflammRes, 2009, 58(6): 336-43.
[22] Al-Madhoun A S, Chen Y X, Haidari L, et al. The interaction and cellular localization of HSP27 and ERβ are modulated by 17β-estradiol and HSP27 phosphorylation[J].MolCellEndocrinol, 2007, 270(1): 33-42.
[23] Krom Y D, Pires N M, Jukema J W, et al. Inhibition of neointima formation by local delivery of estrogen receptor alpha and beta specific agonists[J].CardiovascRes, 2007, 73(1): 217-26.
[24] García-Arguinzonis M, Padró T, Lugano R, et al. Low-density lipoproteins induce heat shock protein 27 dephosphorylation, oligomerization, and subcellular relocalization in human vascular smooth muscle cells [J].ArteriosclerThrombVascBiol, 2010, 30(6): 1212-9.
[25] Chen H F, Xie L D, Xu C S. The signal transduction pathways of heat shock protein 27 phosphorylation in vascular smooth muscle cells[J].MolCellBiochem, 2010, 333(1-2): 49-56.
[26] Huang J, Luo L, Zheng S, et al. Silencing heat shock protein 27 (HSP27) inhibits the proliferation and migration of vascular smooth muscle cells in vitro [J].MolCellBiochem, 2014, 390(1-2): 115-21.
[27] Mendelsohn M E, Karas R H. Rapid progress for non-nuclear estrogen receptor signaling [J].JClinInvest, 2010, 120(7): 2277-9.
[28] Ueda K, Lu Q, Baur W, et al. Rapid estrogen receptor signaling mediates estrogen-induced inhibition of vascular smooth muscle cell proliferation [J].ArteriosclerThrombVascBiol, 2013, 33(8): 1837-43.
[29] Shlipak M G, Angeja B G, Go A S, et al. Hormone therapy and in-hospital survival after myocardial infarction in postmenopausal women [J].Circulation, 2001, 104(19): 2300-4.
Research progress of estrogen-mediated HSP27 in atherosclerosis
ZHANG Ya-yun1,LIN Chao1,SUN Xin1,QIAN Xing1, MA Zhi1, YAO Yuan1, XU Bin1,BIAN Hui-min1,2
(1.CollegeofPharmacy,NanjingUniversityofChineseMedicine,2.JiangsuKeyLaboratoryforPharmacologyandSafetyEvaluationofChineseMateriaMedicine,Nanjing210046,China)
Abstract:Heat shock protein 27 (HSP27) is an endogenous protein that plays an important role in a great variety of physiological and pathological processes. It can express a large number under body stress conditions. Recent studies have shown estrogen upregulates the expression of HSP27 through a number of ways, playing a perfect “triple protection” role. In the early stage of atherosclerosis, estrogen induces the phosphorylation of HSP27 via PI3K/Akt signaling pathway. Phosphorylation of HSP27 can resist the injury of vascular endothelial cells(VECs) through an antioxidant and anti-apoptotic pathway as well as the inhibition of cytochrome C. In the stage of forming foam cells, estrogen induces the expression and release of HSP27 from macrophages by stimulating the estrogen receptor β (ERβ), then HSP27 inhibits the LDL uptake and the release of proinflammatory cytokine by binding scavenger receptor A (SR-A). During the proliferation and migration of vascular smooth muscle cells (VSMCs), estrogen induces estrogen receptor α (ERα) and protein phosphatase 2 (PP2A) to form a complex that enhances the activity of PP2A, then it can lead to the dephosphorylation of HSP27 and finally inhibit cells proliferation and migration. In summary, the anti-atherosclerotic effect of estrogen is closely related to the role of HSP27. Given the side effects of estrogen replacement therapy(MHT), regulating HSP27 may provide a novel therapy for the prevention and treatment of cardiovascular diseases in menopausal women clinically.
Key words:HSP27; phosphorylation; estrogen; atherosclerosis; endothelial cells; macrophages; smooth muscle cells
文献标志码:A
文章编号:1001-1978(2016)02-0159-04
doi:10.3969/j.issn.1001-1978.2016.02.003
作者简介:张亚云(1991-),女,硕士生,研究方向:心血管药理学,E-mail:1071509374@qq.com;卞慧敏(1958-),女,博士,研究员,博士生导师,研究方向:心血管药理学,通讯作者,E-mail:hmbian@sina.com
基金项目:国家自然科学基金资助项目(No 81173190);江苏省中医药管理局项目(No LZ11191);江苏省高校优势学科建设工程资助项目(No ysxk-2010);南京中医药大学中药学一级学科开放课题资助(No 2011zyx4-004); 江苏高校品牌专业建设工程资助项目(No PPZY2015A070)
收稿日期:2015-11-21,修回日期:2015-12-22
网络出版时间:http://www.cnki.net/kcms/detail/34.1086.R.20160125.1557.006.html网络出版地址:2016-1-25 15:57

