沉默MALAT1基因对蜂毒素诱导HepG2细胞增殖和凋亡的影响
赵 斌, 吴毓婷, 黄 成, 吕雄文, 李 俊
(安徽医科大学药学院,安徽 合肥 230032)
沉默MALAT1基因对蜂毒素诱导HepG2细胞增殖和凋亡的影响
赵斌, 吴毓婷, 黄成, 吕雄文, 李俊
(安徽医科大学药学院,安徽 合肥230032)
中国图书分类号:R329.24;R329.25;R342.2;R996.3
摘要:目的探讨沉默HepG2细胞株中MALAT1基因对蜂毒素诱导的细胞增殖抑制和凋亡的影响。方法采用MTT法检测蜂毒素对HepG2细胞的增殖抑制作用;流式细胞仪检测细胞凋亡率;qPCR法检测HepG2细胞中MALAT1基因的表达;采用特异性siRNA对HepG2细胞的MALAT1基因进行沉默;比较单独用蜂毒素处理和给予蜂毒素同时沉默MALAT1的细胞增殖抑制率和凋亡率变化。结果蜂毒素明显抑制HepG2细胞的增殖并促进细胞凋亡,呈浓度依赖性;和正常肝细胞株L0-2相比,MALAT1 mRNA在HepG2细胞中存在高表达(P<0.05);蜂毒素可下调细胞中MALAT1的表达,并随着浓度的增加抑制率升高;给予蜂毒素同时沉默MALAT1的研究组中,细胞增殖抑制和凋亡率都明显高于单独给予蜂毒素组(P<0.05)。结论蜂毒素可下调HepG2细胞株中MALAT1的表达,且沉默MALAT1可促进蜂毒素诱导的HepG2细胞增殖抑制和凋亡。
关键词:蜂毒素;长链非编码RNA;MALAT1;RNA干扰;细胞凋亡;HepG2细胞
长链非编码RNA(long noncoding RNA, lncRNA) 是指长度超过200nt 的RNA分子[1],主要形式是以RNA的形式、不编码蛋白,其主要功能包括在表观遗传水平、转录水平以及转录后水平等多种层面上调控基因的表达,与多种人类疾病的发生有密切的关系。某些特定的lncRNA在多种肿瘤组织和细胞株中表达异常,可能为恶性肿瘤分子诊断和治疗提供依据和靶点[2]。MALAT1基因(metastasis associated in lung denocarcinoma transcript 1)是在研究人非小细胞肺癌的转移中发现的新的长链非编码RNA基因[3],定位人类11q13染色体上。近年发现MALAT1与肝癌关系密切,抑制MALAT1在肝癌细胞HepG2的表达可以有效降低细胞活力、运动、侵袭等[4],可能成为肿瘤治疗的新靶点[5]。蜂毒素(Melittin)是蜂毒的主要活性部分,可以阻滞肿瘤细胞的增殖和诱导凋亡,有望用于临床的肿瘤治疗,然而其抗肿瘤的分子机制尚未完全明确。本研究通过构建针对MALAT1 RNA的小干扰RNA(small interfeting RNA, siRNA),特异沉默MALTA1的表达,观察对蜂毒素诱导的HepG2增殖抑制和细胞凋亡作用的影响,为临床治疗提供新的思路与理论依据。
1材料与方法
1.1材料
1.1.1细胞株人正常肝细胞株L0-2和人肝癌细胞株HepG2购自中国科学院上海细胞研究所。
1.1.2试剂与仪器蜂毒素Melittin购于上海吉尔公司,MTT试剂盒购于Sigma公司,胎牛血清购于杭州四季青公司,培养基购于Hyclone公司,Annexin V-FITC凋亡检测试剂盒购于BestBio公司,逆转录试剂盒购于TaKaRa公司,Real-time Quantitative PCR (RT-qPCR) 试剂盒QuantiTect SYBR® Green PCR Kits购于Qiagen公司,TRIzol Reagent、脂质体LipofectamineTM2000、Opti-MEM购于Invitrogen 公司。引物合成均由上海生工生物工程公司提供。二氧化碳培养箱(Thermoforma),酶标仪(BiotecEL),流式细胞仪(Beckman)。
1.2方法
1.2.1细胞培养细胞培养采用DMEM培养基(含10%胎牛血清、100 U·L-1青霉素和100 mg·L-1链霉素),细胞培养条件为37℃、5% CO2、饱和湿度,细胞为贴壁生长,胰蛋白酶消化后传代,实验时调整细胞状态为对数生长期。
1.2.2MTT法检测蜂毒素对细胞的增殖抑制① 实验分组:阴性对照组、蜂毒素(1、4和8 mg·L-1)3个浓度组。用完全培养基稀释对数生长期细胞至4×108·L-1,将细胞悬液接种于96孔板中,培养12 h后细胞贴壁后换液,加入含不同浓度蜂毒素(1、4和8 mg·L-1)的培养基100 μL,阴性对照组加入等量培养基。设6个复孔。蜂毒素作用48 h。② 实验分组:空白对照组、蜂毒素组(4 mg·L-1)、蜂毒素(4 mg·L-1)+阴性对照组、蜂毒素(4 mg·L-1)+MALAT1 siRNA组。用完全培养基稀释对数生长期细胞至4×108·L-1,将细胞悬液接种于96孔板中,培养24 h细胞贴壁后加入转染复合物100 μL进行转染,转染6 h后,各组加入含蜂毒素(4 mg·L-1)的完全培养基100 μL,空白组加入等量培养基。蜂毒素作用48 h。以上两个分组中,每孔加入MTT 溶液(5 g·L-1)20 μL,继续孵育4 h 后吸去上清,加入DMSO 150 μL,振荡5~10 min,待蓝色晶体完全溶解后,酶标仪上492 nm测定吸光度。按以下公式计算生长抑制率:抑制率/%=(对照组A值-实验组A值)/对照组A值×100%。
1.2.3流式细胞仪检测凋亡率细胞凋亡定量分析采用Annexin-V-FITC凋亡检测试剂盒。① 实验分组:空白对照组、蜂毒素(1、4和8 mg·L-1)3个剂量组。用完全培养基稀释细胞至4×108·L-1,将细胞悬液接种至培养瓶中,用含10%胎牛血清的DMEM培养基培养12 h,细胞贴壁后换液,分别给予蜂毒素(1、4和8 mg·L-1),作用48 h后,用不含EDTA的胰酶消化细胞,低速离心收集细胞。② 实验分组:空白对照组、蜂毒素组(4 mg·L-1)、蜂毒素(4 mg·L-1)+阴性对照组、蜂毒素(4 mg·L-1)+MALAT1 siRNA组。HepG2细胞常规培养至对数生长期,将细胞以4×105接种于6孔板中,24 h左右待细胞贴壁后转染,转染后6 h更换为含血清的完全培养基,并各组加入蜂毒素(4 mg·L-1)2 mL,空白组不进行处理。蜂毒素作用48 h后,用不含EDTA的胰酶消化细胞,低速离心收集细胞沉淀。在以上两个分组中,在收集的细胞沉淀中加入400 μL Binding Buffer 混悬细胞,加入5 μL Annexin V-FITC轻轻混匀后,于2~8 ℃ 避光条件下孵育15 min,加入10 μL PI后轻轻混匀,于2~8 ℃避光条件下孵育5 min。流式细胞仪常规检测。
1.2.4siRNA的合成根据siRNA设计原则,设计针对MALAT1的siRNA序列,在GenBANK表达序列标签(EST)数据库中用BLAST检索,确认所设计siRNA序列的唯一性,靶向目的MALAT1的序列设计两条序列。siRNA1正义链:5′-GAUCCAUAAUCGGUUUCAAGGTT-3′,反义链:5′-CCUUGAAACCGAUUAUGGAUCTT-3′;siRNA2正义链:5′-CACAGGGAAAGCGAGUGGUUGGUAATT-3′,反义链:5′-UUACCAACCACUCGCUUUCCCUGUGTT-3′。同法构建阴性对照组,两条DNA链的正义链:5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACACGUUCGGAGAATT-3′,与任何编码序列无同源性,上海吉玛制药有限公司合成有效siRNA干粉制剂。
1.2.5转染实验分为空白组、阴性对照组、MALAT1 siRNA1组、MALAT1 siRNA2组。用完全培养基稀释对数生长期细胞至4×108·L-1,接种于6 孔板中,常规培养24 h后,调整细胞密度为50% ~80%。在200 μL Opti-MEM中加入5 μL LipofectamineTM2000,室温孵育5 min后,在200 μL Opti-MEM中加入5 μL siRNA;将上述两种稀释液混匀成转染复合物,室温孵育20 min。分别配制阴性对照siRNA、siRNA1、siRNA2组转染复合物。将6孔板中的细胞培养液弃去,PBS清洗1遍,将2 mL Opti-MEM加入空白组;1.6 mL Opti-MEM加入阴性对照组、MALAT1 siRNA1组、MALAT1 siRNA2,再加入对应的上述转染复合物;轻轻摇匀,置于培养箱常规培养,6 h后更换为含胎牛血清的完全培养基,蜂毒素可在换液后加入。
1.2.6Real-time Quantitative PCR方法检测MALAT1表达水平细胞总RNA提取采用TRIzol试剂盒操作指南。提取得到的总RNA按TaKaRa试剂盒操作指南,取2 μL总RNA,2 μL Primer Mix,6 μL Water反转录成cDNA。取3 μL cDNA,2 μL引物,5 μL SYBGREEN体系进行PCR反应。PCR条件按Qiagen试剂盒操作:MALAT1:95 ℃ 5 min;95 ℃ 10 s、60 ℃ 30 s,共进行45个循环;60 ℃ 30 s;升至95℃采集熔解曲线数据。重复实验3次。引物序列:内参为β-actin,上游:5′-CCCACACTGTGCCCA TCTACG-3′,下游:5′-GCCATCTCTTGCTCGAAGTC C-3′;MALAT1上游:5′-AAAGCAAGGTCTCCCCA CAAG-3′,下游:5′-GGTCTGTGCTAGATCAAAAGG CA-3′。采用PikoReal 96 Real-Time PCR软件对实验结果进行分析。
2结果
2.1蜂毒素对HepG2细胞增殖的抑制作用MTT实验结果显示,与空白对照组相比,蜂毒素各浓度组(1、4、8 mg·L-1)处理48h的细胞增殖抑制率均明显升高,如Fig 1所示。随着药物浓度加大,抑制率逐渐增高,呈现出浓度依赖性。

Fig 1 Inhibitory effects of Melittin on proliferation of HepG2 cells
2.2流式细胞术检测蜂毒素诱导HepG2细胞凋亡药物处理48 h后,蜂毒素各浓度组均能诱导HepG2细胞凋亡,并呈现一定的浓度依赖性。1、4、8 mg·L-1蜂毒素作用细胞48 h后,细胞凋亡率明显高于正常对照组(P<0.01),如Fig 2所示。

Fig 2 Effects of Melittin on cell apotosis of HepG2 cells
A:Control group;B-D:HepG2 cells were treated with various concentrations of Melittin(1,4,8 mg·L-1);E:Histogram.**P<0.01vscontrol
2.3MALAT1在HepG2细胞株上的表达通过qPCR检测可以看出,与人正常肝细胞株L0-2相比,MALAT1 mRNA在HepG2细胞株上相对高表达,二者之间差异比较具有统计学意义(P<0.01),如Fig 3所示。

Fig 3 mRNA expression levels of
2.4蜂毒素抑制HepG2细胞中MALAT1的表达用不同剂量的蜂毒素对HepG2细胞进行处理后,检测其MALAT1的表达情况。1、4、8 mg·L-1的蜂毒素处理后的MALAT1 mRNA表达量明显下降,并呈浓度依赖性,如Fig 4所示。提示蜂毒素可明显抑制HepG2细胞中MALAT1 mRNA的表达。

Fig 4 Effects of Melittin on MALAT1 mRNA
2.5MALAT1 siRNAs沉默HepG2细胞中MALAT1 表达用两种MALAT1特异性siRNAs(siRNA1、siRNA2)沉默HepG2细胞中的MALAT1,相对于阴性对照组,siRNAs均可使MALAT1 mRNA的表达明显降低,如Fig 5所示,其中MALAT1-siRNA2效果更为明显,用于后续实验研究。

Fig 5 Effects of siRNAs on MALAT1 mRNA level in HepG2 cells
**P<0.05,**P<0.01vsnegative control
2.6在HepG2细胞株上沉默MALAT1可促进蜂毒素诱导的HepG2细胞凋亡选取中等剂量4 mg·L-1的蜂毒素处理HepG2细胞同时沉默MALAT1,MTT结果显示,与单独给予蜂毒素组比较,siRNA2沉默MALAT1能促进蜂毒素诱导的HepG2细胞增殖抑制率明显升高(P<0.05),如Fig 6所示。流式细胞检测结果显示,给予蜂毒素同时沉默MALAT1能促进细胞凋亡率升高更明显(P<0.01),如Fig 7所示。结果提示沉默MALAT1能有效促进蜂毒素对HepG2细胞增殖抑制和诱导细胞凋亡。
3讨论
长链非编码RNA可在肿瘤细胞中特异性地表达,与癌症的发生发展密切相关[6-7]。MALAT1位于细胞核核小体的核心区,该区域参与基因的聚集、修饰、储存和加工,在基因表达调控上具有重要作用[8]。 MALAT1可在细胞水平调节丝氨酸精氨酸蛋白(SR)磷酸化模式,从而对剪接进行调节[9]。研究表明MALAT1在肝癌细胞中高表达,抑制MALAT1可降低肝癌细胞HepG2的侵袭力并增加细胞凋亡的敏感性[4],作用机制可能是通过干扰转移相关基因与凋亡途径而实现的。已有研究指出抑制MALAT1可上调caspase-3、caspase-8和Bax而下调Bcl-2 和Bcl-xL[10]。
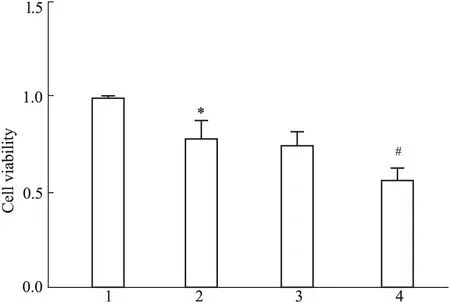
Fig 6 Inhibitory effects of Melittin and MALAT1-siRNA2
1:Control;2: Melittin(4 mg·L-1);3: Melittin(4 mg·L-1)+negative siRNA;4: Melittin(4 mg·L-1)+MALAT1-siRNA2.*P<0.05vscontrol;#P<0.05vsMelittin(4 mg·L-1) + negative siRNA group.

Fig 7 Effects of Melittin and MALAT1-siRNA2
A:Control;B: Melittin(4 mg·L-1);C: Melittin(4 mg·L-1)+negative siRNA;D: Melittin(4 mg·L-1)+MALAT1-siRNA2;E:Histogram.**P<0.01vscontrol;##P<0.01vsMelittin(4 mg·L-1)+negative siRNA group.
我国是全球肝癌新增病例和死亡人数最多的国家,深入研究治疗肝癌的药物具有非常重要的意义。蜂毒素是从蜂毒中提取出来的肽类物质,具有杀菌、抗炎和镇痛作用,能诱导多种肿瘤细胞凋亡。蜂毒素抗肿瘤分子机制仍然不清楚,需要深入探讨研究。目前发现其具有多方面机制[11-14],如通过影响caspases途径,最终激活caspase-3导致细胞凋亡;通过调控Bcl-2家族蛋白,使Bcl-2/Bax降低,使细胞凋亡;通过促进Ca2+内流活化CaMKII-TAK1-JNK/p38途径,并抑制IKK-NF-κB途径诱导肝癌细胞凋亡,并能通过这种方式增强细胞对凋亡诱导剂TRAIL的敏感性。蜂毒素是否能协同或通过长链非编码MALAT1途径促进细胞凋亡值得研究,为疾病的预测、诊断和治疗提供新的分子依据。
本实验研究了蜂毒素对HepG2细胞的增殖抑制和促凋亡作用,MTT显示蜂毒素各浓度组(1、4和8 mg·L-1)处理48h的细胞增殖抑制率均明显升高,呈现出浓度依赖性关系。流式细胞检测能诱导HepG2细胞凋亡,并呈现一定的浓度依赖性。通过qPCR检测发现MALAT1在HepG2细胞株上存在高表达,而用蜂毒素处理48 h后可明显抑制MALAT1的表达,并呈浓度依赖性,可能的机制是蜂毒素可影响肿瘤细胞周期,将其阻滞于G2/M 期,从而减少了MALAT1基因的表达,这一假设有待于进一步的实验验证。鉴于目前RNA沉默技术在肿瘤治疗中越来越受到重视,我们也采取两种MALAT1特异性siRNAs(siRNA1、siRNA2)来沉默HepG2细胞中的MALAT1,结果表明二者均可使MALAT1的表达量明显降低。通过对比,我们用下调效果更为明显的siRNA2与蜂毒素(4 mg·L-1)共同作用于HepG2细胞。 MTT与流式细胞仪结果显示,与单独给予蜂毒素组比较,siRNA2沉默MALAT1同时给予蜂毒素的细胞的抑制率和凋亡率升高更明显,提示沉默MALAT1可以促进蜂毒素诱导的HepG2细胞增殖抑制与细胞凋亡,其中机制可能和影响凋亡信号通路(如Bcl-2家族、caspases家族)有关,这是我们下一步工作的方向。
综上所述,本研究证实了蜂毒素对人肝癌细胞株HepG2促凋亡作用,同时发现蜂毒素还可降低HepG2细胞中MALAT1的表达,体外实验表明对MALAT1进行沉默可促进蜂毒素诱导细胞凋亡的敏感性,提示二者联用有相对高的抗癌作用,为临床用药提供新的思路,其作用机制还有待于进一步阐明。
参考文献
[1]Spizzo R, Almeida M I, Colombatti A, et al. Long non-coding RNAs and cancer: a new frontier of translational research[J].Oncogene, 2012, 31(43): 4577-87.
[2]Gutschner T, Hammerle M, Diederichs S. MALAT1-a paradigm for long noncoding RNA function in cancer[J].JMolMed(Berl), 2013, 91(7): 791-801.
[3]Tano K, Mizuno R, Okada T, et al. MALAT-1 enhances cell motility of lung adenocarcinoma cells by influencing the expression of motility-related genes[J].FEBSLett, 2010, 584(22): 4575-80.
[4]Lai M C, Yang Z, Zhou L, et al. Long non-coding RNA MALAT-1 overexpression predicts tumor recurrence of hepatocellular carcinoma after liver transplantation[J].MedOncol, 2012, 29(3): 1810-6.
[5]Lin R, Roychowdhury-Saha M, Black C, et al. Control of RNA processing by a large non-coding RNA over-expressed in carcinomas[J].FEBSLett, 2011, 585(4): 671-6.
[6]李艳利, 张诗梦, 汪菊, 等. 长链非编码RNA在癌症中的研究进展[J]. 自然杂志, 2014, 36(3): 192-201.
[6]Li Y L, Zhang S M, Wang J, et al. Progress of long noncoding RNA in cancer[J].ChinJNat, 2014, 36(3): 192-201.
[7]Wang X, Li M, Wang Z, et al. Silencing of long noncoding RNA MALAT1 by miR-101 and miR-217 inhibits proliferation, migration, and invasion of esophageal squamous cell carcinoma cells[J].JBiolChem, 2015, 290(7): 3925-35.
[8]Clemson C M, Hutchinson J N, Sara S A, et al. An architectural role for a nuclear noncoding RNA: NEAT1 RNA is essential for the structure of paraspeckles[J].MolCell, 2009, 33(6): 717-26.
[9]Tripathi V, Ellis J D, Shen Z, et al. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation[J].MolCell, 2010, 39(6): 925-38.
[10] Guo F, Li Y, Liu Y, et al. Inhibition of metastasis-associated lung adenocarcinoma transcript 1 in CaSki human cervical cancer cells suppresses cell proliferation and invasion[J].ActaBiochimBiophysSin(Shanghai), 2010, 42(3): 224-9.
[11] Zhang H, Zhao B, Huang C, et al. Melittin restores PTEN expression by down-regulating HDAC2 in human hepatocelluar carcinoma HepG2 cells[J].PlosOne, 2014, 9(5): e95520.
[12] Zhu H, Yang X, Liu J, et al. Melittin radiosensitizes esophageal squamous cell carcinoma with induction of apoptosisinvitroandinvivo[J].TumourBiol, 2014, 35(9): 8699-705.
[13] Wang C, Chen T, Zhang N, et al. Melittin, a major component of bee venom, sensitizes human hepatocellular carcinoma cells to tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)-induced apoptosis by activating CaMKII-TAK1-JNK/p38 and inhibiting IkappaBalpha kinase-NFkappaB[J].JBiolChem, 2009, 284(6): 3804-13.
[14] 沈文文, 赵斌, 黄成, 等. 蜂毒素对人肝癌HepG2细胞增殖和凋亡的影响及其部分机制研究[J]. 中国药理学通报, 2015, 31(9): 1222-7.
[14] Shen W W, Zhao B, Huang C, et al. effect of Melittin on proliferation and apoptosis of human HepG2 cells. [J].ChinPharmacolBull, 2015, 31(9): 1222-7.
Effects of silencing MALAT1 on proliferation and apoptosis in HepG2 cells induced by Melittin
ZHAO Bin, WU Yu-ting, HUANG Cheng, LYU Xiong-wen, LI Jun
(SchoolofPharmacy,AnhuiMedicalUniversity,Hefei230032,China)
Abstract:AimTo investigate the effects of silencing MALAT1 gene on cell proliferation inhibition and apoptosis induced by Melittin in human hepatocellular carcinoma HepG2 cells. MethodsThe inhibitory rate of cell proliferation treated with Melittin in HepG2 cells was examined by MTT assay. Apoptotic rate was detected by flow cytometry. The MALAT1 expression level in HepG2 cells was measured by qPCR. Specific siRNAs were utilized to silence MALAT1 expression. The rates of cell proliferation inhibition and apoptosis in HepG2 cells treated with siRNA and Melittin were compared with those of Melittin alone. ResultsMelittin significantly suppressed the growth of HepG2 and induced cell apoptosis in a dose-dependent manner. Compared with normal liver cell lines, MALAT1 was highly expressed in HepG2 cells(P<0.05). The expression of MALAT1 in HepG2 cells was inhibited by Melittin, and the inhibitory rate increased with the increase of concentration. The rates of cell proliferation inhibition and apoptosis in HepG2 cells treated with siRNA and Melittin were significantly higher than those treated merely with Melittin. ConclusionMelittin can reduce the expression of MALAT1 and silencing MALAT1 can effectively promote proliferation inhibition and apoptosis in HepG2 cells induced by Melittin.
Key words:Melittin; long noncoding RNA; MALAT1; RNA silence; apoptosis; HepG2 cells
文献标志码:A
文章编号:1001-1978(2016)02-0211-06
doi:10.3969/j.issn.1001-1978.2016.02.013
作者简介:赵斌(1979-),男,硕士,研究方向:抗炎免疫药理学,E-mail:ayzhbin@163.com;李俊(1960-),男,博士,教授,研究方向:临床药理学、抗炎免疫药理学,通讯作者,Tel:0551-65161001,E-mail:lijun@ahmu.edu.cn
基金项目:国家自然科学基金资助项目(No 81473268,81273526);高校博士点基金资助项目(No 20123420120001);安徽省自然科学基金资助项目(No 1408085MKL31,1308085MH145)
收稿日期:2015-09-22,修回日期:2015-10-29
网络出版时间:http://www.cnki.net/kcms/detail/34.1086.R.20160125.1557.026.html网络出版地址:2016-1-25 15:57

