中国野生毛葡萄‘丹凤-2’3个芪合酶基因表达与功能分析
杜杨建,李瑞民,程思妍,张剑侠,王跃进
(西北农林科技大学 园艺学院,旱区作物逆境生物学国家重点实验室,农业部西北地区园艺作物生物学与种质创制重点实验室,陕西杨陵 712100)
中国野生毛葡萄‘丹凤-2’3个芪合酶基因表达与功能分析
杜杨建,李瑞民,程思妍,张剑侠,王跃进*
(西北农林科技大学 园艺学院,旱区作物逆境生物学国家重点实验室,农业部西北地区园艺作物生物学与种质创制重点实验室,陕西杨陵 712100)
摘要:为了研究中国野生毛葡萄(Vitis quinquangularis Rehd.)‘丹凤-2’ 3个芪合酶基因的表达与功能,该研究采用同源克隆技术分离了毛葡萄‘丹凤-2’3个芪合酶基因VqSTS21、VqSTS30和VqSTS32(GenBank登录号分别为JQ868677、JQ868668和JQ868666),3个基因的cDNA全长均为1 179 bp,编码392个氨基酸。以抗葡萄白粉病(Uncinula necator)的毛葡萄‘丹凤-2’和不抗病的欧洲葡萄‘赤霞珠’为材料分别进行接种白粉菌和ABA、SA、MeJA、高温、低温和高盐胁迫处理,利用实时定量PCR检测这3个基因在胁迫处理下的表达情况;同时利用农杆菌介导法将这3个基因分别转入模式植物烟草中,检测这3个基因在烟草中的表达产物,分析比较这3个基因的表达功能。结果显示:在2个供试材料中,葡萄白粉菌胁迫下芪合成酶VqSTS32诱导表达量高于VqSTS21和VqSTS30;在非生物胁迫处理下,芪合酶基因VqSTS32对高温处理反应最敏感。采用高效液相色谱分析检测转3个基因烟草的结果显示,转VqSTS32基因烟草比转VqSTS30基因烟草植株中白藜芦醇的累积量高。研究表明,3个基因中VqSTS32具有较高的抗葡萄白粉菌特性并能在转基因烟草中表达出较高的反式云杉新苷产物,这为进一步利用VqSTS32转目的植物葡萄基因研究提供了依据。
关键词:葡萄;中国野生葡萄;芪合酶基因;白藜芦醇;表达分析
欧洲葡萄(VitisviniferaL.)栽培品种由于其优质、高产与用途多样,在全球被广泛栽培。但其突出缺点是抗病、抗逆性差,特别是易感白粉病[1-3],葡萄白粉病[Uncinulanecator(Schw.) Burr.]是严重危害葡萄的一种真菌病害,它不仅造成产量的降低,而且影响果实品质。
芪合成酶的表达产物白藜芦醇不仅在植物体内是一种植保素,参与植物对外界病原入侵的防御反应。而且迄今研究报道葡萄中白藜芦醇的含量较高,白藜芦醇不仅在植物体内表现抗病,而且葡萄果实及其制品还有抗氧化、抗衰老、抗癌作用[4]。2006年美国科学家又发现葡萄果实的白藜芦醇具有防治心血管疾病、防癌的保健作用[5]。当植物在受到真菌侵染、紫外线照射或处于病理状态时,白藜芦醇被诱导积累[6]。白藜芦醇在葡萄的体细胞中诱导病程相关蛋白大量累积,提高葡萄的抗病性[7];对心血管代谢及糖尿病人的血管炎症具有很大改善作用[8-9],此外它还具有控制血小板的聚集[10],有效地抑制低密度脂蛋白的氧化[11]、抑制癌细胞[12]、抗炎活性[13]、抗肿瘤[14]和植物雌性激素作用[15]等功能。
芪合酶是白藜芦醇代谢中的关键酶[16],能够促使香豆酸辅酶A和丙二酰辅酶A反应形成芪类化合物白藜芦醇。多数植物如烟草[17]、小麦[18]、大麦[19]等,在转入外源芪合酶基因后可提高白藜芦醇积累量,并且能增强自身对一些真菌病害的抗性。
中国作为葡萄属植物重要的起源地之一,拥有丰富的抗性种质资源[1-3],研究这些资源中的抗性基因有重要的研究和利用价值。本课题组段朝辉等2002年利用高效液相色谱法(HPLC)对中国葡萄野生种中11个种或变种共36个株系浆果中的白藜芦醇含量进行研究[20],其中抗白粉病的毛葡萄‘丹凤-2’白藜芦醇的含量很高,可达7.518 μg·g-1,此后史江莉等[21]的研究也发现,毛葡萄‘丹凤-2’浆果中的白藜芦积累量较高。
基于芪合酶在白藜芦醇代谢过程中的重要作用,本研究在史江莉研究的41个芪合成酶基因中,选取了VqSTS21、VqSTS30和VqSTS32这3个芪合成酶基因,利用同源克隆技术分离获得了这3个基因cDNA全长;利用生物与非生物因素胁迫处理,研究VqSTS21、VqSTS30和VqSTS32基因的表达差异与功能,进一步通过农杆菌介导法将这3个基因转入烟草中,通过HPLC检测3个转芪合酶基因烟草植株中芪类物质表达的含量,以确定毛葡萄3个芪合酶基因VqSTS21、VqSTS30和VqSTS32的表达与功能,筛选芪合酶活性表达较高的基因,为定向改良欧洲葡萄抗病性提供依据。
1材料和方法
1.1材料与处理
供试材料为西北农林科技大学葡萄种质资源圃中保存的抗白粉病毛葡萄‘丹凤-2’与感白粉病欧洲葡萄‘赤霞珠’。生物胁迫是田间选取受葡萄白粉病菌感染的葡萄叶片,利用压片法[22]将白粉病接种于未感病的‘丹凤-2’与‘赤霞珠’叶片上,在接种后0、6、24、48、72、96和120 h分别取样,收集叶片立即置于液氮中冷冻,并于-80 ℃保存,用于提取RNA和获得芪合成酶cDNA全长分析。
非生物胁迫分别用100 μmol/L水杨酸(SA)、50 μmol/L脱落酸(ABA)和50 μmol/L茉莉酸甲酯(MeJA)以及4 ℃低温、42 ℃高温和200 mmol/L NaCl溶液对生长健康的‘丹凤-2’与‘赤霞珠’进行胁迫,激素诱导后于0、0.5、1、3、6、12和24 h取样,其余在处理后0、3、6、12、24、48和72 h取样,收集叶片立即置液氮中速冻,并于-80 ℃保存。
按照前期提交NCBI公布的芪合酶基因VqSTS21、VqSTS30和VqSTS32(GenBank登录号JQ868677、JQ868668和JQ868666)的cDNA序列,设计引物扩增和实时定量PCR引物,引物由北京奥科公司合成(表1)。
1.2实验方法
1.2.1葡萄叶片总RNA提取及其芪合酶基因cDNA全长克隆参照张今今等改良的SDS/酚法[23],提取‘丹凤-2’幼叶总RNA,参照王西平的方法进行总RNA纯化[24],利用琼脂糖凝胶电泳和Nano Drop检测总RNA的质量与浓度,参照PrimeScriptTMRT reagent Kit试剂盒说明书上的试验步骤对总RNA进行反转录。
以毛葡萄‘丹凤-2’cDNA为模板进行扩增,PCR反应条件为:98 ℃预变性10 s,55 ℃变性15 s,72 ℃退火2 min,30个循环;72 ℃延伸5 min,4 ℃保存。琼脂糖凝胶电泳检测反应产物,利用天根公司DNA回收试剂盒回收后,连接至pGEM-T-easy(大连TaKaRa)并转化Top10感受态细胞中,在含X-gal和IPTG的100 mg/L Amp平板上蓝白斑筛选后,将阳性的重组菌送北京奥科鼎盛测序部测序。
1.2.2实时荧光定量PCR分析分别采取不同时间接种葡萄白粉菌、外源施用ABA、SA、MeJA与高温、低温和高盐非生物因素胁迫下的毛葡萄‘丹凤-2’和‘赤霞珠’叶片组织总RNA,参照RevertAidTMFirst Strand cDNA Synthesis Kit说明书反转录为cDNA。根据VqSTS21、VqSTS30和VqSTS32基因的cDNA序列设计定量PCR分析引物,葡萄18S rRNA作为内参基因(表1)。按照SYBR Premix ExTaqⅡ说明书进行实时定量PCR扩增实验。
1.2.3植物表达载体构建依据3个基因VqSTS21、VqSTS30和VqSTS32的开放阅读框两端序列设计引物,分别引入SacⅠ与XbaⅠ酶切位点,并分别构建到pBI121植物表达载体中,将这3种表达载体利用电转化的方法转入农杆菌菌株GV3101,挑取阳性克隆于LB液体培养基培养至对数生长期,用MS重悬至OD600值为0.4,用作农杆菌介导的遗传转化侵染。
1.2.4农杆菌转化烟草及转基因苗的获得采用农杆菌介导的叶盘法转化烟草植株NC89,分别用含有这3个目的基因的农杆菌侵染无菌烟草叶片,将侵染过的叶片置于共培养基(MS+200 mg/L NAA+2 mg/L 6-BA)28 ℃黑暗条件下培养2~3 d,而后转移至筛选培养基(MS+200 mg/L NAA+2 mg/L 6-BA+200 mg/L Kan+400 mg/L Carb)进行抗性芽筛选分化,当长出比较明显的抗性芽时,切下抗性芽再生成苗,此后,转移至生根培养基(MS+200 mg/L Kan+400 mg/L Carb)诱导转基因烟草植株生根,获得转基因烟草植株。提取转基因烟草基因组DNA,用于PCR分析检测转基因植株。
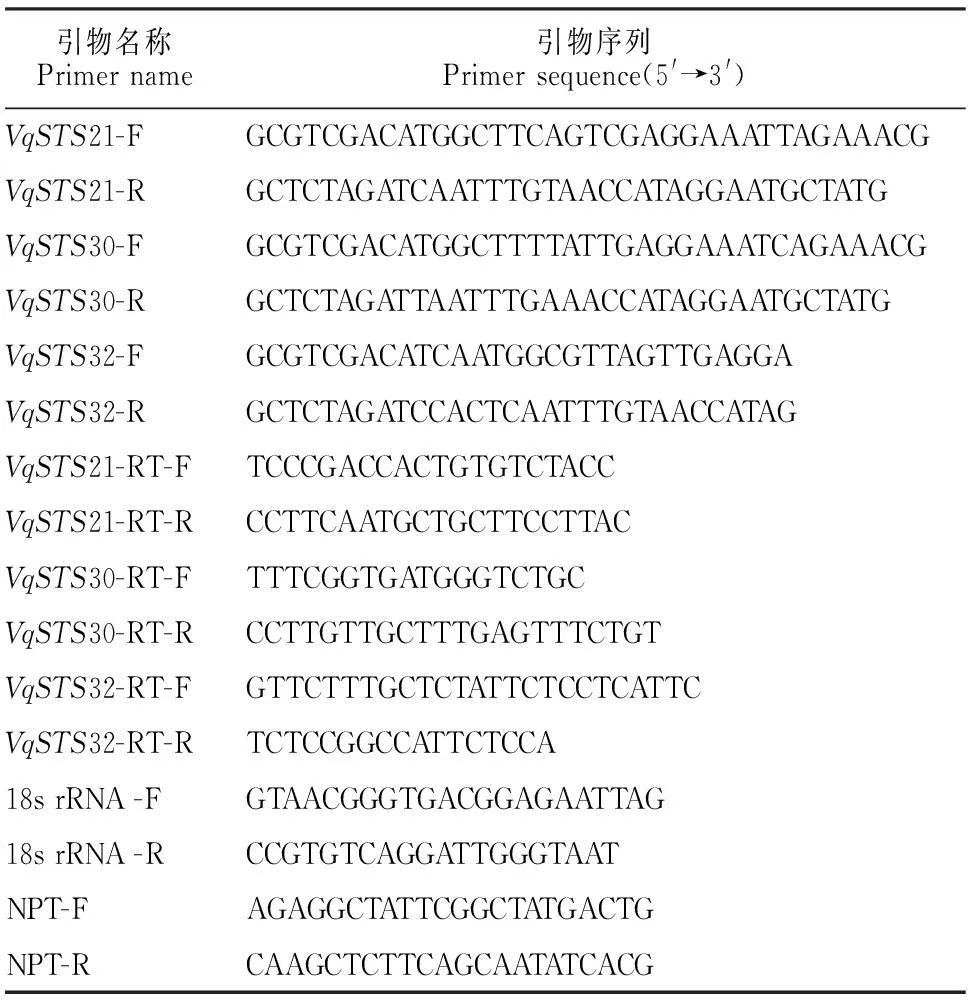
表1 本实验所用引物
1.2.5转基因烟草中的芪类物质测定取转基因烟草幼叶1 g,参照周起的方法[25]进行样品制备与高效液相色谱分析。混合标样中各标样通过标准曲线保留时间的不同区分与鉴定,同时通过对比相同保留时间内标样的峰面积与样品峰面积的比值,计算测定样品芪合成酶表达产物的含量。芪合成酶基因表达白藜芦醇产物的不同存在形式与顺序是:葡萄素、紫檀芪、反式白藜芦醇和反式云杉新苷。
2结果与分析
2.1毛葡萄‘丹凤-2’VqSTS21、VqSTS30和VqSTS32基因的克隆与序列分析
对提取‘丹凤-2’叶的总RNA检测,结果显示,提取的RNA没有发生降解,纯度较高,可用于后期同源克隆以及RT-PCR反应(图1,A)。根据Gen-Bank中已登录的毛葡萄‘丹凤-2’芪合酶基因序列(表2),设计引物(表1),利用反转录cDNA作为模板,进行PCR 扩增,获得约1 200 bp大小的扩增产物(图1,B),经测序分析,获得了与早期cDNA全长序列一致结果[21]。
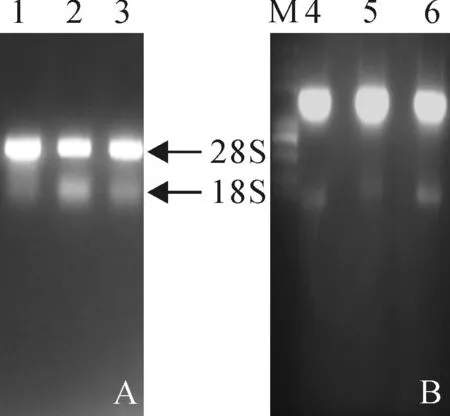
M.Marker Trans 2K Plus;1~3.‘丹凤-2’幼叶RNA;
通过NCBI(http://www.ncbi.nlm.nih.gov/)网站Blastn对所获得的基因序列进行比对分析,获得了目的基因VqSTS21、VqSTS30和VqSTS32全长序列(表2)。通过序列分析,这3个基因均编码392 bp氨基酸。对这3个基因的氨基酸序列进行同源比对分析(图2),发现三者之间同源性很高,其中VqSTS21与VqSTS32的同源性为98.0%,VqSTS21与VqSTS30 以及VqSTS30与VqSTS32间同源性分别为96.7%与97.4%。
2.2葡萄白粉菌诱导后毛葡萄3个芪合酶基因表达分析
经接种白粉菌诱导毛葡萄‘丹凤-2’和‘赤霞珠’后,这3个基因VqSTS21、VqSTS30和VqSTS32,表达方式不同,VqSTS21与VqSTS30虽诱导表达,但表达量较低,而VqSTS32基因表达量随时间的延长而升高,其表达量在‘赤霞珠’中低于毛葡萄中VqSTS32基因的表达,而VvSTS21、VvSTS30和VvSTS32三者的表达趋势一致(图3)。
2.3毛葡萄‘丹凤-2’的3个芪合酶基因在施用不同外源激素诱导下的表达分析
外源施用ABA、SA和MeJA作为非生物胁迫处理,毛葡萄‘丹凤-2’3个基因VqSTS21、VqSTS30和VqSTS32的表达随处理时间的不同而上下波动:ABA处理后6 h,在‘丹凤-2’中基因VqSTS21受诱导表达最显著,其表达量在处理6 h后达到最高(图4,A);而在‘赤霞珠’中,则VvSTS30基因受诱导表达相对略微显著,其表达量在处理3 h后达到最高,VvSTS32与VvSTS21基因均在处理6 h后表达量达到最高(图4,B);经SA处理,毛葡萄‘丹凤-2’中的VqSTS21、VqSTS30和VqSTS32基因均诱导表达明显,三者的表达量在处理12 h后达到最高(图5,A),此后下降;而在‘赤霞珠’中,3个基因的表达量没有发生明显变化,呈现双峰,在处理1 h和12 h后其表达量均达到高值(图5,B);经MeJA处理,在‘丹凤-2’中VqSTS21与VqSTS30的表达量均呈现先升后降的趋势,在处理后6 h其表达量达到最高,而VqSTS32表达处于相对较低水平(图6,A);在对照‘赤霞珠’中,VvSTS30与VvSTS32基因均呈现出先下降后上升再下降的表达趋势,VvSTS21基因的表达较低,但三者的表达量在处理后6 h达到最高(图6,B)。

表2 毛葡萄‘丹凤-2’芪合酶基因序列分析

氨基酸序列相同的部分用黑色阴影表示
2.43个芪合酶基因在高盐、低温和高温胁迫处理下的表达模式分析
在高盐、低温和高温的胁迫下,毛葡萄‘丹凤-2’的3个基因VqSTS21、VqSTS30和VqSTS32的表达水平随处理时间的不同而不同。在高盐处理下,基因VqSTS21的表达水平波动最显著,未处理时表达量最高(图7,A),经处理表达量减少,处理6 h后,处于低水平表达;在 ‘赤霞珠’中,表达量变化最显著的是VvSTS30基因,在处理12 h后其表达量达到最高(图7,B)。在高温处理下,毛葡萄‘丹凤-2’3个基因中,VqSTS32基因表达较显著,在处理后48 h,其表达量持续上调,在48 h达到最高值(图8,A);在 ‘赤霞珠’中,3个VvSTS基因的表达趋势不一(图8,B)。在低温处理后,毛葡萄‘丹凤-2’中,3个基因表达量呈现表达增加;在 ‘赤霞珠’中,VvSTS21基因与在‘丹凤-2’中的表达大体一致,均为逐渐增加,表达量均在处理后72 h达到最高,VvSTS30基因的表达情况也与在‘丹凤-2’中相一致,即在处理后24~72 h均处于高水平表达,VqSTS32基因则在处理后12~72 h表达较高(图9)。
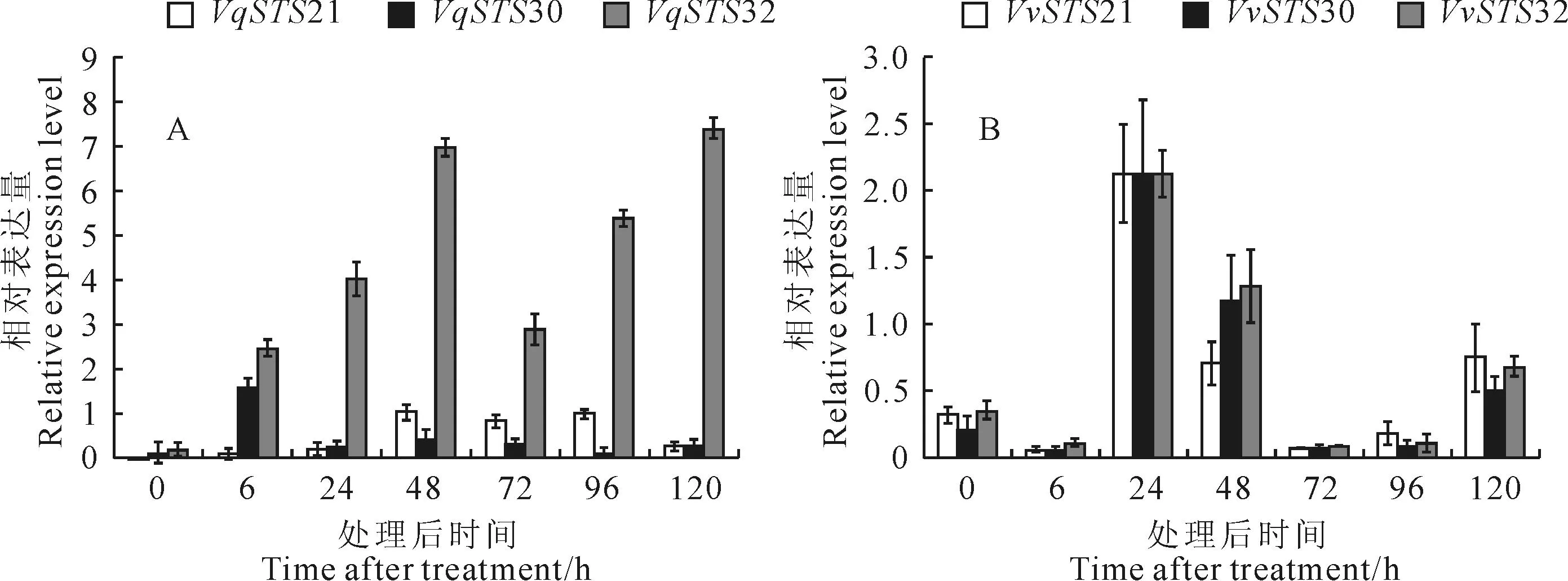
图3 接种白粉病诱导后3个基因在毛葡萄‘丹凤-2’(A)和‘赤霞珠’(B)中的表达
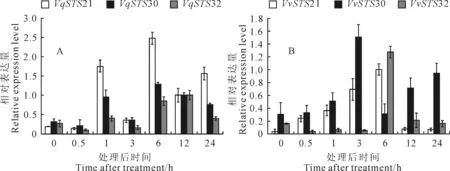
图4 外源施用脱落酸诱导后3个基因在毛葡萄‘丹凤-2’(A)和‘赤霞珠’(B)的表达
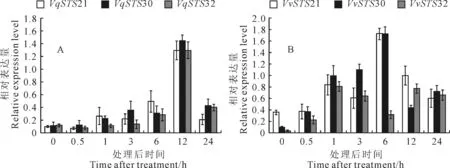
图5 外源施用水杨酸诱导后3个基因在毛葡萄‘丹凤-2’(A)和‘赤霞珠’(B)中的表达
2.5转芪合酶基因烟草NC89植株的PCR检测与芪类物质含量的测定
3个VqSTS基因利用农杆菌介导叶盘法获得抗卡那霉素的转芪合酶基因烟草NC89植株(图10),随机选取10株以及1株阴性对照烟草NC89的嫩叶,以重组载体作为阳性对照,利用PCR分析检测(图11);在阳性对照及转基因植株中均可扩增出647 bp的新霉素磷酸转移酶基因NPTII,而阴性对照未扩增出647 bp片段,PCR检测初步说明3个毛葡萄芪合成酶基因VqSTS已经转入了烟草NC89中。
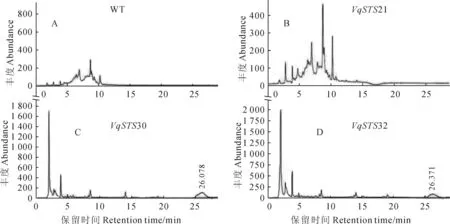
HPLC标准检测结果如下:4种芪类化合物(Viniferin,8.776 min;pterostilbene,14.119 min;trans-resveratrol,17.087 min;trans-piceid,26.58 min)均被检测到(图12);在转入VqSTS30与VqSTS32的转基因烟草NC89植株中均检测到反式云杉新苷的存在,其他3种芪类物种均未检测到(图13)。在转入VqSTS32基因的转基因烟草NC89植株中反式云杉新苷含量最高,为26.371 μg/g;在转入VqSTS30基因的转基因烟草,反式云杉新苷含量为26.087 μg/g(表3);而在阴性对照和转VqSTS21的转基因烟草NC89植株中均没有检测到上述4种芪类物质的积累(表3)。
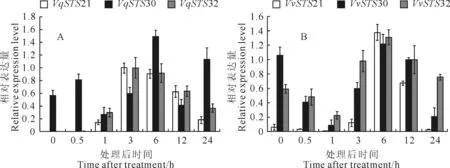
图6 外源施用茉莉酸甲酯诱导后3个基因在毛葡萄‘丹凤-2’(A)和‘赤霞珠’(B)中的表达
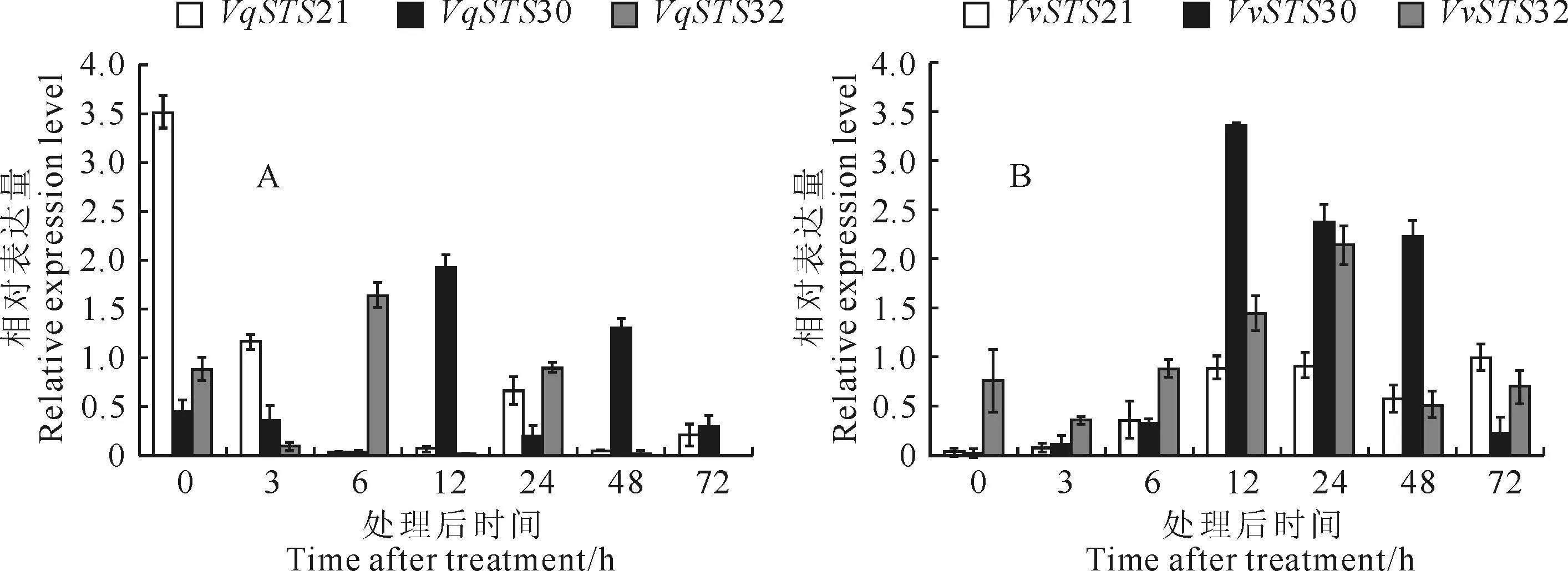
图7 高盐处理下3个基因在毛葡萄‘丹凤-2’(A)和‘赤霞珠’(B)的表达

图8 高温处理下3个基因在毛葡萄‘丹凤-2’(A)和‘赤霞珠’(B)中的表达
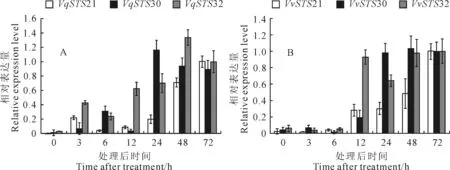
图9 低温处理后3个基因在毛葡萄‘丹凤-2’(A)和‘赤霞珠’(B)中的表达
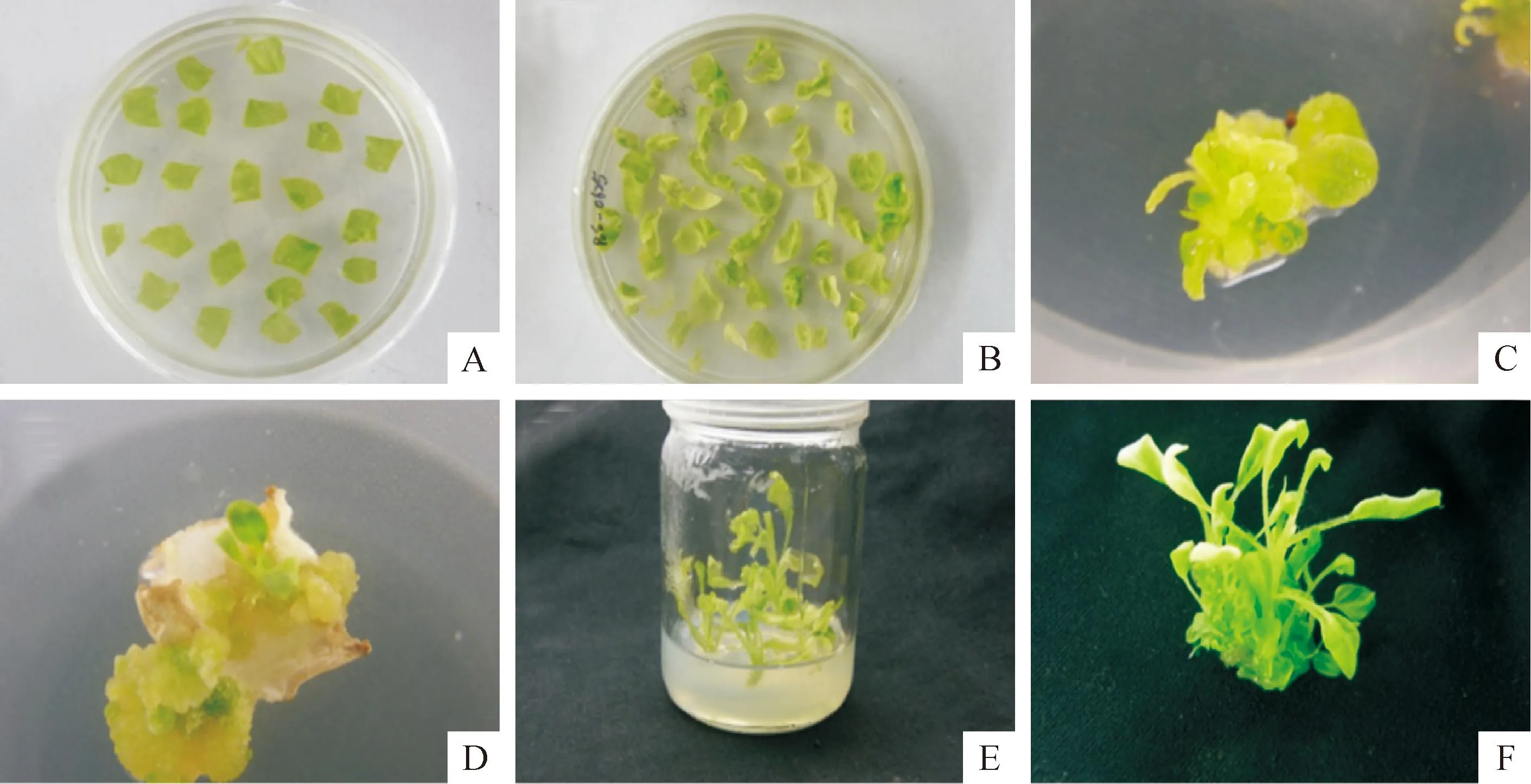
A.烟草子叶于MS培养基上预培养3 d;B.烟草子盘和农杆菌在分化培养基上进行共培养;C.1个星期后烟草子叶生长出愈伤;
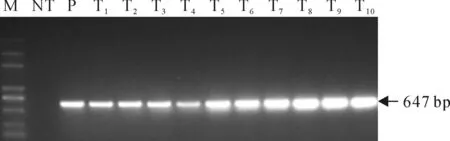
NT.野生型烟草NC89;T1~T3.转入VqSTS21的烟草NC89株系;

1.葡萄素,保留时间为8.776 min;2.紫檀芪,保留时间为
A.野生型烟草NC89;B.3株转入VqSTS30的烟草NC89株系;C.3株转入VqSTS21的
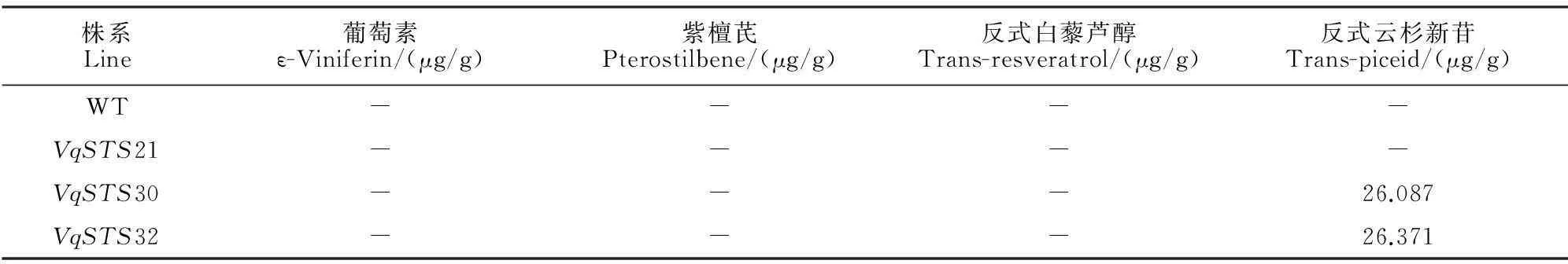
株系Line葡萄素ε-Viniferin/(μg/g)紫檀芪Pterostilbene/(μg/g)反式白藜芦醇Trans-resveratrol/(μg/g)反式云杉新苷Trans-piceid/(μg/g)WT----VqSTS21----VqSTS30---26.087VqSTS32---26.371
3讨论
改进与提高欧洲葡萄的抗病性是世界葡萄育种者研究的重要课题之一,培育欧洲葡萄品种抗白粉病可以通过杂交育种获得抗性种质[2-3],也可以通过转基因途径定向改良欧洲葡萄的抗病性[2-4]。自1997年首次报道芪合成酶表达产物白藜芦醇对人体的健康作用[4]和植物抗病性以来[17-19],研究芪合成酶基因及其表达功能一直是研究的重要方向与领域[21-22]。芪合酶是白藜芦醇代谢中的关键酶[13],芪类化合物的合成与累积增加了植物的抗病性,这也是近年来国内外学者研究植物抗病防御机制和反应的核心所在[1-3,17-21,23-24,26-27]。本研究就是根据芪合成酶基因在植物中具有抗病作用,对人体具有保健作用,毛葡萄‘丹凤-2’存在着芪合酶基因[21],并且可以在目的植物中表达的特点[22],我们克隆了中国野毛葡萄‘丹凤-2’3个芪合酶基因VqSTS21、VqSTS30和VqSTS32;通过接种葡萄白粉菌诱导、外源施用ABA、SA、MeJA处理及采用非生物的高温、低温和高盐胁迫处理,研究毛葡萄这3个VqSTS基因的表达特性,进一步将这3个芪合酶基因转入模式烟草中,检测转基因植物的表达产物与基因功能。研究结果表明,VqSTS32相较于VqSTS21和VqSTS30在葡萄白粉菌诱导下表达显著,且VqSTS32转基因烟草NC89植株中芪类化合物反式云杉新苷累积量较高,表明VqSTS32积极参与了葡萄早期的防御反应,这与Fung等在葡萄中研究白粉菌入侵时,芪合酶基因参与葡萄防御反应的基因的表达量会上调结果相一致[25]。另一方面,国内外学者对生物信号分子ABA、SA 和 MeJA积极的参与植物的生长发育和防御反应也进行了研究[28-29]。植物在受到病原微生物入侵时能够启动复杂的信号传导网络来获得局部和系统性抗性[30],植物信号传导网络中的SA、MeJA 等抗病信号分子被认为是病原菌侵染的次级信号,能提高许多病源菌响应基因的表达[31],对模式植物拟南芥的研究表明,SA 信号途径主要参与抵御生物类胁迫中活体营养型病原物如霜霉病菌、白粉病菌、假单孢杆菌的防卫反应[32-33],MeJA信号途径主要参与抵御生物类胁迫中对坏死营养型病原物如灰霉菌、腐霉病菌和土传病菌等的防卫反应[34],ABA则广泛地参与调控植物生长发育以及抵抗逆境胁迫的多个方面[35-36]。在植物体内,各种抗病信号途径相互拮抗或相互协同形成一个复杂的信号传递网络来增加植物的防卫能力[37]。植物在生长发育过程中也常常遭受诸如高温、低温和盐胁迫等逆境胁迫,均会造成对生长发育的伤害[38]。逆境胁迫诸如高温、低温和盐胁迫均能诱导ABA的合成来增加植物对逆境胁迫的抗性[39-41],植物内源ABA能促进能够充当第二信使参与植物胁迫响应H2O2产生[42]。本研究表明在 ‘丹凤-2’与‘赤霞珠’中受到逆境胁迫高温、低温和盐胁迫处理下这3个VqSTS基因均存在诱导,其中VqSTS21基因对高盐的表达明显,VqSTS32基因对高温的表达较高,而这3个毛葡萄‘丹凤-2’芪合酶基因VqSTS基因在高温、低温和高盐的胁迫表现了不同的反应与表达。
综上所述,通过对中国野生毛葡萄‘丹凤-2’的3个基因VqSTS21、VqSTS30和VqSTS32在接种葡萄白粉病、外源施用小分子物质和非生物高盐、高温与低温的胁迫处理下基因表达的比较,筛选出中国野生华毛葡萄‘丹凤-2’芪合酶基因VqSTS32,该基因受白粉菌诱导表达。我们下一步是将该基因VqSTS32转入优质不抗病的欧洲葡萄品种中,鉴定该基因的抗白粉病与抗病机理,为今后通过杂交育种和转基因技术,实施定向改良欧洲葡萄的抗白粉病性提供依据。
参考文献:
[1]贺普超.中国葡萄属野生资源[M].北京:中国农业出版社,2012:12.
[2]王跃进,贺普超.中国葡萄属野生种叶片抗白粉病遗传研究[J].中国农业科学,1997,30(1):19-25.
WANG Y J,HE P C.Study on the inheritance of resistance to powdery mildew in Chinese native wildVitisL.species[J].ScientiaAgriculturaSinica,1997,30(1):19-25.
[3]WANG Y,LIU Y,HE P,etal.Evaluation of foliar resistance toUncinulanecatorin Chinese wildVitisspecies[J].Vitis,1995,34(3):159-164.
[4]JANG M,CAI L,UDEANI G O,etal.Cancer chemopreventive activity of resveratrol,a natural product derived from grapes[J].Science,1997,275(5 297):218-220.
[5]BAUR J A,PEARSON K J,PRICE N L,etal.Resveratrol improves health and survival of mice on a high-calorie diet[J].Nature,2006,444(7 117):337-342.
[6]江文沁,沈金芳.白藜芦醇的药理活性及作用机制[J].药学进展,2003,27(3):159-162.
JIANG W Q,SHEN J F.Pharmacological properties and effect mechanism of resveratrol[J].ProgressinPharmaceuticalSciences,2003,27(3):159-162.
[7]CHANG X,HEENE E,QIAO F,etal.The phytoalexin resveratrol regulates the initiation of hypersensitive cell death inVitiscell[J].PlosOne,2011,6(10):e26405.
[8]POLLACK R M,CRANDALL J P.Resveratrol:therapeutic potential for improving cardiometabolic health[J].AmericanJournalofHypertension,2013,26(11):1 260-1 268.
[9]RONG G,BAOXIN L,KE W,etal.Resveratrol ameliorates diabetic vascular inflammation and macrophage infiltration in db/db mice by inhibiting the NF-κB pathway[J].Diabetes&VascularDiseaseResearchOfficialJournaloftheInternationalSocietyofDiabetes&VascularDisease,2014,11(2):92-102.
[10]BERTELLI A A,GIOVANNINI L,GIANNESSI D,etal.Antiplatelet activity of synthetic and natural resveratrol in red wine[J].InternationalJournalofTissueReactions,1995,17(1):1-3.
[11]FRANKEL E N,WATERHOUSE A L,KINSELLA J E.Inhibition of human LDL oxidation by resveratrol[J].TheLancet,1993,341(8 852):1 103-1 104.
[12]VERGARA D,SIMEONE P,TORALDO D,etal.Resveratrol downregulates Akt/GSK and ERK signalling pathways in OVCAR-3 ovarian cancer cells[J]MolecularBiosystems,2012,8:1 078-1 087.
[13]CATALINA A D L L,VILLEGAS I.Resveratrol as an anti-inflammatory and anti-aging agent:mechanisms and clinical implications[J].MolecularNutrition&FoodResearch,2005,49(5):405-430.
[14]KOPP P.Resveratrol,a phytoestrogen found in red wine.A possible explanation for the conundrum of the ‘French paradox’[J].EuropeanJournalofEndocrinology,1998,138(6):619-620.
[15]JANNIN B,MENZEL M,BERLOT J P,etal.Transport of resveratrol,a cancer chemopreventive agent,to cellular targets:plasmatic protein binding and cell uptake[J].BiochemicalPharmacology,2004,68(6):1 113-1 118.
[16]RICCARDO V,ANDREY Z,MICHELA T,etal.A high quality draft consensus sequence of the genome of a heterozygous grapevine variety[J].PlosOne,2007,2(12):e1326.
[17]HAIN R,REIF H J,KRAUSE E,etal.Disease resistance results from foreign phytoalexin expression in a novel plant[J].Nature,1993,361(6 408):153-156.
[18]LIANG H,ZHENG J,DUAN X,etal.A transgenic wheat with a stilbene synthase gene resistant to powdery mildew obtained by biolistic method[J].ChineseScienceBulletin,2000,45(7):634-638.
[19]LECKBAND G,LÖRZ H.Transformation and expression of a stilbene synthase gene ofVitisviniferaL.in barley and wheat for increased fungal resistance[J].TheoreticalandAppliedGenetics,1998,96(8):1 004-1 012.
[20]段朝辉.中国葡萄野生种白藜芦醇含量分析的研究[D].陕西杨陵:西北农林科技大学,2002.
[21]SHI J,HE M,CAO J,etal.The comparative analysis of the potential relationship between resveratrol and stilbene synthase gene family in the development stages of grapes (VitisquinquangularisandVitisvinifera)[J].PlantPhysiology&Biochemistry,2014,74:24-32.
[22]ZHOU Q,DU Y,CHENG S,etal.Resveratrol derivatives in four tissues of six wild Chinese grapevine species[J].NewZealandJournalofCropandHorticulturalScience,2015,43(3):204-213.
[23]FULVIO M,URSKA V,GIULIA M,etal.Profiling of resveratrol oligomers,important stress metabolites,accumulating in the leaves of hybridVitisvinifera(Merzling×Teroldego) genotypes infected withPlasmoparaviticola[J].JournalofAgricultural&FoodChemistry,2011,59(10):5 364-5 375.
[24]SCHNEE S,VIRET O,GINDRO K.Role of stilbenes in the resistance of grapevine to powdery mildew[J].PhysiologicalandMolecularPlantPathology,2008,72(4):128-133.
[25]FUNG R W M,GONZALO M,FEKETE C,etal.Powdery mildew induces defense-oriented reprogramming of the transcriptome in a susceptible but not in a resistant grapevine[J].PlantPhysiology,2008,146(1):236-249.
[26]张今今,王跃进,王西平,等.葡萄总RNA提取方法的研究[J].果树学报,2003,20(3):178-181.
ZHNAG J J,WANG Y J,WANG X P,etal.An improved method for rapidly extracting total RNA fromVitis[J].JournalofFruitScience,2003,20(3):178-181.
[27]王西平.中国葡萄野生种抗白粉病基因克隆与序列分析[D].陕西杨陵:西北农林科技大学,2004.
[28]KUNKEL B N,BROOKS D M.Cross talk between signaling pathways in pathogen defense[J].CurrentOpinioninPlantBiology,2002,5(4):325-331.
[29]BARI R,JONES J D G.Role of plant hormones in plant defence responses[J].PlantMolecularBiology,2009,69(4):473-488.
[30]FUJITA Y,FUJITA M,SHINOZAKI K,etal.ABA-mediated transcriptional regulation in response to osmotic stress in plants[J].JournalofPlantResearch,2011,124(4):509-525.
[31]THOMMA B P,PENNINCKX I A,CAMMUE B P,etal.The complexity of disease signaling inArabidopsis[J].CurrentOpinioninImmunology,2001,13(1):63-68.
[32]DELANEY T P,UKNES S,VERNOOIJ B,etal.A central role of salicylic acid in plant disease resistance[J].Science,1994,266(5 188):1247.
[33]LIU X Q,etal.OsWRKY03,a rice transcriptional activator that functions in defense signaling pathway upstream of OsNPR1[J].CellResearch,2005,15(8):593-603.
[34]THOMMA B P H J,EGGERMONT K,BROEKAERT W F,etal.Disease development of several fungi onArabidopsiscan be reduced by treatment with methyl jasmonate [Plectosphaerella][J].PlantPhysiology&Biochemistry,2000,38(5):421-427.
[35]FUJII H,VERSLUES P E,ZHU J K.Identification of two protein kinases required for abscisic acid regulation of seed germination,root growth,and gene expression inArabidopsis[J].PlantCell,2007,19(2):485-494.
[36]FELIX H,RAINER W,SCHROEDER J I.Evolution of abscisic acid synthesis and signaling mechanisms[J].CurrentBiology,2011,21(9):R346-R355.
[37]KUNKEL B N,BROOKS D M.Cross talk between signaling pathways in pathogen defense[J].CurrentOpinioninPlantBiology,2002,5(4):325-331.
[38]ZHU J K.Cell signaling under salt,water and cold stresses[J].CurrentOpinioninPlantBiology,2001,4(5):401-406.
[39]MOTOAKI S,AYAKO K,KAZUKO Y S,etal.Molecular responses to drought,salinity and frost:common and different paths for plant protection[J].CurrentOpinioninBiotechnology,2003,14(2):194-199.
[40]CLARKE S M,MUR L A,WOOD J E,etal.Salicylic acid dependent signaling promotes basal thermotolerance but is not essential for acquired thermotolerance inArabidopsisthaliana[J].PlantJournal,2004,38(3):432-447.
[41]UMEZAWA T,OKAMOTO M,KUSHIRO T,etal.CYP707A3,a major ABA 8′-hydroxylase involved in dehydration and rehydration response inArabidopsisthaliana[J].PlantJournal,2006,46(2):171-182.
[42]RON M,SANDY V,MARTIN G,etal.Reactive oxygen gene network of plants[J].TrendsinPlantence,2004,9(10):490-498.
(编辑:宋亚珍)
Expression and Function Analysis of Three Stilbene Synthase Genes fromVitisquinquangularisRehd.Accession ‘Danfeng-2’
DU Yangjian,LI Ruimin,CHENG Siyan,ZHANG Jianxia,WANG Yuejin*
(College of Horticulture,Northwest A&F University,State Key Laboratory of Crop Stress Biology in Arid Areas,Key Laboratory of Biology and Genetic Improvement of Horticultural Crops,Ministry of Agriculture,Yangling,Shaanxi 712100,China)
Abstract:The purpose of this paper is to study the expression and function of VqSTS21,VqSTS30 and VqSTS32 genes,which cloned from powdery mildew-resistant Chinese wild Vitis quinquangularis accession ‘Danfeng-2’.Sequence analysis indicated that their cDNA has equal length of 1 179 bp and encodes 392 amino acid residues (GenBank accession No.JQ868677,JQ868668 and JQ868666).qRT-PCR showed the expression patterns of VqSTS21,VqSTS30 and VqSTS32 in ‘Danfeng-2’ and powdery mildew-susceptible Cabernet Sauvignon (Vitis vinifera L.) under biotic stress (Uncinula necator) and abiotic stress (ABA,SA,MeJA,heat,low temperature and NaCl).HPLC was employed to analysis resveratrol contents of these three genes overexpressed in transgenic tobacco plants.The results showed that the expression of VqSTS32 was higher than that of other two genes in two grape germplasms tested after treated with biotic stress and heat.Compared with the VqSTS21 and VqSTS30-overexpressed lines,trans-resveratrol was the highest accumulation in the VqSTS32-overexpressed lines of transgenic tobacco plants.Our results suggested that VqSTS32 gene was involved in the resveratrol synthesis pathway in grapes,and played an important role in response to U.necator.
Key words:grapevine;Chinese wild Vitis;stilbene synthase gene;resveratrol;expression pattern
中图分类号:Q789
文献标志码:A
作者简介:杜杨建(1989-),硕士,主要从事果树育种及生物技术研究。E-mail:1017066017@qq.com*通信作者:王跃进,教授,博士生导师,主要从事葡萄种质资源与生物技术育种研究工作。E-mail:wangyj@nwsuaf.edu.cn
基金项目:国家自然科学基金(31372039)
收稿日期:2015-10-13;修改稿收到日期:2016-01-24
文章编号:1000-4025(2016)02-0215-10
doi:10.7606/j.issn.1000-4025.2016.02.0215

