3种地被植物对二氧化硫胁迫的生理响应
杨晓晓,杨 丹,方欢欢,李 西,胡 琪,孙凌霞
(四川农业大学 风景园林学院,成都 611130)
3种地被植物对二氧化硫胁迫的生理响应
杨晓晓,杨丹,方欢欢,李西,胡琪,孙凌霞*
(四川农业大学 风景园林学院,成都 611130)
摘要:该研究以3种地被植物蜂斗菜、峨眉附地菜和绵毛水苏为材料,采用人工模拟熏气方法,在0、5.71、11.43和17.14 mg·m-3SO2浓度水平下,测定了参试植物的外观受害症状以及和生理生化指标对SO2的反应,明确供试植物对大气污染的反应特性,为选择景观效果良好同时具有更好生态效应的地被植物提供依据。结果表明:(1)随着SO2浓度的增加,3种地被植物受伤害症状从重到轻依次为绵毛水苏>峨眉附地菜>蜂斗菜,它们的叶片叶绿素含量、叶液pH值不同程度下降,丙二醛含量、相对叶片电导率、可溶性糖含量、游离脯氨酸含量均不同程度上升,同时其SOD、POD、CAT活性被激活并显著增强。(2)隶属函数和主成分分析综合评定结果显示,3种地被植物对SO2抗性能力由强到弱的顺序为:蜂斗菜>峨眉附地菜>绵毛水苏,与其受伤害症状顺序相反。(3)依据SO2胁迫下叶片含硫量的分析发现,各植物对SO2的净化能力由高到低的顺序为:蜂斗菜>绵毛水苏>峨眉附地菜。研究表明,3种地被植物中的蜂斗菜对SO2的抗性及净化能力最强,能够通过自身应激保护系统来提高对SO2的抗性,维持正常生长,适宜在城市园林绿化中推广。
关键词:地被植物;SO2抗性;净化能力;生理响应
大气中二氧化硫(SO2)主要来源于含硫金属矿的冶炼、含硫煤和石油的燃烧所排放的废气,它已成为近年来中国城市大气污染的主要气态污染物之一[1]。大气中的SO2可以通过植物叶片表面的气孔进入植物体内,先形成亚硫酸盐,再氧化成硫酸盐,变成对植物生长有益的营养物质[2-3]。只要大气中SO2的浓度不超过一定限度,并能有充分的时间使亚硫酸盐转化为硫酸盐,那么植物叶片就能不断吸收大气中的SO2[4]。随着叶片的衰老凋落,所吸收的硫元素也一同落到地上,为土壤所吸收,因而在植物叶枯叶荣的周期变化中,就可不断地将空气中的硫转移到土壤中,使空气不断得以净化。在目前SO2污染源未能完全治理的情况下,利用绿色植物对S的吸收和转化将是净化大气中的SO2污染物的一个有效途径之一[5-7]。
当前国内外学者关于SO2对植物影响的研究多集中在植物的生长及叶片伤害[8]、生理生化响应[2-3,8]、光合作用[4,9]、SO2的吸收和转化机理[5,10]、对SO2的抗性机理[10],以及对SO2抗性和净化能力的植物物种筛选[11-13]等方面。由于不同的植物物种叶片质地及气孔数量、形态结构不同,所以对SO2的敏感性不同,从而导致其对SO2的抗性和吸收能力有差异[5]。目前对SO2具有抗性和吸收能力植物种类的筛选主要集中在乔灌木树种上,还没有开展地被植物在SO2抗性和净化方面的筛选研究[10,14]。而地被植物是城市园林绿化和防止水土流失的重要素材之一,在维持城市生态平衡和丰富城市绿化景观类型等方面具有重要的作用。大气中的SO2通过叶片上的气孔进入植物体内,叶片的质地不同,可能对SO2的敏感性不同而导致抗性和吸收能力有差异[5]。基于此背景,本研究选取了园林上已广泛应用的叶片表面密被绒毛的绵毛水苏(Stachyslanata),正在开始推广使用的纸质叶片的蜂斗菜(Petasitesjaponica)和有厚革质叶片的峨眉附地菜(Trigonotisomeiensis)作为研究对象,采用人工熏气的方法,研究不同浓度SO2处理下3种多年生地被植物的形态和生理响应,并通过综合分析评价其对SO2的抗污和净化能力,从而为今后地被植物抗污和净化能力的深入提供科学的参考依据。
1材料和方法
1.1试验材料
试验材料选用天开园林公司提供的绵毛水苏,蜂斗菜和峨眉附地菜。选取株高一致、长势相近的健康植株栽植于半径规格为22 cm×15 cm花盆中,盆栽基质为过筛的有机营养土和腐殖土(体积比为1∶1)的混合土。试验在四川农业大学科研基地进行,将健康的植株置于基地大棚内正常养护管理。熏气处理前选取盆栽植株在露地进入旺盛生长期后放入熏气室中适应1周后再用SO2进行熏气处理。
1.2试验设计
本试验采用简易静态熏气系统进行SO2熏气处理。熏气箱为自制长、宽、高各为68 cm的封闭玻璃箱,由空调控制室内温度为(22±2) ℃,湿度为(70±5)%,日光灯管提供5 000 lx的光照强度,光/暗周期为16 h/8 h。根据前人设计浓度与预试验结果,试验共设0(对照)、5.71、11.43、17.14 mg·m-3SO2浓度4个处理。每一个熏气室为一个浓度处理,各处理均重复3次。
根据Na2SO3+H2SO4(浓)→Na2SO4+H2O+SO2↑的原理,定量产生SO2气体,入口处放置6 U的小风扇搅匀气体。采用APH型SO2监测仪监测箱内SO2浓度,当箱内SO2浓度达到预设浓度时开始计时,每天9:00开始熏气,17:00将植物从箱内拿出,结束熏气,熏气时间为8 h/d。熏气结束后将植株拿出并放置自然状况下生长,熏气结束6 h以后浇水,目的在于防止SO2立即溶于水,影响熏气效果。在连续熏气7 d后进行取样测定指标。
1.3指标测定
熏气处理结束7 d后,剪取离土表2 cm以上叶片部分标记装袋,进行各项生理生化指标测定。用相机记录下不同植物在不同二氧化硫熏气处理下表型;利用AutoCAD软件测算叶片面积。用丙酮乙醇等量混合法测定叶绿素含量[14]。电导率的测定采用电导法[15]。丙二醛(MDA)和可溶性糖的测定采用硫代巴比妥酸(TBA)比色法[16-17];游离脯氨酸的测定采用酸性茚三酮比色法[18]。超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光化还原法[19];过氧化物酶(POD)活性的测定采用愈创木酚法[20];过氧化氢酶(CAT)活性的测定采用紫外分光光度法[20]。叶液pH值的测定采用杨玉珍等方法[21]。叶片硫含量的测定采用硫酸钡比浊法[22]。植物净化SO2能力的计算参照张德强等的方法[12],将硫的净化率(SO2处理下植物叶片含硫量高出对照的百分率)在40%以上的划为净化能力强的种类,20%~40%之间的划为净化能力中等的种类,20%以下为净化能力差的种类。
1.4数据分析
用SPSS 19.0对试验数据进行显著性分析,并用Excel 2007对数据进行作图,利用模糊数学隶属函数和主成分分析法对植物抗性进行综合评定。
1.4.1模糊数学隶属函数计算每个植物的具体隶属函数值:
U(Xi)=(Xij-Xj min)/(Xj max-Xj min)
△=∑U(Xi)/n
若某个指标与抗性为负相关,则用反隶属函数计算其隶属函数值:
U(Xi)=1-(Xij-Xj min)/(Xj max-Xj min)
△=∑U(Xi)/n
式中,Xij为第i个植物j指标;U(Xi)∈[0,1];△为每个植物各项指标测定的综合评定结果;n为测定的指标总数;Xj max与Xj man为全部植物第j项指标的最大值与最小值;最后将每种植物的各个指标隶属值代入对应的主成分公式,得到最终的抗性对比。
1.4.2主成分分析法利用主成分分析法将具有重叠作用的9个指标化为2个综合指标,并用SPSS 19.0求解。设X=(X1,X2,……,XP)′为一个P维随机向量,考虑如下线性组合:
其中,Y1与Y2不相关,分别为第一主成分,第二主成分;Y1是X1,X2,X3,…XP的一切线性组合中方差最大的,Y2其次;ai1,aI2,…,aiP,i=1,2,3…,P是系数,是观测向量相关矩阵的单位特征向量;P指标总数;X1,X2,……,XP为某种植物某指标的变化率。
2结果与分析
2.1SO2熏气处理对3种地被植物叶片的伤害
3种地被植物叶片在不同浓度SO2熏气处理后均受到不同程度的伤害,且随着SO2处理浓度的升高叶片受伤害的面积都逐渐增加(图1,表1)。其中,蜂斗菜叶片受到SO2处理的伤害较轻,在最高浓度17.14 mg·m-3处理下仅出现细小的坏死斑,其坏死斑的面积约占叶片总面积的5%;峨眉附地菜在SO2浓度为5.71 mg·m-3下主脉两侧出现细胞组织坏死,并随着SO2浓度的升高坏死面积也逐渐加大,在最高SO2浓度17.14 mg·m-3处理下伤害面积达到了总叶片面积的45%;随着SO2浓度的增加,绵毛水苏的叶片受到了更严重的伤害,在17.14 mg·m-3最高SO2浓度处理下出现大面积坏死区域,叶片受伤害率高达45%。可见,从植物表型上可以初步判断蜂斗菜对SO2胁迫的抗性最强,峨眉附地菜其次,绵毛水苏最弱。
2.2SO2熏气处理对地被植物叶片总叶绿素含量的影响
随着SO2处理浓度的增加,3种地被植物叶片的总叶绿素(叶绿素a+b)含量都呈现逐渐下降趋势,但每种植物叶片叶绿素含量下降幅度不同(图2)。其中,绵毛水苏叶片叶绿素含量在SO2浓度为11.43 mg·m-3时骤然下降,在SO2最高浓度17.14 mg·m-3处理下比对照(0 mg·m-3)显著下降了40.5%;随着SO2浓度的升高,蜂斗菜和峨眉附地菜叶绿素含量逐渐缓慢下降,在SO2最高浓度17.14mg·m-3处理下比对照分别降低了29.6%和20.8%。可见,SO2熏气处理对3种地被植物叶片总叶绿素含量均产生显著抑制作用,且绵毛水苏的反应更敏感,下降幅度较大。

表1 各水平SO2 处理下3种植物叶片伤害率
注:伤害率=伤害面积/叶片总面积。
Note:Injury rates=Injury area/total leaf area.

图1 3种地被植物在不同浓度SO2处理7 d后的叶片受伤害症状

短线表示标准差(n=12);不同字母表示各处理间
2.3SO2熏气处理对地被植物叶片膜脂过氧化程度的影响
首先,随着SO2处理浓度的升高,3种地被植物叶片的叶液pH值均呈下降趋势,与对照相比差异均达到显著水平(P<0.05),但降低幅度不同(图3,A)。其中,随着SO2处理浓度的增加,绵毛水苏的叶液pH急剧下降,各处理叶液pH值比对照降低6.07%~14.24%,且处理间差异显著;而蜂斗菜和峨眉附地菜的叶液pH值下降缓慢,各处理分别比对照降低1.77%~2.67%和3.62%~5.63%,但处理间大多差异不显著。
其次,3种地被植物叶片相对电导率随着SO2浓度的增加而逐渐上升,且绵毛水苏上升幅度远大于峨眉附地菜和蜂斗菜(图3,B)。在最高SO2浓度17.14 mg·m-3处理下,绵毛水苏、峨眉附地菜和蜂斗菜叶片相对电导率均达到最高值,它们分别比相应对照显著增加了241.9%、122.1%和114.9%(P<0.05)。
同时,3种地被植物叶片MDA含量都随着SO2浓度的增加而迅速上升,上升幅度最大的是绵毛水苏,其次是峨眉附地菜,最小的是蜂斗菜(图3,C)。在SO2最高浓度17.14 mg·m-3处理下,绵毛水苏、蜂斗菜和峨眉附地菜叶片MDA含量分别比对照显著高出192.8%、68.8%和153.2%(P<0.05)。以上结果说明绵毛水苏在SO2胁迫下膜脂过氧化最严重,蜂斗菜最轻,对SO2抗性为蜂斗菜>峨眉附地菜>绵毛水苏。
2.4SO2熏气处理对地被植物对叶片抗氧化酶活性的影响
不同浓度的SO2处理激活了3种地被植物叶片抗氧化酶SOD、PAD和CAT的活性(图4)。其中,蜂斗菜和峨眉附地菜叶片的SOD活性随着SO2处理浓度的增加均呈现逐渐上升趋势,而绵毛水苏则表现出先升后降的趋势,并在SO2处理浓度11.43 mg·m-3下达到最高值,但各处理均高于对照;蜂斗菜、峨眉附地菜、绵毛水苏叶片的SOD活性最高值分别比相应对照显著增加59.23%、86.69%、25.40%(图4,A)。同时,随着SO2处理浓度的增加,3种地被植物叶片的POD活性均呈现直线上升趋势,蜂斗菜、绵毛水苏、峨眉附地菜在SO2最高浓度17.14 mg·m-3处理下分别比对照显著增加了209.7%、75.4%、72.8%(图4,B)。另外,随着SO2处理浓度的增加,3种植物叶片的CAT活性也呈现逐渐上升趋势,其中上升幅度最大的为峨眉附地菜,其次为蜂斗菜,最小的为绵毛水苏,它们在最高SO2浓度下分别比对照显著增加95.91%、317.66%、78.68%(图4,C)。以上结果说明蜂斗菜与峨眉附地菜能在SO2胁迫下通过增高抗氧化酶活性来抵抗不良环境,所以蜂斗菜与峨眉附地菜对SO2抗性大于绵毛水苏。
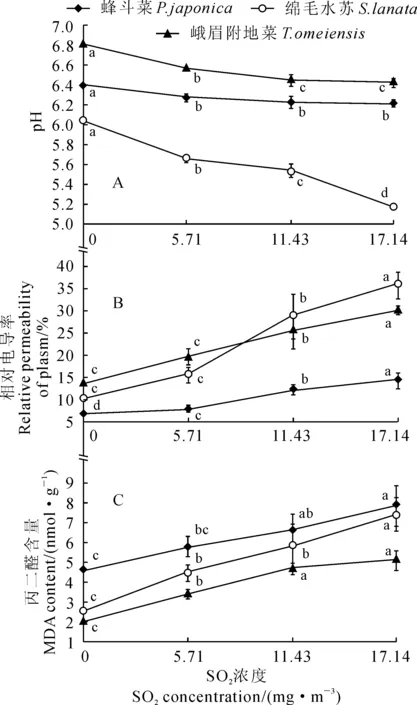
图3 SO2处理下3种地被植物的叶液pH值、
2.5SO2熏气处理对地被植物叶片渗透调节物质含量的影响
随着SO2处理浓度的增加,3种植物叶片可溶性糖含量呈现逐渐上升趋势,但是上升幅度不同(图5,A)。其中,在SO2浓度超过5.71 mg·m-3后,蜂斗菜和峨眉附地菜急剧上升,而绵毛水苏仍缓慢上升;在最高SO2浓度17.14 mg·m-3处理下,蜂斗菜、峨眉附地菜和绵毛水苏叶片可溶性糖含量分别比对照显著增加了149.0%、208.8%和96.9%(P<0.05)。同时,3种植物叶片的脯氨酸含量随着SO2处理浓度的增加也都呈现直线上升趋势(图5,B),在SO2最高浓度17.14 mg·m-3处理下,蜂斗菜、峨眉附地菜和绵毛水苏同对照相比分别显著增加了37.8%、93.7%和86.9%(P<0.05)。可见,各浓度SO2熏气处理均能诱导3种地被植物叶片渗透调节物质含量不同程度增加,且浓度越大效果越明显,并以峨眉附地菜升幅最大。
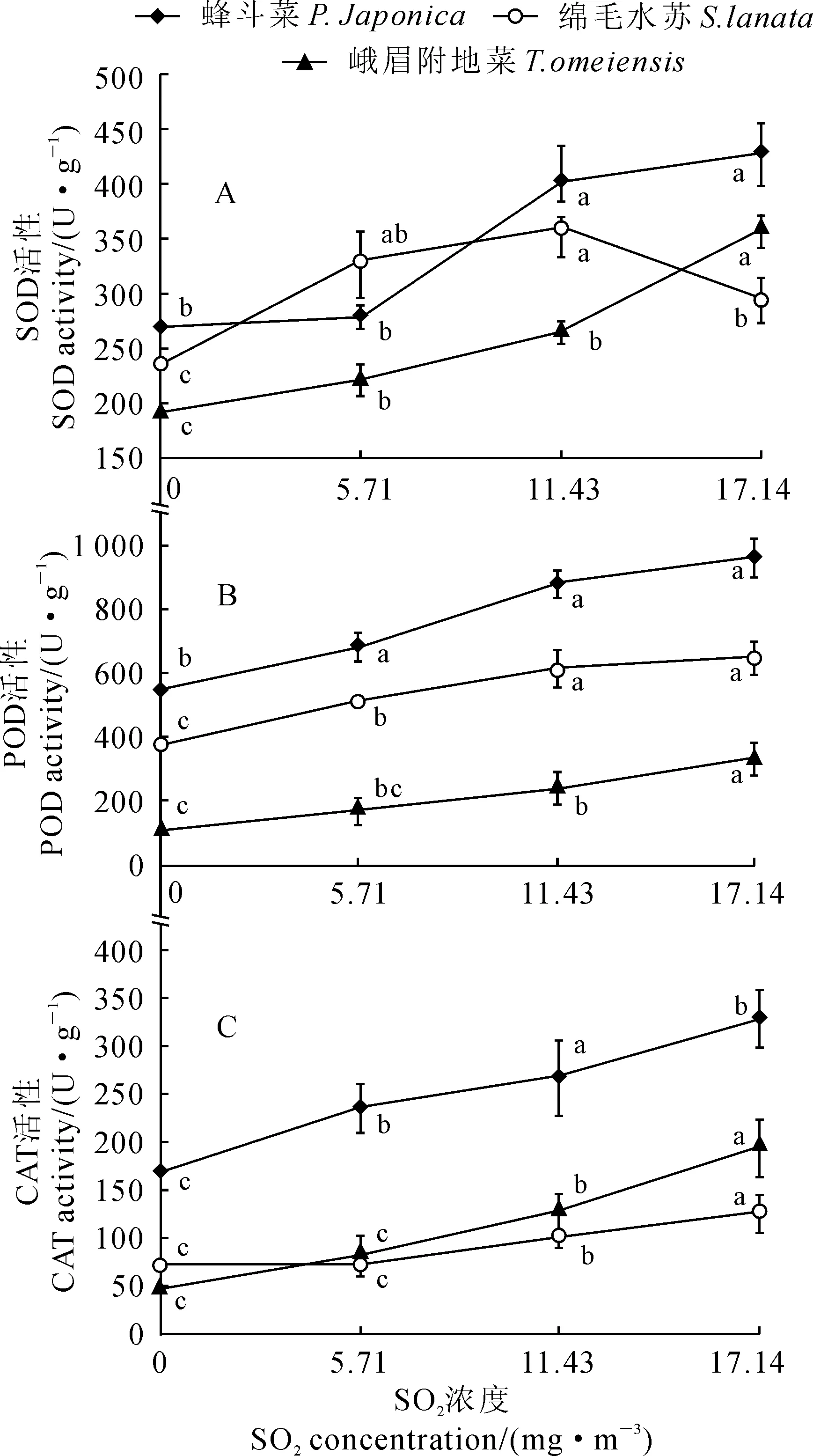
图4 SO2处理下3种地被植物叶片SOD、
2.63种地被植物对SO2净化能力的比较
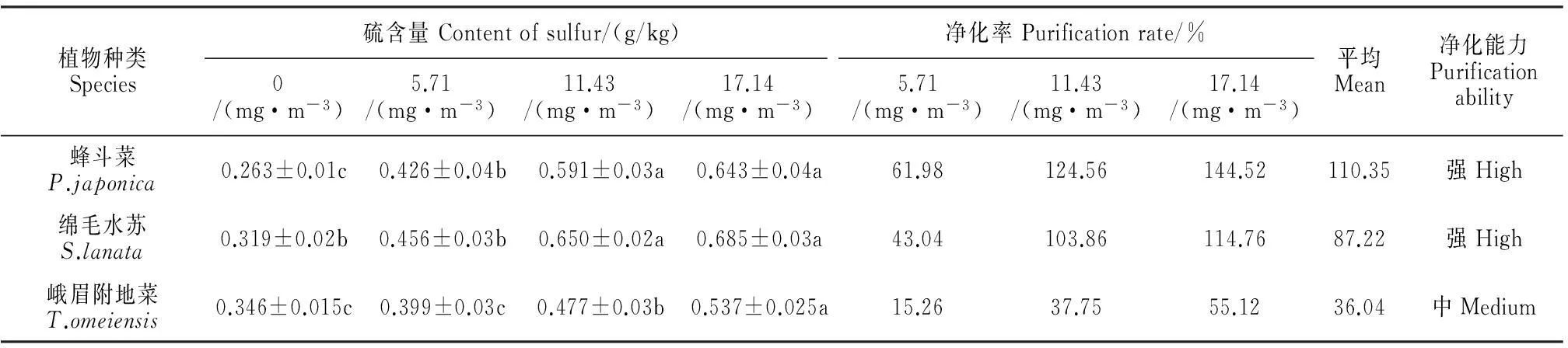
从表2可以看出,在SO2处理浓度从5.71 mg·m-3增加到11.43 mg·m-3时,3种植物叶片的含硫量都骤然增加,而随着SO2浓度的继续增加,叶片含硫量没有再显著增加,但是仍然在最高浓度17.14 mg·m-3下达到峰值(图6);与对照相比,3种植物的叶片含硫量在最大浓度下分别显著增加了144.4%、114.6%和55.3%;3种植物叶片吸硫量的顺序为绵毛水苏>蜂斗菜>峨眉附地菜。

图5 SO2处理下3种植物的叶片中可溶性糖
本试验中,植物对S的净化能力的计算参照张德强等[12]的方法,将熏气处理叶片含硫量比对照高40%以上的植物划分为净化能力强,介于20%~40%的净化能力中等,低于20%净化能力弱。表2结果表明,蜂斗菜、绵毛水苏和峨眉附地菜的平均净化率分别为110.35%、87.22%和36.04%。可见,蜂斗菜和绵毛水苏均为对空气S的净化能力强的植物,而峨眉附地菜的净化能力为中等。3种植物净化SO2能力顺序从高到低依次为蜂斗菜、绵毛水苏和峨眉附地菜。
2.73种地被植物对SO2的抗性能力及光合参数
植物在受到逆境时生理变化是错综复杂的,用一个生理指标很难评定其抗逆能力,测定多个生理指标,并对其进行模糊数学隶属函度公式进行定量转化,除了丙二醛与细胞膜透性用反隶属函数计算,其余指标均用隶属函数计算[23]。但多个生理指标之间存在重叠作用,因此用主成分分析法将9个评定指标化为不重叠的2个综合指标,对其进行综合分析,指标为:

图6 SO2处理对3种植物叶片硫含量的影响
植物种类Species硫含量Contentofsulfur/(g/kg)0/(mg·m-3)5.71/(mg·m-3)11.43/(mg·m-3)17.14/(mg·m-3)净化率Purificationrate/%5.71/(mg·m-3)11.43/(mg·m-3)17.14/(mg·m-3)平均Mean净化能力Purificationability蜂斗菜P.japonica0.263±0.01c0.426±0.04b0.591±0.03a0.643±0.04a61.98124.56144.52110.35强High绵毛水苏S.lanata0.319±0.02b0.456±0.03b0.650±0.02a0.685±0.03a43.04103.86114.7687.22强High峨眉附地菜T.omeiensis0.346±0.015c0.399±0.03c0.477±0.03b0.537±0.025a15.2637.7555.1236.04中Medium
注:数值表示为平均值±标准差形式(n=12);同行不同字母表示处理间在0.05水平存在显著性差异。
Note:The values are mean±standard deviation(n=12);Different letters in the same row indicate the significant differences among the SO2treatments at 0.05 level.
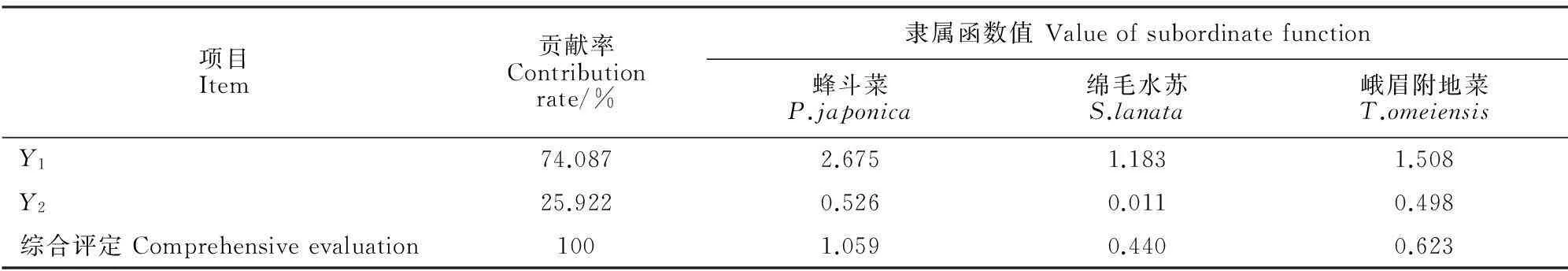
表3 3种地被植物对SO2抗性的综合评定

表4 未熏气情况下3种植物的光合参数
Y1=0.831X1-0.943X2-0.994X3+0.979X4+0.042X5+1.0X6+0.421X7+0.998X8+0.983X9
Y2=0.556X1+0.333X2-0.109X3+0.206X4+0.999X5-0.001X6-0.907X7+0.065X8-0.185X9
其中,X1~X9依次为叶绿素(a+b)含量、电导率、丙二醛含量、可溶性糖含量、游离脯氨酸含量、SOD活性、POD活性、CAT活性和叶液pH的隶属函数值,Y1为综合指标1,Y2为综合指标2。
如表3所示,将综合指标Y1与Y2分别乘以其贡献率再求其平均值,得出相应的综合评定结果。结果表明,3种地被植物对SO2胁迫的抗性顺序为蜂斗菜>峨眉附地菜>绵毛水苏。
前人的研究表明,植物对SO2的抗性同其净光合速率有关[12]。从表4中可以看出,这3种地被植物净光合速率从高到低的顺序为绵毛水苏>峨眉附地菜>蜂斗菜,即它们的净光合速率与其对SO2的抗性呈反比;另外,3种植物中绵毛水苏的叶片蒸腾速率最高,气孔导度介于峨眉附地菜和蜂斗菜之间,从这些结果可以推断绵毛水苏同外界交换气体的能力要强于其他2种植物。
3讨论
前人的研究已表明,在同种污染环境条件下,不同植物对SO2的吸收能力存在着显著差异[13,24-25],同时同种植物在不同的污染环境下,SO2的吸收具有累积性,净化能力与大气环境中的SO2浓度有关系[12,26]。本试验的研究结果也表明经SO2处理后,参试的3种植物对硫的净化能力存在着差异,而且不同的SO2浓度下,其吸收硫的能力也不同,它们对SO2的净化能力从高到低依次为蜂斗菜>绵毛水苏>峨眉附地菜。从SO2胁迫下叶片受伤害的程度结合利用各项生理指标对SO2抗性的综合评定结果来看,3种植物对SO2的抗性能力从高到低的顺序依次为蜂斗菜>峨眉附地菜>绵毛水苏,这些结果表明植物对SO2吸收能力与其抗性不完全一致。本试验中,3种植物正常条件下的净光合速率从高到低的顺序为绵毛水苏>峨眉附地菜>蜂斗菜,这一结果正好与它们对SO2的抗性相反。从这些结果可以推断,硫抗性弱的物种有较高的净光合速率和较强的净化率,说明这些物种同外界的气体交换能力要强一些,叶片吸收的硫也要多一些,这一结论也被张德强等的研究结果所支持[12];蜂斗菜在这3种植物中净光合速率最低,但是叶片中含硫量最高,从这一结果可以推断植物叶片对SO2的净化能力不仅同叶片吸硫量有关,而且同硫在体内的转化和合成,以及其叶片气孔结构和数量、角质层的厚薄有关,也同植物本身在SO2胁迫下其他生理生化过程的变化相关。综上所述,净光合速率可以作为判断植物对SO2抗性能力强弱的一个指标。
也有研究表明在SO2胁迫下pH值也是一个变化明显的指标,因为植物叶片经气孔吸收SO2后通过水合作用生成酸性HSO3-或SO32-,使叶片细胞液pH值降低,进而影响细胞正常的生命代谢活动[5,10]。本研究结果表明,在供试的3种植物中,随着SO2胁迫浓度的升高,绵毛水苏叶液pH值下降最快,其次是峨眉附地菜,叶液pH值变化幅度最小的为蜂斗菜。从此可以推测在SO2胁迫下蜂斗菜的叶片具有较大的缓冲能力,其细胞能维持相对稳定的pH环境,有利于新陈代谢的正常进行,这也可能是其SO2抗性强的一个原因。前人在筛选对SO2抗性强的木本植物上也发现,抗性强的植物其叶液pH值变化幅度较小[11,27]。从这些结果可以推断叶液pH值也可以作为评价SO2抗性能力强弱的一个指标。
SO2胁迫也会引起植物膜脂过氧化,而MDA是植物膜脂过氧化物的重要产物,其含量与代表质膜透性的叶片相对电导率呈正相关,与植株受伤害程度呈正相关[28]。本试验结果显示,随着SO2处理浓度的增加,3种植物叶片的MDA含量和相对电导率都有不同程度的升高。抗性强的蜂斗菜叶片的MDA含量和相对电导率升高最为缓慢,而抗性弱的绵毛水苏随着胁迫浓度的增加而急剧增加。这些结果表明在高浓度的SO2胁迫下,由于蜂斗菜自身调节能力较强,其细胞膜受到的伤害程度远低于绵毛水苏。这一结果也同前人在其他植物上的相关研究相符合[13,29]。SO2胁迫下植物受到的伤害一般来自于胁迫产生的大量活性氧,SOD、POD、CAT是细胞抵御活性氧伤害的主要保护酶类,在逆境状态下被激活。随着SO2胁迫浓度的升高,本研究中3种植物的SOD、POD、CAT活性都有不同程度升高,这3种酶上升幅度最快的就是蜂斗菜,表明其本身清除活性氧的能力最强。此外,在SO2胁迫条件下,植物的自身保护系统渗透调节机制被激活,植物体内的渗透调节物质可溶性糖和脯氨酸都会有不同程度的增加[30-32]。本试验研究表明,随着SO2浓度的升高,3种植物游离脯氨酸和可溶性糖含量均呈现不同幅度上升,其中抗性最强的蜂斗菜中这些渗透调节物质上升幅度最大,而抗性最弱的绵毛水苏上升幅度最小,前人在其他植物对SO2的抗性研究也支持这个结论[33-34]。
此外,叶绿素是植物进行光合作用最重要的一类色素,其含量由于受到SO2逆境的胁迫而导致代谢紊乱,可能通过对叶绿素的漂白作用导致其含量下降[29,35-36]。本试验结果显示,随着SO2胁迫浓度的升高,3种植物的叶绿素含量都有不同程度下降,并以抗性最弱的绵毛水苏下降幅度最大,而蜂斗菜和峨眉附地菜叶绿素下降幅度要小很多。从这一结果可以推断抗性弱的绵毛水苏其正常的细胞代谢在高浓度的SO2胁迫下受到了极大的干扰。
综上所述,许多生理生化指标均与植物的抗SO2能力相关,在本试验的3种植物中,净光合速率最高,SO2胁迫下叶液pH值降低幅度最大的绵毛水苏是抗性最弱的一种,即净光合速率和叶液pH值可以作为评价植物对SO2抗性的优先指标。3种植物中蜂斗菜对SO2的抗性和吸收能力都强,暗示着植物对SO2的净化能力的高低不仅同叶片的含硫量有关,同时也与植物体内S的转化和吸收相关。对SO2的抗性和吸收能力都强的蜂斗菜是我们在城市园林绿化中能作为净化大气SO2污染的首选地被植物。
参考文献:
[1]王学府,狄红梅,曹秋芬.二氧化硫对植物生理特性影响的研究进展[J].山西农业科学,2014,42(4):422-424.
WANG X F,DI H M,CAO Q F.Studies on effects of sulfur dioxide on physiological indexes changes in plants[J].JournalofShanxiAgriculturalSciences,2014,42(4):422-424.
[2]KHAN M W,KHAN M R.Relationship of Plant Pathogenic Microbes with Air Pollution[M]//MUKERJI K G,SING V P.Frontiers in Applied Microbiology (IV).Meerut,India,Rastogi Publishers,1993,:114-125.
[3]DARRALL N M.The effect of air pollutants on physiological processes in plants[J].PlantCellEnviron,1989,12:1-30.
[4]OMASA K,SAJI H,YOUSSEFIAN S,etal.Air Pollution and Plant Biotechnology[M].Tokyo:Springer-Verlag,2002:45.
[5]SINGH L P,GILL S S,GILL R,etal.Mechanism of Sulfur Dioxide Toxicity and Tolerance in Crop Plants[M].Wiley-VCH Verlag GmbH & Co.KGaA,2012:133-137.
[6]刘静.二氧化硫衍生物对植物的氧化损伤效应[D].太原:山西大学.2006.
[7]张华.玉米亚硫酸氧化酶基因(ZmSO)在二氧化硫胁迫下的功能分析[D].郑州:河南农业大学.2012.
[8]VARSHNEY C.K,BOCA RATON F L,GARG J K.Plant response to sulfur dioxide,in critical reviews in environmental control[M].CRC Press,1979:27-29.
[9]张翠萍,温琰茂.大气污染植物修复的机理和影响因素研究[J].云南地理环境研究,2005,17(6):82-85.
ZHANG C P,WEN Y M.The mechanism and influence factor of phytoremediation in air pollution[J].YunnanGeographicEnvironmentRresearch,2005,17(6):82-85.
[10]李彦慧.李属彩叶树种耐SO2机制研究[D].河北保定:河北农业大学,2008.
[11]种培芳,苏世平.种金色叶树木对SO2胁迫的生理响应[J].生态学报,2013,33(15):4 639-4 648.
CHONG P F,SU S P.Physiological responses of four golden-leaf trees to SO2stress[J].ActaEcologicaSinica,2013,33(15):4 639-4 648.
[12]张德强,孔国辉,温达志,等.园林绿化植物的抗性及其对SO2和Pb净化能力分析[J].广州环境科学,2003,(18):22-25.
ZHANG D Q,KONG G H,WEN D ZH,etal.Analysis of the resistance on air pollution and purification on sulfur dioxide(SO2) and lead(Pb) of gardens plants[J].GuangzhouEnvironmentalSciences,2003,(18):22-25.
[13]王丽华,李西,刘尉,等.4种暖季型草坪草对SO2的抗性及净化能力的比较[J].草业学报,2013,22(1):225-233.
WANG L H,LI X,LIU W,etal.A study on resistance and purifying ability of SO2on four warm-season turfgrasses[J].ActaPrataculturaeSinica,2013,22(1):225-233.
[14]孙守家.玫瑰花蕾采后衰老机理研究[D].山东泰安:山东农业大学,2013.
[15]宋凤鸣,葛秀春.活性氧及膜脂过氧化与棉花对枯萎病抗性的关系[J].植物病理学报,2001,31(2):110-116.
SONG F M,GE X C.The roles of active oxygen species and lipid peroxidation in the resistance of cotton seedlings to fusarium wilt[J].ActaPhytopathologicaSinica,2001,31(2):110-116.
[16]郝建军,康宗利.植物生理学实验技术[M].北京:化学工业出版社.2007:79-81.
[17]郝再彬,苍晶,徐仲.生理实验[M].哈尔滨:滨哈尔滨工业大学出版社.2004:190-193.
[18]杨明明.SO2和Cl2及复合胁迫对茶条槭非酶类保护剂生理代谢的影响[D].长春:吉林农业大学,2011.
[19]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:164-165.
[20]郑炳松.现代植物生理化研究技术[M].浙江:浙江大学出版社,2006:269-271.
[21]杨玉珍.不同绿化树种抗氟性机理研究[J].河南农业大学学报,1999,33(1):82-86.
YANG Y Z.Fluoride resistance mechanism of different trees[J].ActaAgriculturaeUniversitatisHenanensis,1999,33(1):82-86.
[22]吴名剑,孙贤军,雷启福,等.硫酸钡溶胶比浊法测定烟草中的硫[J].烟草科技,2005,(1):24-26.
WU M J,SUN X J,LEI Q F,etal.Determination of sulfur in tobacco with barium sulphate turbidimetry[J].TobaccoScience&Technology/TobaccoChemistry,2005,(1):24-26.
[23]孙凌霞,张峻铭,蔡仕珍.南方红豆杉对二氧化硫胁迫的生理响应[J].生态学杂志,2014,33(7):1 811-1 817.
SUN L X,ZHANG J M,CAI S Z.Physiological responses ofTaxuschinensisvar.maireito SO2stress[J].ChineseJournalofEcology,2014,33(7):1 811-1 817.
[24]潘文,张卫强,张方秋,等.广州市园林绿化植物苗木对二氧化硫和二氧化氮吸收能力分析[J].生态环境学报,2012,21(4):606-612.
PAN W,ZHANG W Q,ZHANG F Q,etal.Decontamination ability of sulfur dioxide and nitrogen dioxide for 38 young landscaping plants in Guangzhou City[J].EcologyandEnvironmentSciences,2012,21(4):606-612.
[25]陈卓梅,李庆荣,杜国坚,等.浙江省42种园林绿化植物对SO2气体的抗性及吸收能力研究[J].浙江林业科技,2007,27(6):29-34.
CHEN Z M,LI Q R,DU G J,etal.Resistance and absorbency to gaseous SO2of 42 landscaping plants in Zhejiang[J].JournalofZhejiangForestryScienceandTechnology,2007,27(6):29-34.
[26]朱凤荣,朱南.几种绿化树种叶片含硫量分析[J].北方园艺,2012,(24):61-63.
ZHU F R,ZHU N.Analysis on foliage sulfur content in several afforestation trees[J].NorthernHorticulture,2012,(24):61-63.
[27]刘楠,温学,孔国辉.抗SO2绿化植物的初步筛选[J].热带亚热带植物学报,2003,11(4):364-371.
LIU N,WEN X,KONG G H.Preliminary selection of plants with high resistance to SO2for urban greening[J].JournalofTropicalandSubtropicalBotany,2003,11(4):364-371.
[28]钱永常,余叔文.SO2对植物的氧化作用和植物的抗氧化作用[J].植物生理学通讯,1991,27(5):3 326-3 331.
QIAN Y C,YU S W.Oxidation of sulfur dioxide on plants and anti-oxidation of plants[J].PlantPhysiologyCommunications,1991,27(5):3 326-3 331.
[29]胡丁猛,孙明高,王太明.SO2对3种园林绿化苗木叶片膜脂过氧化和保护酶的影响[J].山东农业大学学报·自然科学版,2005,36(2):175-180.
HU D M,SUN M G,WANG T M,etal.Effect of sulfur dioxide stress on membrane lipid peroxidation and protective enzymes of three ornamental tree seedlings[J].JournalofShandongAgriculturalUniversity(Nat.Sci.Edi.)2005,36(2):175-180.
[30]夏宗良,薛瑞丽,武轲,等.二氧化硫胁迫对不同抗性玉米幼苗活性氧代谢的影响[J].生态环境学报,2010,19(5):1 078-1 081.
XIA Z L,XUE R L,WU K,etal.Effects of sulfur dioxide stress on reactive oxygen species metabolism of maize seedlings with contrasting tolerance[J].EcologyandEnvironmentalSciences,2010,19(5):1 078-1 081.
[31]NOUCHI I.Responses of Whole Plants to Air Pollutions[M]//OMASA K.Air Pollution and Plant Biotechology.Tokyo:Springer-Verlag,2002:4-8.
[32]刘世鹏,刘济明,陈宗礼,等.模拟干旱胁迫对枣树幼苗的抗氧化系统和渗透调节的影响[J].西北植物学报,2006,26(9):1 781-1 787.
LIU S P,LIU J M,CHEN Z L,etal.Effects of simulated drought on antioxidative enzymes and osmotic regulation inZizyphusjujubaseedlings[J].ActaBot.Boreal.-Occident.Sin.,2006,26(9):1 781-1 787.
[33]韩亚琦,李向应,李彦慧,等.紫叶矮樱对二氧化硫胁迫的生理响应[J].北方园艺,2012,(16):51-53.
HAN Y Q,LI X Y,LI Y H,etal.Physiological responses ofPrunus×cistena‘Pissardii’ under SO2stress[J].NorthernHorticulture,2012,(16):51-53.
[34]滕雁梅.城市大气污染的植物修复进展研究综述[J].黑龙江农业科学,2008,(6):164-66.
TENG Y M.The study on phytoremediation of urban air pollution[J].HeilongjiangAgriculturalSciences,2008,(6):64-66.
[35]吕海强,刘福平.化学性大气污染的植物修复与绿化树种选择[J].亚热带植物科学,2003,32(3):73-77.
LÜ H Q,LIU F P.A review of phytoremediation to chemical air pollution and plant species selection for greening[J].SubtropicalPlantScience,2003,32(3):73-77.
[36]李庆杰.大气污染对植物的影响与对策[J].岱宗学刊,2007,(3):45-46.
LI Q J.The impact of air pollution on plants and countermeasures[J].DaizongJournal,2007,(3):45-46.
(编辑:裴阿卫)
Physiological Responses of Three Ground Cover Plants under Sulfur Dioxide Stress
YANG Xiaoxiao,YANG Dan,FANG Huanhuan,LI Xi,HU Qi,SUN Lingxia*
(College of Landscape Architecture,Sichuan Agricultural University,Chengdu 611130,China)
Abstract:Ground cover plants are one of the essential landscape plant species among the current urban greening,and understanding the physiological mechanism of these plants resistance to sulfur dioxide (SO2) can help us choose the suitable species.In this study,three ground cover plant species (Petasites japonica,Stachys lanata and Trigonotis omeiensis) growing under the greenhouse condition were selected and screened for tolerance to acute SO2injury.Four SO2treatments including 0,5.71,11.43,and 17.14 mg·m-3were used in this study,and release of SO2were achieved using the artificial simulated fumigation method.Differential response to SO2injury among these three species was manifested through the phenotypic injuries and the various physiological indexes.Our results showed that:(1)the phenotypic injury of three species is ordered in sequence from severe to light as S.lanata>T.omeiensis>P.japonica.The content of chlorophyll and the value of leaf pH decreased gradually with the increase of SO2concentration,while the levels of MDA content,the electrolyte leakage rate,and the contents of soluble sugar and the proline rose in the varying degree among the three species.Furthermore,the activities of superoxide dismutase(SOD),peroxidase(POD),catalase(CAT) were activated dramatically.(2)Through the subordination function and principal component analysis,we concluded that the resistance to SO2among these three species is ordered in sequence from high to low as P.japonica>T.omeiensis>S.lanata.(3)The purification ability to SO2is ranked in order from high to low as P.japonica>S.lanata>T.omeiensis by analogizing sulfur accumulation within leaf under SO2stress.The results shows that P.japonica has the strongest capacity of resistance and purification of SO2and it can also has no obvious phenotypic injury through its own stress protection system to improve resistance to SO2.This conclusion can guide us in respect of large-scale use of P.japonica in heavily SO2-polluted urban areas.
Key words:ground cover plants;resistance to sulfur dioxide;purification ability;physiological response
中图分类号:Q945.79
文献标志码:A
作者简介:杨晓晓(1990-),女,在读硕士研究生,主要从事园林植物抗性生理研究。E-mail:scnydxblanch@163.com*通信作者:孙凌霞,博士,副教授,硕士生导师,主要从事园林植物培育与应用研究。E-mail:sunlingxiasicau@foxmail.com
基金项目:四川省教育厅基金(13ZB0289);四川农业大学双支计划
收稿日期:2015-10-27;修改稿收到日期:2016-01-15
文章编号:1000-4025(2016)02-0361-09
doi:10.7606/j.issn.1000-4025.2016.02.0361

