油松根际外生菌根真菌龟裂秃马勃的分离鉴定及培养
张好强,余红霞,唐 明
(西北农林科技大学 林学院 陕西杨陵 712100)
油松根际外生菌根真菌龟裂秃马勃的分离鉴定及培养
张好强,余红霞,唐明*
(西北农林科技大学 林学院 陕西杨陵 712100)
摘要:该研究采用组织分离法对黄土高原子午岭林区连家砭林场油松根际外生菌根真菌进行了分离,并采用ITS序列对分离的真菌进行鉴定,研究了菌根真菌的培养条件,为菌剂的生产奠定基础。结果表明:子午岭林区油松根际分离培养出的真菌为龟裂秃马勃(Handkea utriformis),能够与油松形成外生菌根。采用MMN培养基为基础培养基,纯培养条件下,龟裂秃马勃生长的最适pH为6.0,最适温度为25 ℃。以蔗糖为唯一碳源的培养基中龟裂秃马勃生长速度最快,其次是麦芽糖和葡萄糖,生长最慢的为乳糖,在以几丁质和碳酸氢钠为碳源的培养基上不生长。有机氮源中,对脯氨酸为唯一氮源的利用能力最好,其次是酪蛋白,尿素最差;无机氮源中,以磷酸氢二铵为唯一氮源时生长最好,其次是硝酸钙,最差为酒石酸铵。该研究首次报道了黄土高原子午岭林区外生菌根真菌龟裂秃马勃,并初步确定了其最佳培养条件。
关键词:龟裂秃马勃;外生菌根真菌;黄土高原子午岭林区;最佳培养条件
外生菌根(ectomycorrhiza,ECM)是林木最重要的菌根类型[1],广泛分布于全球范围内多种林木树种[2]。基于分类学和生态学的调查,2%~3%的陆生植物能够与ECM真菌形成外生菌根[3-4],其中包括许多重要的生态和经济林木,如松科、壳斗科、桦木科、南青冈科、龙脑香科和苏木科的林木[5]。ECM可以增加宿主植物根系的吸收面积,提高植物对土壤营养的吸收和利用,促进植物生长,改善植物在逆境条件下的适应性以及增强宿主植物的抗逆性,提高逆境条件下宿主植物的成活率[1,5]。
ECM真菌的分离和纯化是室内和野外研究ECM真菌的前提和基础。不同ECM真菌生长的最适pH、温度、碳源和氮源不尽相同[6-9]。由于ECM真菌与林木之间复杂的共生关系,其共生机理涉及到的代谢产物等很多方面都不明确,许多ECM真菌的分离培养比较困难。因此,探索ECM真菌的生物学特性、配制合适的培养基等就成为ECM真菌分离培养成功与否的关键[1]。
油松(Pinustabulaeformis)为中国暖温带森林主要建群种,在黄土高原子午岭林区目前存在唯一保存较为完整的天然次生林,同时存在有超过53 000 hm2的人工纯林[10]。油松对ECM有很强的依赖性并能够与多种真菌形成共生关系[1,11-12],然而目前针对子午岭林区油松根际ECM真菌的研究相对匮乏。本研究首次在子午岭林区油松林采集真菌子实体进行分离、鉴定,并将所得真菌回接油松检测能否成功定殖于油松根系,形成外生菌根。在此基础上,纯培养条件下研究ECM真菌生长的环境因子(温度和pH),以及营养因子(碳源和氮源),确定适宜ECM真菌生长的最佳条件,为ECM真菌菌丝体的扩繁和菌剂生产奠定基础。
1材料和方法
1.1野外真菌的采集与培养
1.1.1采样地概述研究区位于甘肃省合水县连家砭林场(108°10′~109°18′E,35°03′~36°37′N),坐落在黄土高原子午岭林区北部。该地区为黄土高原丘陵沟壑区,属中温带半干旱大陆性季风气候。海拔1 211~1 453 m,年均气温7.4 ℃,年均降雨量587.6 mm。近来年,人工林面积持续增加,其中油松人工林的覆盖面积约为53 000 hm2,占人工林总面积的81%。最常见的伴生树种为辽东栎(Quercusliaotungensis)、山杨(Populusdavidiana)和虎榛子(Ostryopsisdavidiana)[13]。
1.1.2样品采集及真菌分离2010年8月中下旬,在研究区利用路线调查和随机踏查相结合的方法,在油松林下裸露油松根系,寻找大型真菌子实体,进行摄影、记录特征,并小心沿着子实体上的菌索挖至根系,以初步确定是否为ECM真菌,然后小心采集子实体,做好标记,用吸水纸包好装入冰盒带回实验室,48 h内进行分离。用以提取DNA的子实体置于-20 ℃冰箱备用。
真菌分离采用组织分离法,将子实体表面消毒后,无菌操作取新鲜菌肉4 mm3置于培养基上,分离培养基为PDA和MMN[1],每1 000 mL培养基中加入3 mL乳酸和0.06 g链霉素。分离后将培养皿放入25 ℃恒温箱中暗培养。
1.1.3真菌鉴定取纯培养菌丝体、新鲜子实体和成熟风干子实体孢子粉进行ITS序列分析。真菌基因组DNA采用CTAB法提取[14]。真菌ITS序列使用ITS1-F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增[15]。PCR采用50 μL体系,其中包括0.5 μLTaq酶(5 U/μL),2 μL DNA模板,4 μL dNTP mixture (2.5 mmol/L),1 μL引物ITS1-F和ITS4 (10 μmol/L),5 μL 10倍PCR buffer (Mg2+free),4 μL Mg2+(25 mmol/L)和32.5 μL ddH2O。PCR条件为:94 ℃预变性3 min;35个循环,95 ℃变性45 s,55 ℃退火55 s,72 ℃延伸45 s;最终72 ℃延伸10 min。取PCR产物5 μL,在1%琼脂糖凝胶电泳(100 V,30 min)检测。PCR产物送至上海生工生物工程公司进行双向测序。
将获得的ITS序列提交到GenBank数据库后,在线运用BLAST工具进行同源比对,并从NCBI下载GenBank数据库内已知同源序列。使用序列构建软件Clustal X 1.81和MEGA(Version 5.05)进行对比分析,用Neighbor-Joining法构建系统发育树,Kimura-two-parameter模型计算遗传距离,1 000次随机抽样,计算Bootstrap值以评估系统发育树的置信度[16]。
1.2培养真菌回接油松
1.2.1接种真菌培养将分离和纯化的菌株接种到MMN培养基上,25 ℃培养箱内暗培养14 d后,接种时用内径1 cm的打孔器沿菌落边缘打菌饼。
1.2.2育苗油松种子(陕西省林业厅林业技术推广总站提供)用10% H2O2消毒20 min,无菌水冲洗数次后45 ℃浸泡6~7 h。消毒种子转移到铺有灭菌纱布的托盘中,25 ℃培养箱中催芽,每天早晚用水冲洗1次,待种子发芽后播入孔穴盘(灭菌蛭石)育苗。4周后挑选长势一致的油松苗移栽。
1.2.3接种油松栽培基质为河沙、土和蛭石(2∶2∶1,V/V/V)混合物,高温高压蒸汽灭菌(121 ℃,0.1 Mpa)2 h,放置7 d后使用。将油松苗移栽至一次性纸杯(含120 g栽培基质)每杯1株,同时取ECM真菌的菌饼4个放置在幼苗根系周围。
1.2.4培养将接种ECM真菌的幼苗放入人工气候箱(RQH-250,上海精宏)中培养,培养箱参数设置如下:14 h光照/d,25 ℃;无光照10 h/d,20 ℃;空气湿度60%。
1.2.5检测培养8周后,取油松根用流水洗掉表面土后,在体视显微镜下观察根的形态、颜色,并拍照。将根剪成长约1 cm根段,染色后显微镜下观察根内及根外菌丝形态[5]。
1.3不同培养条件对ECM真菌生长的影响
1.3.1生长速度测定在MMN固体培养基上活化ECM真菌,用内径为0.5 cm的灭菌打孔器在菌落边缘打取菌饼,接种到另一MMN培养基(直径9.0 cm,20 mL/皿)中央,25 ℃恒温暗培养,每2 d用游标卡尺通过十字交叉法测量菌落直径,连续记录28 d。
1.3.2pH对生长的影响在250 mL的三角瓶中加入100 mL MMN液体培养基,用1 mol/L HCl或1 mol/L NaOH分别调整pH为3、4、5、6、7和8,然后在121 ℃、0.1 MPa条件下灭菌20 min。MMN液体培养基冷却后接种1个0.5 mm直径菌饼,25 ℃恒温震荡(120 r/min)培养14 d。菌丝用连接有布氏漏斗的真空泵抽滤获得后80 ℃烘箱中烘至恒重,取出置于密闭干燥器中冷却至室温时称菌丝干物重。每个处理设4个重复,试验重复3次。
1.3.3温度对生长的影响将1个0.5 mm直径菌饼置于MMN培养基(直径9.0 cm,20 mL/皿)中央,分别置于15 ℃、20 ℃、25 ℃、30 ℃和35 ℃下恒温暗培养,接种10 d后测量菌落直径(方法同上)。每个处理设4个重复,试验重复3次。
1.3.4碳源对生长的影响分别用10 g/L的葡萄糖、乳糖、甘露醇、可溶性淀粉、果糖、麦芽糖、蔗糖、几丁质(制备成胶体几丁质备用,方法参考Chen等[17])、海藻糖和碳酸氢钠替代MMN培养基中的碳源物质(葡萄糖+麦芽汁)。接种1个0.5 mm直径菌饼后25 ℃恒温暗培养,接种10 d后测量菌落直径(方法同上)。每个处理设4个重复,试验重复3次。
1.3.5氮源对生长的影响分别用0.5 g/L的酒石酸铵、磷酸氢二胺、硝酸纳、硝酸钙、硝酸铵、硫酸铵、甘氨酸、脯氨酸、精氨酸、天冬氨酸、谷氨酸、丙氨酸、尿素和酪蛋白替代MMN培养基中的氮源物质((NH4)2HPO4+麦芽汁)。接种1个0.5 mm直径菌饼后25 ℃恒温下暗培养,接种10 d后测量菌落直径(方法同上)。每个处理设4个重复,试验重复3次。
1.4数据处理与分析
试验数据采用Excel 2010整理,使用SAS(Version 8.1)软件进行方差分析(ANOVA),使用Duncan新复极差法进行多重比较。
2结果与分析
2.1菌种分离与鉴定
野外采集的子实体呈陀螺形,褐色,宽8~10 cm,高10~12 cm(图1)。从野外采集的子实体上成功分离的菌株在PDA及MMN培养基上生长良好,呈白色棉絮状(图2),其生长较为缓慢,且在培养过程中不产孢。
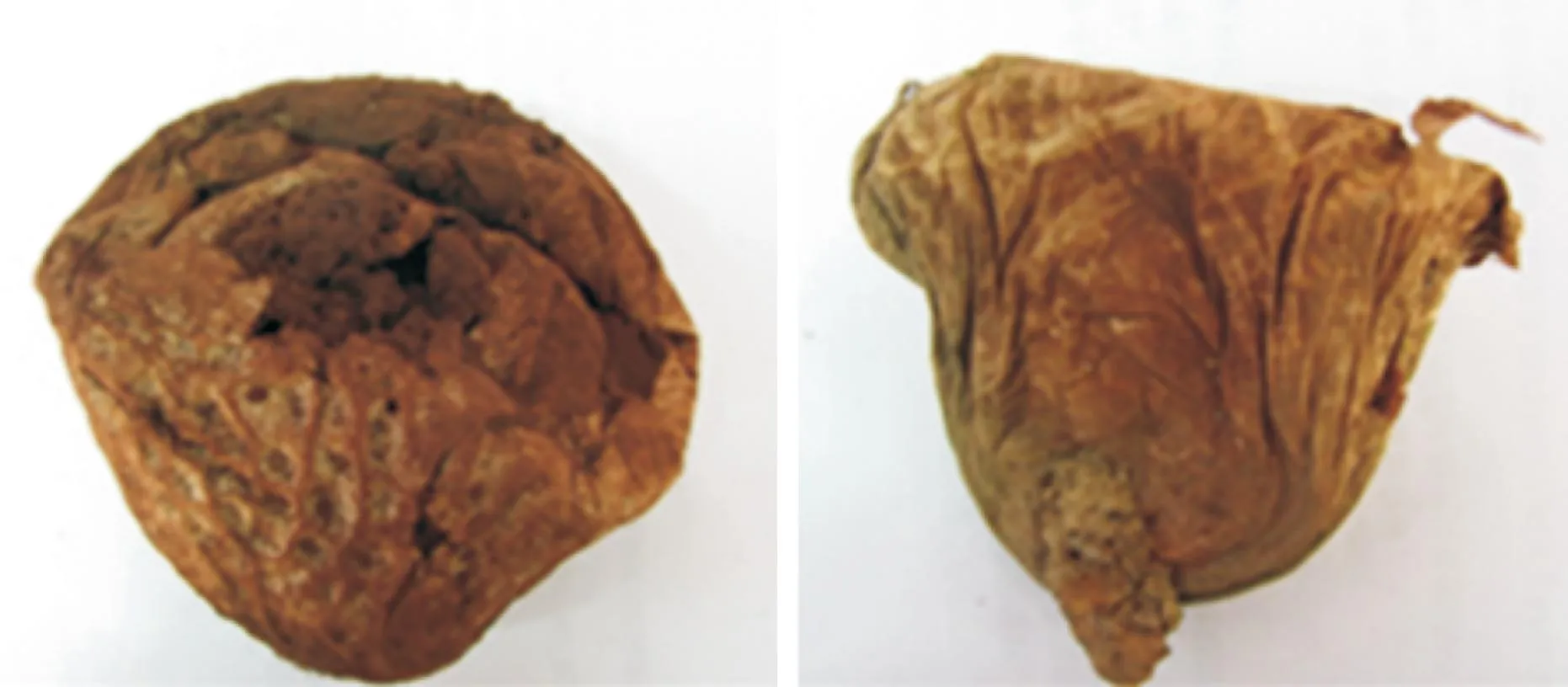
图1 成熟子实体照片
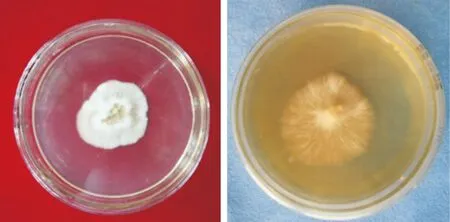
图2 分离菌株在MMN(A)和PDA(B)培养基上
对分离得到真菌的纯培养菌丝体,以及新鲜子实体和成熟风干子实体孢子粉,使用ITS1-F和ITS4引物扩增后(约550 bp)进行双向测序。结果表明野外采集的风干成熟子实体、新鲜子实体以及分离的菌株为同一真菌(菌株编号为H1)。NCBI的BLAST比对结果表明,H1(JN411549)与3株GenBank编号为DQ112607、EU833659和AJ617490的Handkeautriformis真菌序列相似度达99%;构建系统发育树的分析结果表明(图3),H1与这3株H.utriformis真菌的自展支持率为98%,因此可以将H1鉴定为H.utriformis(龟裂秃马勃)。
2.2菌株回接油松
龟裂秃马勃接种油松苗2个月后,能够与油松苗根系形成ECM,主要形态为单轴状和二叉分枝状(图4)。染色后显微镜观察结果表明,龟裂秃马勃与油松的ECM形成了菌套结构,出现在细根根端或者整个包围细根,并在菌套四周有根外菌丝,根系内形成许多根内菌丝。可见,龟裂秃马勃能良好定殖于油松根系,形成外生菌根(图4)。
2.3培养条件对龟裂秃马勃生长的影响
2.3.1龟裂秃马勃的生长曲线通过每天测量龟裂秃马勃菌落直径发现,其生长缓慢,需要4周才能长满整个平板(直径9 cm)。龟裂秃马勃在第2周和第3周时生长较快,而在第1周和第4周生长较为缓慢,生长曲线如图5,A。

图3 基于rDNA ITS序列构建的系统发育树
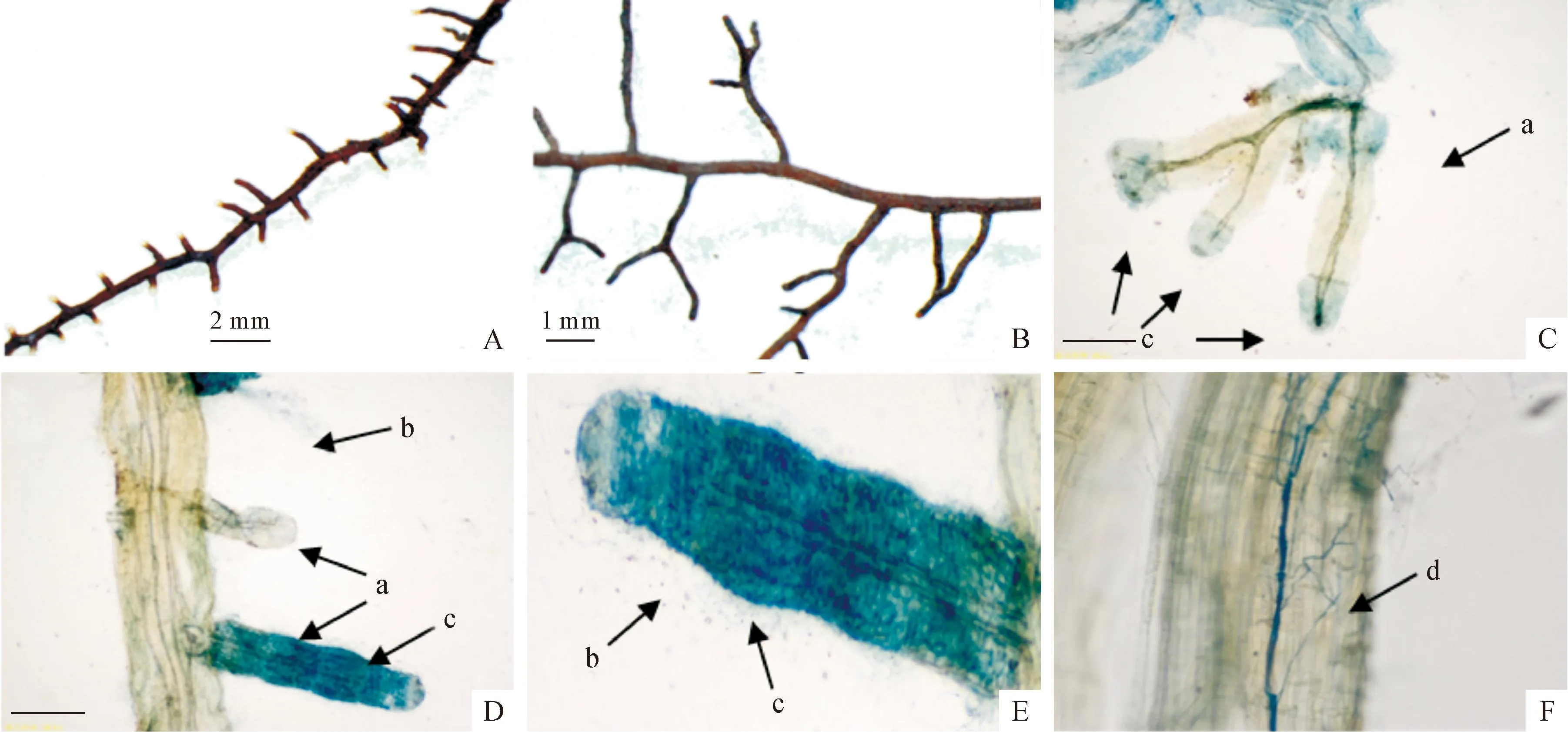
A、B.外生菌根不同形态;C~F.根段染色观察:a.形成的菌根结构;b.根外菌丝;c.形成的菌套;d.根内菌丝
2.3.2pH对龟裂秃马勃生长的影响在pH 3.0~8.0的范围内,龟裂秃马勃均能生长,其生物量随着pH升高先增加后降低,在pH 6.0时达到最大生物量,为(0.38±0.08) g(图5,B)。pH 5.0和6.0时的生物量均高于pH 7.0,也高于pH 8.0,说明弱酸性环境更适合龟裂秃马勃的生长,龟裂秃马勃对酸性环境的适应力较碱性环境要好。然而,当pH下降至4.0和3.0,或上升到7.0和8.0时龟裂秃马勃生物量显著下降,说明龟裂秃马勃对酸碱度的忍耐力有限,过酸和过碱的环境都不利于其生长。
2.3.3温度对龟裂秃马勃生长的影响温度对龟裂秃马勃生长影响显著(图5,C),并在25 ℃时生长最好;温度升高后其生长显著减弱,在35 ℃时生长最差;温度下降至15 ℃和20 ℃时龟裂秃马勃的生长也显著减弱,但分别较温度升高至30 ℃和35 ℃时的生长要好。因此,龟裂秃马勃对温度升高更为敏感,而对温度降低的耐受性强于温度升高。这可能与该真菌生活在野外森林环境中有关,森林中晚上温度较白天温度低,对真菌的生长和进化有一定的适应和选择作用。

图中不同小写字母表示经Duncan新复极差法
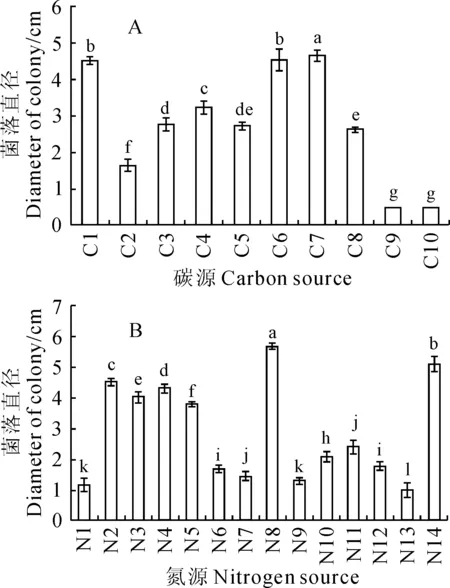
2.3.4碳源对龟裂秃马勃生长的影响龟裂秃马勃对不同碳源的利用能力不同。研究发现,龟裂秃马勃在以几丁质和碳酸氢钠为碳源的培养基上不生长,故仅对剩余8种碳源进行分析,结果见图6,A。以蔗糖为碳源的培养基中龟裂秃马勃生长效果最好,直径达到(4.65±0.15) cm,其次在麦芽糖和葡萄糖为碳源的培养基中也能较好生长,直径分别为(4.52±0.29) cm和(4.49±0.10) cm;而其对其它5种碳源的利用能力显著低于这3种碳源,其中以其对乳糖的利用能力最差,直径仅(1.65±0.17) cm。因此,培养龟裂秃马勃的最佳碳源是蔗糖。
C1.葡萄糖;C2.乳糖;C3.甘露醇;C4.可溶性淀粉;C5.果糖;
2.3.5氮源对龟裂秃马勃生长的影响龟裂秃马勃在本试验14种氮源中均能生长,但其对不同氮源利用能力不同(图6,B)。有机氮源中,对脯氨酸的利用能力最好,生长量达(5.66±0.10) cm,其次是酪蛋白,生长量为(5.07±0.24) cm,而在以尿素为唯一氮源的培养基上生长最差,仅为(0.99±0.24) cm。无机氮源中,在以铵态氮磷酸氢二铵为唯一氮源时生长最好,生长量达(4.51±0.11) cm,其次是硝酸钙,为(4.29±0.15) cm,最差为酒石酸铵,仅为(1.16±0.23) cm。龟裂秃马勃在以不同氨基酸为氮源的培养基上生长差异明显,其中脯氨酸有利于龟裂秃马勃的生长,生长量达(5.66±0.10) cm,而对精氨酸的利用最差,仅为(1.29±0.09) cm。由此可知,龟裂秃马勃对氨基酸具有一定的选择性。
3讨论
经分子特征鉴定以及回接油松检验,本研究首次在子午岭林区油松林分离得到油松外生菌根真菌——龟裂秃马勃(Handkeautriformis)[18]。该菌的同物异名较多,现在比较普遍认可的是Calvatiabovista(Pers.) Kambly & Lee和Calvatiautriformis(Bull.:Pers.) Jaap,其次是LycoperdonutriformeBull.。Handkea属自1989年从马勃属(Calvatia)独立出来,在2008年《真菌词典》第10版分类系统中Handkea在分类地位上属于真菌界(Fungi)、担子菌门(Basidiomycota)、伞菌纲(Agaricomycetes)、伞菌目(Agaricales)、马勃科(Lycoperdaceae)。目前能检索到的Handkea属包括5个种,除了H.utriformis外,其余4个种分别为H.excipuliformis、H.fumosa、H.lycoperdoides和H.subcretacea。龟裂秃马勃在南美、北美、新西兰、欧洲等地区均有报道[19-21]。在黄土高原子午岭林区油松形成外生菌根为首次发现。
龟裂秃马勃的子实体不仅可以食用,同时还具有一定的药用价值[22-23],为了更好地发挥其作用,本研究进一步研究了龟裂秃马勃的培养条件。纯培养条件下,龟裂秃马勃生长的最佳pH 为6.0,最适温度为25 ℃,最佳碳源和氮源分别为蔗糖和脯氨酸。一般来说,菌根真菌喜偏酸性环境,最适pH为4.0~6.0[1]。本研究中,龟裂秃马勃符合这一特点。然而有些菌根真菌如黄地勺菌(Spathulariaflavida)和美丽褶孔牛肝菌(Phylloporusbellus)在微碱条件下生长较好[24]。不同外生菌根真菌生长的最适温度不同,绝大多数为25 ℃[25],少数如暗褐网柄牛肝菌(Phlebopusportentosus)最佳培养温度为30 ℃[8]。葡萄糖、麦芽糖和蔗糖被认为是影响真菌菌丝生长最重要的3种碳源[1]。Adour等[26]研究发现,与无机氮如硝酸铵和硫酸铵相比,有机态氮(如赖氨酸等氨基酸)更能促使一些代谢产物的蓄积。但有报道认为,无机态氮可能更有利于真菌相关代谢酶类的表达和分泌[27]。本研究结果对龟裂秃马勃的进一步研究和应用具有重要的指导意义。
参考文献:
[1]刘润进,陈应龙.菌根学[M].北京:科学出版社,2007.
[2]CAIRNEY J W G.Ectomycorrhizal fungi:the symbiotic route to the root for phosphorus in forest soils[J].PlantandSoil,2011,344(1-2):51-71.
[3]BRUNDRETT M C.Mycorrhizal associations and other means of nutrition of vascular plants:understanding the global diversity of host plants by resolving conflicting information and developing reliable means of diagnosis[J].PlantandSoil,2009,320(1-2):37-77.
[4]TEDERSOO L,MAY T W,SMITH M E.Ectomycorrhizal lifestyle in fungi:global diversity,distribution,and evolution of phylogenetic lineages[J].Mycorrhiza,2010,20(4):217-263.
[5]SMITH S E,READ D J.Mycorrhizal Symbiosis[M].3rd edn London:Academic Press,2008.
[7]ROSSI M J,OLIVEIRA V L.Growth of the ectomycorrhizal fungusPisolithusmicrocarpusin different nutritional conditions[J].BrazilianJournalofMicrobiology,2011,42(2):624-632.
[8]KUMLA J,DANELL E,BUSSABAN B,etal.Suitable growth conditions and nutrition factors oninvitroculture ofPhlebopusportentosus(Boletales)[J].ChiangMaiJournalofScience,2011,38(1):156-159.
[9]KUSUDA M,UEDA M,MIYATAKE K,etal.Effects of carbohydrate substrate on the vegetative mycelial growth of an ectomycorrhizal mushroom,Tricholomamatsutake,isolated fromQuercus[J].Mycoscience,2007,48(6):358-364.
[10]邓娟,上官周平.子午岭林区人工与天然油松林养分库和碳库特征[J].生态学报,2009,29(6):3 231-3 240.
DENG J,SHANGGUAN Z P.Nutrient and carbon pools in both natural and artificialPinustabulaefoemisin Ziwuling region[J].ActaEcologicaSinica,2009,29(6):3 231-3 240.
[11]徐风美,王春燕,褚洪龙,等.松萎蔫病发生区和未发生区油松根部真菌群落研究[J].西北植物学报,2014,34(8):1 627-1 634.
XU F M,WANG C Y,CHU H L,etal.Research on root fungal community ofPinustabuliformisin pine wilt disease damaged and undamaged areas[J].ActaBot.Boreal.-Occident.Sin,2014,34(8):1 627-1 634.
[12]王琴,郭良栋.油松外生菌根的形态解剖特征[J].林业科学,2013,49(2):100-107.
WANG Q,GUO L D.Morphological characteristics of ectomycorrhizae associated withPinustabulaeformis[J].ScientiaSilvaeSinicae,2013,49(2):100-107.
[13]邹厚远,刘国彬,王晗生.子午岭林区北部近50年植被的变化发展[J].西北植物学报,2002,22(1):1-8.
ZOU H Y,LIU G B,WANG H S.The vegetation development in North Ziwuling forest region in last fifty years[J].ActaBot.Boreal.-Occident.Sin.,2002,22(1):1-8.
[14]GARDES M,BRUNS T D.ITS primers with enhanced specificity for Basidiomycetes application to the identification of mycorrhizae and rusts[J].MolecularEcology,1993,2:113-118.
[15]WHITE T J,BRUNS T,LEES J W T,etal.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J].PCRProtocols:AguidetoMethodsandApplications,1990,18:315-322.
[16]TAMURA K,PETERSON D,PETERSON N,etal.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].MolecularBiologyandEvolution,2011,28(10):2 731-2 739.
[17]CHEN J P,LEE M S.Simultaneous production and partition of chitinase during growth ofSerratiamarcescensin an aqueous two phase system[J].BiotechnologyTechniques,1994,8(11):783-788.
[18]KIRK P M,CANNON P F,MINTER D W,etal.Dictionary of the Fungi[M].10th edn Wallingford:CAB International,2008.
[19]KREISEL H,MORENO G.The genusHandkeaKREISEL (Basidiomycetes,Lycoperdaceae) in the southern hemisphere[J].FeddesRepertorium,1996,107(1/2):83-87.
[20]BARNETT C L,BERESFORD N A,SELF P L,etal.Radiocaesium activity concentrations in the fruit-bodies of macro fungi in Great Britain and an assessment of dietary intake habits[J].ScienceoftheTotalEnvironment,1999,231(1):67-83.
[21]DENCHEV C M,FAKIROVA V I,GYOSHEVA M M,etal.Macromycetes in the Pirin Mts (SW Bulgaria)[J].ActaMycologica,2007,42(1):21-34.
[22]戴玉成,杨祝良.中国药用真菌名录及部分名称的修订[J].菌物学报,2008,27(6):801-824.
DAI Y C,YANG Z L.A revised checklist of medicinal fungi in China[J].Mycoscience,2008,27(6):801-824.
[23]PATEL S,GOYAL A.Recent developments in mushrooms as anti-cancer therapeutics:a review[J].Biotech.,2012,2(1):1-15.
[24]李翠,杨艳,张茹琴,等.4种外生菌根真菌培养条件的研究[J].西北农林科技大学学报(自然科学版),2009,37(2):155-159.
LI C,YANG Y,ZHANG R Q,etal.Cultivating conditions on the growth of 4 ectomycorrhizal fungiinvitro[J].JournalofNorthwestA&FUniversity(Nat.Sci.Edi.),2009,37(2):155-159.
[25]毕国昌,郭秀珍,臧穆.在纯培养条件下温度对外生菌根真菌生长的影响[J].林业科学研究,1989,2(2):247-253.
BI G C,GUO X Z,ZANG M.Influence of temperature on colony growth of ectomycorrhizal fungi in pure culture[J].ForestResearch,1989,2(2):247-253.
[26]ADOUR L,COURIOL C,AMRANE A.Organic or mineral nitrogen source duringPenicilliumcamembertiigrowth on a glucose limited medium[J].EnzymeandMicrobialTechnology,2006,38(1/2):55-59.
[27]ELISASHVILI V,PARLAR H,KACHLISHVILI E,etal.Ligninolytic activity of basidiomycetes grown under submerged and solid-state fermentation on plant raw material (sawdust of grapevine cuttings)[J].AdvancesinFoodSciences,2001,23(3):117-123.
(编辑:潘新社)
Isolation,Identification and Cultivation of Ectomycorrhizal FungusHandkeautriformisin the Rhizosphere ofPinustabulaeformis
ZHANG Haoqiang,YU Hongxia,TANG Ming*
(College of Forestry,Northwest A&F University,Yangling,Shaanxi 712100,China)
Abstract:The ectomycorrhizal fungus from Ziwuling forest region on the Loess Plateau was isolated by tissue isolation technique,identified based on ITS sequence,and the cultivation condition in vitro was further investigated to establish the basis of inoculum production.Result showed the isolated fungus from Ziwuling forest region was Handkea utriformis,which could form ectomycorrhiza with Pinus tabulaeformis.Using MMN medium,the optimum pH was 6.0 and temperature was 25 ℃.Growth rate of H.utriformis on MMN medium with sucrose was the fastest,followed by maltose and glucose,and the slowest growth rate was for lactose.This fungus did not grow on medium using chitin and sodium bicarbonate as carbon source.For organic nitrogen source,H.utriformis grow fastest on MMN medium with proline,followed by casein,and slowest with urea.For inorganic nitrogen source,H.utriformis grow fastest with diammonium hydrogen phosphate,followed by calcium nitrate,and slowest with ammonium molybdate.For the first time,this study reported the ectomycorrhizal fungus H.utriformis in the Ziwuling region on the Loess Plateau,and its optimum growth condition in vitro was preliminary confirmed.
Key words:Handkea utriformis;ectomycorrhizal fungus;The Ziwuling forest region on the Loess Plateau;optimum growth condition
中图分类号:Q93-331
文献标志码:A
作者简介:张好强(1982-),男,讲师,主要从事微生物学与森林保护学研究。E-mail:zhanghaoqiang@nwsuaf.edu.cn*通信作者:唐明,教授,博士生导师,主要从事微生物学与森林保护学研究。E-mail:tangm@nwsuaf.edu.cn
基金项目:林业公益性行业科研专项(201404217);国家自然科学基金(31170567);西北农林科技大学博士科研启动基金(Z109021503)
收稿日期:2015-11-06;修改稿收到日期:2015-12-11
文章编号:1000-4025(2016)02-0419-07
doi:10.7606/j.issn.1000-4025.2016.02.0419

