Aβ3-10重复片段质粒免疫接种AD鼠后对脑内BACE1的影响☆
袁裕钧胡细枚宋婷尹静茹郑东明马英
·论 著·
Aβ3-10重复片段质粒免疫接种AD鼠后对脑内BACE1的影响☆
袁裕钧*胡细枚*宋婷*尹静茹*郑东明*马英*
目的探讨Aβ3-10重复片段质粒免疫接种3月龄APPswe/PSEN1双转基因(AD)鼠脑内BACE1的影响。方法应用Aβ3-10重复片段质粒免疫3月龄APPswe/PSEN1双转基因鼠,同等剂量的PBS免疫对照组及C57BL/6J组小鼠,各组小鼠均在免疫后2、4、6次后通过RT-PCR法检测BACE1 mRNA水平,Western blotting法检测BACE1/GFAP/NF-κB蛋白水平,免疫组化法观察Aβ1-42脑内分布情况。水迷宫检测其行为学改变。结果在免疫2次后BACE1 mRNA表达水平C57BL/6J组<Aβ3-10组<对照组(F=4.649,P=0.021);免疫4次Aβ3-10组<C57BL/6J组<对照组(F=115.683,P=0.001);免疫6次C57BL/6J组<Aβ3-10组<对照组(F=86.600,P<0.001)。BACE1的蛋白表达水平在免疫2、4、6次后C57BL/6J组<Aβ3-10组<对照组(F=432.843,P<0.001;F= 57.673,P<0.001;F=26.550,P=0.001),NF-κB的蛋白表达水平在免疫2次后C57BL/6J组<Aβ3-10组<对照组(F=109.127,P<0.001);免疫4,6次后Aβ3-10组<C57BL/6J组<对照组(F=30.301,P<0.001;F=129.967,P<0.001)。GFAP的蛋白表达水平在免疫2、4、6次后C57BL/6J组<Aβ3-10组<对照组(F=27.782,P=0.001;F= 26.132,P=0.001;F=26.450,P=0.001);Aβ1-42在脑内的分布C57BL/6J组<Aβ3-10组<对照组(皮质:F=5.395,P= 0.021;F=47.135,P=0.000;F=25.306,P=0.000,海马:F=11.023,P=0.002;F=14.936,P=0.001;F=50.132,P= 0.000)。总潜伏期C57BL/6J组<Aβ3-10组<对照组(F=8.938,P=0.016;F=5.745,P=0.04;F=7.073,P=0.017)。结论Aβ3-10重复片段质粒可以影响脑内BACE1的表达,影响Aβ产生,改善空间记忆能力。
质粒 免疫疗法 β-分泌酶(BACE1)阿尔茨海默病 β-淀粉样蛋白
1907年,Alois Alzheimer在德国Tubingen的一次会议中首次报告1例病例,其典型临床症状表现为记忆障碍及行为改变,病理表现为粟粒样小体(淀粉样板块)和致密纤维束(神经纤维缠结),多年后由Kraepelin命名为阿尔茨海默病(AD)[1]。AD的病理机制很复杂,病因也尚未明确,但有证据表明淀粉样前体蛋白(APP)的异常代谢在产生毒性Aβ的过程中发挥重要作用。ɑ-,β-,γ-分泌酶均参与APP代谢过程,APP在生理条件下被ɑ-分泌酶裂解产生可溶性非淀粉样神经片段(sAPPɑ),在β-分泌酶(BACE1)、γ-分泌酶的作用下产生Aβ[2-3],因此推测BACE1,γ-分泌酶是预防和治疗AD的两大主要研究靶点。我们的实验重点探讨经质粒免疫治疗小鼠后是否能有效减少其脑内BACE1表达,减少Aβ的形成及改善认知功能。
1 材料与方法
1.1 动物模型与分组将3月龄鼠分别分成3组(均购自中国医科大学动物部):①Aβ3-10质粒组:转基因鼠,pcDNA3.1-(Aβ3-10)10-CPG 100µg(体积约100µL;②3月龄对照组:转基因鼠,PBS(灭菌、0.01 mol/L、pH 7.4)100µL;3月龄C57BL/6J组:PBS(灭菌、0.01 mol/L、pH 7.4)100µL,(文中略写为Aβ3-10组,对照组,C57BL/6J组)。每组15只鼠,雌性,共免疫6次,每个月免疫注射1次,部位为小鼠大腿内侧股四头肌。每次间隔1个月[4]。
1.2 质粒构建质粒pcDNA3.1-(Aβ3-10)10-CPG的构建由长沙赢润生物技术有限公司完成。Aβ 3-10-cpG序列片段由南京金斯瑞合成。采用克隆位点HindIII和EcoRI进行酶切,阳性质粒切出约300 bp左右的Aβ3-10-cpG片段带和约5.4 kb左右的载体带。将鉴定的阳性菌种送长沙赢润生物技术有限公司测序。
1.3 组织样本取材在分别免疫2、4、6次后1个月对每组小鼠进行检测,麻醉小鼠后分离大脑用于进一步检测。
1.4 BACE1的mRNA水平检测应用TRI试剂(Life technologies Corporation,Carlsbad,CA,USA)按照操作说明提取总RNA。以β-actin为内参照,RT-PCR法测定BACE1mRNA相对表达量。用凝胶成像系统分析PCR产物电泳条带光密度值,表达水平以待测mRNA与β-actin mRNA的光密度值之比来表示。应用PowerScript逆转录酶(Invitro⁃gen,Camarillo,CA)合成cDNA的第一条链。应用Taq DNA聚合酶进一步扩增。最后相对定量分析用2-Δct计算。
1.5 BACE1,GFAP,NF-κB蛋白水平检测取冰冻标本数例,裂解剪碎组织,离心后取上清,酚试剂法测浓度。加入100 μL 5XBuffer,沸水变性5 min。SDS-PAGE电泳分离蛋白(每孔上样20 μL);湿转至PVDF膜上,封闭2 h;加入抗BACE1抗体(AB5832 EMD Millipore Corporation,Temecula, CA92590,USA,1:500);抗GFAP抗体(ab68428 ab⁃cam,USA,1:1000);抗NF-κB p65抗体112A1021(ab13594 abcam,USA,1:500)4℃过夜,加入辣根酶标记的山羊抗兔IgG(LOT571001100,北京鼎国昌盛生物技术有限公司,1:5000),洗膜3次后应用Tanon-5200全自动化学发光图像分析系统进行照相和条带密度扫描(上海天能),应用ImageJ(USA)软件进行灰度值测定用于统计分析,目标灰度值/内参灰度值作为相对表达量进行统计计算。
1.6 检测Aβ脑内的分布应用免疫组化SP法(ZA⁃GB-BIO,Catalog Number:70B12A)进行组织分析。常规二甲苯脱蜡,酒精脱水后水洗5次;3%双氧水37℃孵育10 min,PBS冲洗;抗原修复,冷却,PBS冲洗3次;封闭;滴加单克隆抗Aβ蛋白抗体(Sigma,USA,CloneBam-10,ProductNo. A5231),4℃过夜,PBS冲洗3次;滴加生物素标记辣根没标记的山羊抗兔IgG(LOT571001100,北京鼎国昌盛生物技术有限公司),37℃孵育30 min,PBS冲洗3次;滴加辣根过氧化物酶标记的链霉素卵白素工作液,37℃孵育30 min,PBS冲洗3次;DAB显色,冲洗;苏木素复染,脱水,透明,干燥,中性树胶封片,计算Aβ沉积所占面积百分比。图像分析应用MetaMorph显微图像分析系统(USA)。1.7水迷宫实验检测是否有行为学损害,每次免疫接种结束后4周,采用Morris水迷宫恒温游泳池(淮北正华生物仪器设备有限公司http:// www.6062307.com)多方面记录并分析小鼠的学习及记忆能力。
1.8 统计学分析采用SPSS 17.0统计软件进行数据处理与分析。呈正态分布的计量资料以(±s)表示,计量资料应用单因素分析,方差齐时选用LSD方法,方差不齐时选用Dunnett T3方法比较三组间差异。检验水准α=0.05,双侧检验。
2 结果
2.1 pCDNA3.1(+)-Aβ3-10-cpG载体构建与测序用HindIII和EcoRI双酶切重组质粒,切出约300 bp左右的rno-mir124片段带和约5.4 kb左右的载体带,如图1(箭头)所示。测序结果显示质粒DNA为成功构建pcDNA3.1-(Aβ3-10)10-CPG(图2)。
2.2 水迷宫测试结果Morris水迷宫测试结果如表1、2所示。经Aβ3-10免疫治疗AD小鼠可以改善其空间记忆能力。
2.3 RT-PCR法检测BACE1 mRNA水平如图3所示,免疫4,6次后对照组BACE1 mRNA表达均比Aβ3-10组、C57BL/6J组高,差异均具有统计学意义(P<0.01)。
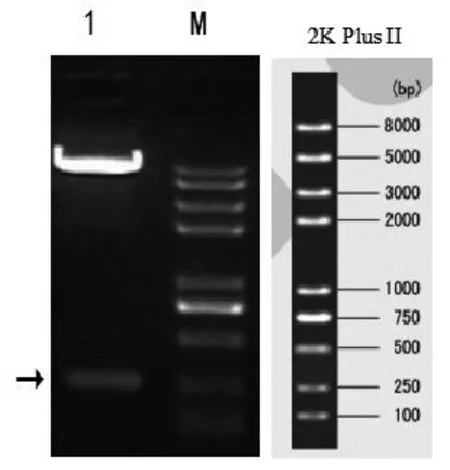
图1 pLVX-EN-rno-mir124酶切鉴定图 M:2K Plus II;1:pCD⁃NA3.1(+)-Aβ3-10-cpG经HindIII和EcoRI酶切结果

表1 3月龄小鼠总平均潜伏期(s)
2.4 小鼠脑内BACE1/GFAP/NF-κB蛋白水平如图4所示免疫2,4,6次后BACE1蛋白相对表达量在3组间有统计学差异(F=432.893,P=0.000;F= 57.673,P=0.000;F=26.550;P=0.001),GFAP的蛋白相对表达量在3组间有统计学差异(F=27.782,P= 0.001;F=26.123,P=0.001;F=25.560;P=0.001);NF-κB的蛋白相对表达量在3组间有统计学差异(F=109.127,P=0.001;F=30.301,P=0.001;F= 129.967,P=0.000)。

图2 pUC57-Aβ3-10-cpG测序比对图 Sequence 0:Aβ3-10-cpG序列;Sequence 2:pUC57-Aβ3-10-cpG.ab1序列
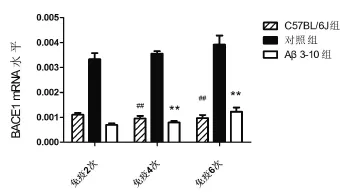
图3 BACE1 mRNA水平##:C57BL/6J组与对照组比较P<0.01; **:Aβ3-10组与对照组比较P<0.01
2.5 免疫组化法检测脑内Aβ分布情况图5为海马及皮层区Aβ沉积情况,经统计Aβ沉积所占面积百分比依次为:对照组>Aβ3-10组>C57BL/6J组,且均有统计学差异。
3 讨论
十多年前有5个研究小组经多次实验,均发现一种新型具有β分泌酶活性的天冬氨酸蛋白酶,后被起名为BACE或BACE1。BACE1在组织中广泛表达,比如在胰腺中BACE1的mRNA含量很高,但其作用是一种选择性的剪切变异体仅能裂解少量的APP,在脑内很多区域可以检测到BACE1 mRNA,其中在皮层的水平最高[5]。在AD脑中,BACE1表达及活性的增加影响了Aβ的沉积,有研究证实BACE1缺乏的小鼠脑内病理性淀粉样沉积明显减少[6],这些发现更说明了BACE1在介导APP转化成Aβ过程中所发挥的重要作用,因此这也意味着BACE1成为了治疗AD的重要研究目标[7]。
BACE1的表达水平从转录到翻译受很多因素调节[8],缺血,氧化应激和脑创伤均会增加BACE1的表达和活性[9]。暴露于应激状态下的AD小鼠模型中可以加速Aβ沉积及tau神经病变[10],其中两种基因即APP,BACE1对其影响意义重大[11-12]。而在CORDNER等[13]研究进一步证明慢性应激可以降低脑内DNA的甲基化,增加BACE1的表达,因此形成一系列恶性关联,即应激-病理性Aβ-AD,并且他们的研究表明幼龄和老龄鼠均会出现此现象,但老龄鼠对应激的反应更敏感。

表2 小鼠空间探索实验结果(n=15)

表3 Aβ沉积所占面积的百分比(n=15)
BACE1除了介导产生Aβ外还参与很多重要的生理过程,包括活化神经元,参与髓鞘形成,指导轴索形成,活化突触前膜和保持认知行为[14]。BACE1的这些生理功能也是我们研制BACE1抑制剂的安全隐患[15]。有实验证明Aβ3-10重复片段质粒免疫转基因小鼠可以减少其炎症反应,改善小鼠空间及记忆能力,并且没有出现明显不良反应[4]。
通过文献我们了解免疫疗法是AD治疗的新发展,而在以往的研究中大多是探索及证实质粒免疫治疗的效果,并且我们的前期工作已经证实Aβ3-10重复片段质粒免疫接种AD鼠后可以产生抗Aβ抗体并且安全有效[4]。因此本文在继以往的研究基础上进一步探索质粒免疫治疗AD对BACE1的影响及其机制。结果显示,经过免疫治疗后的AD小鼠其脑内BACE1mRNA及蛋白的表达水平下降,GFAP,NF-κB的蛋白表达水平下降,Aβ沉积减少,小鼠的空间记忆能力也明显得到改善,提示Aβ的沉积多少与BACE1,GFAP,NF-κB的表达有关。YANG等[9]报告经质粒免疫可以降低小鼠脑内炎症反应,下调BACE1的表达及活性,GU等[16]证明通过质粒免疫可以降低NF-κB的活性从而使BACE1的表达及活性降低,减少了对APP的裂解。NF-κB是APP,BACE1,γ-分泌酶基因的转录因子,可以激活其活性,因此可以增加Aβ的产生[16]。本研究也证实经免疫治疗的AD小鼠脑内BACE1,GFAP,NF-κB的表达均有所下降,验证其机制为降低BACE1的表达,减少对APP的裂解从而减少Aβ产生[2,6];减少炎性反应,减少NF-κB活化,从而间接减少BACE1表达,减少Aβ产生[7,17]。在尸检AD患者神经元我们发现其神经纤维缠结和发育不全的神经突触中均有NF-κB的存在,并且NF-κB更可以被神经元周围斑块的Aβ激活。因此在BACE1介导的Aβ产生过程中NF-κB途径有着非同小可的作用[18]。
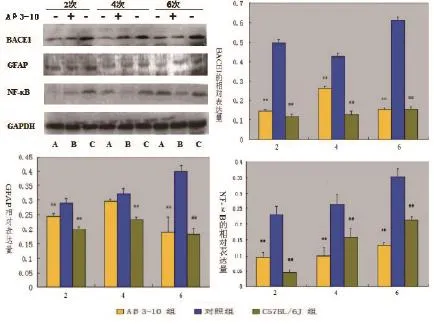
图4 Western blotting检测BACE1/GFAP/NF-κB蛋白表达及相对表达量 “-”表示未接受Aβ3-10免疫,“+”表示接受Aβ3-10免疫治疗,“A”为C57BL/6J组,“B”为Aβ3-10组,“C”为对照组“##”表示C57BL/6J组与对照组比较P<0.01;“**”表示Aβ3-10与对照组比较P<0.01

图5 小鼠海马与皮质中Aβ沉积情况(40×)A为Aβ3-10组,B为对照组,C为C57BL/6J组,“1”为免疫2次,“2”为免疫4次,“3”为免疫6次
综上所述Aβ3-10重复片段质粒对AD鼠脑内BACE1的表达水平具有一定影响,可直接影响BACE1的转录和翻译,从而使Aβ产生减少;另一方面可降低脑内炎症反应,降低NF-κB水平,从而间接影响BACE1介导APP的产生Aβ通路,减少Aβ产生,改善小鼠空间记忆能力。
[1]BLENNOW K,DE LEON MJ,ZETTERBERG H.Alzheimer's disease[J].Lancet,2006,368(9533):387-403.
[2]AZMI NH,ISMAIL M,ISMAIL N,et al.Germinated Brown Rice Alters Aβ(1-42)Aggregation and Modulates Alzheimer's Disease-Related Genes in Differentiated Human SH-SY5Y Cells[J].Evid Based Complement Alternat Med,2015:153684.
[3]VASSAR R,BENNETT BD,BABU-KHAN S,et al.Beta-secre⁃tase cleavage of Alzheimer's amyloid precursor protein by the transmembrane aspartic protease BACE[J].Science,1999,286 (5440):735-741.
[4]MA Y,LI Y,ZONG LX,et al.Improving memory and decreas⁃ing cognitive impairment in Tg-APPswe/PSEN1dE9 mice with Aβ3-10 repeat fragment plasmid by reducing Aβ deposition and inflammatory response[J].Brain Res,2011,1400:112-124.
[5]TAN J,EVIN G.Β-site APP-cleaving enzyme 1 trafficking and Alzheimer's disease pathogenesis[J].J Neurochem,2012,120 (6):869-880.
[6]VASSAR R,KOVACS DM,YAN R,et al.The beta-secretase enzyme BACE in health and Alzheimer's disease:regulation, cell biology,function,and therapeutic potential[J].J Neurosci, 2009,29(41):12787-12794.
[7]WANG R,CHEN S,LIU Y,et al.All-trans-retinoic acid reduc⁃es BACE1 expression under inflammatory conditions via modu⁃lation of nuclear factor κB(NFκB)signaling[J].J Biol Chem, 2015,290(37):22532-22542.
[8]VASSAR,R.,KOVACS,D.M.,YAN,R.,et al.The β-secretase enzyme BACE in health and Alzheimer’s disease:regulation, cell biology,function,and therapeutic potential[J].J.Neurosc, 2009,12787–12794.
[9]YANG L-B,LINDHOLM K,YAN R,et al.Elevated beta-secre⁃tase expression and enzymatic activity detected in sporadic Al⁃zheimer disease[J].Nat Med,2003,9(1):3-4.
[10]CARROLL JC,IBA M,BANGASSER DA,et al.Chronic stress exacerbates tau pathology,neurodegeneration,and cognitive per⁃formance through a corticotropin-releasing factor receptor-de⁃pendentmechanism in a transgenic mouse model of tauopathy[J]. J Neurosci,2011,31(40):14436-14449.
[11]GREEN KN,BILLINGS LM,ROOZENDAAL B,et al.Glucocor⁃ticoids increase amyloid-β and tau pathology in a mouse model of Alzheimer’s disease[J].J Neurosci,2006,26(35):9047-9056.
[12]SAMBAMURTI K,KINSEY R,MALONEY B,et al.Gene struc⁃ture and organization of the human β-secretase(BACE)promot⁃er[J].FASEB J,2004,18(9):1034-1036.
[13]CORDNER ZA,TAMASHIRO KL.Effects of chronic variable stress on cognition and Bace1 expression among wild-type mice [J].Transl Psychiatry,2016,6(7):e854.
[14]GAUTAM V,D'AVANZO C,HEBISCH M,et al.BACE1 activi⁃ty regulates cell surface contactin-2 levels[J].Mol Neurodegen⁃er,2014,9(9):4.
[15]JACOBSEN H,OZMEN L,CARUSO A,et al.Combined treat⁃ment with a BACE inhibitor and anti-Aβ antibody gantenerum⁃ab enhances amyloid reduction in APPLondon mice[J].J Neuro⁃sci,2014,34(35):11621-11630.
[16]GU SM,PARK MH,HWANG CJ,et al.Bee venom ameliorates lipopolysaccharide-induced memory loss by preventing NF-kap⁃paB pathway[J].J Neuroinflammation,2015,12:124.
[17]CHEN CH,ZHOU W,LIU S,et al.Increased NF-κB signalling up-regulates BACE1 expression and its therapeutic potential in Alzheimer's disease.Int J Neuropsychopharmacol[J].2012,15 (1):77-90.
[18]NATUNEN T,PARRADO AR,HELISALMI S,et al.Elucida⁃tion of the BACE1 regulating factor GGA3 in Alzheimer's dis⁃ease[J].J Alzheimers Dis,2013,37(1):217-232.
The effects of Aβ3-10 repeat fragment plasmid immunotherapy on the BACE1 in the AD mice.
YUAN Yu⁃jun,HU Ximei,SONG Ting,YING Jingru,ZHENG Dongming,MA Ying.Department of Neurology,Shengjing Hospital of China Medical University,Shenyang 110004,China.Tel:024-96615-28111.
Objective To explore the effects of Aβ3-10 repeat fragment plasmid immunotherapy on BACE1 in AP⁃Pswe/PSEN1 double transgenic(AD)mouse brains.Method Aβ3-10 repeat fragment plasmid was used to immune 3 months APPswe/PSEN1 double transgenic mice.Equal amount of PBS was used to immune the control and C57BL/6J groups.RT-PCR method,Western blotting methods immunohistochemical method were used to detect BACE1 mRNA level,BACE1/GFAP/NF-κB protein levels and Aβ1-42distribution in the brain after 2,4 and 6 immunization injections in every group,respectively.Morris water maze was used to detect the changes of behaviors.Result After two injections, the BACE1 mRNA expression levels was,in a descent order,C57BL/6J group<Aβ3-10 group<control group(F=4.649, P=0.021).After four injections,the BACE1 mRNA expression levels was,in a descent order,the Aβ3-10 group<C57BL/6J group<control group(F=115.683,P=0.001);after six injections,the BACE1 mRNA expression levels was,ina descent order,the C57BL/6J group<Aβ3-10 group<control group(F=86.600,P<0.001).After two,four and six injec⁃tions,the protein expression level of BACE1 was C57BL/6J group<Aβ3-10 group<control group(F=432.843,P<0.001;F=57.673,P<0.001;F=26.550,P=0.001);the protein expression level of GFAP was C57BL/6J group<Aβ3-10 group<control group(F=27.782,P=0.001;F=26.132,P=0.001;F=26.450,P=0.001);and Aβ1-42distribution in the brain was C57BL/6J group<Aβ3-10 group<control group(cortex:F=5.395,P=0.021;F=47.135,P=0.000;F=25.306,P= 0.000,hippocampus:F=11.023,P=0.002;F=14.936,P=0.001;F=50.132,P=0.000).The total latent period was C57BL/6J group<Aβ3-10 group<control group(F=8.938,P=0.016;F=5.745,P=0.04;F=7.073,P=0.017).Conclu⁃sion Aβ3-10 repeat fragment plasmid immunotherapy can affect the expression level of BACE1 and Aβ production,im⁃proving spatial memory.
Plasmid Immunotherapy β-secretase Alzheimer disease β-amyloid protein
R742.9
A
2016-07-28)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2016.11.005
☆ 国家自然科学青年基金(编号:81200834);辽宁省自然科学基金(编号:2013021070);沈阳市科学技术计划项目(编号:F10-205-1-10)
* 中国医科大学附属盛京医院(沈阳 110004)
E-mail:mayingwfdsy@163.com)

