CD8+ T细胞对胃腺癌细胞雌激素受体表达的影响
刘冠兰?付济宁?张龙?刘英
【摘要】 目的 观察CD8+ T细胞对胃癌细胞增殖及其表面受体雌激素受体α(ERα)的影响。方法 应用健康成人外周血分离得到的CD8+ T细胞与胃腺癌细胞系SGC-7901混合培养。混合培养96 h后用经流式细胞仪检查细胞周期;免疫荧光法检测分析共培养48 h后SGC-7901细胞的凋亡情况及雌激素受体表达情况。结果 经流式细胞仪检查, 混合培养96 h后CD8+ T细胞与SGC-7901细胞粘附, 大部分SGC-7901细胞滞留在G1期;混合培养组与对照组相比, SGC-7901细胞膜上表达ERα数明显降低。结论 CD8+ T细胞抑制胃癌细胞增殖的同时降低ERα的表达, 为深入研究胃癌的生物治疗及靶向治疗奠定了基础。
【关键词】 CD8+ T细胞;胃癌;SGC-7901细胞;雌激素受体
DOI:10.14163/j.cnki.11-5547/r.2016.08.019
胃癌是世界上最常见的恶性肿瘤之一, 全球超过 40%的胃癌病例发生在中国, 死亡率在恶性肿瘤中占第二位[1]。目前对胃癌的治疗主要是采用以手术为主的综合治疗, 但总体效果不令人满意。由于肿瘤患者机体免疫功能低下或缺陷与恶性肿瘤发生发展的各阶段关系密切, 而病情发展又进一步加重免疫低下状态, 恶性肿瘤的免疫治疗已成为目前的研究热点。
CD8+ T 细胞又称作 T 抑制细胞或细胞毒 T 细胞, 可以特异性识别细胞表面的MHCI 类抗原从而特异性杀死肿瘤细胞, 在抗肿瘤免疫中起到了重要作用。但其作用的相关机制还不清楚。在本研究中, 应用健康成人外周血分离得到的CD8+ T细胞与胃腺癌细胞系SGC-7901共培养, 通过免疫荧光法检测分析共培养48 h后SGC-7901细胞的凋亡情况及雌激素受体表达水平, 以期为临床筛选个体化治疗方案提供理论依据, 前瞻性指导肿瘤患者的免疫治疗, 具体报告如下。
1 材料与方法
1. 1 外周血单个核细胞分离 将10 ml全血(健康志愿者)转入50 ml离心管中, 加入10 ml PBS溶液稀释, 轻轻混匀;取两支15 ml离心管, 先加入5 ml Ficoll溶液。然后将稀释的血液轻轻加到两支离心管的Ficoll上层, 每只离心管各10 ml稀释血液;2000 r/min, 30 min;用1 ml枪头插到白色云五层, 吸取单个核细胞(PBMC)置另一干净的15 ml离心管中。加入PBS至10~15 ml, 1500 r/min, 10 min离心后去掉上清, 再加入培养基(RPMI 1640+10% FBS)进行相同操作的清洗2次。
1. 2 外周血单个核细胞培养 分离得到的PBMC用RPMI 1640+10% FBS+异戊烯焦磷酸(IPP) 1 μg/ml+白细胞介素-2 (IL-2) 20万U/ml培养, 2~3 d换培养基一次, 第五代(P5)用于实验。
1. 3 流式细胞仪检查T细胞表型 取100 μl细胞与PBS+2%胎牛血清(FBS)混悬液, 分别加入10 μl CD3、CD4、CD8抗体(贝克曼公司), 震荡器充分混匀后, 室温避光放置10 min;裂解红细胞:混合液放置10 min后, 加入红细胞裂解液500 μl (贝克曼公司), 均匀混合后, 室温避光放置10 min;离心(2000 r/min, 5 min)后倒掉上清, 上机检测:加入500 μl的缓冲液, 混匀后上流式细胞仪器检测(仪器为贝克曼公司FC500型流式细胞仪)。
1. 4 CD8+ T分离 取5个小平皿(60 mm), 加入10%多聚赖氨酸0.5 ml, 37℃5%CO2培养箱中过夜。4℃加入CD8抗体2 μl 4 h。加入上述单个核细胞混悬液过夜。次晨, 去上清。0.25%胰酶消化贴壁的细胞。细胞计数板计数后, 取10000个细胞进行流式细胞仪检测, 方法同上。
1. 5 CD8+ T与SGC-7901细胞共培养 SGC-7901细胞计数后, 平均铺到5个小平皿(60 mm)中, 过夜培养让细胞贴壁, 融合率到70%~80%。取两小平皿用胰酶消化, 计数后分别按CD8+ T与SGC-7901细胞1∶10加入成为贴壁肿瘤细胞+T细胞培养组;单独SGC-7901细胞和单独T细胞为对照组。SGC-7901细胞与CD8+ T细胞共培养48 h后显微镜观察细胞增殖情况;吸去旧培养基按相同比例换含新CD8+ T细胞的新鲜培养基继续培养48 h。培养96 h后, 吸去培养基, 进行细胞周期检测和免疫荧光检查。
1. 6 细胞周期检测 CD8+ T与SGC-7901细胞混合培养在96 h后, 0.25%胰酶消化。消化后的细胞经PBS 清洗2次, 加入FITC标记annexin Ⅴ和PI溶液, 轻轻混均。室温避光放置15 min, 用流式细胞仪检查DNA含量。所得结果用细胞周期分析软件(Cell FIT, Becton Dickinson)分析。
1. 7 免疫荧光检查 将CD8+ T用DAPI染核后与SGC-7901细胞共接种到预先放置有处理过的盖玻片的培养皿中, 96 h后取出盖玻片, PBS洗2次。4%多聚甲醛4℃固定细胞过夜。3%小牛血清白蛋白(BSA)封闭30 min, 加入ERα抗体(PE标记) 4℃过夜。PBST漂洗3次, 冲洗5 min/次。加入二抗室温避光孵育1 h, PBST漂洗3次, 冲洗5 min/次后, 再用蒸馏水漂洗1次。滴加封片剂一滴, 封片, 荧光显微镜检查。
2 结果
2. 1 CD8+ T细胞检测 经流式细胞仪检查, 培养得到的CD8+ T阳性率为91.3%。
2. 2 混合培养96 h后细胞周期检查 经流式细胞仪检查, 混合培养96 h后大部分细胞滞留在G1期。
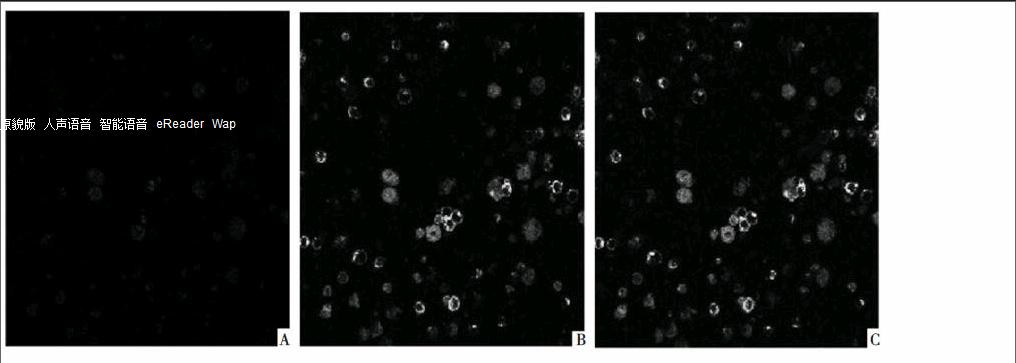
2. 3 混合培养96 h后SGC-7901细胞ERα抗体表达情况 CD8+ T细胞用DAPI将细胞核染成蓝色, ERα在荧光显微镜下呈绿色, 在SGC-7901细胞膜上表达。混合培养96 h后, 可见CD8+ T细胞与SGC-7901细胞粘附。混合培养组与对照组相比, SGC-7901细胞膜上表达ERα数明显降低。见图1。
图1 混合培养96 h后SGC-7901细胞ERα抗体表达情况
注:A图, CD8+ T组96 h贴壁增殖情况;B图, SGC-7901细胞96 h ERα抗体表达;C图, 混合培养96 h后SGC-7901细胞ERα抗体表达情况
3 讨论
现代肿瘤免疫生物学的飞跃发展, 使恶性肿瘤的免疫治疗成为目前的研究热点, 它将成为继手术、化疗、放疗之后的第四种肿瘤治疗模式。本研究通过CD8+ T细胞与SGC-7901细胞混合培养, 证实CD8+ T细胞对SGC-7901细胞的增殖具有明显抑制作用;并降低SGC-7901细胞的特异性受体ERα的表达。因此, 本研究结果为肿瘤的生物靶向治疗提供了理论依据。
雌激素调节生长、分化和功能多样化的目标组织内外的生殖系统[2]。雌激素的生物功能大部分是对通过靶细胞的雌激素受体ERα和ERβ, 调节相关基因的表达。尽管胃不是称为性激素的直接目标器官, 流行病学和动物研究表明胃癌可能对雌激素敏感。胃癌的男女发病比率约为2∶1。因此, 有研究认为雌激素可能对胃癌有保护作用。ERα和ERβ均在胃癌表达[3, 4]。ERα在胃癌发生、发展中的作用研究较多, 大多认为胃癌中ERα的表达较ERβ多, 表达范围广泛, 且与胃癌的分化及转移相关[5, 6]。部分ER阳性的胃癌患者根治切除后对内分泌治疗反应良好均说明胃癌的ER与乳腺癌中的ER 一样具备代谢活性。因此, 对雌激素及其受体的相关研究可能影响胃癌的进展和治疗。迄今为止, 有关胃癌ER与预后的关系尚未清楚。
CD8+ T 细胞又称作T抑制细胞或细胞毒T细胞, 通过穿孔素/颗粒酶途径和Fas/FasL途径能够高效、特异性地杀伤靶细胞, 而不损害正常组织。细胞毒性CD8 T细胞高表达的胃癌通常预后好于低表达的胃癌患者, 表明过继免疫在肿瘤免疫监视系统的关键作用[7]。本研究结果还显示 CD8+ T细胞抑制胃癌细胞增殖。CD8+ T具有特异性直接杀伤肿瘤细胞的作用, 分化越差的肿瘤往往恶性程度越高, 越容易产生免疫耐受, 导致CD8+ T细胞表达降低。本研究观察CD8+ T细胞对胃腺癌细胞ERα的表达, 结果显示, CD8+ T可以降低胃腺癌细胞ERα的表达。
综上所述, CD8+ T细胞抑制胃癌细胞增殖的同时降低ERα的表达, 为深入研究胃癌细胞的生物治疗及靶向治疗奠定了基础。
参考文献
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin, 2011, 61(2):69-90.
[2] Katzenellenbogen BS. Estrogen receptors: bioactivities and interactions with cell signaling pathways. Biol Reprod, 1996, 54(2): 287-293.
[3] Furukawa H, Iwanaga T, Koyama H, et al. Effect of sex hormones on the experimental induction of cancer in rat stomach - a preliminary study. Digestion, 1982, 23(3):151-155.
[4] Kim MJ, Cho S, Lee K, et al. Effects of 17β-estradiol and estrogen receptor antagonists on the proliferation of gastric cancer cell lines. J Gastric Cancer, 2013 , 13(3):172-178.
[5] Lindblad M, Ye W, Rubio C, et al. Estrogen and risk of gastric cancer: a protective effect in a nationwide cohort study of patients with prostate cancer in Sweden. Cancer Epidemiol Biomarkers Prev, 2004, 13(2):2203-2207.
[6] Freedman ND, Chow WH, Gao YT, et al. Menstrual and reproductive factors and gastric cancer risk in a large prospective study of women. Gut, 2007, 56(12):1671-1677 .
[7] Sangiolo D. Cytokine induced killer cells as promising immuno-therapy for solid tumors. J Cancer, 2011(2):363-368.
[收稿日期:2015-11-09]

