辣椒疫霉病无毒基因RXLR128001克隆与蛋白表达纯化
王晓梅,张钟文,杨 楠吉林农业大学农学院,吉林长春130118
辣椒疫霉病无毒基因RXLR128001克隆与蛋白表达纯化
王晓梅*,张钟文,杨楠
吉林农业大学农学院,吉林长春130118
摘要:本文从强致病辣椒疫霉菌SD33分离克隆了1个效应分子RXLR128001基因,利用生物信息学软件BLAST and SignalP4.1 Server,分析了该效应分子的基因序列结构。在此基础上进行了该基因大肠杆菌(Escherichia coli)表达与纯化,界定了适宜该基因高效表达的诱导条件,经过亲和层析和离子交换层析,获得了RXLR128001基因较高纯度的蛋白,以利于后续晶体的培养与优化研究。
关键词:辣椒疫霉;效应蛋白;基因克隆;蛋白表达纯化
辣椒疫霉病(Phytophthora capsici)是一种重要的土传卵菌病害[1,2],呈世界性分布,该病害严重发生,常给辣椒生产造成严重减产,乃至绝收[3]。其病原菌寄主范围广,可侵染辣椒、西葫芦、黄瓜、茄子、番茄等20多种作物[4]。近年来,已有关于辣椒疫霉菌关键致病因子及致病流行机制的探索研究[5,6]。
植物病原菌侵染寄主植物过程中常分泌若干效应蛋白分子(effectors)[7],植物病原卵菌在与寄主植物互作过程中,也分泌效应蛋白分子进入寄主细胞中,通过破坏或干扰寄主细胞代谢,而促进自身的分泌和传递[7]。病原卵菌效应蛋白具诱导寄主细胞坏死而导致寄主植物发病,或诱导寄主细胞产生防卫反应的性能[8]。这类效应分子共同特点是在N-端含有一个信号肽,协助效应分子分泌渗入寄主细胞内,后比邻一个保守的RXLR-dEER motif,该类效应蛋白分子通常含100至400个氨基酸[9-11]。生物信息学比对发现辣椒疫霉基因组中含300余个RXLR效应分子,但有关辣椒疫霉RXLR效应分子基因克隆、蛋白表达纯化及其功能机制特性的研究资料积累较少,本研究克隆了辣椒疫霉的1个RXLR效应分子,基于蛋白表达纯化技术获得了该效应分子较高纯度的蛋白,为该蛋白晶体优化培养及结构研究提供了基础。
1 材料与方法
1.1材料
供试菌种辣椒疫霉菌株SD33由山东农业大学真菌研究室分离鉴定。
1.2辣椒疫霉RxLR效应分子基因克隆
1.2.1辣椒疫霉效应蛋白分子RXLR128001界定与引物设计利用基因信息软件比对发现,辣椒疫霉基因组JGI(http://genome.jgi.doe.gov/)中含1个效应蛋白分子RXLR128001,基于RXLR128001基因全长序列设计克隆引物RxLR128001-F: 5`-ATGCGCCTCCTTTATTTGGC-3`;RXLR128001-R: 5`-CTACACACTGTTGAGTTTCG-3`,该对引物由上海博尚生物有限公司合成。
1.2.2RXLR128001基因克隆基因克隆载体pGEM-T Easy Vector购自Promega公司,大肠杆菌Escherichia coli DH5α JM109菌株购自上海Sangon公司。以辣椒疫霉菌基因组DNA为模板,对RXLR128001基因进行PCR扩增:95℃5 min;94℃30 s,55℃30 s,72℃2 min,30个循环;72℃延伸5 min。产物电泳后,含目的DNA的琼脂糖胶,回收。克隆步骤:1)制备100 μg/mLAmp LB平板室温下放置2~3 h备用;2)从-80℃取出E. coli DH5(JM109)感受态细胞,冰浴中融化,轻弹混匀,然后在无菌1.5 mL Ep管加入10 μL回收产物,取50 μL感受态细胞与连接产物轻轻混匀,冰浴中放置30 min;3)放入42℃水浴中,热激90 s,然后冰浴2 min;4)每管中加入500 μL LB培养基,37℃200 r/min培养45 min;5)离心1 min(8000~10000 r/min),用100 μL LB培养基回溶,取适量(100 μL)涂布于培养基上,37℃倒置培养12~16 h后出现菌落;6)取单菌落,于液体LB培养基中37℃,200 r/min培养12~16 h后OD=0.5左右时,菌落PCR鉴定,然后送样测序。
1.3RXLR128001基因原核表达与蛋白纯化
1.3.1原核表达载体构建选用pET-28a为表达载体,为保证目的基因片断单方向插入质粒中,在片断5`和3`端分别设计BamHI和EcoRI酶切位点,合成一对特异性引物RXLR128001-F: 5`-CGCGGATCCCTCTCCACGCCTACGGCACCTG-3`;RXLR128001-R:5`-CCGGAATTCTTAGCCGG ACACCACACCCAC-3`用于RxLR128001基因PCR扩增,设计引物切除信号肽序列后,PCR扩增片段为RXLR128001基因成熟肽序列,PCR扩增体系和反应条件参照文献[12],扩增后的基因经琼脂糖凝胶电泳进行纯化回收,对目的基因和载体质粒进行双酶切[12],酶切之后通过琼脂糖凝胶电泳进行纯化回收,之后进行基因和载体连接转化[12]。重组质粒经菌落PCR筛选,测序鉴定。
1.3.2转化宿主蛋白表达目的蛋白试表达:将阳性重组质粒转入表达宿主BL21(DE3),涂于Kana抗性平板。
1)从LB平板上分别挑取5个单克隆菌落,接入5 mL LB(50 mg/L Kana)的15 mL离心管中,于37℃震荡培养OD值至0.6~0.8之间;
2)每管各取500 μL菌液和15%的甘油1:1(V/V)混合后装至灭菌冻存管中,-80℃保存;
3)每管取500 μL菌液,做为诱导表达前的对照;
4)每管中加入5 μL IPTG(终浓度为1 mM/L),37℃200 r/min诱导表达4 h;
5)诱导结束后各取500 μL菌液,与诱导前菌液共离心,12000 r/min,2 min;
6)弃上清,各加入10 μL的5×样品缓冲液,100℃加热5 min变性,12000 r/min,5 min;
7)15%SDS-PAGE电泳分析表达结果。
1.3.3蛋白表达条件优化在获得可溶性蛋白基础上,需进一步确定最佳表达条件,具体操作:
1)分别取5个含100 mL LB(100 mg/mL Kana)250 mL锥形瓶,1~5号锥形瓶分别加入重组的RXLR128001-28a菌液1 mL,37℃200 r/min振荡培养。
2)菌液OD600约为0.6~0.8,对1~5号锥形瓶进行条件筛选,不同诱导剂浓度(IPTG终浓度为0.2 mM/L、0.4 mM/L、0.6 mM/L、0.8 mM/L、1.0 mM/L)下诱导表达,诱导结束后离心,4℃,5000 r/min,6 min,弃上清,用10 mL预冷的重悬液重悬沉淀,于4℃下超声波细胞破碎,破碎后离心,4℃15000 r/min,30min,1~5号分别取上清、沉淀,加入10 μL的5×样品缓冲液,于100℃加热5 min变性,上样前离心,12000 r/min,5 min。
3)15%SDS-PAGE电泳分析,确定可溶性蛋白最优表达条件。
1.3.4融合蛋白大量表达在上述研究基础上,挑取阳性克隆,接种致10 mL LB(50 mg/L Kana)培养基中,37℃震荡培养至OD600=0.6~0.8,然后按1:100接种至1 L LB培养基(50 mg/L Kana),37℃震荡培养至OD600=0.6~0.8,按上述最佳优化条件表达,冷却至16℃,添加IPTG至最适浓度,培养20 h,然后5000 r/min,离心6 min收集菌体,待用。
1.4融合蛋白的纯化
1.4.1亲和层析纯化1)每1 L培养物细胞沉淀悬于50 mL预冷重悬液(20 mM Tris-HCl,150 mM NaCl,pH 8.5)中,于4℃下超声波破碎(600 W,每6 s间隔6 s共100次),4℃、14000 r/min离心30 min,收集上清,0.22 μm滤膜过滤备用。
2)亲和层析纯化融合蛋白①将超声破碎后上清溶液加入装有预处理Ni-NTA琼脂糖介质柱中,4℃下自然通过层析柱,重复3次。②用洗杂液(20mM/LTris-HCl,150mM/LNaCl,20mM/L咪唑,pH8.5)冲洗挂过蛋白Ni-NTA柱。③用含50~1000 mM咪唑缓冲液(20 mM/L Tris-HCl,150 mM/L NaCl,pH 8.5)梯度洗脱目标蛋白,收集洗脱液。④用SDS-PAGE鉴定梯度洗脱效果,确定最佳洗脱浓度,供后续纯化使用。
1.4.2离子交换纯化1)将亲和柱纯化的样品用分子截留量为10 KD的超滤管进行浓缩至1 mL左右,并将原溶液换成(20 mM Tris-HCl,50 mM/L NaCl,pH 8.5)。
2)浓缩好的样品4℃,12000 rpm离心15 min,取上清,用于离子交换层析上样。
3)将ResourcesQ柱接到AKTA蛋白纯化仪上,用低盐缓冲液(20 mM Tris-HCl,50 mM/L NaCl,pH8.5)进行柱平衡约5个柱体积。
4)将蛋白样品加到上样器中,运行程序,采用盐浓度梯度洗脱的方式纯化目的蛋白。其中高盐缓冲液为(20mMTris-HCl,2 M/LNaCl,pH8.5),低盐缓冲液为(20mMTris-HCl,50mM/LNaCl,pH8.5)。
5)不同浓度盐的洗脱液进行收集,并用SDS-PAGE检验分离效果。
2 结果与分析
2.1辣椒疫霉RxLR128001基因克隆与基因序列结构分析
利用辣椒疫霉基因组中效应蛋白RXLR128001基因设计引物,从高致病性菌株SD33内克隆RXLR128001基因。克隆测序以及BLAST比对最终获得了RXLR128001基因,并且全部上传Genbank (Genbank no KT726224),利用SignalP4.1 Server软件预测RXLR128001基因信号肽。辣椒疫霉RXLR128001基因序列数据分析如下(图1)。
辣椒疫霉效应蛋白RXLR128001基因完整的开放阅读框ORF序列为2016 bp,编码671个氨基酸,预测编码蛋白的分子量为75.8 kDa,信号肽含21个氨基酸。
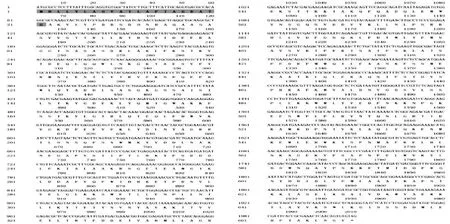
图1 辣椒疫霉菌效应蛋白分子RXLR128001基因氨基酸序列Fig.1 Amino-acid sequence of Phytophthora capsici effector gene RXLR128001阴影部分为信号肽氨基酸序列,*为终止密码子Amino acids within shady indicate the signal peptide,* is terminal code
2.2RXLR128001表达与纯化
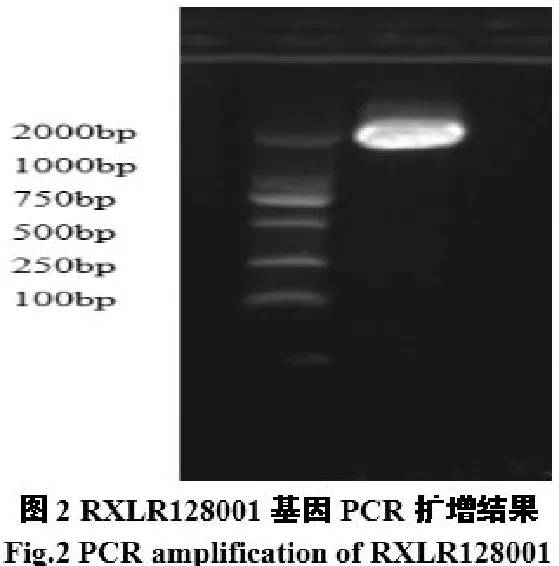
2.2.1RXLR128001重组质粒构建与鉴定PCR扩增产物经1.0%琼脂糖凝胶电泳检测,电泳图显示有特异DNA条带,与预期值2016 bp大小相符,见图2。
RXLR128001-28a重组质粒构建后,经PCR筛选,结果证明为阳性。将重组质粒送上海博尚生物公司测序,结果表明读码框架完全正确,表明RXLR128001-28a重组质粒构建成功。
2.2.2RXLR128001蛋白表达将pET28a(+)-RXLR128001重组质粒转到表达菌株BL21中,由IPTG诱导表达后取样进行15%SDS-PAGE检测,图3所示,电泳图显示RXLR128001重组融合蛋白在大肠杆菌中大量表达,图中1号泳道为诱导前,2~5号泳道为加入IPTG,37℃诱导4 h后,可发现明显的增强带,大小和目的蛋白75.8 KDa相吻合。
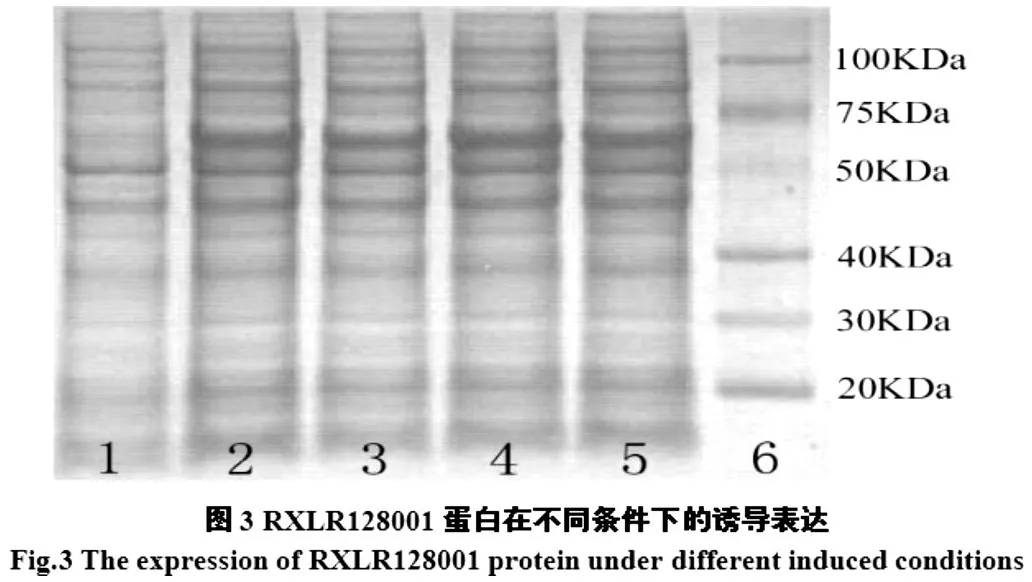
通过对不同温度、诱导剂浓度和诱导时间等表达条件优化,结果显示:在16℃,IPTG终浓度1 mM/L,诱导16 h条件下,pH10.3的Buffer中,破菌后的上清液RXLR128001蛋白可溶性和表达较好,由此确定蛋白大量表达的适宜条件。
2.2.3RXLR128001蛋白纯化
(1)RXLR128001蛋白亲和层析纯化对RXLR128001蛋白超声裂解后SDS-PAGE分析,发现在中性及弱碱性条件下蛋白质均不溶,说明RXLR128001蛋白可溶性较差,疏水性较高,提高pH 10.3及在洗脱液中加入尿素改善其疏水情况,用含50~500 mM咪唑洗脱液进行梯度洗脱,确定最佳洗脱条件确定为100 mM,分别对不同洗脱浓度取样,进行SDS-PAGE检测(图4),发现目标蛋白主要在100 mM咪唑浓度下能被大量洗脱,剩余少量蛋白在200 mM咪唑可有效洗脱,图4中1号泳道为超声后上清液,2~7号泳道分别为50 mM、100 mM、200 mM、300 mM、400 mM、500 mM咪唑洗脱的蛋白。
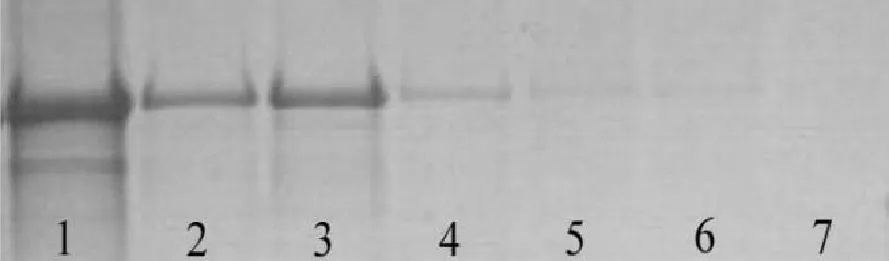
图4 RXLR128001蛋白亲和层析纯化Fig.4 Purification of RXLR128001 protein with affinity chromatography
(2)RXLR128001蛋白离子交换层析纯化亲和纯化后的蛋白样品,在ResourceQ柱纯化中大约在250 mM/L的NaCl浓度下,可看到一个明显的高峰如图5:B所示,此时目的蛋白已经被洗脱下来,收集不同盐浓度的洗脱蛋白组分进行SDS-PAGE分析,结果如图5:A所示,通过离子交换层析后,已除去部分杂蛋白,初步获得了RxLR128001的较高纯度的蛋白。
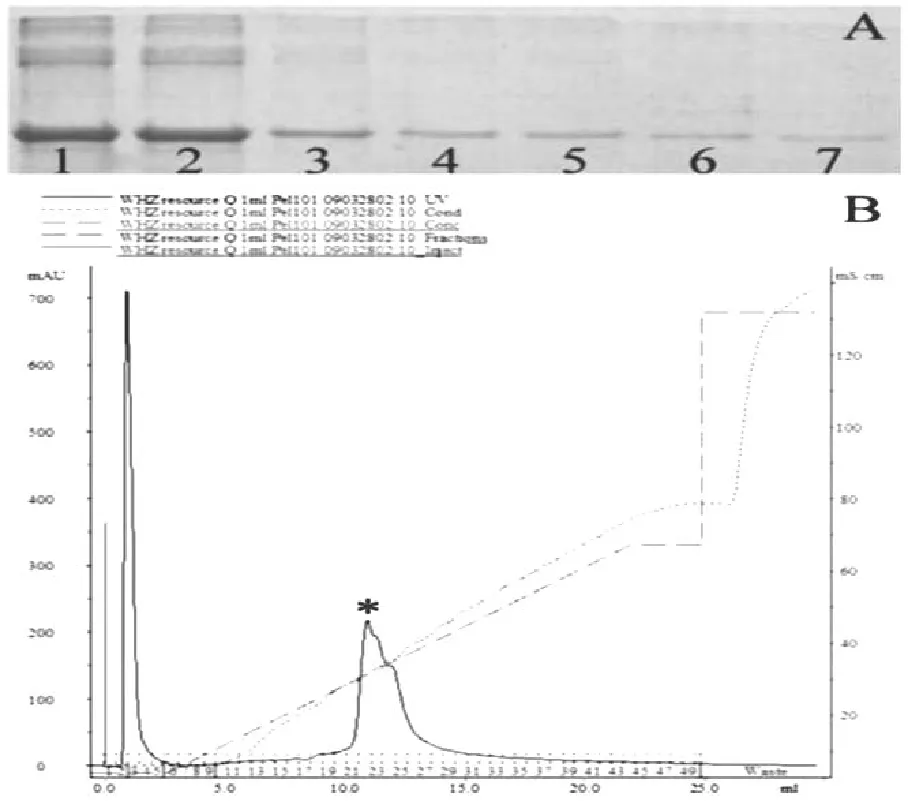
图5 A: RXLR128001蛋白离子交换层析纯化;B: RXLR128001蛋白ResourceQ柱纯化峰值,*号所示Fig.5 A: Purification of RXLR128001 protein with ion exchange chromatography B: Purification of RXLR128001 protein with ResourceQ column, The peak value was showed by *
3 结论与讨论
本研究从辣椒疫霉全基因组JGI(http://genome.jgi-psf.org/)中选取了1个效应蛋白分子RXLR,该基因辣椒疫霉全基因组中的序列号为128001,由此将该基因命名为RXLR128001。基于辣椒疫霉全基因组信息,本研究从辣椒疫霉强致病菌株SD33中分离鉴定了RXLR128001基因,该基因的ORF 含2016 bp,编码671个氨基酸,编码的蛋白分子量为75.8 kDa,其氨基酸数量与蛋白分子量大小均超过了前人预测的卵菌效应蛋白分子RXLR氨基酸数(100~400个氨基酸)及其蛋白分子量大小[9-11],因此该基因进化历程中可能发生了较大的变化。此外,RXLR128001基因含1个信号肽(21个氨基酸),卵菌效应蛋白分子信号肽具调控效应蛋白分泌或协调效应分子在寄主细胞内的功能行使[11]。基于上述分析推测RXLR128001基因可能是一个重要的功能基因,在辣椒疫霉菌与辣椒寄主互作过程中,可被分泌至辣椒寄主细胞,并具明显的破坏或干扰辣椒寄主细胞代谢的性能,或者可能具诱导寄主细胞坏死或诱导寄主产生防卫反应的功能。因此,在已克隆RXLR128001基因和分析该基因序列信息基础上,利于后续深入开展该基因功能的研究。
目前有关卵菌效应蛋白结构生物学研究信息积累较少,但如解读具重要功能的效应蛋白三级结构,基于结构信息基础上,深入开展基因功能机制的研究,利于探明效应蛋白分子分泌、诱导细胞坏死致病乃至诱导寄主细胞产生防卫反应的性能。因此,针对性的开展卵菌效应蛋白表达纯化,获得高纯度蛋白,对于开展晶体结构生物学具重要的意义。本研究开展了RXLR128001基因的原核表达研究,证明该基因重组蛋白可在大肠杆菌中大量表达,并进一步优化了适宜该基因高效表达的诱导因子。在此基础上,借助亲和层析和离子交换层析技术,对RXLR128001效应蛋白进行了多次纯化,获得了较高纯度的蛋白(图4,图5)。本研究制备了该效应蛋白的高纯度蛋白,为进一步优化及进行蛋白结构生物学研究提供了扎实的技术储备。在此基础上,开展晶体优化培养和蛋白结构生物学和基因功能机制研究,利于深入探明卵菌不同效应蛋白分子-病菌寄主互作过程中的分子作用机制,预期研究具重要的科学意义。
参考文献
[1]张海英,刘永刚,吕和平,等.河西地区辣椒疫病菌的形态特征及其致病力的初步研究[J].西北农业学报,2008,17(1):74-76
[2]王晓敏,巩振辉,逯红栋,等.辣椒疫霉菌孢子诱导技术研究[J].西北农业学报,2006,15(2):59-62
[3]杨宇红,冯兰香,冯东昕,等.防治辣椒土传病害的常用杀菌剂室内药效测定[J].山地农业生物学报,2001,20(6):417-421
[4] FengBZ,ZhuXP,FuL,etal.Characterizationofnecrosis-inducingNLPproteinsinPhytophthoracapsici[J].BMCPlantBiol,2014,14:126
[5] Fu L,Zhu CY,Ding XM,et al. Characterization of cell death-inducing members of the pectate lyase gene family in Phytophthora capsici and their contributions to infection of pepper[J]. Mol. Plant Microbe Interact,2015,28:766-775
[6] Chu YZ,Yang XY,Lv F,et al. Phytophthora capsici homolog of the cell cycle regulator SDA1 is required for sporangial morphology,mycelial growth and plant infection[J]. Mol. Plant Pathol,2015. DOI:10.1111/mpp.12285
[7] Stephen C,Whisson PC,Boevink LM,et al. Armstrong,Severine Grouffaud,Pieter van West,Sean Chapman,Ingo Hein,Ian K. Toth,Leighton Pritchard,Paul R. J. Birch.Atranslocation signal for delivery of oomycete effector proteins into host plant cells[J]. Nature,2007,450:115-118
[8] Saunders DGO,Breen S,Win J,et al. Host Protein BSL1 Associates with Phytophthora infestans RXLR Effector AVR2 and the Solanum demissum Immune Receptor R2 to Mediate Disease Resistance[J]. Plant Cell,2012,24:3420-3434
[9] Tyler BM,Tripathy S,Zhang X,et al. Phytophthora genome sequences uncover evolutionary origins and mechanisms of pathogenesis[J]. Science,2006,313:1261-1266
[10] Win J,Morgan W,Bos J,et al.Adaptive evolution has targeted the C-terminal domain of the RXLR effectors of plant pathogenic oomycetes[J]. Plant Cell,2007,19:2349-2369
[11] Jiang RHY,Tripathy S,Govers F,et al. RXLR effector reservoir in two Phytophthora species is dominated by a single rapidly evolving superfamily with more than 700 members[J]. Proc Natl Acad Sci USA,2008,105:4874-4879
[12] Wang HZ,Zhang K,Zhu J,et al. Structure reveals regulatory mechanisms of a Mao CLike Hydratase from Phytophthora capsici involved in biosynthesis of Polyhydroxyalkanoates(PHAs)[J]. PLoS one,2013,8(11):e80024
Clone of Nontoxic Gene RXLR128001 in Phytophthora capsici and Expression and Purification of Effector Protein
WANG Xiao-mei*,ZHANG Zhong-wen,YANG Nan
College of Agronomy/Jilin Agricultural University, Changchun 130118,China
Abstract:In this study,we cloned a nontoxic gene RXLR128001 from Phytophthora capsici and then analyzed the sequence structure of it based on the BLAST and SignalP4.1 Server software. At the same time,we expressed and purified RXLR128001 gene in Escherichia coli and determined the optimal conditions that could induce RXLR128001 gene to be effective expressed. Finally,we prepared the high pure protein of RXLR128001 gene to be beneficial to the further study on the crystal cultivation and optimization of it.
Keywords:Phytophthora capsici;effector protein;gene clone;expression and purification of protein
*通讯作者:Author for correspondence. E-mail:wxm820@126.com
作者简介:王晓梅(1971-),女,副教授,主要从事植物病理学研究. E-mail:wxm820@126.com
基金项目:转基因生物新品种培育重大专项(2014ZX0801004B)
收稿日期:2015-10-11俢回日期:2015-10-20
中图法分类号:Q943.2
文献标识码:A
文章编号:1000-2324(2016)01-0025-05

