高考中原电池电极反应式的几种考查类型
湖北 王小华
高考中原电池电极反应式的几种考查类型
湖北 王小华
原电池一直是高考中的热点、重点,关于电极反应式书写的考查在历年高考题中屡见不鲜,题型有选择题和填空题。笔者结合近几年的高考题,将原电池电极反应式的书写归纳成几个类型,希望高三学子们记住这几个典型的例子,融会贯通后再举一反三,力争这部分内容不失分或少失分。
类型一:一次电池电极方程式的考查
(1)干电池的考查
【例1】(1)(2015新课标Ⅱ)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回答下列问题:该电池的正极反应式为________,电池反应的离子方程式为________。
(2)(2014四川,节选)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________。
【解析】干电池是常见的一次电池,又分为酸性和碱性,通过上述高考题,可看出年年都考。酸性干电池电解质为NH4Cl,水解出H+显酸性,使用久了会产生NH3,造成电池膨胀,渗出液体。其负极为锌筒,电极方程式为:Zn-2e-=== Zn2+,正极是碳棒,上面有铜帽,但正极碳棒不反应,是MnO2在正极得电子发生还原反应,产物为MnCl2或MnOOH,电极方程式写法有两种,反应物中阳离子可写成H+或,原因是此处H+由NH4Cl水解产生。显然此题(1)问考酸性干电池,(2)问考碱性锌锰电池,且正极电极方程式考得多,故有必要将总反应和正极方程式记下来以便备考。碱性干电池只不过是电解质换成了KOH,正极负极材料不变,但由于负极产生的Zn2+与碱性条件下的OH-不共存,会生成Zn(OH)2沉淀,故负极电极方程式变化为:Zn-2e-+2OH-===Zn(OH)2;正极显然参加反应的不再有H+,应为H2O,再据MnO2变化为MnOOH锰化合价降低,得电子,要满足电荷守恒,故生成物中有氢氧根离子,则方程式不难写出。
【答案】(1)MnO2++e-===MnOOH+NH3或 MnO2+H++e-===MnOOH Zn+2MnO2+=== Zn2++2MnOOH+2NH3或Zn+2MnO2+2H+=== 2MnOOH+Zn2+
(2)2MnO2+2H2O+2e-===2MnOOH+2OH-
【变式训练1】(2012新课标Ⅰ)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________ _________________,该电池总反应的离子方程式为______ ___________________。
【解析】既然题目给出与MnO2-Zn电池类似,且为碱性电池,则负极显然是Zn,正极参加反应的是K2FeO4,得电子后变为+3价铁,由于溶液为碱性,故K2FeO4的还原产物为Fe(OH)3;而负极Zn在碱性条件下只能生成Zn(OH)2沉淀,3Zn-6e-+6OH-===3Zn(OH)2;正极反应式为2FeO24-+6e-+8H2O-===2Fe(OH)3+10OH-,总反应的离子方程式相加即得。
【答案】+3e-+4H2O ===Fe(OH)3+5OH- 3Zn++8H2O ===3Zn(OH)2+2Fe(OH)3+4OH-
(2)铜锌原电池的考查
【例2】(2015天津)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO2-4)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【解析】铜锌原电池是最简单的一次电池,教材上又分为有盐桥和无盐桥两种,无论哪种,其原理都一样,即铜作正极,发生还原反应。锌作负极,发生氧化反应。
【答案】C
类型二:二次电池电极方程式的考查
(1)铅蓄电池的考查
【例3】(2014新课标Ⅱ)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。回答下列问题:
PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式:______________________。
【解析】铅蓄电池是二次电池,分为充电和放电。原理为PbO2+Pb+2H2SO4===2PbSO4+2H2O;放电时为原电池,应从左往右看,此时电极称为正负极,负极为Pb,产生Pb2+,与不共存,生成PbSO4,Pb-2e-+===PbSO4;正极为PbO2得电子,生成正二价Pb,同样与不共存生成PbSO4,PbO2+2e-++4H+=== PbSO4+2H2O;充电时为电解池,从右往左看,此时电极称为阴阳极,原来原电池的正极此时应重新由PbSO4变为PbO2,称为阳极,电极反应式为PbSO4+2H2O-2e-=== PbO2++4H+,负极则由PbSO4变为Pb,称为阴极,电极反应式为PbSO4+2e-===Pb+;本题据题意知应重新由Pb(NO3)2变为PbO2,Pb(NO3)2中Pb为+2价,PbO2中Pb为+4价,则Pb(NO3)2会失电子被氧化,应在阳极反应,由于电解质溶液为酸性,故Pb2+变为PbO2,其中氧元素由H2O提供,故可得方程式。
【答案】Pb2++2H2O-2e-===PbO2↓+4H+
(2)手机锂离子电池的考查
常见的手机电池也是二次电池,一般用锂离子电池,因为锂是质量最轻的金属,比能量最高。
【例4】(2014新课标Ⅱ)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是( )

A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
【解析】由图可知,该装置为原电池装置,其中金属锂较活泼,放电时作负极,即b为电池的负极,a处LiMn2O4为电池的正极,则A项对,负极反应式为Li-e-===Li+,LiMn2O4是正极材料,本身不参加反应,反应式为Mn2O4+e-+Li+===LiMn2O4,则放电时总反应方程式为Li+Mn2O4===LiMn2O4或Li1-xMn2O4+xLi ===LiMn2O4;充电时为电解池,总反应方程式为LiMn2O4=== Li1-xMn2O4+xLi,故B项对;放电时,阳离子向正极迁移,阴离子向负极迁移,则Li+应向a迁移,D项对;放电时,a处锂的化合价不发生变化,发生变化的应是Mn2O4中的Mn元素化合价改变。
【答案】C
类型三:燃料电池电极反应式的考查
燃料电池其实也是一次电池,只不过不同于一般的一次电池,因为其燃料未存储在电池内部,而是分别在两极通入。常见的燃料电池即教材上出现的氢氧燃料电池,其电解质溶液有酸性、碱性等。下面笔者归纳了四个方面,即以酸性、碱性、熔融氧化物,熔融分别作电解质,来书写电极方程式。
(1)酸性燃料电池
【例5】(2013新课标Ⅰ)二甲醚(CH3OCH3)可作为一种新型能源。二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为________。
【解析】据题意知本题为二甲醚燃料电池,其原理就是利用二甲醚与氧气的氧化还原反应,总反应为CH3OCH3+3O2===2CO2+3H2O,显然通氧气一极为正极,由于电解质为酸性,有大量的H+,故反应式为O2+4H++4e-=== 2H2O,用总反应方程式减正极反应式即可得答案;或者直接根据化合价知识也可写出,CH3OCH3中碳为-2价,反应后产物应为CO2,+4价,则一分子二甲醚失12电子,据氧守恒反应物补充H2O,则生成物补充H+,再配平即可。
【答案】CH3OCH3+3H2O-12e-===2CO2+12H+
【变式训练2】(2015新课标Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2===6CO2+6H2O
【解析】本题为微生物电池,但材料很新颖,乍一看不知怎么做。不过可根据一般规律即燃料在负极反应,O2在正极,得电子发生还原反应(看图知有质子交换);C6H12O6在负极失电子发生氧化反应。
【答案】A
(2)碱性燃料电池
【例6】(2013新课标Ⅰ,有改动)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚。二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为________。
【解析】本题为二甲醚(CH3OCH3)碱性燃料电池,显然二甲醚在负极反应,O2在正极反应,产物先为CO2和H2O,由于为碱性,CO2继续OH-与反应生成和H2O。故正极方程式为O2+2H2O+4e-===4OH-,负极反应二甲醚中碳为-2价,反应后CO32-中碳为+4价,则负极方程式为CH3OCH3+16OH--12e-===+11H2O,电池总反应为CH3OCH3+3O2+4OH-===+5H2O
【答案】CH3OCH3+16OH--12e-===+11H2O
(3)熔融氧化物燃料电池
【例7】(2013北京)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
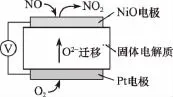
①Pt电极上发生的是__________(填“氧化”或“还原”)反应。
②写出NiO电极的电极反应式:__________________ _____________。
【解析】本题较简单,通过示意图可看出O2得电子变为O2-,则通O2一极应为正极,即Pt电极上发生还原反应,电极反应式为O2+4e-===2O2-;通NO一极应为负极,由图可知NO变为NO2,失电子,发生氧化反应,反应式为NO+O2--2e-===NO2,电池总反应为2NO+O2===2NO2。
【答案】①还原 ②NO+O2--2e-===NO2
(4)熔融碳酸盐燃料电池
【例8】(2015江苏)一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O3H+CO,每消耗1mol2CH4转移12mol电子
B.电极A上H2参与的电极反应为H2+2OH--2e-===2H2O
C.电池工作时,CO23-向电极B移动
D.电极B上发生的电极反应为O2+2CO2+4e-
【解析】本题较复杂,首先是左边的CH4和H2O变为H2和CO,然后H2和CO再在电极A上反应生成CO2和H2O,显然H2和CO中氢元素和碳元素的化合价升高,发生氧化反应,电极A为负极,则通O2的一极即电极B为正极,发生还原反应,由于有参与循环,则电极A上H2参与的反应为H2+-2e-===CO2+2H2O,CO参与的反应为CO+-2e-===2CO2;电极B上O2参与的反应为O2+2CO2+4e-===,总反应为CO+3H2+ 2O2===CO2+3H2O。
【答案】D
【变式训练3】书写甲烷燃料电池在下列条件下的电极反应式:
(1)酸性条件下,负极___________;正极___________;总反应________。
(2)碱性条件下,负极___________;正极___________;总反应________。
(3)熔融Y2O3-Na2O为电解质(O2-参与循环),负极________;正极________;总反应________。
【答案】(1)负极CH4+2H2O-8e-===CO2+8H+
正极2O2+8H++8e-===4H2O
总反应CH4+2O2===CO2+2H2O
(2)负极CH4+10OH--8e-===+7H2O
正极2O2+4H2O+8e-===8OH-
总反应CH4+2O2+2OH-===+3H2O
(3)负极CH4+4O2--8e-===CO2+2H2O
正极2O2+8e-===4O2-
总反应CH4+2O===2CO2+2H2O
(4)负极CH4+4CO2-3-8e-===5CO2+2H2O
正极2O2+4CO2+8e-===4CO2-3
总反应CH4+2O===2CO2+2H2O
综上所述,笔者认为书写电极方程式的一般方法为,第一步应找准对象,看正负极材料及参加反应的物质是什么,发生什么反应;第二步要根据化合价变化算准得失,即电子个数要弄对;第三步则要根据题目所给的环境,巧用氢氧元素去写出两极方程式;第四步则注意两极方程式的得失电子相等或守恒,相加为总方程式,利用此原理,当某一极方程式较难时,也可先写总方程式和较简单一极的方程式,相减即得。
【考点定位及解题建议】高考题中关于原电池主要考查反应原理,涉及反应类型、离子浓度的变化、电极的判断、离子的移动方向的判断等。电化学反应原理是选修4中的重要内容,也是难点之一。原电池的反应原理的应用,抓住化学反应的本质、正负极的判断、正负极反应类型的判断、电极反应式的书写、总反应方程式的书写、电子的流向、电流的流向、溶液中离子的流向、电极是否参加反应、电子的转移、有关氧化还原反应的计算、离子交换膜的判断等都是解题的关键。
(作者单位:湖北省荆州市公安县南闸中学)

