透析密度应用
安徽 黎绍亮 王贺法
透析密度应用
安徽 黎绍亮 王贺法
密度是指在一定温度和压强下,某种物质的质量和其体积的比值,即某种物质单位体积内所含物质的质量数。作为物理学科的一个基本概念,它表示物质的一种特性,不随质量和体积的变化而变化,只随物质温度、压强变化而变化。密度在化学中也广泛应用,主要体现在四个方面:常见不同物质密度的相对大小比较、气态或液态物质间密度的半定量比较、液体密度的有关计算和晶体密度的有关计算。
一、常见不同物质密度的相对大小比较
常见不同物质密度的相对大小比较,可以是气体间密度大小比较,运用排气收集气体法实验;可以是气体和液体间密度比较,运用排液收集气体法实验;可以是液体间密度大小比较,运用(互不相溶、互不反应)液体间的萃取、分液实验。
【例1】用如图装置收集NO气体,不正确的操作是( )
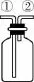
A.从①口进气,用排水法集气
B.从①口进气,用排氢气法集气
C.从②口进气,用排水法集气
D.从②口进气,用排二氧化碳法集气
【答案】A
【解析】由于NO气体能与空气中的氧气迅速反应,且其密度与空气接近,不能用排空气法收集,因此只能用排“惰性气体”法收集:由于其密度大于氢气,可以用向上排氢气法收集,选项B(长进短出)不符合题意;由于一氧化氮密度小于二氧化碳,可以用向下排二氧化碳法收集,选项D(短进长出)不符合题意。由于NO气体密度比水小,且不溶于水、不与水反应,因此能用排水法收集,即选项C(短进长出)不符合题意,选项A(长进短出)符合题意。
【例2】(2013·广东,节选)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( )

【答案】C
【解析】氯气是密度比空气大且有毒的气体,必须用碱性物质(如氢氧化钠溶液)吸收尾气。选项A,用单孔塞的集气瓶,不能排出空气,装置不合题意;选项B,应该短进长出收集,且缺少尾气处理,装置不合题意;选项D,氯气直接被装置中的氢氧化钠溶液反应,装置不合题意;选项C,既考虑到氯气与空气相对密度大小,用长进短出收集,又用防止倒吸装置吸收尾气,装置符合题意。
【例3】(2014·新课标Ⅰ,节选)在反应器皿A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤。在洗涤、分液操作中,应充分振荡,然后静置,待分层后( )
A.直接将乙酸异戊酯从分液漏斗的上口倒出
B.直接将乙酸异戊酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
【答案】D
【解析】乙酸异戊酯不溶于水,不与水反应,且密度比水小,因此液体发生分层。在分液操作时,应该使密度较大的下层(即水层)先从分液漏斗的下口放出,再将密度较小的上层(即乙酸异戊酯)从上口倒出。
二、密度的半定量比较
【例4】下列说法正确的是( )
A.质量相等、密度不等的N2和C2H4的分子数一定相等
B.等体积、等密度的CO2和C2H4的分子数一定相等
C.等体积、等密度的盐酸和硝酸溶液含有的氢离子数目相等
D.等体积、等物质的量浓度但密度不等的盐酸和硝酸溶液中含有的氢离子数目不相等
【答案】A
【解析】选项A,质量相等的N2和C2H4,由于二者摩尔质量都是28g/mol,因此二者的物质的量相等,分子数也一定相等。该种情况下,分子数与气体密度无关,命题正确;选项B,等体积、等密度的CO2和C2H4,二者质量相等,但二者摩尔质量不同,因此二者的物质的量不相等,分子数也一定不相等,命题不符合题意;选项C,等体积、等密度的盐酸和硝酸溶液,说明两种溶液的质量相等,但溶质的物质的量浓度未知,溶液中含有的氢离子数目也不一定相等,命题不符合题意;选项D,等体积、等物质的量浓度的盐酸和硝酸溶液,含有相同物质的量溶质,因此溶液中含有的氢离子数目相等,命题不符合题意。
【例5】在一定温度下,不论容器体积是否改变,下列可逆反应中密度一定能作为化学平衡标志的是( )

【答案】C
【解析】根据密度公式ρ(g)=m(g)总÷V(器),对于全气体参加的可逆反应体系,根据质量守恒定律,m总(g)(即气体总质量)始终相等,分为两种情况:ΔV(g)=0的反应,气体总物质的量是个恒量,容器体积不随反应变化,因此密度一定不能作为化学平衡标志,选项D不符合题意;ΔV(g)≠0的反应,如果保持容器体积不变,密度一定不能作为化学平衡标志。但保持恒压,气体总物质的量在未达到平衡前是一直变化的量,到达平衡才是一个恒量。同时,容器的体积会随气体总物质的量的变化而变化,则密度未达到平衡前是一直变化的,到达平衡才是一个恒量,因此可以作为化学平衡标志。综合可知选项A、B均不符合题意。
对于不是全气体参加的可逆反应体系,根据质量守恒定律,m总(g)(即气体总质量)在未达到平衡前是一直变化的量,到达平衡才是一个恒量。因此,不论容器体积是否改变,此时密度也一定在未达到平衡前是一直变化的量,到达平衡才是一个恒量。选项C中物质C是固体,H2O、CO、H2为气体,命题符合题意。
三、液体密度的有关计算
【例6】两种硫酸溶液,一种硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2;将它们等体积混合后,所得溶液的密度为ρ3,则混合后溶液的物质的量浓度为____________。
【答案】
【解析】根据物质的量浓度和密度的基本公式计算:
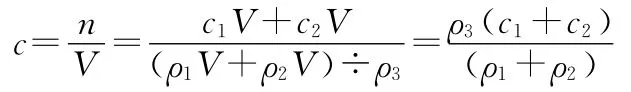
【例7】密度为0.91g/mL的氨水,质量百分比浓度为25%,该氨水用等体积的水稀释后,所得溶液的质量百分比浓度为( )
A.等于12.5% B.大于12.5%
C.小于12.5% D.无法确定
【答案】C
【解析】两种质量百分比浓度不相同的同种溶质溶液,只有等质量混合时,混合溶液的质量百分比浓度才能是两个质量百分比浓度的平均值。根据题意,水的密度(1.0g/mL)大于氨水的密度(0.91g/mL),当它们等体积混合后,水的质量比原氨水的质量多,即混合后溶液的总质量是原氨水的质量的2倍多,所以混合溶液的溶质质量百分比浓度一定小于平均值12.5%。
四、晶体密度的有关计算
【例8】(2014·新课标Ⅰ,37节选)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_______。列式表示Al单质的密度________g/cm3(不必计算出结果)。
【答案】12
【解析】面心立方晶体,属于在二维密置层的基础上进行的ABC型三维堆积,并可以截出相应的晶胞,因此晶胞中铝原子的配位数为12。
计算铝单质密度,实际上就是要计算出1mol晶胞的质量和1mol晶胞的体积,二者的比值就是单质密度。(1)求1mol晶胞的质量。先计算出一个晶胞含有Al原子个数为,则1mol晶胞含有4mol铝,其质量为27g/mol×4mol=27×4g;(2)求1mol晶胞的体积。先计算出一个晶胞的体积为(0.405nm)3=(0.405× 10-7m)3,需注意单位一致。则1mol晶胞的体积为(0.405×10-7cm)3×6.02×1023。综合(1)(2)可得到铝单质的密度,即
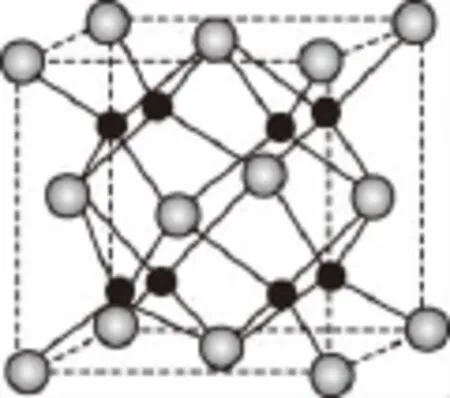
【例9】(2015·新课标Ⅱ,37节选)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________;晶胞中A原子的配位数为________;列式计算晶体F的密度:________g/cm3。
【答案】Na2O 8
【解析】根据题意,可以判断出A为氧元素,B为钠元素。再观察晶胞结构,①已知微粒半径O2->Na+,则以面心立方排列的是A元素微粒,即氧离子,共有6=4;晶胞内部排列的为B元素微粒,即钠离子,共有1× 8=8。综合得到F的化学式为Na2O。②晶胞中A原子(即阳离子)的最邻近原子为钠离子,以晶胞上面的面心位置处的阳离子为例,可知其下方有4个钠离子,同样其上方也有4个钠离子,故A原子的配位数为8。③计算晶体的密度,实际上就是要计算出1mol晶胞的质量和1mol晶胞的体积,二者的比值就是物质密度。已知一个晶胞含有4个氧离子和8个钠离子,则1mol晶胞含有8mol钠离子和4mol氧离子,1mol晶胞的质量为(23×8+16×4)g;一个晶胞的体积为(0.566×10-7)3cm3,1mol晶胞的体积(0.566×10-7)3×6.02×1023cm3。综合可得该晶体的密度
(作者单位:安徽省阜阳市第五中学安徽省阜阳市红旗中学)

