高考新宠
——pH
湖北 汪 洋
高考新宠
——pH
湖北 汪 洋
pH是溶液中氢离子物质的量浓度的负对数,即pH=-lgc(H+)。当溶液中c(H+)≤1mol·L-1时,直接用氢离子物质的量浓度表示溶液的酸碱性不方便,而用pH表示。常温下pH的范围在0~14之间,pH<7,溶液显酸性;pH=7,溶液呈中性;pH>7,溶液显碱性。在近几年全国各地高考题中,以pH为中心,与其他知识结合的试题俯拾即是,现选取几例,以飨读者。
一、pH与溶度积
【例1】(2013新课标卷Ⅱ·13)室温时,M(OH)2(s)M2+(aq)+2OH-(aq),Ksp=a;c(M2+)=b mol·L-1时,溶液的pH等于( )

【解析】因为M(OH)2(sM2+(aq)+2OH-(aq);椐据难溶物溶度积的定义有:Ksp=c(M2+)·c2(OH-)=a;c2(OH-)=,再结合水的离子积公式Kw=c(H+)·
【答案】C
【点拨】要搞清pH、溶度积、水的离子积的定义;水的离子积与温度有关,温度一定,水的离子积一定;难溶物质的溶度积也与温度有关,温度一定,难溶物质的溶度积一定。类似地,我们还可以计算出某离子开始沉淀及沉淀完全时的pH。
二、pH与电解质溶液的稀释
【例2】(双选)(2014上海·21)室温下,甲、乙两烧杯均盛有5mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是( )
A.溶液的体积:10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙
【解析】若该一元酸是强酸,则10V甲=V乙;若该一元酸是弱酸,稀释时会继续电离,加水稀释至10V甲=V乙时,pH<4;而要加水稀释至pH=4,需要多加水,即10V甲<V乙,A正确;室温下,甲溶液中水电离出的OH-的浓度为10-11mol·L-1,乙溶液中水电离出的OH-浓度为10-10mol·L-1,即10c(OH-)甲=c(OH-)乙,B错误;稀释不改变溶质的物质的量,即两溶液中酸的物质的量相等,分别用等浓度的NaOH溶液完全中和,消耗NaOH溶液体积相等,若是强酸,所得溶液显中性,pH:甲=乙,若是弱酸,则生成强碱弱酸盐,乙中溶液浓度较小,c(OH-)小,pH小,pH:甲>乙,即pH:甲≥乙,C错误;若分别与5mL pH=11的NaOH溶液反应,若是强酸,所得溶液显中性,pH:甲=乙,若是弱酸,则酸过量,溶液显酸性,乙中浓度小酸性较弱,pH较大,即pH:甲≤乙,D正确。
【答案】AD
【点拨】对于强酸溶液(pH=a),每稀释10n倍,pH增大n个单位,即pH=a+n且pH<7;对于弱酸溶液(pH=a),每稀释10n倍,pH的范围是:a<pH<a+n<7,即对于pH相同的强酸和弱酸,稀释相同的倍数,强酸的pH变化的程度大;对于强碱溶液(pH=b),每稀释10n倍,pH减小n个单位,即pH=b-n且pH>7;对于弱碱溶液(pH=b),每稀释10n倍,pH的范围是:7<b-n<pH<b,即对于pH相同的强碱溶液和弱碱溶液,稀释相同的倍数,强碱的pH变化的程度大。在稀释过程中,如果酸溶液中氢离子浓度、碱溶液中氢氧根离子浓度小于10-5mol·L-1时,要考虑水的电离。常温下任何溶液的稀释,溶液的pH都向7靠近。
三、pH与酸碱中和滴定图象
【例3】(2015山东·13)室温下向10mL 0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )
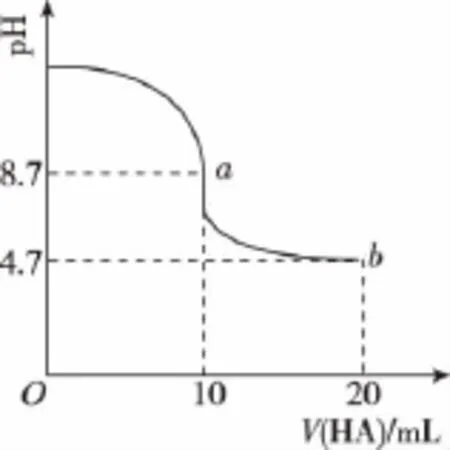
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
【解析】a点HA溶液体积是10mL,与NaOH恰好完全反应,溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生水解反应,A-+H2OHA+OH-,c(Na+)>c(A-)>c(HA)>c(H+),A错误;a点NaA发生水解反应,促进了水的电离,b点HA与NaA等物质的量,溶液显酸性,抑制水的电离,所以a点水的电离程度大于b点水的电离程度,B错误;根据电荷守恒,c(H+)+c(Na+)=c(OH-)+c(A-),pH=7,则c(H+)=c(OH-),则c(Na+)=c(A-),C错误;b点HA过量且HA与NaA等物质的量,溶液呈酸性,HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),D正确。
【答案】D
【点拨】从酸碱中和滴定图象中提取信息时一定要搞清酸碱恰好反应的点对应的体积与pH,恰好反应时,室温下的溶液pH不一定等于7;室温下的溶液pH等于7时不一定恰好反应。记住“有弱才水解,越弱越水解,谁强显谁性,弱弱具体定”。根据生成的盐的阴阳离子具体分析水解情况;能灵活运用物料守恒、电荷守恒,质子守恒进行离子浓度的比较。
四、pH与pOH
【例4】(2013山东·13)某温度下,向一定体积0.1mol·L-1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg(OH-)]与pH的变化关系如图所示,则( )

A.M点所示溶液导电能力强于Q点
B.N点所示溶液c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
【解析】Q点的pOH=pH,溶液为中性,因此M点溶液为酸性,N点溶液为碱性。由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,A错误;N点所示溶液为碱性,根据溶液电荷守恒c(Na+)+c(H+)=c(CHCOO-)+c(OH-),易得出:c(Na+)>c(CH3COO-),B错误;由于M点的c(H+)等于N点的c(OH-),对水的电离抑制能力相同,所以M点和N点水电离程度相同,C正确;Q点的pOH=pH,溶液为中性,而两者等浓度、等体积混合后恰好完全反应生成醋酸钠,水解显碱性。则所加NaOH溶液体积略小于醋酸溶液的体积时,Q点的pOH=pH,D错误。
【答案】C
【点拨】pH是溶液中氢离子物质的量浓度的负对数,pOH是溶液中氢氧根离子物质的量浓度的负对数;由于Kw=c(H+)·c(OH-),因此:pOH+pH=-lgKw,室温下,同一溶液的pOH+pH=14;无论什么温度下,当c(H+)=c(OH-)或pOH=pH时,就是中性溶液。
五、pH与pM
【例5】(2013江苏·14)一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知:pM=-lgc(M),p(CO2-3)=-lg c(CO2-3)。下列说法正确的是( )


【解析】pH越大,c(H+)越小;同理pM、p数值越大,对应的实际浓度越小。而MgCO3、CaCO3、MnCO3是同类型的难溶物,因此MgCO3、CaCO3、MnCO3的Ksp依次减小,A错误;a点在斜线上,表示MnCO3溶液是饱和溶液,a点又在角平分线上,故c(Mn2+)=,B正确;b点在斜线上,表示CaCO3溶液是饱和溶液,但b点位于斜线与角平分线交点下方,b点pM<p(),图中数值越大,实际浓度越小,故c(Ca2+)>c(),C错误;c点在曲线上方,可表示MgCO3的不饱和溶液,c点位于斜线与角平分线上方,p()<pM,且图线中数值越大,实际浓度越小,故c(Mg2+)<c(),D正确。
【答案】BD
【点拨】能根据pH定义认识pM、p;根据pH越大,c(H+)越小的关系认识到当p<pM时,;当=pM时,;当时,;三条实线中,每条实线上的点都表示饱和溶液,实线上方的点都表示不饱和溶液,实线下方的点都表示过饱和溶液。
六、pH与弱电解质平衡体系中各微粒浓度变化
【例6】(2015浙江·12)40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
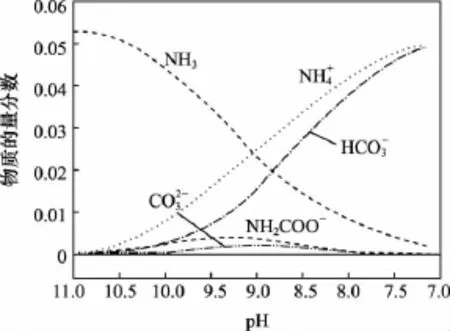
C.随着CO2的通入不断增大
D.在溶液中pH不断降低的过程中,有含NH2COO-的中间产物生成
【解析】过pH=9.0的点作横轴的垂线与图中五条曲线有五个不同的交点,从图中可以看出:c(NH+4)>c(HCO-3)>c(NH2COO-)>c(CO2-3),A正确;根据溶液中各离子的电荷守恒,得出:c(NH+4)+c(H+)=2c(CO2-3)+c(HCO-3)+c(NH2COO-)+c(OH-),B正确;随着CO2的通入,温度一定,氨水的电离平衡常数Kb不变,而从图中可以看出,是不断增大的,因此不断减小,C错误;在溶液中pH不断降低的过程中,有含NH2COO-的中间产物生成,D正确。
【答案】C
【点拨】学生要能够从图中获取解题的有用信息,图中所含几种粒子及粒子浓度的变化趋势特别是横轴与纵轴表示的意义及数据的变化趋势,pH相同时,各微粒的物质的量分数越大,该微粒的物质的量浓度越大。
(作者单位:湖北省随州市曾都区第一高级中学)
——饱和溶液与不饱和溶液

