化学反应与能量变化热点题型分析
湖北 罗功举
化学反应与能量变化热点题型分析
湖北 罗功举
化学反应过程中既包括“质”的变化,又包括“能”的变化,而“能”的变化主要以反应热的形式表现出来,是化学反应研究的重点内容之一,也是历年高考考查的热点知识。下面将其常考题型分析如下,供参考。
题型一:反应热的计算
【方法精要】(1)利用热化学方程式进行相关量的求解,可先写出热化学方程式,再根据热化学方程式所体现的物质与物质间、物质与反应热间的关系直接或间接求算物质的质量或反应热。需要注意的事项有:①反应热数值与各物质的化学计量数成正比,因此热化学方程式中各物质的化学计量数改变时,其反应热数值需同时做相同倍数的改变。②热化学方程式中的反应热是指反应按所给形式完全进行时的反应热。③正、逆反应的反应热数值相等,符号相反。
(2)根据燃烧热计算:可燃物完全燃烧产生的热量=可燃物的物质的量×燃烧热。
(3)根据键能计算:反应热(焓变)等于反应物中的键能总和减去生成物中的键能总和,ΔH=∑E反-∑E生(E表示键能)。
例1 (2005天津)磷在氧气中燃烧,可能生成两种固态氧化物P2O3和P2O5,现将3.1g的单质磷(P)在3.2g氧气中燃烧至反应物耗尽,并放出XkJ的热量。
(1)反应后生成物的组成(用化学式表示)是________,其相应的质量为________。
(2)已知单质磷的燃烧热为YkJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH=________。
(3)若3.1g磷在3.6g氧气中燃烧,至反应物耗尽,并放出ZkJ的热量,则X________(填“<”“>”或“=”)Z。
(4)磷的两种氧化物中,较稳定的是________。
分析:(1)3.1g P和3.2g O2的物质的量均为0.1mol,由可知:所以燃烧后P、O2均耗尽,生成0.025mol P2O3和0.025mol P2O5,共放出热量XkJ。则m(P2O3)=0.025mol×110g·mol-1=2.75g,m(P2O5)=0.025mol×142g·mol―1=3.55g。
(2)由燃烧热的概念可知,1mol P完全燃烧生成P2O5时放出的热量为Y kJ,则0.05mol P完全燃烧生成0.025mol P2O5放出的热量为0.05YkJ,那么,0.05mol P燃烧生成0.025mol P2O3放出的热量为(X-0.05Y)kJ,则1mol P燃烧生成P2O3放出的热量为(X-0.05Y)/0.05=(20 X-Y)kJ,故ΔH=-(20 X-Y)kJ·mol―1。
(3)将3.6g分为3.2g和0.4g,则可将题设情况理解为P2O3继续在0.4g氧气中燃烧放热,故X<Z。
(4)因为P2O3还可以继续被氧化为P2O5,故磷的两种氧化物中,P2O5较稳定。
点拨处理混合物(如H2和CH4的混合气体燃烧)计算、平行反应(如P在Cl2中燃烧)计算等问题时,可以用列方程组的方法解题,如本题第(1)问。也可用元素守恒法写“总反应式”,再结合部分反应结果进行加减推算,如本题第(2)问。
题型二:热化学方程式的书写与正误判断
【方法精要】(1)书写要领:①必须在化学方程式的右边标明反应热ΔH的符号、数值和单位(ΔH与最后一种生成物之间留一空格);②ΔH与测定条件(温度、压强等)有关、因此应注明ΔH的测定条件。绝大多数ΔH是在25℃、101kPa下测定的,此时可不注明温度和压强;③反应热与物质的聚集状态有关,因此必须注明物质的聚集状态(s、l、g),溶液中的溶质标明“aq”。化学式相同的同素异形体除标明状态外还需标明其名称[如C(s,金刚石)]。热化学方程式中不标示“↑”和“↓”,一般不需在等号或箭头上写“点燃、△、高温、催化剂”等条件;④热化学方程式中的化学计量数只表示物质的量而不表示分子数或原子数。因此化学计量数可以是整数,也可以是分数;⑤书写燃烧热、中和热的热化学方程式时,要注意其限定要求,即可燃物或水(l)的计量数为1,ΔH的数值与其匹配。
(2)正误判断视角:①热化学方程式是否已配平,是否符合客观事实;②各物质的聚集状态是否标明、是否正确;③反应热ΔH的数值与该热化学方程式的化学计量数是否对应;④反应热ΔH的符号是否正确,放热反应的ΔH为“-”,吸热反应的ΔH为“+”,是否漏写或写错单位。
例2 化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃。室温时AX3与气体X2反应生成1mol AX5,放出热量123.8kJ。该反应的热化学方程式为_____________。(其他各问从略)
分析:本题并未直接给出各物质的聚集状态,而是给出各物质的性质(熔沸点),要求由此先判断出各物质的聚集状态,显然AX3为液态、AX5为固态;再写出反应方程式,为AX3+X2===AX5,进而确定反应热ΔH=-123.8kJ/mol;然后加上各物质的状态,即得完整的热化学方程式,为AX3(l)+X2(g)===AX5(s) ΔH=-123.8kJ/mol。
点拨遇到需要计算才能确定ΔH的热化学方程式书写问题时,应先以反应方程式为依据找到关系式、关系量,然后列式计算,求出│ΔH│,最后再按基本书写方法完成反应式。特别注意:不能漏写或错写物质的聚集状态、ΔH的“+”“-”号及单位。
题型三:图象分析
【方法精要】一要看清楚图象的横、纵坐标的含义;
二要看清反应物、生成物的能量高低及微粒呈现形式(如分子或原子、聚集状态),特别要注意各能量状态下的原子个数是守恒的;
三要注意图中的数据,有的是给出ΔH,它包含“+”“-”号、数值或字母及单位(kJ/mol),有的是给出Q,它只含数值或字母及单位(kJ);
四要注意各微粒的计量数(数值或字母),它与ΔH或Q的大小是呈比例的,计算或书写热化学方程式时,特别要注意这一点。
例3 当今世界,能源的发展日益成为全世界、全人类共同关注的问题。乙烷、二甲醚燃烧热较大,可用作燃料,如图是乙烷、二甲醚燃烧过程的能量变化图。请回答下列问题:

(1)乙烷的燃烧热ΔH=________kJ/mol。
(2)等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物放出的热量________(填“多”或“少”)。
(3)根据该图写出二甲醚燃烧的热化学方程式:___________________。
(4)二氧化碳是重要的温室气体,从环保角度分析,放出相同的热量时选择________(填“乙烷”或“二甲醚”)作为燃料产生的CO2较少。
分析:注意观察图示,图中各物质的计量数中,只有H2O前的计量数为1,其他各物质的计量数均为字母,因此以产物1mol H2O(l)作基准,确定a=1/3,b=7/6,c=1,d=2/3,得:

所以乙烷的燃烧热ΔH=-520kJ/mol×3=-1 560kJ/mol。
由于液态乙烷所具有的能量低于气态乙烷具有的能量,故生成稳定氧化物时放出的热量少。放出相同热量时,由方程式知乙烷产生CO2较少。
答案:(1)-1 560 (2)少 (3)CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 455kJ/mol或CH3OCH3(g)+O2(g)===CO2(g)+H2O(l) ΔH=-485kJ/mol (4)乙烷
点拨本题易出现的典型错误是看图不仔细,未判断出a=1/3,导致第(1)问结果错答为-520/a、第(3)问热化学方程式中前三种物质的计量数还为字母,因此,看清图象中各要素是正确解题的前提。
题型四:物质的稳定性比较或判断
【方法精要】(1)对于图象类问题,则根据“物质具有的能量越低,其稳定性越好”这一规律判断;
(2)判断同素异形体的稳定性,可以根据其相互转化的热化学方程式或盖斯定律分析,若由A→B的转化是吸热反应,则A的稳定性好,反之,B的稳定性好。
(3)判断同分异构体的热稳定性,可以根据其燃烧热数据判断,燃烧热数值大的,其热稳定性差;也可以用作图(能量变化示意图)法分析,它们完全燃烧的产物相同,产物具有的总能量相同,但反应物能量不同,进而可确定物质的稳定性。
例4 一些烷烃的燃烧热如下表:
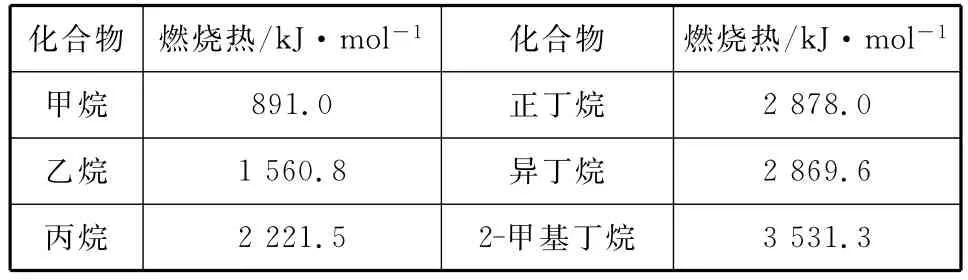
化合物燃烧热/kJ·mol―1化合物燃烧热/kJ·mol―1__甲烷__ ______891.0正丁烷2 878.0_____乙烷1 560.8异丁烷3 531.3 2 869.6_____丙烷__ ______2 221.5 2-甲基丁烷
下列表达正确的是( )
A.正戊烷的燃烧热大于3 531.3kJ·mol―1
B.稳定性:正丁烷>异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1 560.8kJ·mol―1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
分析:正戊烷和2-甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,互为同分异构体的化合物中,支链多的燃烧热小,故正丁烷的燃烧热大于2-甲基丁烷的,即正戊烷的燃烧热大于3 531.3kJ/mol,A项正确。由表格中的数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷具有的能量低(用作图法分析更易判断),即热稳定性为正丁烷<异丁烷,故B项错误;根据乙烷燃烧热的含义:完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1 560.8kJ的热量,所以热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=―3 121.6kJ/mol,故C项错误;相同质量的烃(视为CHx),含氢量越高,燃烧放出的热量越多,或直接比较1g的各烃燃烧放出的热量,甲烷为55.7kJ,乙烷为52.0kJ,丙烷为50.5kJ,D项错误。答案为A。
点拨判断物质稳定性时,要分清问题类型,找准判断依据;对于表格数据类问题,则要善于总结归纳,从数据中发现规律,并迁移应用到新的问题分析中,再解决之。
题型五:ΔH的大小比较
【方法精要】(1)ΔH带“+”“-”号,比较其大小时也应考虑“+”“-”号。
(2)根据反应物的本性比较。等物质的量的不同物质与同一种物质反应时,性质不同,其反应热不同。如等物质的量的不同金属或非金属与同一种物质反应,金属或非金属越活泼,反应就越容易发生,放出的热量就越多,ΔH越小。
(3)依据盖斯定律,或把热化学方程式看作数学中的代数方程进行加、减、乘、除等数学运算,借助所得新反应的ΔH即可比较运算前各反应的ΔH的大小。
(4)根据反应进行程度比较。对于多步进行的放热反应(如磷在氧气中燃烧可生成P2O3和P2O5),反应越完全,则放热越多,ΔH越小。对于可逆反应,若正反应是放(吸)热反应,反应程度越大,反应放出(吸收)的热量越多,ΔH越小(大)。
(5)根据反应规律及影响ΔH大小的因素比较。如同一反应中,当物质状态不同时,要考虑物质在三态变化中自身的能量大小;等量的某物质完全反应,生成稳定(价态、状态)的产物比生成不稳定的产物放出的热量多(如碳燃烧生成CO2和CO);中和反应中,生成等量的水,当有弱电解质参与反应时,放出的热量要少,ΔH则大;等等。
(6)根据物质的稳定性比较。同素异形体和同分异构体完全燃烧时,其产物是相同的,物质能量越高,反应放出的热量越多,ΔH越小。
例5 (2014新课标Ⅱ)室温下,将1mol的CuSO4· 5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4· 5H2O(s)===CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断中正确的是( )
A.ΔH2>ΔH3
B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2
D.ΔH1+ΔH2>ΔH3
分析:根据题意知,CuSO4·5H2O(s)溶于水的热化学方程式为CuSO4·5H2O(s)===Cu2+(aq)+SO2-4(aq)+5H2O(l),降温吸热,ΔH1>0;CuSO4(s)溶于水的热化学方程式为CuSO4(s)===Cu2+(aq)+SO2-4(aq),升温放热,ΔH2<0;根据盖斯定律知,CuSO4·5H2O受热分解的热化学方程式为:CuSO4·5H2O(s)===CuSO4(s)+5H2O(l),ΔH3=ΔH1-ΔH2>0。A项,根据上述分析知,ΔH2<ΔH3,错误;B项,根据上述分析知,ΔH1<ΔH3,正确;C项,根据上述分析知,ΔH3=ΔH1-ΔH2,错误;D项,根据上述分析知,ΔH1+ΔH2<ΔH3,错误。故答案为B。
点拨第一,本题反应关系可以设计为盖斯定律循环图,用此方法分析更直观、简单。第二,比较ΔH大小和比较ΔH数值大小是不同的,前者要考虑“+”“-”号,后者只需看数值大小。因此,解题时要注意审题。
题型六:盖斯定律的应用
【方法精要】(1)推算某些难以通过实验直接测定的化学反应的焓变时,可以通过设计循环路线法来解决。设计时,只要抓住起始反应物和最终的生成物,设计一个封闭的循环路线就行。分析时要注意两点:一是该方法的原理与高中物理知识中的位移和路程关系类似;二是起始反应物和最终的生成物的状态要分别相同。
(2)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到新的热化学方程式,可进行反应热的有关计算。其注意的事项有:①热化学方程式同乘某一个数时,反应热数值也必须乘上该数。②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。③将一个热化学方程式左右两边的物质进行颠倒时,ΔH的“+”“-”号必须随之改变。
例6 (2015重庆)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=xkJ·mol-1。已知碳的燃烧热ΔH1=akJ·mol-1,S(s)+2K(s)===K2S(s)ΔH2=b kJ·mol-1,2K(s)+N2(g)+3O2(g)===2KNO3(s)ΔH3=c kJ·mol-1,则x为( )
A.3a+b-c B.c+3a-b C.a+b-c D.c+a-b
分析:根据题意,先写出硫的燃烧热的热化学方程式,为:C(s)+O2(g)CO2(g) ΔH1=akJ·mol-1;然后将ΔH数据已知的三个热化学方程式依次记为①、②、③;由这三个反应式求对象反应的ΔH的方法是:①×3+②-③,解得:S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=(3a+b-c)kJ·mol-1。故答案为A。
点拨用热化学方程式加减法计算反应热时,一定要根据对象反应式中各物质的计量数确定四则混合运算式,盲目加减是会出现错误的。另外,答题时还要注意题设要求,如书写所推热化学方程式时,则不能漏写物质状态;如计算ΔH时,不能漏写单位等。
除上述类型的问题外,还有概念辨析(如燃烧热、中和热等)、吸热反应和放热反应实例的判断、学科内综合问题(如与化学平衡、氧化还原反应、化学实验等相联系)分析等,不一一列举。总之,通过学习,要初步掌握各类常考题型及涉及知识内容、解题方法等,唯有如此,我们的能力才会不断提高。
(作者单位:湖北省枝江一中)

