用于检测巯基化合物的荧光探针的研究进展
刘 柳,马景川,盖冬玮,张 妍,冯 昕,马梦瑶,张 明,武祥龙
(西北工业大学生命学院 空间生物实验模拟技术重点实验室,陕西 西安 710072)
用于检测巯基化合物的荧光探针的研究进展
刘柳,马景川,盖冬玮,张妍,冯昕,马梦瑶,张明,武祥龙
(西北工业大学生命学院 空间生物实验模拟技术重点实验室,陕西 西安 710072)
摘要:巯基化合物在生物体内有着重要的生理作用,它的有效检测在病理学和生命科学领域具有非常重要的应用价值。依据荧光探针的结构,分类综述了可检测巯基化合物的荧光探针的研究进展。
关键词:巯基化合物;荧光探针;检测
生物体内巯基化合物是构成蛋白质和某些大分子(如半胱氨酸、同型半胱氨酸、谷胱甘肽等)的主要物质,在人体生理活动中起着至关重要的作用,不仅参与了许多重要的细胞反应过程(包括氧化还原平衡和细胞生长),还可以表征细胞内氧化还原状态以及蛋白质的高级有序结构[1]。细胞内巯基化合物的水平与人体的许多疾病有关。如半胱氨酸水平异常与儿童生长缓慢、毛发色素脱失、水肿、嗜睡、肝损害、皮肤病变等[2]密切相关;同型半胱氨酸水平异常是导致心血管疾病与阿尔茨海默病的一个重要因素,也与神经管畸形、妊娠并发症、炎症性肠病、骨质疏松症有关[3];谷胱甘肽与许多细胞反应过程有关,包括细胞内的氧化还原平衡、外源性物质的代谢与维持、细胞内信号传导、基因调控等。异常的谷胱甘肽水平会导致癌症、不正常的衰老、心脏问题和其它疾病的发生[4]。
基于巯基化合物在生物体内的重要生理作用,它的有效检测在病理学和生命科学领域具有非常重要的应用价值。目前检测巯基化合物的方法主要有高效液相色谱法、酶法、电化学分析法、环化反应动力学法、紫外分光光度法和荧光光谱法[5]。其中,荧光光谱法因具有灵敏度高、选择性强、快速简便等优点已成为研究热点。近年来,用于检测巯基化合物的荧光探针发展迅速,各种探针不断涌现,作者在此根据荧光探针的结构,分类综述了用于检测巯基化合物的荧光探针的研究进展。
1荧光纳米材料荧光探针
1.1荧光金纳米团簇
纳米生物技术是整合了纳米技术、生物学、生物化学和医学等学科的交叉学科,在医药、生命科学、材料科学等领域有着广泛的应用。通常,当物质的尺度降至纳米级别时,其物化性质也随之发生巨大变化,特别是光学性质的改变为其在生物标记和光学影像领域的应用带来极大的发展空间。金纳米团簇(AuNCs)是由几个至几十个金原子组成的具有荧光性和良好水溶性的稳定聚集体,是一种新型的荧光纳米材料。Xu等[6]研究发现,聚合物保护的金纳米粒子(AuNPs)通过共振能量转移机制(FRET)有效猝灭AuNCs的荧光;引入半胱氨酸后,AuNCs的荧光恢复。基于此原理,设计合成了一种新的AuNCs和聚合物保护的AuNPs荧光探针。
当PDMAM(高分子絮凝剂)-AuNPs加入到BSA(牛血清白蛋白)-AuNCs溶液中时,能有效猝灭BSA-AuNCs的荧光;加入半胱氨酸后,它会附着在AuNPs上,巯基与金形成Au-S,可以阻止BSA-AuNCs的荧光被PDMAM-AuNPs猝灭。因此,不断加入半胱氨酸可以进一步诱导BSA-AuNCs从PDMAM-AuNPs中释放,最终恢复荧光。该方法已成功用于人尿液中半胱氨酸的检测。
1.2荧光碳点
荧光碳点(CDs)作为一种新型碳纳米材料,是以蜂蜜、去离子水和氨水为原料,利用传统水热法合成,经透析、氯仿洗涤、冷冻干燥得到。CDs有两个优点:(1)不含重金属,对生物体无毒性;(2)进行表面修饰后,荧光性能不变且修饰物不易脱落。其优良的光学性质使其在生物影像、生物标记和传感器等方面的应用备受瞩目。CDs具有光稳定性高、生物相容性好、毒性低、表面易于功能化修饰以及制备原材料来源广等优势。
Gu等[7]首次合成了Au(Ⅲ)修饰的碳点簇Au(Ⅲ)/CDs,采用荧光“off-on”方法检测谷胱甘肽。“off”过程是将Au(Ⅲ)引入到发光碳点簇中,形成Au(Ⅲ)/CDs复合物,使碳点簇荧光猝灭。因为CDs与谷胱甘肽的强烈作用使得Au(Ⅲ)从CDs表面脱离,所以,巯基化合物能够将Au(Ⅲ)从复合物中移除,使得CDs的荧光恢复,从而达到“on”的过程。利用该过程可以检测生物硫醇(尤其是谷胱甘肽),检测限为2.02μmol·L-1(S/N=3)。由于荧光的恢复与谷胱甘肽浓度有关,因此Au(Ⅲ)/CDs可用来检测溶液与细胞质中的谷胱甘肽。Au(Ⅲ)/CDs检测具有简单、轻便、成本低等优点。
2荧光素类荧光探针
Wang等[8]报道了一种新的基于荧光素的荧光探针1。该探针对含有十六烷基三甲基溴化铵(CTAB)的缓冲溶液中的谷胱甘肽显示出较好的选择性和敏感性。由于荧光素的内酯式结构使得探针没有荧光性,引入谷胱甘肽后,CTAB胶束中吸电子的二硝基苯基酯与谷胱甘肽有效反应,使荧光素的内酯式结构变成醌式结构而恢复荧光。当谷胱甘肽浓度在0~10 mmol·L-1范围内时,探针的荧光强度与谷胱甘肽浓度成线性关系。荧光强度的变化是由于吸电子的二硝基苯基醚与CTAB胶束中的谷胱甘肽反应导致游离的荧光素释放。共聚焦显微镜实验显示,这种探针在人体细胞中检测谷胱甘肽具有很大应用前景。该探针的优点是能够有效从半胱氨酸、同型半胱氨酸和谷胱甘肽中选择性检测出谷胱甘肽。在20 mmol·L-1乙醇-PBS缓冲溶液(体积比3∶7,pH=7.4,含1.5 mmol·L-1CTAB)中的荧光光谱分析表明,谷胱甘肽的加入导致探针在520 nm处的荧光显著增强。这是由于谷胱甘肽含有2个带负电荷的羧基,它能强烈地结合并渗透到含有疏水性底物的带正电的CTAB胶束中,从而表现出催化作用。而半胱氨酸、同型半胱氨酸只含有1个带负电荷的羧基,因此效果不明显。
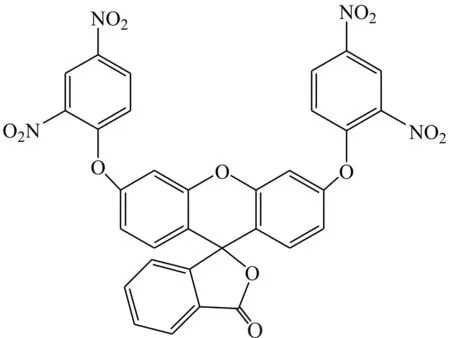
探针1
近红外(NIR,650~900 nm)生物分子荧光探针因其在生物成像中的应用潜力而备受关注。这种新的探针易制备,且具有优异的传感特性:可以从各种分析物包括同型半胱氨酸和谷胱甘肽中有效检测出半胱氨酸;在温和条件下利用比色法和近红外光谱快速荧光检测各种分析物包括同型半胱氨酸和谷胱甘肽;几乎没有背景荧光,细胞毒性低,可用于细胞内半胱氨酸近红外荧光成像。Xue等[9]报道了一种基于纳米荧光素的近红外荧光探针2,它显示了一种快速、高灵敏度、高选择性的近红外荧光“off-on”检测,且有显著的颜色变化和荧光信号变化。探针2溶液无色、无荧光。加入半胱氨酸后,溶液在几分钟内变蓝,并显示出强烈的红色荧光特性。因此,探针2可作为“可视化”荧光探针。

探针2
3香豆素类荧光探针
Xu等[10]发现,氯醛7-香豆素(探针3)是一种比色型和比率型荧光探针,可以从半胱氨酸和同型半胱氨酸中选择性检测谷胱甘肽。半胱氨酸或同型半胱氨酸在发生诱导串联芳香亲核取代(SNAr)反应后重排形成氨基香豆素,导致吸收峰和发射峰分别发生75 nm和35 nm的蓝移。而谷胱甘肽通过SNAr反应生成的巯基香豆素由于空间位阻的影响并没有发生重排,而是分子内的醛亚胺缩合导致循环反应,使吸收峰和发射峰分别发生47 nm和39 nm的红移。细胞成像表明,探针3具有明显的细胞通透性,并高度响应于谷胱甘肽水平的变化。因此,它适用于活细胞中谷胱甘肽水平的监测。

探针3
Jung等[11]报道,香豆素荧光团中的双键喹啉单元可以与巯基化合物发生迈克尔加成反应,发生“off-on”荧光变化,可作为检测巯基化合物的荧光化学传感器,并因此设计合成了探针4。由于香豆素和苯并磺胺的分子内电子转移机制,探针4在10 mmol·L-1PBS缓冲溶液(pH=7.4,含10% DMSO)中没有荧光性,加入半胱氨酸后,其荧光光谱由497 nm蓝移到474 nm,溶液颜色从橙色变为绿色,通过迈克尔加成反应实现了硫醇的“off-on”检测。该探针成功应用于HepG2细胞中荧光成像检测半胱氨酸。
Hu等[12]基于香豆素荧光探针5-Cu2+体系有效检测出谷胱甘肽。加入谷胱甘肽后,探针5从探针5-Cu2+体系中游离出来,在520 nm处有强烈的荧光释放。该体系对谷胱甘肽的响应体现在荧光强度以及颜色(从无色变成黄色)的明显变化,背景氨基酸对谷胱甘肽的检测无干扰,可用于细胞内荧光成像检测谷胱甘肽。该探针在化学环境和生物系统中均有实际应用。
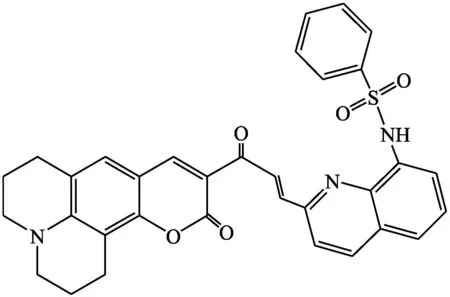
探针4
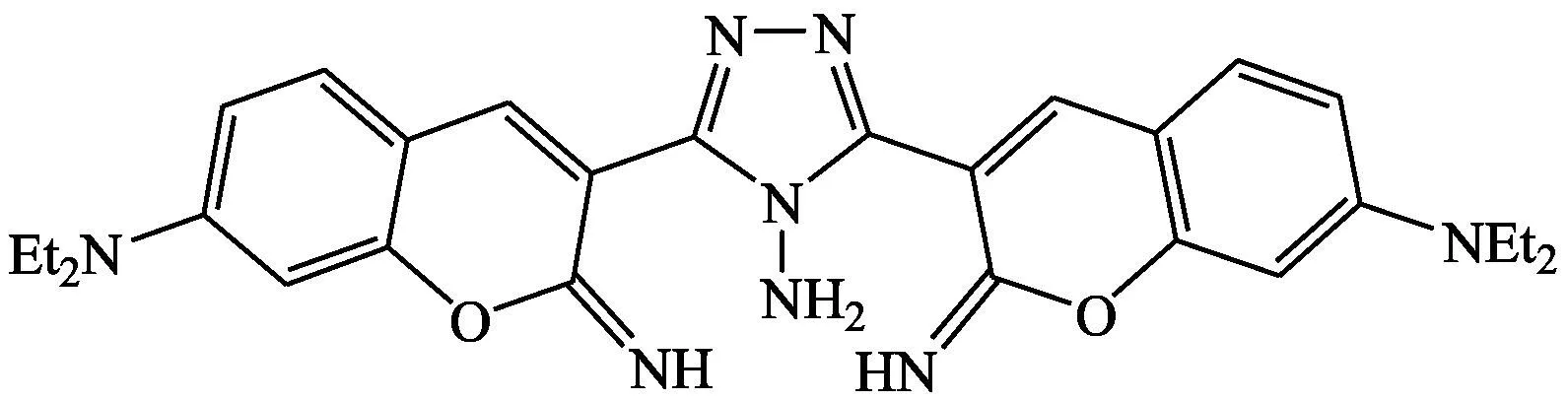
探针5
Lim等[13]报道了一种含有二硫键的氨基香豆素探针6,其可在羟乙基哌嗪乙硫磺酸(HEPES)缓冲溶液中选择性检测巯基化合物。该探针具有较高的选择性和灵敏度,最初在400 nm处有荧光释放,加入谷胱甘肽后,发射峰红移到440 nm处并在413 nm处有一个明显的间歇点。随着巯基化合物的增加,该探针显示出荧光比率变化,反应动力学显示比率k2=6.5×10-3L·mol-1·s-1,因此可用于生物活细胞内谷胱甘肽的定量检测。
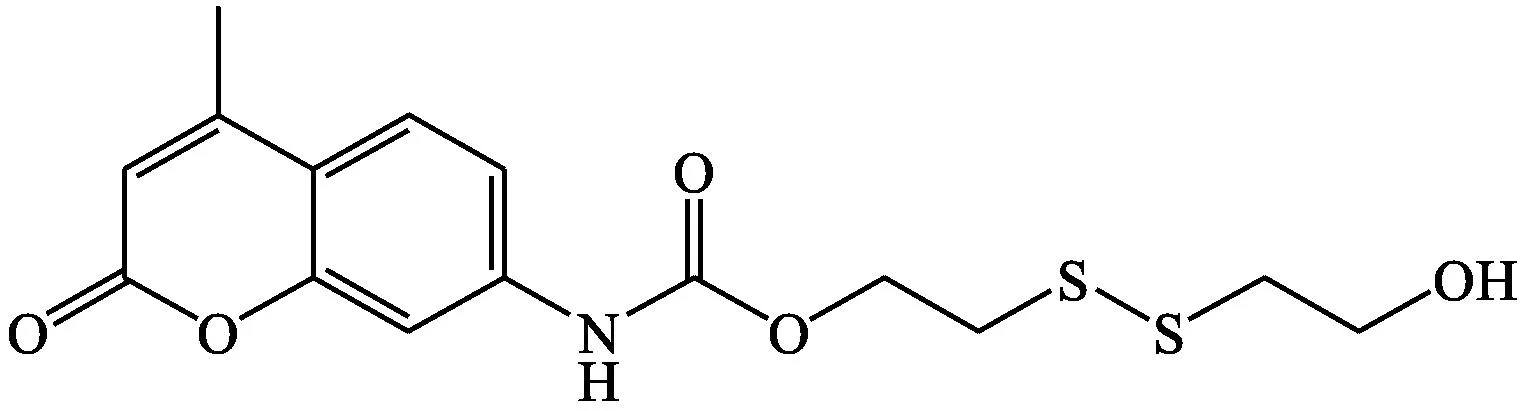
探针6
4罗丹明类荧光探针
Lim等[14]报道了一种基于罗丹明类的用于检测半胱氨酸的荧光探针7。该探针被对羟基苯甲醇单元(HBA)保护,加入半胱氨酸后,经迈克尔加成反应和分子内环化反应,荧光性逐渐增强。该探针无论在试管内还是活细胞内都对半胱氨酸表现出较高的选择性。

探针7
5苯的衍生物类荧光探针
Lu等[15]报道了一种针对红细胞的荧光探针8,并将其应用于活细胞中还原型谷胱甘肽的荧光成像。该探针采用2,4-二硝基苯构建组(DBS)作为猝灭剂进入红细胞荧光团,由于分子内强烈的电荷转移过程,探针本身呈现弱的荧光性。芳香亲核取代谷胱甘肽使探针中DBS单元被除去,导致荧光强度增强。在优化条件下,探针的荧光强度与谷胱甘肽浓度(0.5~0.6 μmol·L-1)成一定比例。探针8的长波长发射可达650 nm,从而可以避免短波长荧光团的影响,在生物成像方面具有广阔的应用前景,可用于HeLa细胞中荧光成像检测谷胱甘肽。
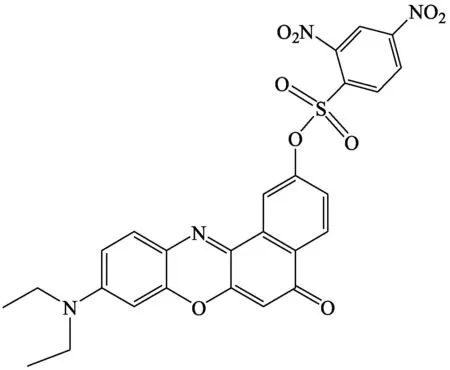
探针8
Sun等[16]报道了一种基于苯并噻唑的荧光探针9。该探针对巯基化合物显示出较高的“off-on”荧光信号变化以及很好的选择性,成功应用于活细胞中荧光成像检测巯基化合物。
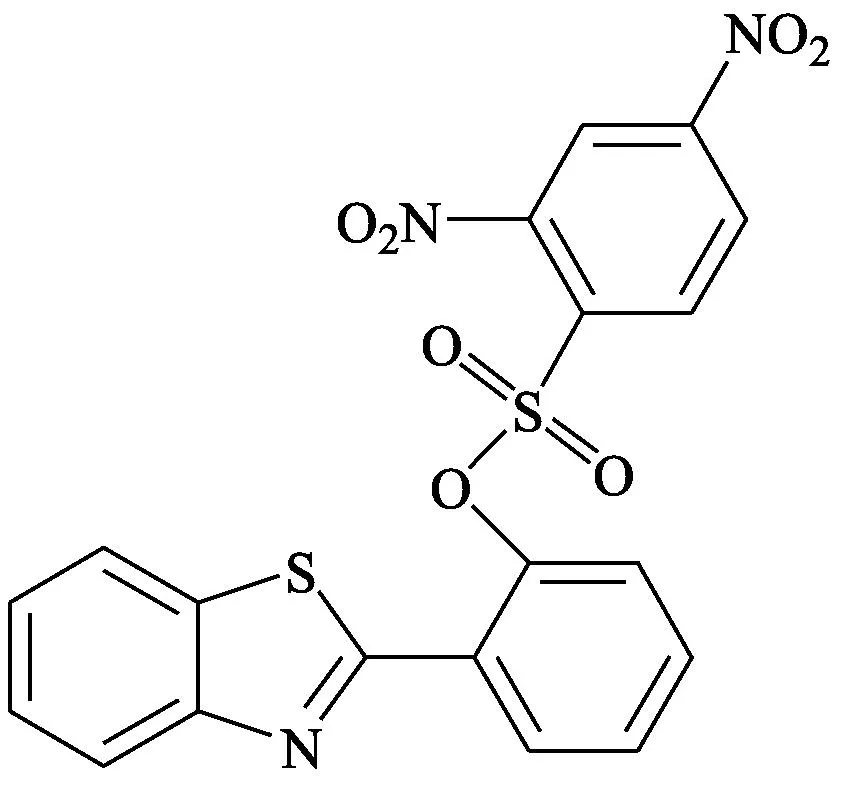
探针9
6吡唑啉基类荧光探针
Wang等[17]设计出基于吡唑啉基的用于检测谷胱甘肽的荧光探针10。该探针在EtOH-PBS缓冲溶液(体积比3∶7,pH=7.4)中本没有荧光性,当与谷胱甘肽混合后,在474 nm处出现蓝移并且荧光强度增强。该探针灵敏度高,针对谷胱甘肽显示出线性“off-on”荧光反应,检测限为8.2×10-8mol·L-1。在HeLa细胞中活细胞成像表明该探针的细胞通透性较好且细胞毒性低。
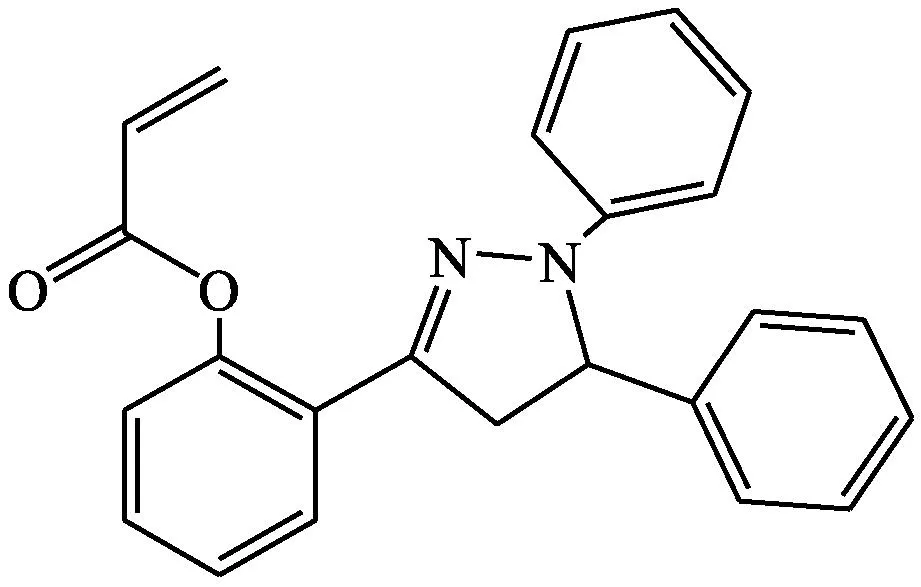
探针10
7其它新型荧光探针
Kand等[18]用NBD-氯(探针11)从半胱氨酸、同型半胱氨酸和谷胱甘肽中快速检测出半胱氨酸。其作用机理包括2个步骤:芳香亲核取代和S-NSmiles重排反应。一般硫取代的NBD相对于氨基取代的NBD显示弱的荧光性,但是硫取代的NBD通过S-NSmiles重排反应可以转化成相应的氨基取代的NBD衍生物,从而显示出强的荧光性。因此,探针11在加入半胱氨酸后通过循环五元过渡态快速进行分子内重排反应形成硫取代的NBD,从而可以快速检测半胱氨酸。该探针的优点是能够从半胱氨酸和同型半胱氨酸中快速检测出半胱氨酸。荧光光谱分析表明,对于半胱氨酸的检测会导致荧光强度增强1 600倍。此探针也可用于活细胞成像检测巯基化合物。

探针11
Zhang等[19]设计合成了含有萘硫醇荧光团和马来酰亚胺结合组的反应激发荧光探针12来检测生物硫醇。该探针在DMSO-水介质中检测含巯基的氨基酸会产生较强的荧光信号。这是因为,硫醇与马来酰亚胺基团的C=C双键反应增强,阻断了从联萘基团到马来酰亚胺基团的ICT过程,导致联萘荧光激发的恢复。在30 μmol·L-1DMSO-水溶液(体积比3∶1,HEPES缓冲溶液,pH=7.4)中加入半胱氨酸后,探针12荧光从402 nm红移到500 nm,荧光量子率从0.023增加到0.596,溶液从无色变成绿色。荧光强度的增强是硫醇与探针的马来酰亚胺基团进行迈克尔加成反应所致。该探针具有很好的细胞通透性和生物相容性,可以应用于硫醇的活细胞成像。
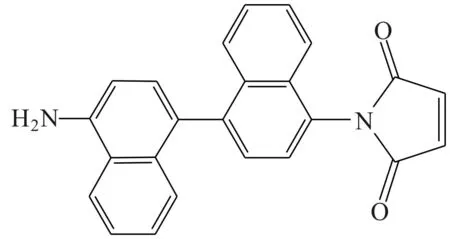
探针12
Hou等[20]合成了2种比色和荧光探针13和探针14来检测半胱氨酸。探针14是探针13的异构体,比探针13的空间位阻大。表观反应动力学实验表明探针13与硫醇的反应速率远大于探针14与硫醇的反应速率。由于探针13无细胞毒性,因此成功应用于生物硫醇在活细胞和斑马鱼中的细胞成像。在含有探针13的Triton X-100-PBS溶液中,随着半胱氨酸的加入,探针13在440 nm处的吸收峰立即减弱并且红移153 nm,在593 nm处的新吸收峰强度随半胱氨酸浓度的增大逐渐增强,同时,溶液颜色从黄色变为紫色。说明,探针13可作为检测半胱氨酸的“可视化”探针,且该探针在610 nm处的发射峰强度也会增强。该研究有助于开发有针对性的传感器,通过电子效应和空间位阻效应对半胱氨酸作出快速响应。
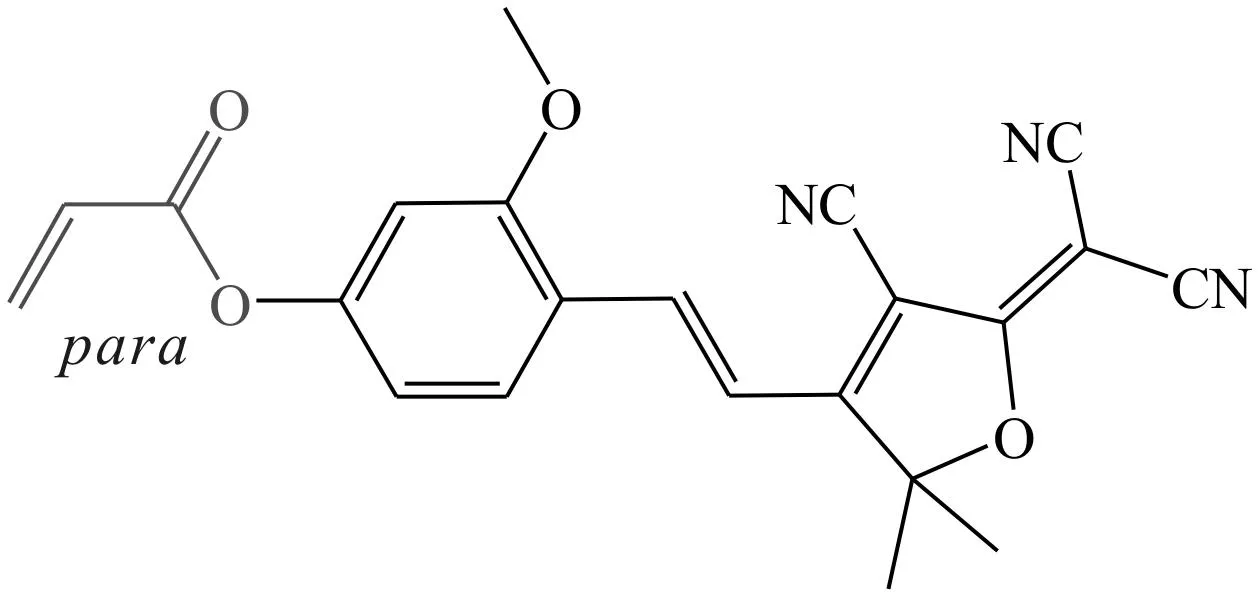
探针13
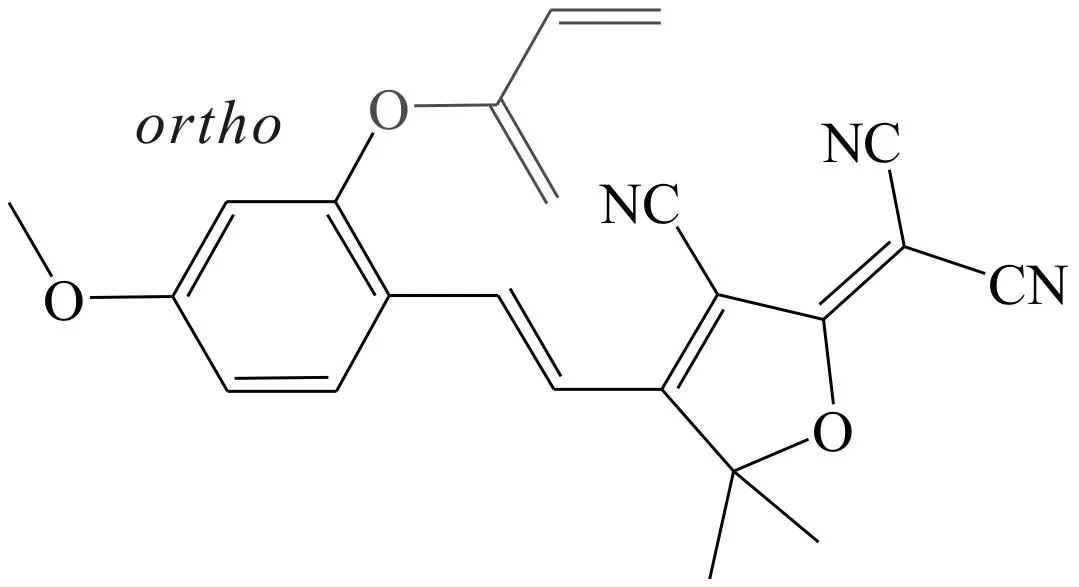
探针14
Yoshida等[21]设计合成了高灵敏度的指定DNs-HMRG(探针15)来检测谷胱甘肽。该探针的荧光由2种不同的机制(光诱导电子转移和分子内螺化物)进行调节。探针15具有良好的细胞通透性,因其荧光强度可迅速增强而被应用于活细胞成像。此外,基于肿瘤组织细胞内的谷胱甘肽水平高于正常组织,该探针可快速(几秒钟内)检测荷瘤小鼠中的微小肿瘤结节(直径<1 mm)。探针15在各种生物应用中都是一个强大的工具,特别是对氧化还原状态的研究。在生理条件(pH=7.4)下,DNs-HMRG处于螺环闭合状态,没有颜色也没有荧光性。此外,对少量共存的螺环开放形式通过分子内的光诱导电子转移(PET)进行荧光猝灭,如DNs组具有足够低的LUMO能级。因此,通过分子内螺化物和PET两种荧光猝灭机理共同作用,能有效抑制DNs-HMRG的荧光。但当加入谷胱甘肽后,磺胺键一步反应快速裂解出HMRG,其pKa为8.1,具有高荧光性。研究表明,1 μmol·L-1DNs-HMRG与10 mmol·L-1谷胱甘肽反应60 min后的荧光强度增强7 000倍。这是目前为止所报道的荧光探针中最大的荧光比率。此外,在生理浓度范围内,荧光强度与谷胱甘肽浓度成正比。
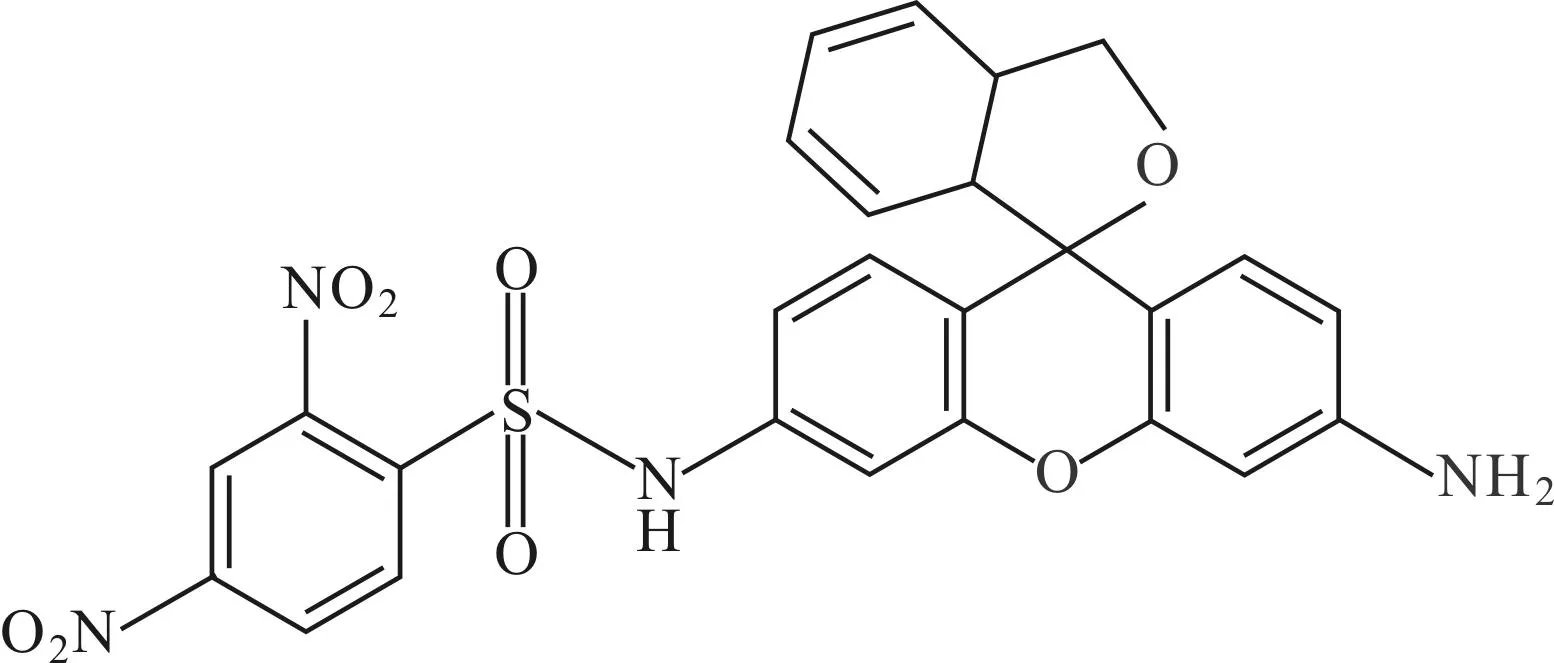
探针15
Shi等[22]设计合成了一种高灵敏度的基于1,8-萘酰亚胺的荧光探针16,并详细研究了其对不同氨基酸的比色和荧光性质。在PBS缓冲溶液中探针16对硫醇具有特定的比色反应和荧光响应,它可以推导探针16与硫醇之间的共轭加成/环化反应。探针16可以迅速、选择性地识别半胱氨酸,可成功检测细胞内硫醇。在0.1 mol·L-1PBS缓冲溶液(pH=7.4,含0.2% DMSO)中加入半胱氨酸后,探针16在346 nm处的最大吸收峰红移106 nm,溶液颜色从无色变为黄色,在547 nm处的发射峰荧光强度增强60倍。这主要是因为,硫醇与C=C双键的共轭加成阻止了PET过程,使得探针荧光性增强。表明,该探针可以通过比色和荧光方法检测半胱氨酸。
Peng等[23]设计合成了一种“off-on”型荧光探针DNBS-CSA(探针17)来检测硫醇。探针17具有广泛使用的2,4-二硝基苯基(DNBS),可与硫醇反应并释放具有聚集诱导发光特性(AIE)的荧光水杨醛酮。AIE染料能够阻止聚集诱导发光猝灭探针荧光,这对于其它硫醇传感器是一种挑战。在10 mmol·L-1PBS缓冲溶液(pH=7.4,含30% DMSO)中加入半胱氨酸后,荧光强度立即增强,且在558 nm处发生170 nm的斯托克斯位移。在最优条件下,荧光强度随半胱氨酸浓度(8~18 μmol·L-1)的增大而线性增强,线性关系R2=0.991。该探针细胞通透性好,可应用于硫醇在HEK 293T细胞中的成像。
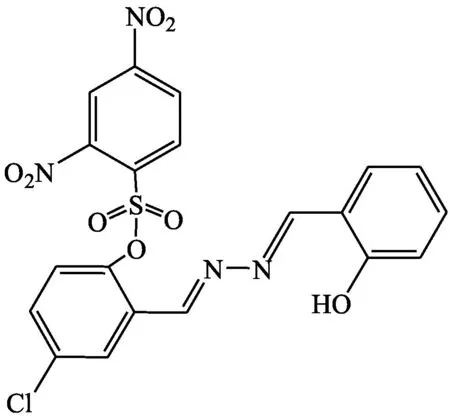
探针17
癌症若能尽早发现且能采取正确的治疗方法,可以提高患者的生存率。Ren等[24]设计合成了具有高灵敏度的荧光探针18。该探针可以消除背景荧光的干扰,通过检测巯基水平来区分正常细胞和肿瘤细胞,通过2种细胞不同波长的荧光发射强度比例可以定量检测谷胱甘肽,通过检测肿瘤移植小鼠组织和血液中的谷胱甘肽水平来确定肿瘤的生长状态。探针18是一个有前途的预测和诊断标志物,具有广泛和潜在的临床应用价值。在10 mmol·L-1PBS缓冲溶液(pH=7.4)中,探针18在372 nm和321 nm处有双吸收峰,在550 nm处有强烈的发射峰,加入谷胱甘肽后,发射峰蓝移到496 nm处,且荧光强度比率增强。

探针18
Zhang等[25]设计合成了一种基于吡唑啉和丙烯酸酯的新的荧光探针19。在DMSO-HEPES缓冲溶液(体积比1∶1,pH=7.4)中探针19对硫醇显示出线性“off-on”荧光响应。在没有硫醇时,探针19在474 nm处显示弱的荧光性;随着半胱氨酸浓度的增大,探针19的荧光强度逐渐增强,荧光量子率从0.0015增加到0.0877。反应机制基于迈克尔加成反应。在HeLa细胞中的活细胞成像表明该探针具有良好的细胞通透性及检测硫醇的高灵敏性。

探针19
Dai等[26]设计合成了基于香豆素和吡唑啉的荧光探针DPCA(探针20)来检测半胱氨酸。这是香豆素类和吡唑啉类化合物首次结合应用于荧光探针。探针20充分利用了香豆素类和吡唑啉类荧光团具有强荧光、高量子产率的优点。通常,吡唑啉的激发波长小于400 nm,香豆素的激发波长在400~450 nm之间。吡唑啉是广泛使用的荧光探针,但很少应用于比率传感器。将吡唑啉和7-羟基香豆素结合能获得较大的共轭化合物,探针20在40 min内即可检测出半胱氨酸,检测限为5.08 μmol·L-1。反应机制包括共轭加成/环化反应。该探针成功应用于活细胞成像。
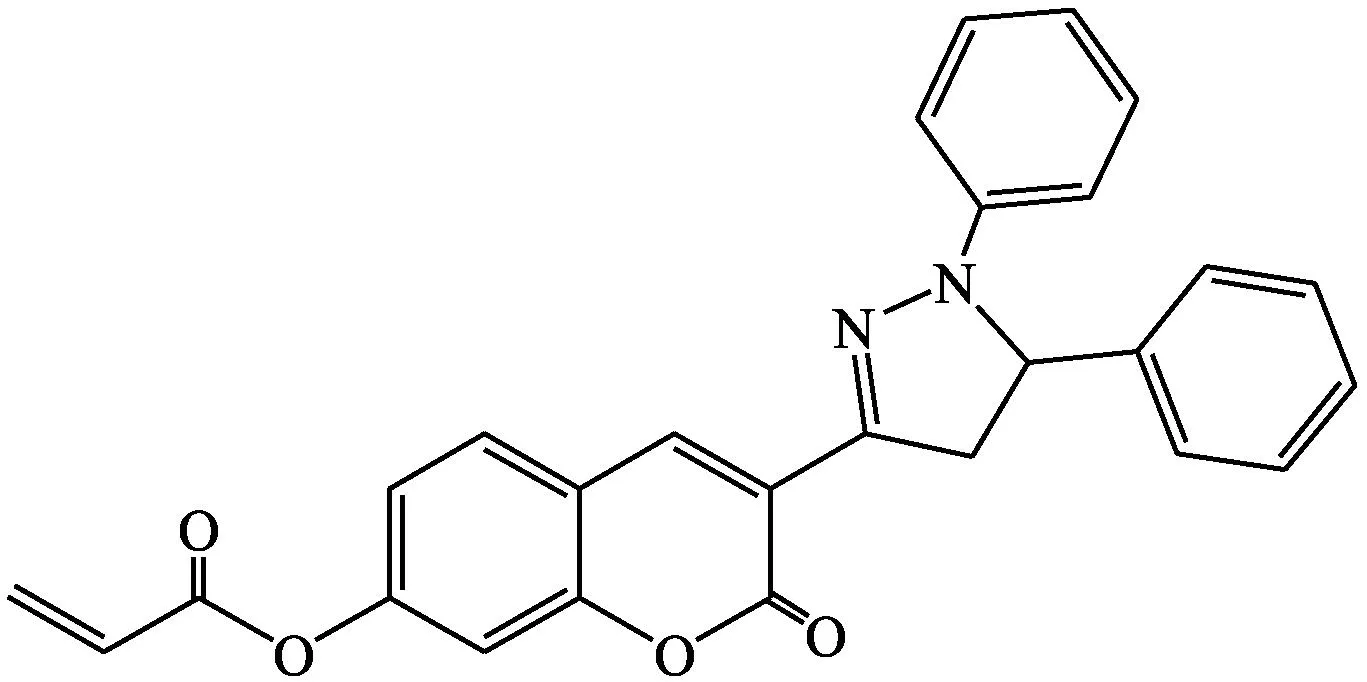
探针20
Yin等[27]建立了一种近红外比率型荧光探针Cy-NB(探针21)用于从谷胱甘肽和同型半胱氨酸中选择性检测半胱氨酸,在线粒体中可以表明氧化应激状态。选择发光区在红外光区的七甲川菁染料作为Cy-NB的荧光团,选择具有半胱氨酸特性的对硝基甲苯作荧光调节器,一旦被半胱氨酸激发,游离的对硝基甲苯π电子体系重排为聚甲炔,导致光谱中的吸收峰和发射峰有一个明显的位移。基于此,设计了一种比率荧光信号来检测半胱氨酸,检测限为0.2 μmol·L-1,检测时间为5 min。探针21在不同的氧化应激状态下能灵敏地检测HepG2细胞线粒体内半胱氨酸水平变化,还成功地应用于活体小鼠成像检测半胱氨酸水平的变化。
Meng等[28]设计合成了一种双光子比率型荧光探针MQ(探针22)。探针22在710 nm处显示了双光子吸收截面。在缓冲溶液(PBS∶DMSO=1∶9,pH=7.4)中,探针22的紫外可见光谱在350 nm处有强吸收峰,加入半胱氨酸后,吸收峰蓝移到323 nm,且吸光度从0.84增大到1.43。反应完成时间为6 min,可以用于活细胞成像。

探针21

探针22
8结语
基于巯基化合物重要的生理作用,实时准确地检测巯基化合物对于疾病的诊断有重要意义。近年来,关于巯基化合物的荧光探针的研究发展迅速,在以下方面获得突破:(1)半胱氨酸、同型半胱氨酸、谷胱甘肽等巯基化合物的结构和反应机理相似,不易检测,目前已研究了多种检测某一种巯基化合物的荧光探针;(2)设计出了双光子激发的可用于细胞内巯基化合物检测的探针,解决了光损伤问题。荧光探针具有良好的生物相容性、低毒性,可应用于细胞内成像和活体组织成像,具有重要的实际应用意义,今后应致力研究可用于对巯基化合物定量检测、灵敏度更高、更适合生物应用和临床应用的荧光探针。
参考文献:
[1]ZHENG C H,PU S Z,LIU G,et al.A highly selective colorimetric sensor for cysteine and homocysteine based on a new photochromic diarylethene[J].Dyes and Pigments,2013,98(2):280-285.
[2]DENG L,WU W T,GUO H M,et al.Colorimetric and ratiometric fluorescent chemosensor based on diketopyrrolopyrrole for selective detection of thiols:An experimental and theoretical study[J].Journal of Organic Chemistry,2011,76(22):9294-9304.
[3]YANG Z G,ZHAO N,SUN Y M,et al.Highly selective red- and green-emitting two-photon fluorescent probes for cysteine detection and their bio-imaging in living cells[J].Chemical Communications,2012,48(28):3442-3444.
[4]YIN J,KWON Y,KIM D,et al.Cyanine-based fluorescent probe for highly selective detection of glutathione in cell cultures and live mouse tissues[J].Journal of the American Chemical Society,2014,136(14):5351-5358.
[5]MACCOSS M J,FUKAGAWA N K,MATTHEWS D E.Measurement of homocysteine concentrations and stable isotope tracer enrichments in human plasma[J].Analytical Chemistry,1999,71(20):4527-4533.
[6]XU X Z,QIAO J,LI N,et al.Fluorescent probe for turn-on sensing of L-cysteine by ensemble of AuNCs and polymer protected AuNPs[J].Analytica Chimica Acta,2015,879:97-103.
[7]GU J J,HU D H,WANG W N,et al.Carbon dot cluster as an efficient “off-on” fluorescent probe to detect Au(Ⅲ) and glutathione[J].Biosensors & Bioelectronics,2015,68:27-33.
[8]WANG L,CHEN H,WANG H,et al.A fluorescent probe with high selectivity to glutathione over cysteine and homocysteine based on positive effect of carboxyl on nucleophilic substitution in CTAB[J].Sensors and Actuators B:Chemical,2014,192:708-713.
[9]XUE S,DING S,ZHAI Q,et al.A readily available colorimetric and near-infrared fluorescent turn-on probe for rapid and selective detection of cysteine in living cells[J].Biosensors & Bioelectronics,2015,68:316-321.
[10]XU C,LI H D,YIN B Z.A colorimetric and ratiometric fluorescent probe for selective detection and cellular imaging of glutathione[J].Biosensors & Bioelectronics,2015,72:275-281.
[11]JUNG H S,HAN J H,PRADHAN T,et al.A cysteine-selective fluorescent probe for the cellular detection of cysteine[J].Biomaterials,2012,33(3):945-953.
[12]HU Z Q,SUN L L,GU Y Y,et al.A sensitive and selective fluorescent probe for detection of glutathione in the presence of Cu2+and its application to biological imaging[J].Sensors and Actuators B:Chemical,2015,212:220-224.
[13]LIM S Y,NA M J,KIM H J.7-Aminocoumarinyldisulfide as a ratiometric fluorescent probe for biothiols in water[J].Sensors and Actuators B:Chemical,2013,185(8):720-724.
[14]LIM S Y,YOON D H,HA D Y,et al.Caged rhodamine-based fluorescent probe for biothiol:Selective detection of cysteine over homocysteine and glutathione in water[J].Sensors and Actuators B:Chemical,2013,188(11):111-116.
[15]LU J X,SONG Y C,SHI W,et al.A long-wavelength fluorescent probe for imaging reduced glutathione in live cells[J].Sensors and Actuators B:Chemical,2012,161(1):615-620.
[16]SUN W,LI W,LI J,et al.A benzothiazole-based fluorescent probe for thiol bioimaging[J].Tetrahedron Letters,2012,53(18):2332-2335.
[17]WANG S Q,WU Q H,WANG H Y,et al.Novel pyrazoline-based fluorescent probe for detecting glutathione and its application in cells[J].Biosensors & Bioelectronics,2014,55(9):386-390.
[18]KAND D,SAHA T,TALUKDAR P.Off-on type fluorescent NBD-probe for selective sensing of cysteine and homocysteine over glutathione[J].Sensors and Actuators B:Chemical,2014,196(6):440-449.[19]ZHANGY,HUOF,YINC,etal.Anoff-onfluorescentprobebasedonmaleimidefordetectingthiolsanditsapplicationforbioimaging[J].SensorsandActuatorsB:Chemical,2015,207:59-65.
[20]HOU J T,YANG J,LI K,et al.A colorimetric and red emissive fluorescent probe for cysteine and its application in bioimaging[J].Sensors and Actuators B:Chemical,2015,214:92-100.
[21]YOSHIDA M,KAMIYA M,YAMASBA T,et al.A highly sensitive,cell-membrane-permeable fluorescent probe for glutathione[J].Bioorganic & Medicinal Chemistry Letters,2014,24(18):4363-4366.
[22]SHI J M,WANG Y J,TANG X L,et al.A colorimetric and fluorescent probe for thiols based on 1,8-naphthalimide and its application for bioimaging[J].Dyes and Pigments,2014,100(1):255-260.
[23]PENG L,ZHOU Z J,WEI R R,et al.A fluorescent probe for thiols based on aggregation-induced emission and its application in live-cell imaging[J].Dyes and Pigments,2014,108(14):24-31.
[24]REN W X,HAN J Y,PRADHAN T,et al.A fluorescent probe to detect thiol-containing amino acids in solid tumors[J].Biomaterials,2014,35(13):4157-4167.
[25]ZHANG R R,ZHANG J F,WANG S Q,et al.Novel pyrazoline-based fluorescent probe for detecting thiols and its application in cells[J].Molecular & Biomolecular Spectroscopy,2015,137:450-455.
[26]DAI X,ZHANG T,LIU Y Z,et al.A ratiometric fluorescent probe for cysteine and its application in living cells[J].Sensors and Actuators B:Chemical,2015,207:872-877.
[27]YIN K,YU F,ZHANG W,et al.A near-infrared ratiometric fluorescent probe for cysteine detection over glutathione indicating mitochondrial oxidative stressinvivo[J].Biosensors & Bioelectronics,2015,74:156-164.
[28]MENG X M,YE W P,WANG S X,et al.A ratiometric two-photon fluorescent probe for cysteine and homocysteine in living cells[J].Sensors and Actuators B:Chemical,2014,201(4):520-525.
Research Progress on Fluorescent Probe for Detecting Thiol Compounds
LIU Liu,MA Jing-chuan,GAI Dong-wei,ZHANG Yan,FENG Xin,MA Meng-yao,ZHANG Ming,WU Xiang-long
(KeyLaboratoryforSpaceBioscienceandBiotechnology,SchoolofLife,NorthwesternPolytechnicalUniversity,Xi′an710072,China)
Abstract:Thiol compounds are playing vital physiological roles in human body,so the efficient detection of thiol compounds has very important applicable values in pathology and life sciences.According to the structure of fluorescent probes,the research progress of fluorescent probes for the detection of thiol compounds is reviewed in this paper.
Keywords:thiol compounds;fluorescent probe;detection
中图分类号:O 625
文献标识码:A
文章编号:1672-5425(2016)02-0001-07
doi:10.3969/j.issn.1672-5425.2016.02.001
作者简介:刘柳(1992-),女,河北保定人,硕士研究生,研究方向:有机合成化学,E-mail:2356054360@qq.com;通讯作者:武祥龙,副教授,E-mail:wuxianglong@nwpu.edu.cn。
收稿日期:2015-10-08
基金项目:国家自然科学基金资助项目(21202130),中央高校基本科研业务费专项资金资助项目(3102014JCQ15005),陕西省自然科学基础研究计划面上项目(2015JM2067),国家级大学生创新创业训练计划项目(201510699278)

