黄芪甲苷联用维生素D3对二维回转培养大鼠原代成骨细胞增殖的影响
王婷梅,梅其炳,曲丽娜,李莹辉,
(1.西北工业大学生命学院,陕西 西安 710072;
2.中国航天员科研训练中心航天医学基础与应用国家重点实验室,北京100094)
黄芪甲苷联用维生素D3对二维回转培养大鼠原代成骨细胞增殖的影响
王婷梅1,梅其炳1,曲丽娜2,李莹辉1,2
(1.西北工业大学生命学院,陕西 西安 710072;
2.中国航天员科研训练中心航天医学基础与应用国家重点实验室,北京100094)
摘要:探讨了黄芪提取物黄芪甲苷与维生素D3联用对二维回转培养大鼠原代成骨细胞增殖的影响。离体培养大鼠原代成骨细胞后,用碱性磷酸酶染色、茜素红染色等方法对细胞进行鉴定;通过细胞回转器模拟微重力效应,采用MTT、细胞计数等方法研究不同浓度配比的黄芪甲苷与维生素D3混合液对大鼠原代成骨细胞增殖的影响。结果表明,单用黄芪甲苷或维生素D3均对正常培养成骨细胞增殖具有促进作用,最佳促增殖浓度分别为1×10-7mol·L-1和1×10-8mol·L-1,当1×10-7mol·L-1黄芪甲苷分别配以1×10-9mol·L-1或1×10-8mol·L-1维生素D3时,其相对增殖率可达200%和196%;不同浓度配比的黄芪甲苷与维生素D3混合液对模拟微重力下二维回转培养成骨细胞的增殖有显著促进作用,其最佳促增殖浓度为1×10-7mol·L-1黄芪甲苷配以1×10-9mol·L-1维生素D3。
关键词:黄芪甲苷;维生素D3;成骨细胞;二维回转培养;模拟微重力;细胞增殖
航天飞行实践或地面模拟实验证实,当机体处于微重力环境时,人体骨骼系统会出现骨密度降低、骨量丢失、骨力学性能下降、骨骼脱矿等一系列类似临床骨质疏松(osteoporosis)症状,即出现失重性骨丢失[1-4]。为了防止失重性骨丢失对航天员造成不良影响,人们开展了一系列关于失重性骨丢失防护措施的研究。
中医药在我国有着数千年的历史,是中华民族的宝贵财富。将中国传统医学与航天医学结合,是我国航天医学发展的独特优势。骨质疏松归属于中医骨痿、骨枯、骨痹范畴,中医临床采用补肾壮骨、健脾益气、活血养肝等措施防治骨质疏松,长期的临床实践发现了许多疗效确切、副作用小且能长期服用的中药,如淫羊藿、地黄、黄芪、骨碎补、补骨脂、续断、杜仲等。失重性骨丢失主要发生在承重骨,其主要原因是骨形成的减少[5-11]。成骨细胞作为骨形成的功能细胞,成为失重性骨丢失发生机制及药物防护相关研究的主要研究对象,可通过刺激成骨细胞的骨形成作用来防止失重性骨丢失。
黄芪为豆科植物蒙古黄芪Astragalus rnembranaceus (Fisch.)Bge.var.mongholicus(Bge.)Hsiao或膜荚黄芪Astragalus embranaceus (Fisch.)Bge.的干燥根[12],具有补气固表、利尿脱毒、排脓、敛疮生肌等功效。研究发现,黄芪的主要有效成分为皂苷、黄酮、多糖及氨基酸类化合物,具有多种药理作用[13]。中药临床研究发现,黄芪或含有黄芪的方剂可以有效阻止绝经后骨质疏松患者骨量丢失[14-15]。
维生素D3又名烟碱酸胺、胆骨化醇,是维生素D家族中最重要的成员之一。其本身是一种激素原,无活性。维生素D3经肝脏代谢为25-羟胆钙化醇,再由肾脏进一步羟化为其活性形式1,25(OH)2D3,然后1,25(OH)2D3与其特异性受体VDR结合来发挥其生物学效应。有资料显示,失重导致负钙平衡的同时伴随血清1,25(OH)2D3水平降低。因此,作者针对失重性骨丢失这一热点问题,利用二维回转模拟微重力效应,采用MTT、细胞计数等方法研究不同浓度配比的黄芪甲苷与维生素D3混合液对大鼠原代成骨细胞增殖分化的影响,以期为航天微重力环境下失重性骨丢失的药物防护提供依据。
1实验
1.1试剂与仪器
DMEM高糖细胞培养液、胎牛血清、0.25% 胰酶、L-谷氨酰胺,美国Hyclone公司;胶原酶、胰蛋白酶、MTT、β-甘油磷酸钠、抗坏血酸,美国Sigma公司;ALP染色试剂盒,南京建成生物工程研究所;茜素红,天津化学试剂厂。
细胞培养箱、低温台式高速离心机,德国Heraus公司;超纯水系统,美国Millipore公司;荧光显微镜,日本Nikon公司;数码照相机,日本Olympus公司;双向多样本回转器,中国航天员科研训练中心;多功能酶标仪,美国BIO-TEK公司。
1.2大鼠原代成骨细胞的分离培养及鉴定
取出生1~2d的SD乳鼠,采用多次酶消化法进行SD乳鼠颅骨原代成骨细胞的分离与培养;在镜下观察原代成骨细胞的形态,并采用碱性磷酸酶染色、茜素红染色等方法对其进行鉴定,取3~6代成骨细胞用于实验。
1.3黄芪甲苷与维生素D3联用对正常培养大鼠原代成骨细胞增殖的影响
将大鼠原代成骨细胞培养至4代时消化,调整细胞密度为2.5×103个·孔-1,接种于96孔板,每孔接种体积为100μL,孵育8h后,分别加入不同浓度的黄芪甲苷、维生素D3及不同浓度配比的黄芪甲苷与维生素D3混合液进行药物处理,每组设8个副孔。药物处理48h后,每孔加入已配好的MTT溶液20μL,置于CO2培养箱中继续孵育4h,终止培养,小心移除培养液,然后每孔加入DMSO溶液150μL,避光振荡10min,在酶标仪上读取570nm处的吸光度。以空白对照为基准计算细胞相对增殖率,确定黄芪甲苷、维生素D3的最佳浓度及黄芪甲苷与维生素D3混合液的最佳浓度配比。
1.4黄芪甲苷与维生素D3联用对二维回转培养大鼠原代成骨细胞增殖的影响
将对数生长期的大鼠原代成骨细胞以1.2×105个·片-1的细胞数接种于灭菌处理的血盖片上,细胞贴附后,加入最佳浓度配比的黄芪甲苷与维生素D3混合液进行药物处理。二维回转培养48 h后取出细胞培养片,采用细胞计数法研究黄芪甲苷与维生素D3混合液对二维回转培养大鼠原代成骨细胞增殖的影响。
采用SPSS 11.0软件对实验数据进行统计学分析。数据以均数+标准差表示,多组间的比较采用单因素方差分析,两组间的比较用LSD检验。P<0.05为显著性差异。
2结果与讨论
2.1大鼠原代成骨细胞的鉴定
镜下观察分离培养的大鼠原代成骨细胞的形态及碱性磷酸酶染色、茜素红染色结果,如图1所示。
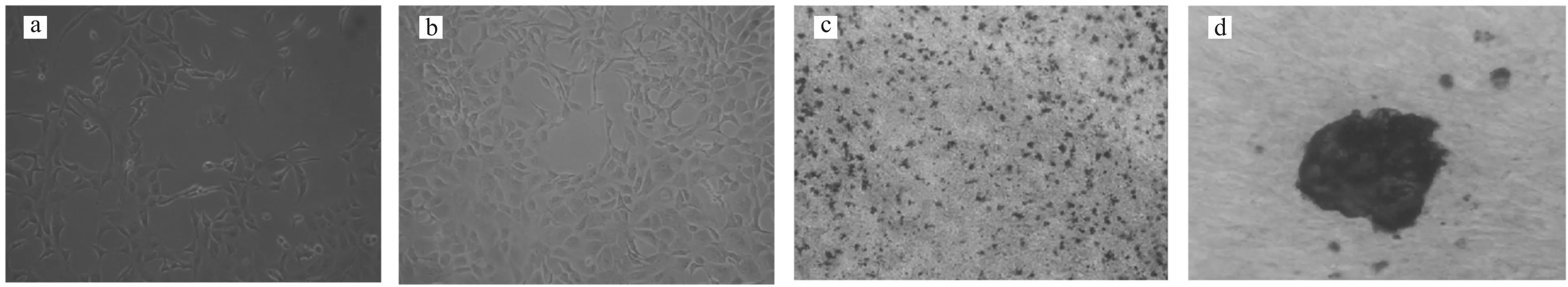
培养48 h 培养7 d 碱性磷酸酶染色 茜素红染色
实验发现,培养24 h左右,有少量细胞贴壁生长,贴壁生长细胞为梭形或多边形;培养48 h后,细胞基本贴壁生长(图1a);培养7 d左右,能够长满培养瓶壁(图1b)。
碱性磷酸酶是成骨细胞分化的特异性标志,而大鼠原代成骨细胞碱性磷酸酶染色结果呈阳性,大部分细胞染色呈深蓝色(图1c)。
成骨细胞在体外培养时,长满后如不进行传代继续培养,则细胞可以重叠生长,并分泌大量基质形成结节,随着培养时间的延长,便发生矿化,一般培养2~3周左右即会出现矿化结节。实验发现,大鼠原代成骨细胞培养至14 d左右时便有结节形成,继续培养至21 d后进行茜素红染色,发现有一些大小形态各异的红色至暗红色斑块(图1d)。
上述实验结果均与成骨细胞生物学特性相符,表明分离培养的细胞确为成骨细胞。
2.2黄芪甲苷与维生素D3联用对正常培养大鼠原代成骨细胞增殖的影响
2.2.1黄芪甲苷的影响
大鼠原代成骨细胞经不同浓度的黄芪甲苷处理后,采用MTT法测定细胞相对增殖率,结果见图2。
由图2可知,与对照组相比,用浓度分别为1×10-10mol·L-1、1×10-9mol·L-1、1×10-8mol·L-1、1×10-7mol·L-1、1×10-6mol·L-1的黄芪甲苷处理48 h后均能促进大鼠原代成骨细胞的增殖(P<0.05 &P<0.01)。其中,黄芪甲苷浓度为1×10-7mol·L-1的促增殖效果最显著(P<0.01)。
2.2.2维生素D3的影响
大鼠原代成骨细胞经不同浓度的维生素D3处理后,采用MTT法测定细胞相对增殖率,结果见图3。

*:P<0.05(vs.对照) **:P<0.01(vs.对照)

*:P<0.05(vs.对照) **:P<0.01(vs.对照)
由图3可知,与对照组相比,用浓度分别为1×10-10mol·L-1、1×10-9mol·L-1、1×10-8mol·L-1、1×10-7mol·L-1的维生素D3处理48 h后均能促进大鼠原代成骨细胞的增殖(P<0.05 &P<0.01)。其中,维生素D3浓度为1×10-8mol·L-1的促增殖效果最显著(P<0.01)。
2.2.3黄芪甲苷与维生素D3混合液的影响
将大鼠原代成骨细胞用不同浓度配比的黄芪甲苷与维生素D3混合液处理48 h,采用MTT法测定细胞相对增殖率,结果见图4。

1~6,黄芪甲苷浓度(mol·L-1):0,1×10-10,
由图4可知,当不同浓度黄芪甲苷与不同浓度维生素D3联用时,其促进细胞增殖作用优于单独使用黄芪甲苷。其中,当黄芪甲苷浓度为1×10-7mol·L-1、维生素D3浓度为1×10-9mol·L-1或1×10-8mol·L-1时,促增殖效果最佳(P<0.01),其相对增殖率分别达到200%和196%。
2.3黄芪甲苷与维生素D3联用对二维回转培养大鼠原代成骨细胞增殖的影响
选取具有最佳促增殖效果的药物组合处理二维回转培养大鼠原代成骨细胞48 h,即用1×10-7mol·L-1黄芪甲苷与1×10-9mol·L-1维生素D3混合液以及1×10-7mol·L-1黄芪甲苷与1×10-8mol·L-1维生素D3混合液分别处理回转培养细胞,然后采用细胞计数法测定细胞增殖情况,结果见图5。
由图5可知,1×10-7mol·L-1黄芪甲苷及1×10-7mol·L-1黄芪甲苷分别配以1×10-9mol·L-1、1×10-8mol·L-1维生素D3的混合液处理组的细胞数显著高于对照组细胞数(P<0.05 &P<0.01);1×10-7mol·L-1黄芪甲苷与1×10-9mol·L-1维生素D3混合液对二维回转培养大鼠原代成骨细胞的促增殖效果明显优于单独使用黄芪甲苷组(P<0.05)。

*:P<0.05(vs.对照)**:P<0.01(vs.对照)
图5二维回转培养条件下,黄芪甲苷与维生素D3
联用对大鼠原代成骨细胞增殖的影响
Fig.5Effect of astragaloside Ⅳ combined with vitamin D3
on the proliferation of rat primary osteoblasts
during 2D-clinorotation culture
3结论
探讨了黄芪提取物黄芪甲苷与维生素D3联用对二维回转培养大鼠原代成骨细胞增殖的影响。离体培养大鼠原代成骨细胞后,用碱性磷酸酶染色、茜素红染色等方法对细胞进行鉴定;通过细胞回转器模拟微重力效应,采用MTT、细胞计数等方法研究不同浓度配比的黄芪甲苷与维生素D3混合液对大鼠原代成骨细胞增殖的影响。结果表明,单用黄芪甲苷或维生素D3均对正常培养成骨细胞增殖具有促进作用,最佳促增殖浓度分别为1×10-7mol·L-1和1×10-8mol·L-1,当1×10-7mol·L-1黄芪甲苷分别配以1×10-9mol·L-1或1×10-8mol·L-1维生素D3时,其相对增殖率可达200%和196%;不同浓度配比的黄芪甲苷与维生素D3混合液对模拟微重力下二维回转培养成骨细胞的增殖有显著促进作用,其最佳促增殖浓度为1×10-7mol·L-1黄芪甲苷配以1×10-9mol·L-1维生素D3。
参考文献:
[1]XU D,ZHAO X,LI Y,et al. The combined effects of X-ray radiation and hindlimb suspension on bone loss[J].Journal of Radiation Research,2014,55(4):720-725.
[2]SUN L W,LUAN H Q,HUANG Y F,et al.Effects of local vibration on bone loss in tail-suspended rats[J].International Journal of Sports Medicine,2014,35(7):615-624.
[3]SMITH S M,ZWART S R,HEER M,et al.Men and women in space:Bone loss and kidney stone risk after long-duration spaceflight[J].Journal of Bone and Mineral Research:the Official Journal of the American Society for Bone and Mineral Research,2014,29(7):1639-1645.[4]SMITHSM,ABRAMSSA,DAVIS-STREETJE,etal.Fiftyyearsofhumanspacetravel:Implicationsforboneandcalciumresearch[J].AnnualReviewofNutrition,2014,34:377-400.
[5]MOREY E R,BAYLINK D J.Inhibition of bone formation during space flight[J].Science,1978,201(4361):1138-1141.
[6]LAI C F,CHAUDHARY L,FAUSTO A,et al.Erk is essential for growth,differentiation,integrin expression,and cell function in human osteoblastic cells[J].The Journal of Biological Chemistry,2001,276(17):14443-14450.
[7]DOTY S B,MOREY-HOLTON E R,DURNOVA G N,et al.Cosmos 1887:Morphology,histochemistry,and vasculature of the growing rat tibia[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology,1990,4(1):16-23.
[8]WRONSKI T J,MOREY-HOLTON E R,DOTY S B,et al.Histomorphometric analysis of rat skeleton following spaceflight[J].The American Journal of Physiology,1987,252(2):R252-R255.
[9]JEE W S,WRONSKI T J,MOREY E R,et al.Effects of spaceflight on trabecular bone in rats[J].The American Journal of Physiology,1983,244(3):R310-R314.
[10]WRONSKI T J,MOREY E R.Skeletal abnormalities in rats induced by simulated weightlessness[J].Metabolic Bone Disease & Related Research,1982,4(1):69-75.
[11]DOTY S B.Morphologic and histochemical studies of bone cells from SL-3 rats[J].The Physiologist,1985,28(S6):S225-S226.
[12]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2009:283-284.
[13]吴发宝,陈希元.黄芪药理作用研究综述[J].中药材,2004,27(3):232-234.
[14]阳波,杨静.黄芪对绝经后骨质疏松症患者影响的临床研究[J].四川医学,2007,28(3):291-293.
[15]周志昆,曾红兵,秦佳佳,等.黄芪三仙汤治疗绝经后骨质疏松症30例疗效观察[J].新中医,2006,38(6):40-41.
Effect of Astragaloside Ⅳ Combined with Vitamin D3on Proliferation of Rat Primary Osteoblasts During 2D-Clinorotation Culture
WANG Ting-mei1,MEI Qi-bing1,QU Li-na2,LI Ying-hui1,2
(1.SchoolofLifeScience,NorthwesternPolytechnicalUniversity,Xi′an710072,China;2.StateKeyLabofSpaceMedicineFundamentalsandApplication,ChinaAstronautResearchandTrainingCenter,Beijing100094,China)
Abstract:Effect of astragaloside Ⅳ combined with vitamin D3 on the proliferation of rat primary osteoblasts during 2D-clinorotation culture was investigated.Cultured rat primary osteoblasts were obtained and identified by using alkaline phosphatase staining and alizarin red staining methods.Clinostat were used to simulate microgravity,and the effects of astragaloside Ⅳ combined with vitamin D3 at different concentration ratios on proliferation of rat primary osteoblasts were studied by MTT assay and cell counting method.Results showed that,during normal culture,the proliferation of rat primary osteoblasts was significantly increased by treating with astragaloside Ⅳ or vitamin D3,and the optimal concentration was 1×10-7mol·L-1astragaloside Ⅳ or 1×10-8mol·L-1vitamin D3,respectively.Moreover,the proliferative effect was further enhanced when osteoblasts were treated with astragaloside Ⅳ(1×10-7mol·L-1) combined with vitamin D3 (1×10-9mol·L-1or 1×10-8mol·L-1),and the relative proliferation rate was 200% and 196%,respectively.During 2D-clinorotation culture,the proliferation of rat primary osteoblasts were significantly increased by mixed solutions of astragaloside Ⅳ combined with vitamin D3 at different concentration ratios and the optimal conditions were 1×10-7mol·L-1astragaloside Ⅳ combined with 1×10-9mol·L-1vitamin D3.
Keywords:astragaloside Ⅳ;vitamin D3;osteoblasts;2D-clinorotation culture;simulated microgravity;cell proliferation
中图分类号:R 332R 282.71R 329.24
文献标识码:A
文章编号:1672-5425(2016)02-0031-04
doi:10.3969/j.issn.1672-5425.2016.02.006
作者简介:王婷梅(1986-),女,青海人,博士研究生,研究方向:航天医学,E-mail:tingting_student@163.com;通讯作者:曲丽娜,研究员,E-mail:linaqu@263.net;李莹辉,研究员,E-mail:yinghuidd@vip.sina.com。
收稿日期:2015-10-21
基金项目:国家科技重大专项重大新药创制资助项目(2012ZX09J12201),国家重大科学仪器设备开发专项项目(2013YQ19046706,2012YQ0401400901)

