SPME- GC- NPD法测定肉制品中挥发性N-亚硝胺
杨华,方长发,张甜,马俪珍(.山西农业大学食品科学与工程学院,山西太谷03080;2.天津农学院食品科学与工程学院,天津300384)
SPME- GC- NPD法测定肉制品中挥发性N-亚硝胺
杨华1,方长发1,张甜1,马俪珍2,*
(1.山西农业大学食品科学与工程学院,山西太谷030801;2.天津农学院食品科学与工程学院,天津300384)
摘要:改进3种N-亚硝胺(N-亚硝基二乙胺,NDEA;N-亚硝基二甲胺,NDMA;N-亚硝基吡咯烷,NPYR)的测定方法。以固相微萃取(SPME)为样品萃取方式,配备氮磷检测器的气相色谱仪(GC-NPD)为检测工具,研究3种N-亚硝胺(NDEA、NDMA、NPYR)的测定方法。以PDMS/DVB/CAR为萃取头,萃取温度50℃、搅拌速度400 r/min、萃取时间30 min、盐离子浓度0.20 g/mL时NDEA能得到最大的萃取面积。对3种N-亚硝胺的线性分析得出,NDEA的测定在10 ng/mL~100 ng/mL时线性关系为0.994;NDMA在10 ng/mL~100 ng/mL时的线性关系为0.912;NPYR在0~10 ng/mL时没有表现出明显线性关系。采用SPME,结合GC-NPD测定N-亚硝胺的方法,对NDEA的测定灵敏度最高,RSD为6.7 %,加标回收率为89.7%,最低检出限(LOD)0.67ng/mL,可以满足肉制品中NDEA的定量测定。
关键词:SPME;N-亚硝胺;萃取条件;线性关系;肉制品
固相微萃取技术(SPME)是一种无溶剂的样品前处理技术,集采样、萃取、浓缩、进样于一体,可以用于样品中各类挥发性或半挥发性物质的分析。SPME在国内主要应用于食品中香气成分的分析,对挥发性N-亚硝胺的分析研究报道较少。国外对SPME在挥发性N-亚硝胺方面的测定起步于1997年,多是结合热能分析仪(TEA)[1]以及GC-MS[2]的报道。国标GB/T 5009.26-2003《食品中N-亚硝胺类的测定》方法[3]对食品中N-亚硝胺的分析中样品前处理方法工作量大,费时费工,且使用有毒的有机溶剂二氯甲烷。而固相微萃取技术比溶剂萃取法更快更简单,比较容易操作,不需要用有毒且昂贵的试剂。本试验将以SPME为萃取方式,配备氮磷检测器的气相色谱仪(GC-NPD)为检测工具,研究挥发性N-亚硝胺的测定方法。试验从检测条件、解析时间、萃取头、萃取方式、萃取条件等进行条件优化,并用SPME-GC-NPD分析方法对肉制品中N-亚硝胺含量进行检测的精确性分析,包括线性分析、回收率试验、精密度试验、检出限的确定等,并将该方法与国标中规定的方法进行比较。本研究结果将对于肉制品中挥发性N-亚硝胺的快速定量测定具有一定的实际应用价值。
1 材料与方法
1.1材料与设备
甲醇(色谱纯)、NaCl(分析纯):均购自天津市化学试剂研究所;NDMA、NDEA和NPYR标品:美国Sigma公司;市售烤肠:购自天津华润万家超市;GC-14C气相色谱仪(配备NPD氮磷检测器):日本岛津;30 m色谱柱:Restek Corporation(U.S);5 cm可调节刻度固相微萃取装置,50/30 μm灰色PDMS/DVB/CAR萃取头,65 μm蓝色平头PDMS/DVB萃取头,75 μm黑色平头CAR/PDMS萃取头,1 cm磁力搅拌子,15 mL棕色样品瓶:美国supelco;EMS-9B加热磁力搅拌器:天津欧诺仪器表有限公司;DHP-420电热恒温培养箱:天津中环实验电炉有限公司;水蒸汽蒸馏装置与K-D浓缩器:天津津京玻壳股份有限公司。
1.2方法
1.2.1分析方法的优选
1.2.1.1萃取步骤
液体样品取10 mL于15 mL的样品瓶中,固体样品粉碎后取2 g于样品瓶并用超纯水定容至10 mL,同时加入一定量NaCl,加入搅拌子,摇匀,密封后固定于自制萃取台,设定恒温培养箱温度,将萃取针插入样品瓶,伸出萃取头(液面以上)并调节搅拌速度,顶空方式萃取一定时间后缩回萃取头,插入气相色谱仪进样口,伸出萃取头,于高温进样口解析,缩回萃取头并拔出萃取针。完成一次进样过程,为了不影响下一次萃取操作,可适当延长解析时间,以保证萃取头中的残留物全部被解析。
1.2.1.2气相色谱检测条件
进样口温度:230℃;氮磷检测器温度:250℃;色谱柱温度:程序升温,初温50℃保持4 min,5℃/min升至120℃保持3 min,8℃/min升至180℃保持4 min。载气:N2流速为30 mL/min,H2流速为50 mL/min;空气:流速500 mL/min,采用不分流进样。利用clarity工作站对色谱图进行分析及数据处理,采用保留时间定性,峰面积定量。
1.2.1.3 3种萃取头萃取效果比较
选用65 μm PDMS/DVB、75 μm CAR/PDMS、50/ 30 μm DVB/CAR/PDMS(2 cm)3种不同涂层材料对NDMA、NDEA、NPYR的萃取效果进行比较,以浓度为10 ng/mL的NDMA、NDEA、NPYR混合标准液为萃取对象,分别利用3种萃取头在30℃,搅拌速度400r/min,萃取时间30 min,NaCl加入量为1 g的条件下进行比较试验。萃取条件的选择用最佳萃取头对萃取效果最明显的1种N-亚硝胺进行萃取操作,用以选择合适的萃取条件。
1.2.1.4氮磷检测器背景电流及量程的选择
以10 ng/mL NDEA溶液为标准,在30℃,搅拌速度400 r/min,NaCl加入量为1 g的条件下萃取30 min,用小量程(0.1),背景电流为20、40 pA进行组合分析,最低检出限(LOD)为评定指标,在此后的试验阶段均选用最佳的量程及背景电流选择合适的萃取条件。
1.2.1.5解析时间的选择
以浓度为100 ng/mL的NDEA标准液为萃取对象,在30℃,搅拌速度400 r/min,NaCl加入量为1 g的条件下萃取30 min,解析时间设为1、3、5 min。选择最佳的解析时间。
1.2.1.6萃取方式选择
以10 ng/mL NDEA溶液为标准,在30℃,搅拌速度400 r/min,NaCl加入量为1 g的条件下,分别选择一步萃取,平衡时间0 min,萃取时间30 min;两步萃取(1),平衡时间10 min,萃取时间20 min;两步萃取(2),平衡时间20 min,萃取时间10 min,3种萃取方式进行比较。
1.2.1.7萃取条件的优化
在确定了背景电流、放大器量程、萃取方式、解析时间的前提下,以萃取效果最佳的萃取头为优化对象,对固相微萃取条件进行单因素试验。即在前期优选的萃取条件下,单因素研究萃取时间(5、10、15、20、25、30、40、50 min)、萃取温度(25、35、40、45、50℃)、搅拌速度(200、400、500、600、700 r/min)以及NaCl浓度(0、0.05、0.10、0.15、0.20、0.25 g/mL)对萃取效果的影响,根据单因素试验结果选择正交试验的水平值,以浓度为10 ng/mL的NDEA标准液,采用一步萃取方式,萃取时间为30 min的条件下,通过正交试验优选出NDEA的萃取条件。
1.2.2标准曲线制作
用甲醇配置100 μg/mL的3种N-亚硝胺的混合母液,然后用10 mL的容量瓶分别配制100、200、400、600、800、1 000 ng/mL的N-亚硝胺标准工作液。分别吸取0.1 mL的上述N-亚硝基胺标准工作液,加入装有9.9 mL去离子水的15 mL样品瓶中,使得样品瓶中溶液的总体积为10 mL,同时加入2 g NaCl,加入搅拌子,摇匀,萃取操作,使得其稀释后的浓度分别为1 ng/mL~100 ng/mL。且保证加入到样品瓶中的甲醇量一致。同时吸取10 mL的双蒸水,做空白试验。
1.2.3回收率试验
在已知NDEA含量并切碎的熟肉样中加入25 ng/g NDEA,测定时取2g加标肉样于样品瓶中定容至10mL,样品瓶中NDEA的理论含量为50 ng/mL,用PDMS/ DVB/CAR萃取头萃取,进行回收率试验,同时对50 ng/mL的NDEA标准液进行测定,以峰面积定量,计算回收率。回收率的计算公式:
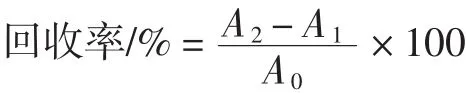
式中:A1为加标前的样品中NDEA峰面积,mV· s;A2为加标后的样品中NDEA峰面积,mV·s;A0为50 ng/mL标准品的峰面积,mV·s。
1.2.4精密度试验
以25 ng/g的加标(NDEA)样品取样2 g,进行精密度试验,重复5次。
1.2.5最低检出限测定

式中:LOD为最低检出限,ng/mL;H0为标准物的峰高,mV;S0为标准物的浓度,ng/mL;N为噪音,由仪器自动得出,mV。
噪音的测量采用10 min的噪音带来计算,由clarity色谱工作站自动得出。以10 ng/mL的NDMA、NDEA、NPYR混合标准液进行萃取试验。
1.2.6肉制品中N-亚硝胺的测定
1.2.6.1 SPME-GC-NPD法测定
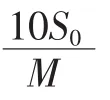
式中:S为样品中N-亚硝胺的含量,ng/g或μg/kg;S0为样品瓶中N-亚硝胺的浓度,ng/mL;10为稀释液的体积,mL;M为样品的取样量,g;
1.2.6.2国标法测定[3]
利用国标GB/T 5009.26-2003《食品中N-亚硝胺类的测定》的测定方法对上述市售的3种烤肠中NDEA进行分析,样品中的N-亚硝胺类化合物经水蒸气蒸馏和有机溶剂萃取后,K-D浓缩器浓缩至一定量,采用气相色谱-质谱联用仪的高分辨峰匹配法进行确认和定量。
2 结果与分析
2.1仪器检测条件的确定
2.1.1 3种萃取头的萃取效果
3种萃取头对NDMA、NDEA、NPYR的萃取效果见表1及图1所示。
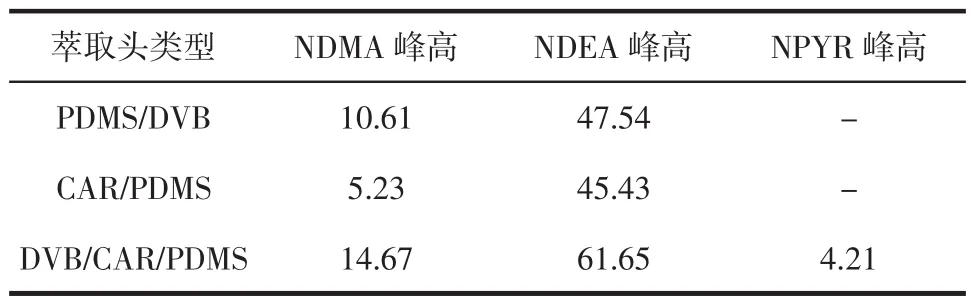
表1 3种萃取头对三种N-亚硝胺(1 μg/mL)的萃取效果Table 1 Extraction results of N-nitrosamines(1 μg/mL)with three type of fibers mV

图1 CAR/DVB/PDMS萃取头对3种N-亚硝胺1 μg/mL的萃取效果Fig.1 Extraction results of N-nitrosamines(1 μg/mL)with CAR/ DVB/PDMS fiber
从表1和色谱图1可以看出,DVB/CAR/PDMS萃取头对NDEA的萃取效果表现最佳,峰高达到61.65mV,对其余两种N-亚硝胺的萃取效果均优于PDMS/DVB 及CAR/PDMS两种萃取头。
2.1.2氮磷检测器背景电流及量程的选择
氮磷检测器背景电流及量程的选择的测定结果如表2所示。

表2背景电流及量程对LOD的影响Table 2 The NPD range and background current to the impact of the LOD
从表2可以看出量程及背景电流的选择对LOD有显著影响,同一量程下,改变背景电流的大小对LOD的影响较小,而在相同背景电流下,改变量程,对LOD的影响极其显著。可以推断,当量程一定时,增大背景电流,目标检测物的信号峰及基线噪音同时增大,但所增大的幅度不同,放大器对于含氮的N-亚硝胺所产生的信号放大远远大于基线噪音的放大。综合考虑LOD及检测器碱源的使用寿命,选择量程为1,背景电流设定为40 pA。
2.1.3解析时间的确定
在相同萃取条件下,采用不同解析时间100 ng/mL NDEA的出峰面积如下表3所示。

表3解析时间对NDEA出峰面积的影响Table 3 The effects of analysis time to the extraction of NDEA
从表3可以看出,解析时间的长短对出峰面积有一定的影响,解析时间为3 min与解析时间为1 min时NDEA的出峰面积具有显著性,而解析时间为3 min与解析时间为5min时的出峰面积之间没有显著差异。这就说明在3 min的解析时间已经足够让NDEA基本解析。在对解析3 min后的萃取头进行老化操作时,并没有出现残留峰及杂质峰,3 min的解析时间也确保了萃取头的老化操作。
2.1.4 SPME萃取方式的确定
SPME萃取方式的比较试验结果见表4。

表4萃取方式的比较Table 4 Comparison of extraction methods
从表4可以看出,一步萃取与两步萃取中所得到的NDEA的峰面积大小差异显著,也就是在总时间相同的的前提下,一步萃取法对NDEA的萃取效率更高,两步萃取过程之间差异不显著。对在以后的试验阶段,都将采用一步萃取法,即不经过平衡,直接边搅拌边萃取一定时间。
2.1.5萃取条件的优化
2.1.5.1萃取温度的选择
不同萃取温度对NDEA的萃取效果结果见图2。

图2萃取温度对NDEA萃取效果的影响Fig.2 The effects of extraction temperature to the extraction of NDEA注:相同大写字母表示差异不显著,不同表示差异显著(P<0.05)。
从图2可看出,萃取温度的高低对出峰面积的大小有显著影响,随着萃取温度的升高NDEA的出峰面积有上升的趋势,在40℃时,相对于35℃时表现出显著差异;在45及50℃时,NDEA的出峰面积有所升高,虽萃取温度在50℃时NDEA出峰面积达到最大,并有继续增大的趋势,但相对于45及40℃时的出峰面积差异不明显,且增加的趋势已经趋于平缓。萃取温度对于挥发性物质在萃取过程中加快萃取平衡起到重要的作用。SPME对N-亚硝胺的萃取也适合低温下操作[4]。但同时也得出,较高的温度有利于萃取物在溶液与顶空间达到动态平衡,在25℃的温度下萃取效果较4℃好。
2.1.5.2萃取搅拌速度的选择
不同搅拌速度对萃取效果的影响结果见图3。

图3搅拌速度对NDEA萃取效果的影响Fig.3 The effects of stirring speed to the extraction of NDEA注:相同大写字母表示差异不显著,不同表示差异显著(P<0.05)。
从图3可以看出,搅拌速度的快慢对出峰面积的大小有显著影响,随着搅拌速度的加快NDEA的出峰面积并没有明显递增趋势,当搅拌速度在400 r/min时达到最高,且相对于其它搅拌速度下的出峰面积差异显著。
2.1.5.3萃取时间的选择
不同萃取时间对萃取效果的影响结果见图4。
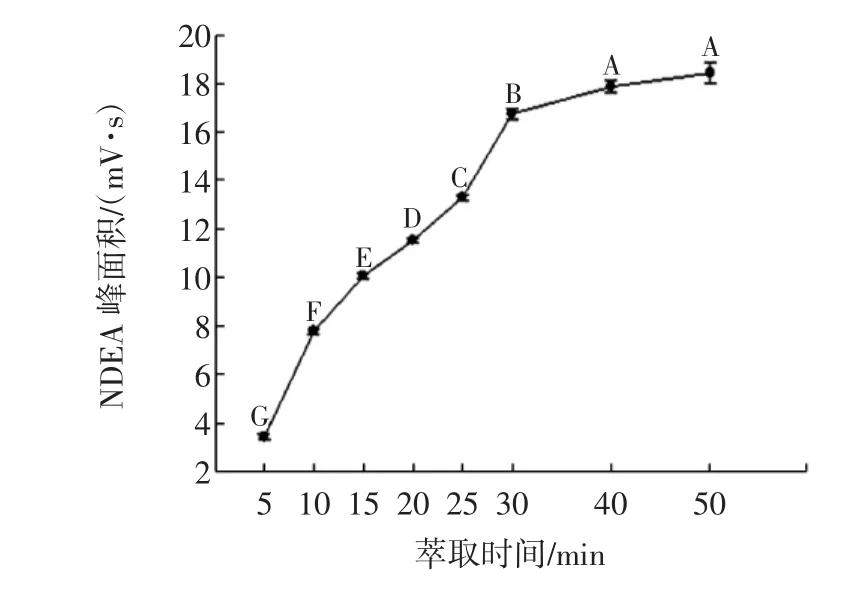
图4萃取时间对NDEA萃取效果的影响Fig.4 The effects of extraction time to the extraction of NDEA注:相同大写字母表示差异不显著,不同表示差异显著(P<0.05)。
从图4可以看出,萃取时间对NDEA的出峰面积影响较大,从5 min至25 min随着萃取时间的延长,NDEA的出峰面积增大的趋势较明显,从30 min至50 min这一时间区间,NDEA的出峰面积仍然在增加,但增加的趋势已经趋于平缓。这说明萃取头对被萃取物的富集过程是一个没有终点的漫长过程。有研究利用SPME-DED(direct extraction device)装置,探讨了萃取时间(15、30、60、120、180 min)对萃取效果的影响,得出结论:15 min的萃取时间足够用于分析[4]。本实验考虑到SPME并不是一种完全萃取操作,以及快速萃取操作及进样分析时间的可行性,最终选取30 min作为萃取时间。
2.1.5.4盐离子浓度的选择
不同盐离子浓度对萃取效果的影响见图5。

图5 NaCl浓度对NDEA萃取效果的影响Fig.5 The effects of Salt concentration to the extraction of NDEA注:相同大写字母表示差异不显著,不同表示差异显著(P<0.05)。
图5可以看出,萃取时NaCl的加入量对NDEA的出峰面积影响较大,加入NaCl 0.05 g/mL与不加NaCl时NDEA的出峰面积相比有显著差异。当NaCl加入量达到0.20 g/mL时,NDEA的出峰面积有显著增大,继续增大NaCl加入量到0.25 g/mL时,虽然NDEA的出峰面积有所增大,但两者间的差异不显著,考虑到NaCl在40℃的溶解度(36.6)及其对N-亚硝胺萃取效果的影响,选取NaCl加入量为0.20 g/mL作为萃取时添加的离子浓度,也就相当于在10 mL的溶液中加入2 g固体NaCl。
2.1.5.5正交试验的水平值及正交实验结果因素水平表及正交试验结果见表5。
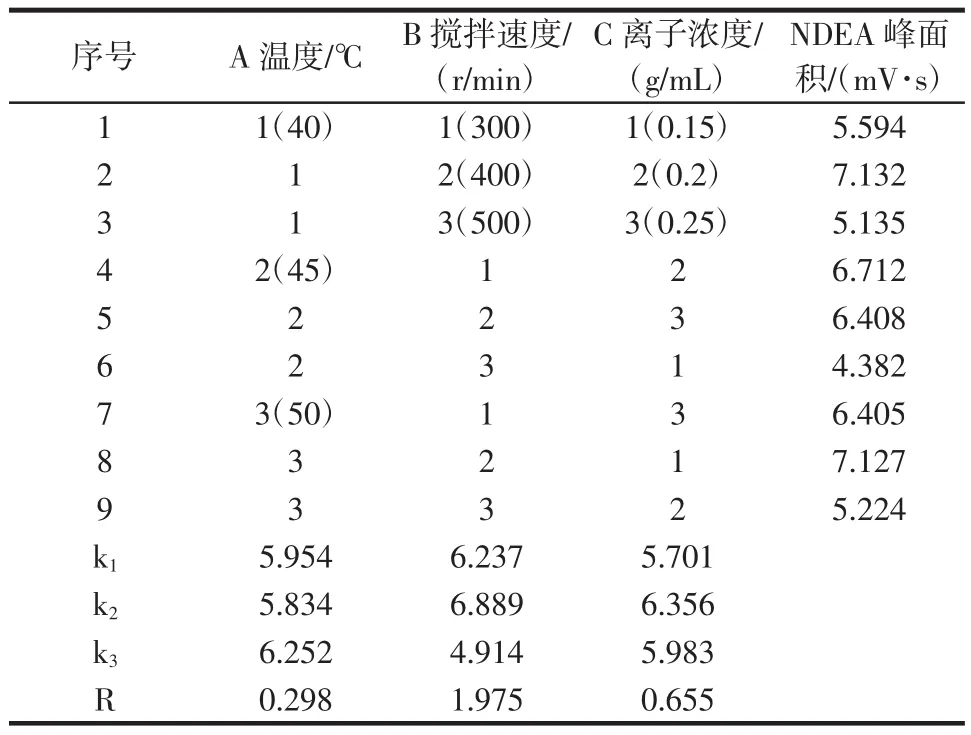
表5 NDEA萃取条件的正交试验结果Table 5 The orthogonal experiment result of extraction of NDEA by SPME
从表5可知对萃取效果的影响顺序分别是搅拌速度、离子浓度、萃取温度,最佳的萃取条件为A3B2C2,即萃取温度50℃、搅拌速度为400 r/min、离子浓度为0.2 g/mL,在上述最佳萃取条件下得到的NDEA峰面积为7.42,比表5中的第二组的萃取效果(该组的NDEA峰面积最大,为7.132)还好,确定采用此条件萃取对NDEA、NDMA及NPYR进行萃取操作。
2.2线性关系考察结果
对3种N-亚硝胺的线性分析得出,PDMS/DVB/ CAR萃取头对NDEA的测定表现出较好的线性,其R2在10 ng/mL~100 ng/mL时为0.994,在0~10 ng/mL时为0.977。对NDMA在0~10 ng/mL时的R2仅为0.902,对NPYR在0~10 ng/mL时没有表现出明显线性关系。2.3加标回收率计算结果
对加标样品进行3次平行测定,得出该方法的加标回收率为89.7 %,RSD为1.97 %。
2.4精密度试验结果
连续进样供试样品5次得到NDEA峰面积的RSD为2.7 %,说明仪器精密度良好。
2.5 3种N-亚硝胺的最低检出限
NDEA、NDMA及NPYR的最低检出限分别为0.67、2.71、9.18 ng/mL,国标中规定肉制品中NDEA的限量标准为5 μg/kg[5],根据本方法的取样量及稀释倍数计算,要检测出肉制品中NDEA含量在5 μg/kg时样品,NDEA的LOD最高不能高于1 ng/mL,试验结果的NDEA的LOD最小,表示该方法对NDEA的灵敏度最高,且可以满足肉制品中NDEA的定量测定,该方法对NDMA及NPYR这两种N-亚硝胺的萃取及检测方法还有待进一步研究。
2.6肉制品中N-亚硝胺的测定结果
用SPME-GC-NPD法测定3种样品,都检测出含有NDEA,而没有检测出NDMA及NPYR,原因可能是样品中的NDMA及NPYR含量很低,低于该方法的最低检出限。根据3次检测NDEA的峰面积计算得出3种烤肠中NDEA的含量分别为9.67、4.45、3.68 μg/kg。用国标法测定3种烤肠中NDEA的含量分别为8.94、4.17、3.21 μg/kg。也没有检测出NDMA及NPYR,经分析,与采用本试验SPME-GC-NPD法得出的结论相比,两者间的RSD分别为5.55 %、4.59 %、9.65 %,平均RSD为6.60 %,进一步验证了SPME-GC-NPD法对于测定肉制品中NDEA含量的可行性。
3 讨论
3.1萃取介质对萃取效果的影响
本试验采用去离子水作为萃取介质对N-亚硝胺的萃取条件进行研究,得出较理想的结果,将所确定的萃取条件、测定方法应用于固态食品也同样有较理想的回收率(89.7 %),这说明该方法适合于固态食品的测定。有研究报道以模拟固态食品(20 %明胶)[6-7]或直接利用发酵香肠来研究萃取条件[8-9]。S.ventanas.J.R 等[7](2006)利用直接萃取装置与SPME装置结合,与GC-MS联用,采用浸入萃取法对N-亚硝胺的萃取效果进行研究,得出较理想的结果。而采用发酵香肠等实际产品进行萃取条件分析,对N-亚硝胺的定量是一件比较困难的事情。去离子水作为萃取介质,对N-亚硝胺的定量控制比较准确且其有很好的分散性,能对萃取条件作出比较精确的控制。其缺点在于,N-亚硝胺在水相中的萃取效果优于在固态的肉制品中的萃取效果,这与采用明胶模拟固态食品的作用相反。由于肉类斩碎成肉糜状后,其仍然属于水包油型的体系,在水中的分散性能很好,所以对肉类中N-亚硝胺的测定条件的摸索可以通过去离子水作为萃取介质。当然更加适合于萃取条件优化的介质有待进一步的摸索。
3.2方法的优越性
SPME结合GC-NPD测定挥发性亚硝胺的方法相比于国标GB/T 5009.26-2005《食品中N-亚硝胺类的测定》中的测定方法有以下优点:1)样品前处理:样品前处理耗时短,国标方法中样品经过水蒸汽蒸馏,二氯甲烷萃取,并经过浓缩后所耗费的时间在2 h~3 h左右,而固相微萃取结合萃取与浓缩于一体,操作简单,整个过程只需30 min,并且不使用有毒的二氯甲烷做溶剂。在国标法中,样品在高温蒸馏的过程中,还有可能产生N-亚硝胺[10],这对检测结果有一定的影响。但SPME操作是在低温环境中进行,则可以避免这一现象的发生。此外,在低温下,也可减少食品中较难挥发的物质对N-亚硝胺定性定量的影响;2)取样量:国标中规定的取样量是200 g,而采用固相微萃取处理样品仅仅需要2 g左右的样品。3)仪器设备更容易配备:本方法中采用的是配备氮磷检测器的气相色谱仪,省去了价格昂贵的质谱仪。
4 结论
采用SPME,结合GC-NPD测定N-亚硝胺的方法,对NDEA的测定灵敏度最高,RSD为6.7 %,加标回收率为89.7 %,最低检出限(LOD)0.67 ng/mL,可以满足肉制品中NDEA的定量测定。以PDMS/DVB/CAR为萃取头,萃取温度50℃、搅拌速度400 r/min、萃取时间30 min、盐离子浓度0.20 g/mL时NDEA能得到最大的萃取面积。NDEA的测定在10 ng/mL~100 ng/mL时线性关系为0.994;NDMA在10 ng/mL~100 ng/mL时的线性关系为0.912;NPYR在0~10 ng/mL时没有表现出明显线性关系。
参考文献:
[1] Nrisinha PS, Stephen W, Seaman B, et al. Rapid semi-quantitative estimation of N-nitrosodibutylamine and N-nitrosodibenzylamine in smoked hams by solid-phase microextraction followed by gas chromatography-thermal energy analysis[J]. Journal of Chromatography A, 1997 (88): 131-140
[2] Ventanas S, Ruiz J. On-site analysis of volatile nitrosamines in food model systems by solid-phase microextraction coupled to a direct extraction device[J]. Talanta, 2006, 70(5): 1017-1023
[3]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 5009. 26-2003食品中N-亚硝胺类的测定[S].北京:中国标准出版社,2003
[4] Ventanas S, Martin D, Estévez M, et al. Analysis of volatile nitrosamines from a model system using SPME-DED at different temperatures and times of extraction[J]. Food Chemistry, 2005, 99(4): 842-850
[5]中华人民共和国卫生部,中国国家标准化管理委员会.GB 2762-2005食品中污染物限量[S].北京:中国标准出版社,2005
[6] Ventanas S, Martin D, Estévez M, et al. Analysis of volatile nitrosamines from a model system using SPME–DED at different temperatures and times of extraction[J]. Food Chemistry, 2005, 99 (4): 842-850
[7] Ventanas S, Ruiz J. On-site analysis of volatile nitrosamines in food model systems by solid-phase microextraction coupled to a direct extraction device[J]. Talanta, 2006, 70(5): 1017-1023
[8] Raquel A, Felix GR Reyes, Susanne Rath. A method for the determination of volatile N-nitrosamines in food by HS-SPME-GC-TEA [J]. Food Chemistry, 2005, 91(1): 173-179
[9] Camila B Dutra, Raquel A, Felix G R. Reyes and Susanne Rath. Determination of volatile N-nitrosamines in sausages by HS-SPMEGC-TEA[J]. Toxicology Letters, 2006, 106(1): 274-275
[10] Sebastien R, Eric G, Hugues, et al. Rapid solid-phase extraction method for the detection of volatile nitro-samines in food[J]. Journal of Agricultural and Food Chemistry,1997,45(12):4706-4713
Determination of Volatile N-Nitrosamines by SPME-GC-NPD in Meat Products
YANG Hua1,FANG Chang-fa2,ZHANG Tian1,MA Li-zhen2,*
(1. College of Food Science and Engineering,Shanxi Agricultural University,Taigu 030801,Shanxi,China;2. Department of Food Science,Tianjin Agricultural University,Tianjin 300384,China)
Abstract:To improve the test method of N-nitrosamines including NDEA,NDMA and NPYR. The experiment used solid-phase microextraction(SPME)as the extraction method,GC-NPD(gas chromatograph with nitrogen and phosphorus detector)as the detection tool to determine the volatile nitrosamines. Taking PDMS/ DVB/CAR as the extraction,when the extraction temperature was 50℃,stirring speed was 400 r/min,extraction time was 30 min and the concentration of salt ions was 0.20 g/mL,it could get the largest area of NDEA. We found that when the concentration of NDEA was from 10 ng/mL to 100 ng/mL,it could get the best linear,which reached 0.994. When the concentration of NDMA was from 10 to 100 ng/mL,the linear was better,reached 0.912,and NPYR didn't show clear linear relationship in the concentration range from 0 to 10 ng/mL. To determine the concentration of nitrosamines,solid-phase microextraction with GC-NPD had a good sensitivity of NDEA,RSD was 6.7 %,the recovery rate was 89.7 %,the lowest detection limit(LOD)was 0.67 ng/mL,which meet the quantitative determination of meat and other food products.
Key words:solid-phase microextraction;N-nitrosamines;extraction conditions;linear relationship;meat products
收稿日期:2015-09-29
*通信作者:马俪珍(1963—),女,教授,博士,研究方向:肉品科学与技术。
作者简介:杨华(1979—),女(汉),副教授,博士,研究方向:肉品科学与技术。
基金项目:山西省自然科学基金项目(2013011033-2);山西农业大学引进人才博士科研启动基金(2013YJ34)
DOI:10.3969/j.issn.1005-6521.2016.03.039

