肿瘤化学疗法止吐治疗新进展
·综述·
肿瘤化学疗法止吐治疗新进展
谭光根(综述),刘洋博(审校)(重庆市第五人民医院肿瘤科,重庆 400062)
[关键词]化疗,辅助;恶心;呕吐;治疗;综述文献
doi:10.3969/j.issn.1007-3205.2016.03.034
在肿瘤治疗中,化学疗法(化疗)是重要的治疗手段之一,但由化疗导致的恶心呕吐(chemotherapy induced nausea and vomiting,CINV)等常见的消化道反应是影响患者化疗期间生存质量的重要原因[1-2],同时也是导致患者恐惧化疗、依从性降低的主要因素之一[3]。如果缺乏有效防治措施,大约90%患者会出现严重的高度致吐性癌症化疗反应( highly emetogenic chemotherapy,HEC)[4-5]。CINV极大的影响了患者的治疗效果,急性剧烈的恶心、呕吐可能导致患者代谢失衡、营养不良,自身抵抗力下降以及神经性厌食症,严重者可因食道黏膜损伤而发生出血、感染,甚至死亡[6-10]。因此,有效预防CINV,对改善患者生活质量、保证化疗顺利进行及疗效至关重要。现就肿瘤化疗止吐治疗新进展综述如下。
1CINV分类
CINV分为预期性CINV、急性CINV、延迟性CINV、暴发性CINV和难治性CINV 5种类型。
2CINV影响因素
2.1药物因素包括使用的化疗药物品种、使用剂量以及使用方法等,另外还有化疗前是否合理有效使用止吐药物。
2.2非药物因素包括患者性别、年龄、酒精摄入耐受量、妊娠期呕吐程度和既往化疗恶心呕吐程度等。
3CINV发生机制
目前认为CINV是大脑皮质通路受到刺激所导致的,如化疗药物刺激胃肠道嗜铬细胞释放神经递质,神经递质与相应的受体结合产生神经冲动,经迷走神经和交感神经传入直接刺激化学感受器触发区,影响唾液分泌增加,呼吸加快,咽、胃肠道和腹部肌肉收缩,进而导致呕吐。目前,5-羟色胺(5-hydroxytryptamine,5-HT)被认为是介导急性CINV的主要神经递质,但其是否参与延迟性CINV的发生尚未明确[11]。除5-HT外,导致呕吐的神经递质主要有多巴胺、组胺、P物质等。而P物质NK-1受体,可经中枢和外周2种途径调控呕吐反应,但以前者为主[12-13]。除上述经典的化疗致吐机制外,化疗药物及其代谢产物也可直接刺激延髓催吐化学感受区,进而传递至中枢导致呕吐。同时患者的感觉、精神因子可直接刺激大脑皮质通路导致呕吐。
4CINV治疗
4.1CINV治疗药物
4.1.1多巴胺受体拮抗剂多巴胺受体阻断剂分为吩噻嗪类、丁酰苯和普鲁卡因酰胺类等。而普鲁卡因酰胺类中的甲氧氯普胺在其中又占据重要地位,小剂量时可阻滞多巴胺D2受体,大剂量时又可阻滞5-HT3受体,但其对多巴胺D2受体的作用明显强于对5-HT3受体作用,因此曾经很长一段时间内,其为控制化疗呕吐的首选药物[14]。
4.1.2作用于呕吐中枢的药物抗组胺类药物如苯海拉明和异丙嗪主要作用于组胺H1受体、西咪替丁主要作用于组胺H2受体、抗胆碱类药物东莨菪碱主要通过阻断M受体产生止吐作用。

4.1.4类固醇激素类药物常作为止吐辅助药物,在预防急性CINV和延迟性CINV中扮演了重要角色,几乎存在于所有止吐方案中,用于预防急性高、中、低度化疗致吐风险的患者。皮质激素类药物联合应用5-HT3受体拮抗剂可明显提高止吐疗效[15]。
4.1.55-HT3受体拮抗剂5-HT3受体拮抗剂可有效、高选择性地与5-HT3受体结合,竞争性地抑制5-HT3与其受体结合,从而阻止恶心呕吐的发生。因其止吐疗效高,且不良反应较低,故成为预防急性CINV的一线药物[2,5]。但仍有50%以上患者在应用CINV药物时会出现恶心、呕吐,尤其是延迟性CINV[16]。第1代5-HT3(昂丹司琼、格拉司琼、托烷司琼、多拉司琼)半衰期短(8~12 h),患者出院后中断止吐治疗,易导致延迟性CINV的发生[17]。第2代5-HT3受体拮抗剂(帕洛诺司琼),其半衰期明显延长,大约为40 h,与受体亲和力也增加了30倍,给药次数少,对于预防延迟性CINV有一定优势[18-19]。
4.1.6NK-1受体拮抗剂NK-1受体拮抗剂可通过血脑屏障,占领大脑中的NK-1受体,具有高选择性和亲和性,而对NK-2和NK-3受体亲和性很低[20]。选择性NK-1受体拮抗剂可阻断细胞毒性化疗药物所致的呕吐。NK-1受体拮抗剂代表药物阿瑞吡坦可以抑制由细胞毒性化疗药物引起的呕吐,对顺铂引起的呕吐具有良好的镇吐效果。临床试验表明,在使用中、高度致吐的化疗药物中,联合使用阿瑞吡坦可明显控制CINV[21]。
4.1.7其他止吐药物①奥氮平:奥氮平是一种非典型抗精神病药物,可阻断5-HT受体、多巴胺受体、胆碱能毒蕈碱受体、H1受体等,对CINV产生止吐作用[22-23]。②醋酸甲地孕酮:醋酸甲地孕酮是人工合成的孕激素,有研究表明醋酸甲地孕酮可减少CINV[24]。
4.2抗幽门螺杆菌治疗在肿瘤化疗止吐中的作用幽门螺杆菌感染是胃炎、消化性溃疡、胃癌的病因之一[25]。对幽门螺杆菌感染阳性患者,给予有效的抗幽门螺杆菌治疗,能在一定程度上预防和缓解这部分患者化疗中出现的消化道不良反应[26]。
4.3中医药在防治CINV中的作用除了运用传统的针灸疗法治疗呕吐以外,小半夏加茯苓汤等方剂对顺铂联合化疗所致延迟性CINV具有显著疗效[27]。
4.4控制CINV的原则①预防恶心、呕吐是根本目标,止吐治疗须贯穿化疗呕吐风险期始终。②多药联合方案化疗诱发的恶心、呕吐,其治疗方案应基于致吐风险最高的药物制定。③每个周期化疗期间,采取最佳止吐治疗方案是防止预期性CINV的关键。
此外,还须注意癌症患者的其他潜在致吐因素,包括肠梗阻、前庭功能障碍、脑转移、电解质紊乱、尿毒症、使用阿片类麻醉药物、伴有胃部疾病和精神心理因素等。
4.5联合用药对CINV的作用对于暴发性CINV,预防比治疗更重要。联合应用不同作用机制的多种止吐药物是处理暴发性CINV的主要原则,并且强调按时给药。接受多日化疗的患者会面临急性CINV和延迟性CINV双重风险,致吐性与化疗药物致吐风险高低及化疗药物使用顺序有关。国际肿瘤护理协会(Multinational Association of Supportive Care in Cancer,MASCC)、美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)、美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)和欧洲医学肿瘤学会(European Society for Medical Oncology,ESMO)公布的CINV预防和治疗指南[28-30]提示,引起HEC和中度致吐性癌症化疗反应(moderately emetogenic chemotherapy,MEC)约90%以上的患者在出现严重化疗呕吐反应后需要接受NK-1受体拮抗剂、5-HT3受体拮抗剂以及地塞米松的联合治疗(第1天~第3天或第1天~第4天),联合用药方式可最大程度防止化疗所带来的呕吐风险,联合2种环恩霉素(阿霉素或者表柔比星)和环磷酰胺(AC方案)容易导致较为严重的HEC。见表1。
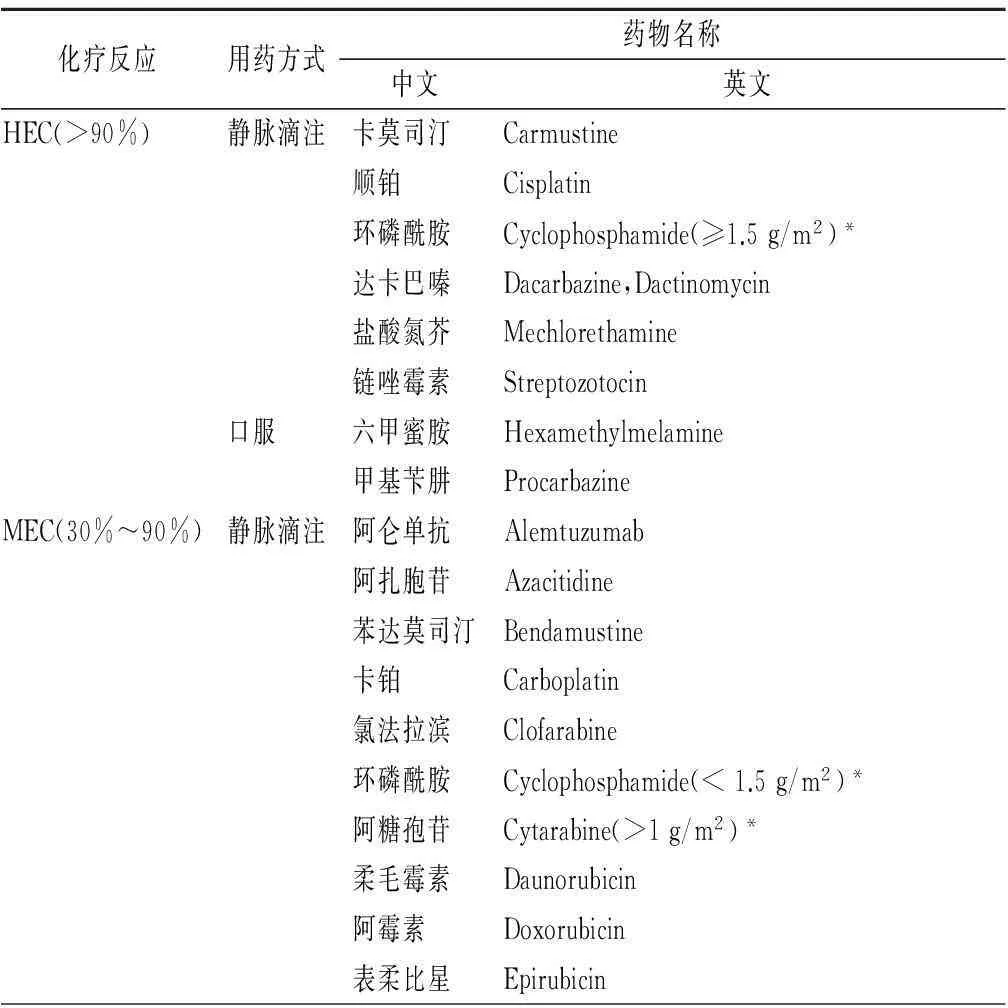
表1 MASCC、ASCO、 NCCN和ESMO发布化疗药物

表1 (续)
*超过此剂量可引起CINV
4.6HEC和MEC引起的急性呕吐及预防推荐使用帕洛诺司琼(仅第1天)加地塞米松(第1~3天),AC方案除外。若帕洛诺司琼无效,临床医生可替换第1代5-HT3受体拮抗剂,优选格拉司琼或昂丹司琼[31],有证据表明加入阿瑞匹坦与其他5-HT3受体拮抗剂联合使用都是有效的,且口服与静脉注射在疗效上没有太大区别,推荐使用剂量可参照表2,3。

表2 严重化疗呕吐反应止吐药物剂量推荐表
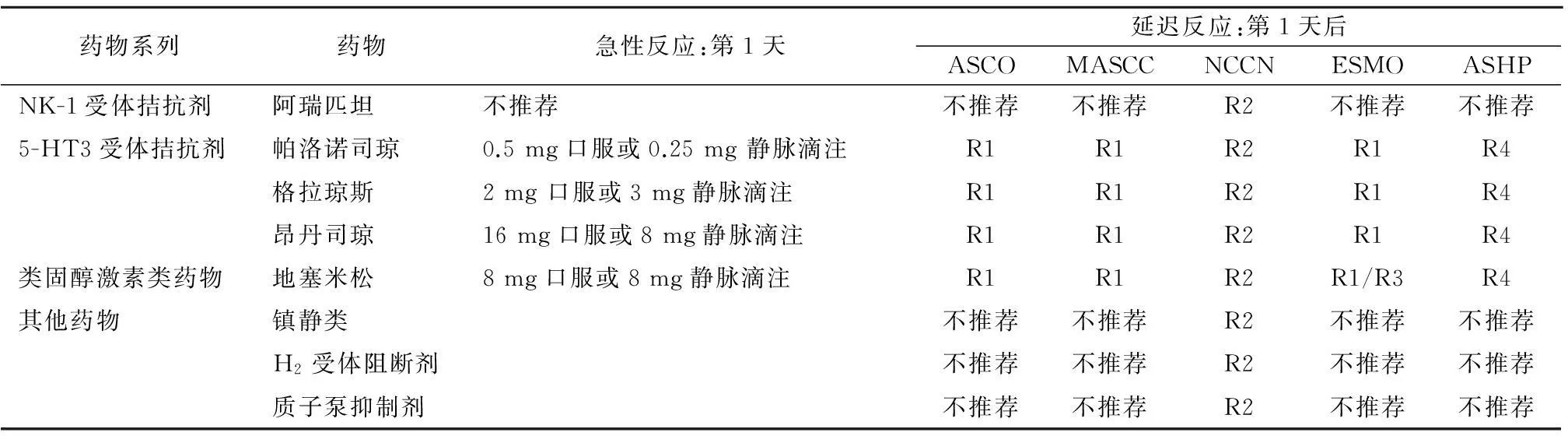
表3 中度化疗呕吐反应止吐药物使用推荐表
注: R1=5-HT3受体拮抗剂/地塞米松;R2=阿瑞匹坦/阿瑞匹坦+地塞米松/地塞米松/5-HT3受体拮抗剂/5-HT3受体拮抗剂+镇静类;R3=类固醇激素类药物;R4=5-HT3受体拮抗剂+地塞米松;ASHP(American Society of Health-System Pharmacists,美国医药卫生协会)
4.7对比5-HT3受体拮抗剂大多数试验主要集中于昂丹司琼和格拉司琼的研究[32],一小部分研究集中于多拉司琼和托烷司琼上。研究显示昂丹司琼和格拉司琼的药物作用效果是基本相当的。有报道指出第1代5-HT3受体拮抗剂中,昂丹司琼和格拉司琼的药物作用效果明显优于托烷司琼[33]。亦有报道发现第1次化疗后24 h,雷莫司琼和格拉司琼的药物作用效果是相当的。而大规模临床研究发现帕洛诺司琼能对化疗后的恶心和呕吐提供更好的保护,特别是在化疗后24~120 h之间[34-35]。这些所有的研究都是基于AC方案的,对比帕洛诺司琼和第1代5-HT3受体拮抗剂,包括地塞米松,帕洛诺司琼更值得被推荐[35]。在未使用顺铂或AC方案化疗中,一般不会使用NK-1受体拮抗剂,使用帕洛诺司琼加地塞米松又明显优于格拉司琼加地塞米松。以此推论,治疗非AC方案化疗止吐的效果,帕洛诺司琼加地塞米松明显优于第1代5-HT3受体拮抗剂加地塞米松[28]。
4.8对比NK-1受体拮抗剂根据第1个三期临床试验结果[36],建议接受AC化疗方案的患者,使用阿瑞匹坦加第1代5-HT3受体拮抗剂以及地塞米松联合治疗。有小样本的研究显示在昂丹司琼搭配地塞米松组合中添加阿瑞匹坦没有任何的优势,但由于样本量较小,所以说服力不足[37]。最近,一项848例大规模三期临床试验提示阿瑞匹坦组明显优于昂丹司琼搭配地塞米松组(对照组)[38]。最主要的功效是在开始化疗后的5 d时间里(0~120 h),没有出现呕吐情况。值得注意的是对比阿瑞匹坦组与对照组的止吐率分别为72.6%和62.1%,同样阿瑞匹坦组与对照组控制严重的延迟反应率和止呕吐率分别为92.0%、83.7%和77.9%、66.8%。虽然此研究效果显著,但是考虑不够周全,因为阿瑞匹坦是推荐用于非AC方案化疗的药物。
5小结
基于目前和未来的研究,对大多数接受癌症治疗的患者来说,重点在于何种止吐方案能更有效地防止呕吐和减轻恶心[39]。探索新的方式控制特殊人群的恶心和呕吐,尤其是儿科患者是非常重要的。同样研究并改善这些患者的症状也是必要的[28]。
对于大多数患者来说,本文所提及的方案可以减轻患者的呕吐反应,但仍有一部分患者出现难治性的呕吐、恶心、食欲减退。因此,开发更有效的止吐药物,优化、规范临床止吐治疗迫在眉睫。另外,同期已开展部分临床试验用于研究接受放射治疗后止吐药对其伴随症状的改善情况[39]。而5-HT3受体拮抗剂治疗急性CINV优于其他止吐药物,第1代5-HT3受体拮抗剂对延迟性CINV治疗没有优势,第2代5-HT3受体拮抗剂帕洛诺司琼,因半衰期长对预防延迟性呕吐有一定优势,单用该类药仍有9%~30%的患者不足以完全止吐。地塞米松对预防急性和延迟性CINV具有重要作用,几乎存在于所有止吐方案中,用于预防急性各种程度的化疗呕吐患者。目前,正在研究中的奈妥吡坦和帕洛诺司琼的复方制剂(称为NEPA),是5-HT3受体拮抗剂和NK-1受体拮抗剂的固定剂量复合剂,如联合奈妥吡坦(300 mg)和帕洛诺司琼(0.5 mg)在ASCO 2013年年会上发布已进入三期临床试验,试验包括1 455例接受AC方案的化疗患者,随机分配接受地塞米松或NEPA或者帕洛诺司琼,NEPA组止吐效果迅速,且效果持续更长久。
在过去的20年中,临床医师们在治疗化疗呕吐方面取得了很多的成绩,如阿瑞匹坦和帕洛诺司琼已经成为最新的治疗药物,且均有较好的效果,与地塞米松及5-HT3受体拮抗剂联合使用时止吐疗效显著[11]。但仍需积极开展一些针对性较强的临床研究,希望在不久的将来找到更好的控制各种CINV的措施,使化疗能够顺利进行。
[参考文献]
[1]Roila F,Herrstedt J,Gralla RJ,et al. Prevention of chemotherapy- and radiotherapy-induced nausea and vomiting:guideline update and results of the Perugia consensus conference[J]. Support Care Cancer,2011,19(Suppl 1):S63-65.
[2]Rojas C,Slusher BS. Pharmacological mechanisms of 5-HT(3) and tachykinin NK(1) receptor antagonism to prevent chemotherapy-induced nausea and vomiting[J]. Eur J Pharmacol,2012,684(1/3):1-7.
[3]Hesketh PJ. Chemotherapy-induced nausea and vomiting[J]. N Engl J Med,2008,358(23):2482-2494.
[4]Schwartzberg LS,Jacobs P,Matsouka P,et al. The role of second-generation 5-HT3 receptor antagonists in managing chemotherapy-induced nausea and vomiting in hematological malignancies[J]. Crit Rev Oncol Hematol,2012,83(1):59-70.
[5]Likun Z,Xiang J,Yi B,et al. A systematic review and meta-analysis of intravenous palonosetron in the prevention of chemotherapy induced nausea and vomiting in adults[J]. Oncologist,2011,16(2):207-216.
[6]Roscoe JA,Morrow GR,Aapro MS,et al. Anticipatory nausea and vomiting[J]. Support Care Cancer,2011,19(10):1533-1538.
[7]Lindley CM,Hirsch JD,O′Neill CV,et al. Quality of life consequences of chemotherapy-induced emesis[J]. Qual Life Res,1992,1(5):331-340.
[8]O′Brien BJ,Rusthoven J,Rocchi A,et al. Impact of chemotherapy-associated nausea and vomiting on patients′ functional status and on costs:survey of five Canadian centres[J]. CMAJ,1993,149(3):296-302.
[9]Ettinger DS,Grunberg SM,Hauber AB,et al.Evaluation of the relative importance of chemotherapeutic and antiemetic efficacy in various oncologic settings[J]. Support Care Cancer,2009,17(4):405-411.
[10]Hesketh PJ. Chemotherapy-induced nausea and vomiting[J]. N Engl J Med,2008,358(23):2482-2494.
[11]王转转,卢愿. 化疗相关性恶心与呕吐的治疗进展[J].齐鲁医学杂志,2013,28(2):186-187.
[12]Hesketh PJ. Chemotherapy-induced nausea and vomiting[J]. N Engl J Med,2008,358(23):2482-2494.
[13]Trigg ME,Higa GM. Chemotherapy induced nausea and vomiting:ant emetic trials that impacted clinical practicep[J]. J Oncol Pharm Pract,2010,16(4):233-244.
[14]牛桂珍.止吐类药物综述[J].临床合理用药杂志,2013,6(26):180-181.
[15]陈文举,宋金森,方惠娟,等.肿瘤化疗中止吐药物的合理应用[J].中国药事,2013,27(2):209-214.
[16]Turini M,Piovesana V,Ruffo P,et al. An assessment of chemotherapy-induced nausea and vomiting direct costs in three EU countries [J]. Drugs Context,2015,28(4):212285.
[18]Eisenberg P,Machintosh FR,Ritch P,et al. Efficacy,safety and Pharmacokinetics of palonosetron in patients receiving highly emetogenic cisplatin-based chemotherapy:a dose-ranging clinical study[J]. Ann Oncol,2004,15(2):330-337.
[19]张雯,王金万,周爱萍,等.帕洛诺司琼和恩丹西酮预防化疗诱发恶心呕吐的临床对比研究[J].中华肿瘤防治杂志,2011,18(16):1296-1298.
[20]Haddjeri N,Blier P. Neurokinin-1 receptor antagonists modulate brain noradrenaline and serotonin interactions[J]. Eur J Parmacol,2008,600(1/3):64-70.
[21]Paul B,Trovato JA,Thompson J,et al. Efficacy of aprepitant in patients receiving high-dose chemotherapy with hematopoietic stem cell support[J]. J Oncol Pharm Pract,2010,16(1):45-51.
[22]Navari RM. Antiemetic control:toward a new standard of care for emetogenic chemotherapy[J]. Expert Opin Pharmacother,2009,10(4):629-644.
[23]Licup N. Olanzapine for nausea and vomiting[J]. Am J Hosp Palliat Care,2010,27(6):432-434.
[24]Zang J,Hou M,Gou HF,et al. Antiemetic activity of megestrol acetate in patients receiving chemotherapy[J]. Support Care Cancer,2011,19(5):667-673.
[25]Ruggiero P. Helicobacter Pylor infection:what's new[J]. Curr Opin Infect Dis,2012,25(3):337-344.
[26]朴瑛,刘兆喆,丁震宇,等.抗幽门螺杆菌治疗在肿瘤化疗止吐中的作用研究[J].中国肿瘤临床,2012,39(22):1832-1834.
[27]施俊,魏品康.化疗呕吐的中医临床治疗进展[J].江西中医学院学报,2011,23(2):97-100.
[28]Basch E,Prestrud AA,Hesketh PJ,et al. Antiemetics:American Society of Clinical Oncology clinical practice guideline update[J]. J Clin Oncol ,2011,29(31):4189-4198.
[29]Herrstedt J,Roila F,ESMO Guidelines Working Group. Chemotherapy-induced nausea and vomiting:ESMO clinical recommendations for prophylaxis[J]. Ann Oncol,2009,20(Suppl 4):156-158.
[30]Roila F,Herrstedt J,Aapro M,et al. Guideline update for MASCC and ESMO in the prevention of chemotherapy-and radiotherapy-induced nausea and vomiting:results of the Perugia consensus conference[J]. Ann Oncol,2010,21(Suppl 5):v232-243.
[31]王展海,焦宝良,钱龙江,等.昂丹司琼联合消积理气汤治疗乳腺癌术后化疗所致恶心呕吐疗效观察[J].河北医科大学学报,2013,34(1):64-66.
[32]Billio A,Morello E,Clarke MJ. Serotonin receptor antagonists for highly emetogenic chemotherapy in adults[J]. Cochrane Database Syst Rev,2010,20(1):CD006272.
[33]Jordan K,Hinke A,Grothey A,et al. A meta-analysis comparing the efficacy of four 5-HT3-receptor antagonists for acute chemotherapy- induced emesis[J]. Support Care Cancer,2007,15(9):1023-1033.
[34]Aapro M,Fabi A,Nole F,et al. Double-blind,randomised,controlled study of the efficacy and tolerability of palonosetron plus dexamethasone for 1 day with or without dexamethasone on days 2 and 3 in the prevention of nausea and vomiting induced by moderately emetogenic chemotherapy[J]. Ann Oncol,2010,21(5):1083-1088.
[35]Saito M,Aogi K,Sekine I,et al. Palonosetron plus dexamethasone versus granisetron plus dexamethasone for prevention of nausea and vomiting during chemotherapy:a double-blind,double-dummy,randomised,comparative phase III trial[J]. Lancet Oncol,2009,10(2):115-124.
[36]Warr DG,Hesketh PJ,Gralla RJ,et al. Efficacy and tolerability of aprepitant for the prevention of chemotherapy-induced nausea and vomiting in patients with breast cancer after moderately emetogenic chemotherapy[J]. J Clin Oncol,2005,23(12):2822-2830.
[37]Yeo W,Mo FK,Suen JJ,et al. A randomized study of aprepitant,ondansetron and dexamethasone for chemotherapy-induced nausea and vomiting in Chinese breast cancer patients receiving moderately emetogenic chemotherapy[J]. Breast Cancer Res Treat,2009,113(3):529-535.
[38]Rapoport BL,Jordan K,Boice JA,et al. Aprepitant for the prevention of chemotherapy-induced nausea and vomiting associated with a broad range of moderately emetogenic chemotherapies and tumor types:a randomized,double-blind study[J]. Support Care Cancer,2010,18(4):423-431.
[39]Hickok JT,Roscoe JA,Morrow GR,et al. Nausea and emesis remain significant problems of chemotherapy despite prophylaxis with 5-hydroxytryptamine-3 antiemetics:a University of Rochester James P. Wilmot Cancer Center Community Clinical Oncology Program Study of 360 cancer patients treated in the community[J]. Cancer,2003,97(11):2880-2886.
(本文编辑:许卓文)
[中图分类号]R453.9
[文献标志码]A
[文章编号]1007-3205(2016)03-0364-05
[作者简介]谭光根(1965-),女,四川简阳人, 重庆市第五人民医院主任医师,医学学士,从事消化道肿瘤诊治研究。
[收稿日期]2015-08-31;[修回日期]2015-09-03

