以废旧钴酸锂电池为原料制备钴粉
周 涛,范百林,徐莉萍,徐 宝
(中南大学 化学化工学院,湖南 长沙 410083)
以废旧钴酸锂电池为原料制备钴粉
周涛,范百林,徐莉萍,徐宝
(中南大学 化学化工学院,湖南 长沙410083)
摘要:利用柠檬酸和双氧水作为浸出剂对预处理得到的正极活性物质进行还原浸出.采用联氨液相还原方法从柠檬酸浸出液中制备钴粉,并通过研究不同反应条件对柠檬酸浸出液中钴还原率的影响从而找出最佳制备条件.研究结果表明:最佳制备条件为反应温度为80 ℃、联氨与钴的物质的量比为2.5,反应时间为30 min, pH值为12.在此条件下,柠檬酸浸出液中钴的还原率超过90%,制备出的钴粉为混晶型细球形钴粉,平均粒径为0.62 μm.
关键词:废旧锂离子电池;钴粉;联氨还原;柠檬酸
如今,锂离子电池被广泛应用于可携带电子设备如智能手机、笔记本电脑和数码相机等.与传统的二次电池相比锂离子电池具有使用寿命长、环境污染小、体积小和比能量高等优点[1-5].随着社会的发展,锂离子电池的需求量也在逐年增加.据统计,2005年全球锂离子电池产量为500万只,2010年达到了20.5亿只[6].然而,锂离子电池的使用寿命是有限的,大量的废旧锂离子电池也随之产生.锂离子电池中微量的重金属和有毒的有机物会对人类生活环境造成危害[7-9].此外,废旧锂离子电池中含有大量的有价金属如锂、镍、铝、铜和钴.因此,合理的对废旧锂离子电池进行回收不仅会对环境起到保护作用而且还会带来一定的经济价值.
酸浸出在湿法回收过程中扮演了很重要的角色,其主要目的是将活性物质中的金属转移到浸出液中从而便于后期的分离过程.无机酸如HCl[10]、HNO3[11]和H2SO4[12]已经被广泛应用于废旧锂离子电池的回收浸出过程.但是无机酸在浸出的过程中会产生有害气体如Cl2, NOx和SO3,这会对环境造成二次污染.柠檬酸由于其高效环保已经引起的广泛的关注,Li等[13]研究了柠檬酸作为浸出剂对废旧钴酸锂电池的浸出效果,结果表明超过90%的钴能够被浸出.
作为一种过渡金属材料,单质钴已经被广泛关注和研究.它被广泛应用于硬质合金、永磁材料、催化剂等领域[14].钴粉的制备方法有很多种,主要有:真空热分解法、液相还原法、气相还原法、溶胶凝胶法、多元醇法、微乳液法[15-16].相较于其他方法,液相还原法具有操作简单、设备投资小、纯度高等优点.本文利用柠檬酸作为浸出剂,利用联氨液相还原法从废旧钴酸锂中制备出超细钴粉.研究了反应温度、反应时间、联氨与钴物质的量比和反应体系pH值对柠檬酸浸出液对钴粉还原率的影响.
1材料与方法
1.1试剂和仪器
本实验所用的废旧锂离子电池是由天津力神电池股份有限公司提供,活性物质为钴酸锂(LiCoO2).柠檬酸;过氧化氢;硼氢化钾;联氨;N-甲基吡咯烷酮 (NMP),实验所用试剂均为分析纯.
实验仪器:马弗炉;真空干燥箱;电感耦合等离子发射仪;X线衍射仪;扫描电子显微镜;恒温水浴槽;pH计;真空抽滤仪;恒温水浴锅.
1.2废旧锂离子电池预处理
图1为废旧锂离子电池的预处理过程.首先将废旧电池进行手工拆解得到正极、负极、隔膜和外壳.然后将正极和负极分别放入盛有NMP溶液的烧杯中,在90 ℃下磁力搅拌1 h.待正负极上的活性物质与集流体分离后对其进行过滤分离,铝箔和铜箔直接被回收.然后将干燥后的正极活性物质放入马弗炉中700 ℃煅烧2 h以除去活性物质中少量的杂质(PVDF,炭).最后将活性物质充分研磨以便于后续浸出过程.活性物质中Li、Co、Al、Ni的质量分数分别为6.78%、58.65%、0.49%、0.54%.

图1 废旧锂离子电池预处理
1.3柠檬酸还原浸出
将预处理得到的黑色活性物质加入到250 mL三颈烧瓶中,采用水浴加热反应条件控制为:1.25 mol/L的柠檬酸,液液比为1%,反应温度为90 ℃,浸出时间为30 min,搅拌速度为300 r/min浸出固液比20 g/L.浸出反应后将含有锂离子和钴离子的浸出液与残渣通过真空抽滤进行分离.分离后将浸出液用于下一步钴粉制备实验.
1.4钴粉制备
首先将50 mL浸出液加入250 mL三颈瓶中,温度由水浴锅控制.溶液pH值由氢氧化钠溶液进行调节.然后将晶核引发剂硼氢化钾(约为20 mg)加入浸出液中.最后将联氨通过恒压漏斗缓慢加入到反应器中.反应过后将底部生成的灰黑色固体通过真空抽滤仪进行分离并用乙醇将产品冲洗3次.将产品放入到60 ℃的真空干燥相中干燥24 h以便于后续的产品表征.为了得到比较好的产率,本实验研究了温度、反应时间、pH值和物质的量比对钴还原率的影响.根据计算公式(1),计算柠檬酸浸出液中钴粉还原率.
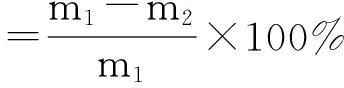
(1)
式中:m1为柠檬酸浸出液钴的总质量(g),m2液相还原反应后滤液中钴的质量(g).
2结果与讨论
2.1柠檬酸浸出
柠檬酸是一种常见的有机弱酸.柠檬酸含有三个羧基,理论上1 mol的柠檬酸可以电离出3 mol的氢离子.事实上,在水溶液中柠檬酸并不能完全电离.在浸出的过程中柠檬酸提供氢离子,过氧化氢作为还原剂能够将不稳定的三价钴还原为稳定的二价钴.使用柠檬酸作为浸出剂,锂和钴都能被有效的浸出.柠檬酸浸出反应[13]如方程式(2)~(4)所示.
6H3Cit+2LiCoO2+H2O2=2Li++6H2Cit-+2Co2++4H2O+O2
(2)
6H2Cit-+2LiCoO2+H2O2=2Li++2Co2++6HCit2-+4H2O+O2
(3)
6HCit2-+2LiCoO2+H2O2=2Li++2Co2++6Cit3-+4H2O+O2
(4)
2.2钴粉制备原理
柠檬酸作为配位剂,联氨作为还原剂合成钴粉已经有文献报道[17].由电极反应[18]式(5)和(6)可知在碱性条件下,N2H4/N2的还原电位为-1.16 V,Co2+/Co的还原电位为-0.28 V,氧化还原的电动势为0.88 V.因此在碱性条件下联氨还原制备钴粉在热力学上是可行的.在本实验中,浸出后二价钴将会与柠檬酸根进行配位,这也避免了在调节溶液pH值的过程中二价钴形成氢氧化物的沉淀.微量的硼氢化钾作为晶核引发剂首先能够制备出少量的单质钴,会对后续的联氨液相还原起到促进的作用[19].因此在联氨作为还原剂和硼氢化钾作为晶核引发剂的条件下,浸出液中的二价钴能够被还原为单质钴.联氨液相还原制备钴粉原理如反应(7)所示[17]:
(5)
(6)
(7)
2.3反应条件对浸出液中钴还原率的影响
2.3.1反应时间对还原率的影响
在反应温度为80 ℃、pH值为12、钴和联氨物质的量比为3的条件下,研究时间对钴还原率的影响,实验结果如图2(a)所示.由图2(a)可以看出,在30 min之前钴的还原率随着反应时间的增加而升高.在反应初期钴的还原率比较低,当反应时间为5 min时浸出液中钴的还原率为36.9%.当反应时间增加到30 min时,钴的还原率达到了91.5%.进一步提升反应时间,钴的还原率不发生变化,说明此时液相还原反应已经达到平衡.因此,在废液循环浸出过程中,反应时间30 min是比较合适的.
2.3.2 反应温度对还原率的影响
反应温度对钴的还原率影响如图2(b)所示.钴和联氨的物质的量比为3,液相还原时间为30 min,溶液的pH值为12.由图2(b)可以看出,在温度达到80 ℃之前钴的还原率随着反应温度的增加而增加.当反应温度为50 ℃时,钴的还原率为零,说明此时反应不能发生.当反应温度升高到80 ℃时,钴的还原率达到了91.5%.进一步提升反应温度,浸出液中钴还原率基本上不发生变化.因此,液相还原反应温度控制为80 ℃比较适宜.
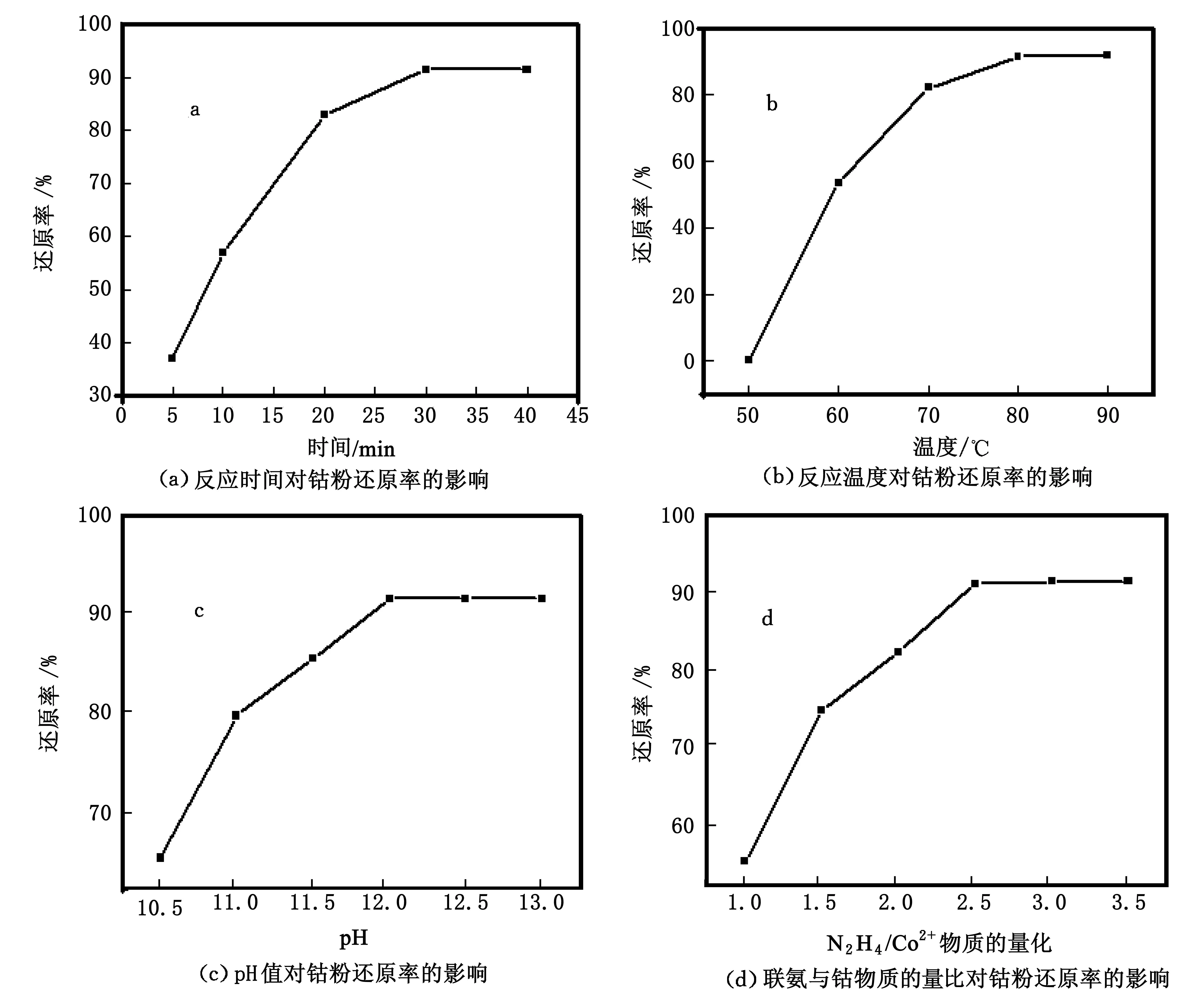
图2 时间、温度、pH值、联氨与钴物质的量化对钴粉还原率的影响
2.3.3溶液pH值对还原率的影响
图2(c)所示为在反应温度为80 ℃,反应时间为30 min,联氨与钴的物质的量比为3.0的条件下,溶液pH值对钴还原率的影响.由图2(c)可以看出随着反应体系pH值的升高,浸出液中钴的还原率呈现递增的状态.当反应体系的pH值为10.5时,钴的还原率为65.5%.当反应体系pH值为12时,钴的还原率达到了91.5%后,进一步提高溶液的pH值,对钴的还原率基本上没有影响.根据联氨与氮气的电极方程式(8)可知OH-作为反应物能够促使反应平衡向正方向移动.此外,联氨在强碱性的条件下具有更强的还原性.因此在比较高的pH值条件下,钴粉的还原率会增加.
(8)
2.3.4联氨与钴物质的量比对还原率的影响
图2(d)所示为在反应温度为80 ℃、溶液pH值为12和反应时间为30 min条件下,联氨与钴的物质的量比对浸出液中钴的还原率的影响.由图2(d)可以看出钴的还原率随着联氨与钴的物质的量比的增加而增加.由反应方程式(7)可知联氨液相还原制备钴粉的理论物质的量比(N2H4/Co2+)为0.5.经实验发现联氨用量为理论用量时,钴粉的还原率很低,这是因为部分联氨会在钴粉的催化下发生自分解生成氮气和氨气[18], 反应为方程式(9).当联氨与钴的物质的量比为1.0时,浸出液中钴的还原率为55.5%.当联氨与钴的物质的量比为2.5时,钴的还原率达到了91.5%.进一步提高溶液的pH值,对钴的还原率基本上没有影响.因此联氨与钴的物质的量比为2.5时为最佳反应条件.
(9)
2.4产品的表征
基于上述条件可知:在反应温度为80 ℃,反应时间为30 min,联氨与钴的物质的量比为2.5的条件下,废旧锂离子电池浸出液中钴的还原率超过了90%.图3为在上述条件下从废旧锂离子电池中制备出的钴粉的XRD, SEM和粒径统计图.由图3(a)可知:制备的钴粉为混晶型产物,分别为面心立方晶型(CCP)和六方密堆晶型(HCP)[14].其中位于42.0°, 44.8°, 48.0°和 76.0°4个衍射峰分对应的是hcp钴的(100),(002),(101),(102)和(110) 晶面.位于44.8°, 51.4°和76.0°3个衍射峰对应的是ccp钴的(111),(200)和(220)晶面.由图3(b)可知:大多数的钴粉颗粒为球形颗粒,颗粒细小均匀,伴有团聚现象,这是由于钴粉颗粒之间的表面张力和静电作用力共同作用的结果.图3(c)所示为钴粉采用Simple PCI软件测定的粒径分布图.结果表明:钴粉的平均粒径为0.62 μm, 粒径主要分布在0.2~1.6 μm.
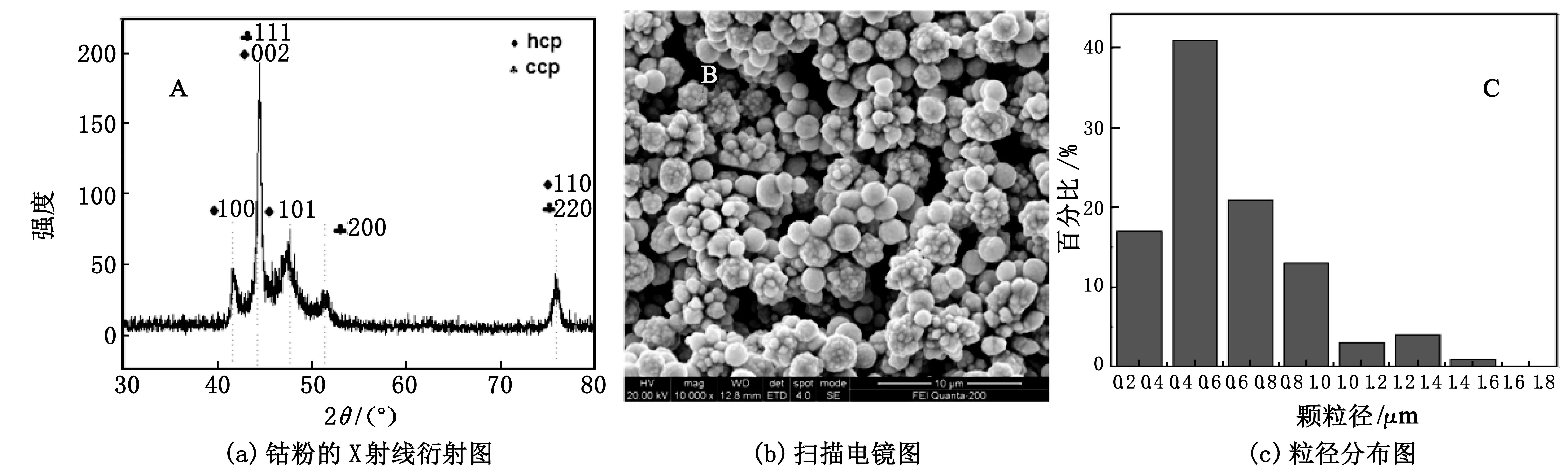
图3 产品的表征图
3结论
本文利用联氨液相还原法,研究了从废旧钴酸锂电池柠檬酸浸出液中制备钴粉的过程.利用1.25 mol/L柠檬酸和1%过氧化氢作为浸出剂对废旧钴酸锂充分浸出得到含钴浸出液.最后利用联氨从浸出液中还原制备钴粉.通过对比实验研究了反应条件对浸出液中钴还原率的影响,从而得到最佳工艺制备条件.在反应温度为80 ℃、联氨与钴的物质的量比为2.5、反应时间为30 min和pH值为12的条件下,浸出液中钴的还原率达到了91.5%.在此条件下得到的钴粉为混晶型球形钴粉,平均粒径为0.62 μm.
参考文献:
[1] BERTUOL D A,TONIASSO C,JIMENEZ B M,et al.Application of spouted bed elutriation in the recycling of lithium ion batteries[J].Journal of Power Sources,2015(275):627-632.
[2] GEORGI-MASCHLER T,FRIEDRICH B,WEYHE R,et al.Development of a recycling process for Li-ion batteries[J].Journal of power sources,2012(207):173-182.
[3] HU C,GUO J,WEN J,et al.Preparation and electrochemical performance of nano-Co3O4anode materials from spent Li-Ion batteries for Lithium-Ion batteries[J].Journal of Materials Science & Technology,2013,29(3):215-220.
[4] 赵鹏飞,尹晓莹,满瑞林,等.废旧锂离子电池回收工艺研究进展 [J].电池工业,2011,16(6).
[5] 李德耿,吴森,夏洋,等.涂布法制备锌//聚苯胺二次电池[J].徐州工程学院学报(自然科学版),2015,30(1):35-41.
[6] XU J,THOMAS H R,FRANCIS R W,et al.A review of processes and technologies for the recycling of lithium-ion secondary batteries[J].Journal of Power Sources,2008,177(2):512-527.
[7] LISBONA D,SNEE T.A review of hazards associated with primary lithium and lithium-ion batteries,Process Safety and Environmental Protection[J].2011,89(6):434-442.
[8] ZENG X L,LI J H.Innovative application of ionic liquid to separate Al and cathode materials from spent high-power lithium-ion batteries[J].Journal of hazardous materials,2014(271):50-56.
[9] 刘晓磊,周鹤方,庞茂平,等.盐酸介质中 N,N′-二甲基-N,N′-二辛基-3-氧戊二酰胺萃取 Cu2+的研究[J].徐州工程学院学报(自然科学版),2013(1):61-64.
[10] SWAIN B,JEONG J,LEE J,et al.Hydrometallurgical process for recovery of cobalt from waste cathodic active material generated during manufacturing of lithium ion batteries [J].Journal of Power Sources,2007,167(2):536-544.
[11] LI J H,SHI P X,WANG Z F,et al.A combined recovery process of metals in spent lithium-ion batteries [J].Chemosphere,2009,77(8):1132-1136.
[12] LEEA C K,RHEE K I.Reductive leaching of cathodic active materials from lithium ion battery wastes [J].Hydrometallurgy,2003,68(1):5-10.
[13] LI L,GEA J,WU F,et al.Recovery of cobalt and lithium from spent lithium ion batteries using organic citric acid as leachant[J].Journal of Hazardous Materials,2010,176(1):288-293.
[14] ZHU Y C,ZHENG H G,YANG Q,et al.Growth of dendritic cobalt nanocrystals at room temperature [J].Journal of Crystal Growth,2004,260(3):427-434.
[15] CAO H Q,XU Z,SANG H,et al.Template synthesis and magnetic behavior of an array of cobalt nanowires encapsulated in polyanilinenanotubules[J].Advanced Materials,2001,13(2):121-123.
[16] 罗振勇,刘志宏.金属钴粉的制备及应用[J].粉末冶金工业,2008,18(2):40-44.
[17] LI Y L,ZHAO J Z,SU X D,et al.A facile aqueous phase synthesis of cobalt microspheres at room temperature[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2009,336(1):41-45.
[18] 熊育飞,熊仁金,周大利,等.湿化学还原法合成 Co 纳米粒子的研究[J].材料导报,2006,20(11):170-173.
[19] SALGUEIRINO-MACEIRA V,CORREA-DUARTE M A,FARLE M,et al.Synthesis and characterization of large colloidal cobalt particles[J].Langmuir,2006,22(4):1455-1458.
(编辑崔思荣)
A Novel Process of Cobalt Powder Preparation from Spent Lithium Ion Batteries
ZHOU Tao,FAN Bailin,XU Liping,XU Bao
(College of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
Abstract:An innovative process was proposed for the preparation of cobalt powders from spent lithium ion batteries (LIBs), which includes pretreatment,acid leaching,preparation of cobalt powder procedures.First,cathode active materials obtained after pretreatment were leached with citric acid and hydrogen peroxide.Then target product of cobalt powders can be obtained by hydrazine reduction of Co ions in the leaching solution.The optimal conditions for preparing cobalt powder were obtained by contrast experiment.The experiment results show that over 90 % cobalt can be recovered as cobalt powders under the optimal conditions of reaction temperature-80 ℃,molar ratio of N2H4/Co(2+)-1∶2.5, reaction time-30 min and pH=12.The obtained cobalt powders posses two mixed phase of hcp and ccp.The morphology of cobalt powders obtained is spherical and the average particle size of obtained cobalt powder is 0.65 μm.
Key words:spent lithium ion batteries; cobalt powder; hydrazine reduction; citric acid
中图分类号:O646.21
文献标志码:A
文章编号:1674-358X(2016)01-0009-05
作者简介:周涛 (1963-),男,教授,博士生导师,主要从事纳米材料、超微细颗粒的制备和表面改性、多相流与流态化、二次资源回收研究;范百林(1991-),男,硕士研究生,主要从事废旧锂离子电池回收研究.
基金项目:国家自然科学基金项目(21176266)
收稿日期:2016-01-15

