超声波辅助复合酶提取鸡软骨中硫酸软骨素
宋志鹏,徐丽萍,王 鑫(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨 150076)
超声波辅助复合酶提取鸡软骨中硫酸软骨素
宋志鹏,徐丽萍,王鑫(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨 150076)
摘要:以鸡软骨为原料,采用超声波辅助碱-双酶法提取硫酸软骨素,以硫酸软骨素得率为考察指标,选取最优提取方法,并对最优方法进行单因素试验和响应曲面优化.试验结果表明,最佳工艺参数为超声波功率500 W,超声时间120 min,碱性蛋白酶添加量为1%,木瓜蛋白酶添加量为2%,硫酸软骨素得率可达到36.08%.超声波辅助碱-双酶法耗时短,操作简单且得到的产品纯度高.
关键词:鸡软骨;硫酸软骨素;双酶;超声波
硫酸软骨素(Chondroitin Sulfate,CS)又称牛磺软骨素、康得宁,多分布于哺乳动物的软骨、肌膜和韧带中,是结缔组织的主要成分之一[1].硫酸软骨素一种白色或淡黄色的粉末,无臭、无味,不溶于乙醇、丙酮等有机溶剂,易溶于水.低温条件下比较稳定,当温度在60℃以上时则会降解[2].硫酸软骨素具有抗血栓、调节血脂、抗感染、增强免疫功能、清除自由基以及抗肿瘤等生理功能[3-5].在不同动物体内的存在类型不同,在猪、牛、羊等动物的软骨中主要存在的是硫酸软骨素A,而在鲨鱼等海洋动物体内主要含有的是硫酸软骨素C[6]软骨中的硫酸软骨素以蛋白多糖的形式存在,是一种酸性粘多糖[7].
硫酸软骨素对于角膜炎、视力老化等眼科疾病具有一定的治疗效果,可与生理盐水、羟基水杨酸己基汞钠等药物制成复方眼药水[8-11].硫酸软骨素在作为临床生化药物的同时,还被人们用在膳食补充剂中来改善人体机能[12-13].动物软骨中的硫酸软骨素迄今为止仍无法人工合成[14],因而其提取及应用已成为当前功能性食品研究的一大热点.本文采用超声波辅助碱-双酶法提取硫酸软骨素,找出一种简单合理、成本低廉的提取硫酸软骨素的方法,使之能够尽快应用于生产当中,同时提高农产品附加值,对发展我国经济具有十分深远的意义.
1材料与方法
1.1材料与仪器
鸡软骨,哈尔滨千鹤冷冻食品;碱性蛋白酶、木瓜蛋白酶,北京澳博星生物技术有限责任公司;无水乙醇,天津市天力化学试剂有限公司;氢氧化钠,天津市大陆化学试剂厂;氯化钠,天津市天新精细化工开发中心;盐酸、浓硫酸,西陇化工股份有限公司;咔唑,上海源叶生物科技有限公司.
FZ102型中草药粉碎机,天津市泰斯特仪器有限公司;HH-4型数显恒温水浴锅,国华电器有限公司;DL-5-B型低速容量离心机,上海安亭科学仪器厂;ZDF-6090型真空干燥箱,上海恒一科学仪器有限公司;ALC-1100.2型电子分析天平,北京赛多利斯仪器系统有限公司;TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;酒精计,河间市黎民居玻璃仪表厂;KQ-500VDE型数控超声波清洗器,昆山市超声仪器有限公司.
1.2实验方法
1.2.1鸡软骨预处理
鸡软骨经解冻处理后,置于锅内煮约30 min,至鸡软骨表面附着肉、筋膜、脂肪及其他软组织等杂质脱落,清水洗净,切割至薄片,烘干,粉碎,过40目筛后备用.
1.2.2硫酸软骨素的提取
取5 g软骨粉,按料液比1∶20(g/mL)加入体积分数为3%的NaOH溶液,置于500 W、25 ℃条件下超声波辅助提取120 min.调节pH至10,加入原料质量分数1%的碱性蛋白酶[15-16],50 ℃条件下搅拌酶解3 h.将酶解液进行离心操作,取上清液.调节pH值至6.8,加入原料质量分数2%的木瓜蛋白酶进行酶解.55 ℃水浴加热0.5 h后,80 ℃恒温5 min灭酶.离心,取上清液.将上清液调至中性,按滤液体积加入 2%的NaCl,搅拌至溶解加入无水乙醇至醇沉体系体积分数为 65%(V/V),静置过夜,收集沉淀离心,离心得到的沉淀再用少量无水乙醇洗涤脱水,放于鼓风干燥箱 60 ℃干燥,得到硫酸软骨素粗提物.
1.2.3硫酸软骨素含量测定
准确称取0.01 mL硫酸软骨素样品置于25mL具塞试管中,加入蒸馏水稀释至 5 mL,冰水浴中冷却.加入6 mL浓硫酸,盖塞振荡均匀后置于沸水中加热 20 min,取出放于冰水浴中冷却.加入 0.20 mL咔唑溶液,摇匀后置于沸水中加热 15 min,显色,取出迅速置于冰水浴中冷却至室温.用无醛乙醇作为空白溶液进行参比,在 526 nm波长下测定硫酸软骨素溶液的吸光度值.
1)硫酸软骨素含量的计算
其中:C为测量质量浓度,mg/mL; n为稀释倍数;V为提取液体积;mL; M为原料干重,g.
2)硫酸软骨素得率的计算
其中:W为硫酸软骨素得率,% ;m为硫酸软骨素粗品质量,g ;M为干燥鸡软骨粉质量,g.
3)硫酸软骨素纯度的计算
其中:W为硫酸软骨素质量分数,% CS为硫酸软骨素百分含量,% ; P为硫酸软骨素得率,%.
1.2.4硫酸软骨素提取工艺单因素试验
1) 超声波时间单因素实验
称取5份3g原料,按料液比1∶20(g/mL)加入体积分数为3%的NaOH溶液,置于500W、25 ℃条件下超声波辅助提取100、120、140、160、180min.之后按提取方法的工艺流程进行操作,得到硫酸软骨素粗提物.干燥称重,计算硫酸软骨素得率.
2) 超声波功率单因素实验
称取5份3g原料,按料液比1∶20(g/mL)加入体积分数为3%的NaOH溶液,置于300、350、400、450、500W,25 ℃条件下超声波辅助提取120min.之后按1.2.2进行试验.干燥称重,计算硫酸软骨素得率.
3)碱性蛋白酶添加量单因素实验
称取5份3g原料,按料液比1∶20(g/mL)加入体积分数为3%的NaOH溶液,置于500W、25 ℃条件下超声波辅助提取120min.调节pH至10,加入原料质量分数0.6%、0.8%、1.0%、1.2%、1.4%的碱性蛋白酶,50 ℃条件下搅拌酶解3h.离心,取上清液.之后按1.2.2进行试验.干燥称重,计算硫酸软骨素得率.
4)木瓜蛋白酶添加量单因素实验
称取5份3g原料,按料液比1∶20(g/mL)加入体积分数为3%的NaOH溶液,置于500W,25 ℃条件下超声波辅助提取120min.调节pH至10,加入原料质量分数1%的碱性蛋白酶,50 ℃条件下搅拌酶解3h.离心,取上清液.调节pH值至6.8,加入原料质量分数1.6%、1.8%、2.0%、2.2%、2.4%的木瓜蛋白酶酶解.55 ℃水浴加热0.5h后,80 ℃恒温5min灭酶.离心,取上清液.将上清液调至中性,按滤液体积加入2%的NaCl.醇沉,干燥,得到硫酸软骨素粗提物.称重,计算硫酸软骨素得率.
1.2.5响应曲面法优化硫酸软骨素的提取工艺条件
依据单因素实验结果,采用Box-Behnken模型对超声波辅助碱-双酶法提取硫酸软骨素的工艺条件进行响应曲面设计优化.以硫酸软骨素得率为响应值,考察超声波时间、碱性蛋白酶添加量、木瓜蛋白酶添加量三个因素对硫酸软骨素得率的影响.各因素的区间为:超声波时间100~120min,碱性蛋白酶添加量0.8%~1.2%,木瓜蛋白酶添加量1.8%~2.2%,因子编码及水平见表1.

表1 Box-Behnken实验设计因素水平及编码
2结果与讨论
2.1硫酸软骨素提取结果
采用超声波辅助碱-双酶法提取硫酸软骨素,经浓缩干燥,三次平行试验得率分别为30.07%、34.37%、31.25%,平均得率为31.89%.
2.2硫酸软骨素提取工艺单因素实验结果分析
2.2.1超声波时间实验的结果分析
由图1可以看出,超声时间在100~120 min范围内时,硫酸软骨素得率随着时间的延长而增加,在时间为120 min时达到最大值为30.44%.这是因为随着超声时间的延长,超声波的空化和机械震荡等作用得到充分发挥,可使细胞破裂更完全,使硫酸软骨素得率随之增大.但时间超过120 min后,硫酸软骨素得率反而随着超声时间的延长而降低,这可能是由于长时间的作用造成了大分子多糖的断裂,其中部分硫酸软骨素发生水解,而且水解程度大于浸出的速度,造成提取过程中的损失增大而使硫酸软骨素得率降低.结果分析可知,最佳超声时间为120 min.
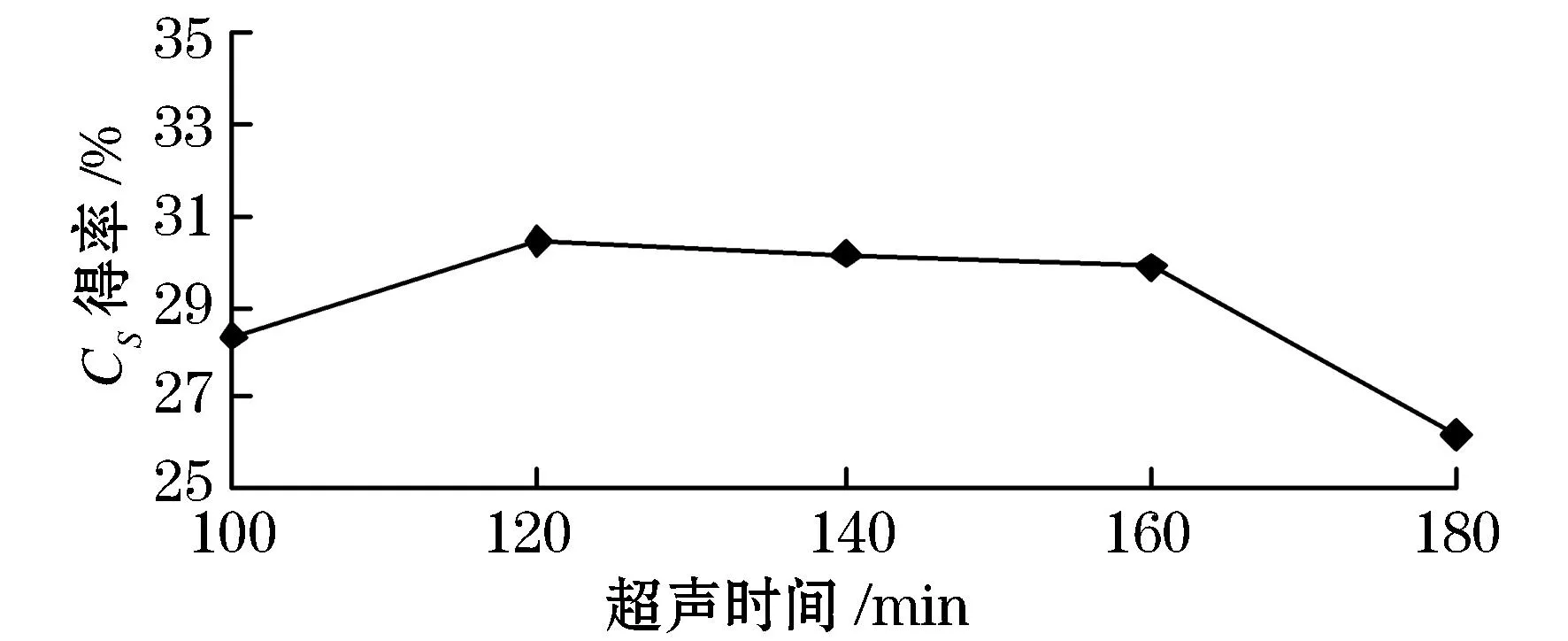
图1 超声时间对硫酸软骨素得率的影响
2.2.2超声波功率实验的结果分析
由图2可以看出,超声波功率在350~500 W范围内时,硫酸软骨素的得率随着功率的增加而增加,在功率500 W时达到最大值为30.25%.这是因为随着超声波功率的增加,超声波的空化和机械震荡等作用得到充分发挥,可使细胞破裂更完全,使硫酸软骨素得率随之增大,在500 W时达到最大值.结果分析可得,最佳超声波功率为 500 W.
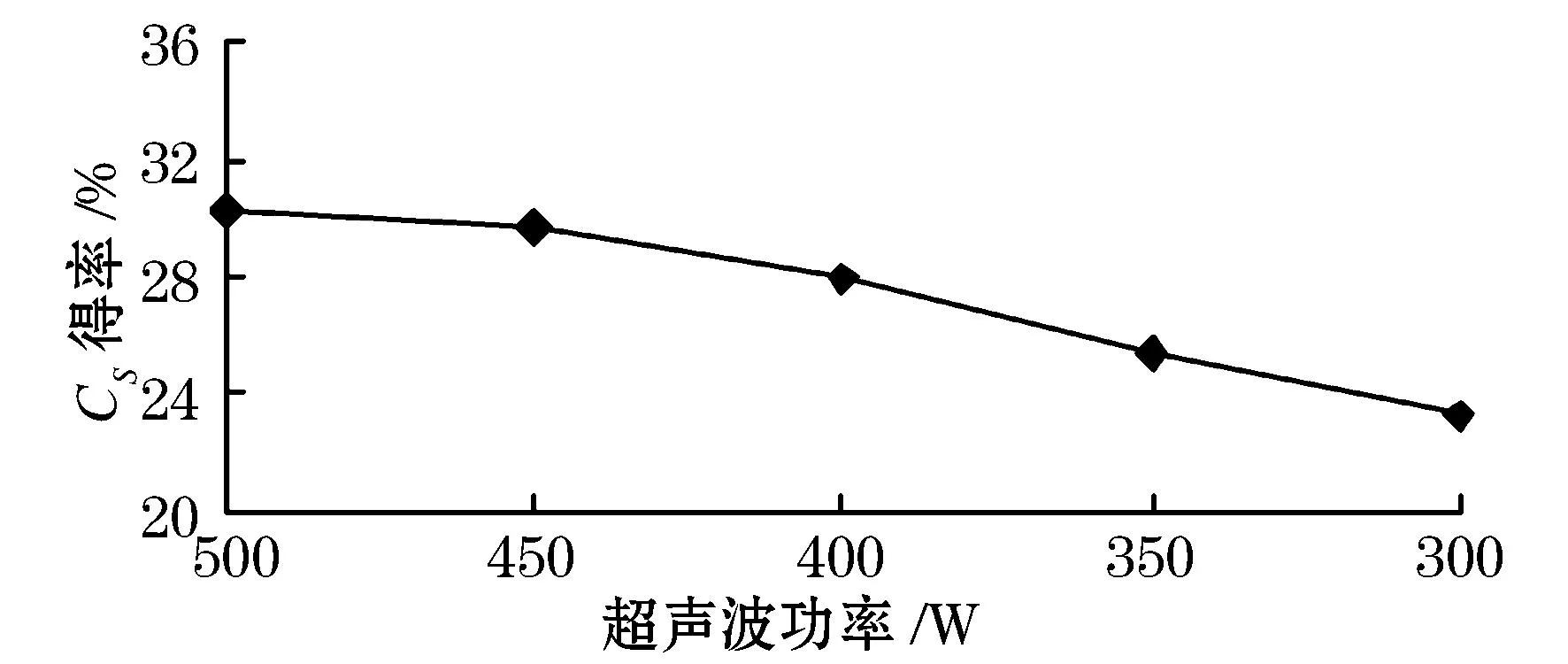
图2 超声波功率对硫酸软骨素得率的影响
2.2.3碱性蛋白酶添加量实验的结果分析
见图3.
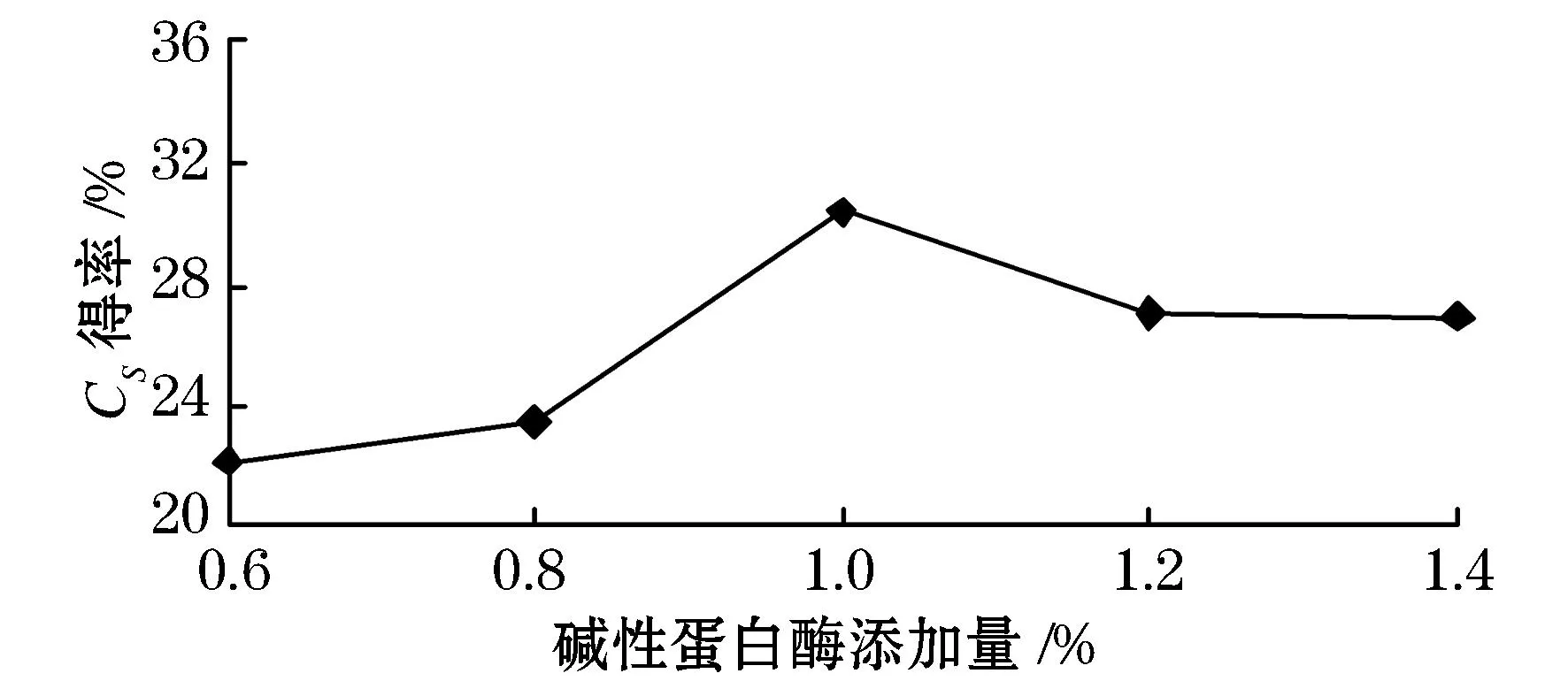
图3 碱性蛋白酶添加量对硫酸软骨素得率的影响
2.2.4木瓜蛋白酶添加量实验的结果分析
由图3可以看出,当碱性蛋白酶添加量在0.6~1.0%的范围内时,随着酶添加量的增加,硫酸软骨素的得率也随之增加,在1.0%时达到最大值30.37%.酶添加量超过1.0%后,硫酸软骨素得率随添加量的增加而逐渐降低.这可能是因为在酶浓度较低时,底物不能与酶充分反应,从而限制了蛋白质的水解程度,但随着酶添加量的不断加大,所有的底物都能与酶进行充分反应,以蛋白多糖形式存在的硫酸软骨素可以得到充分释放,进而提高了硫酸软骨素的得率.但如果酶添加量继续不断增大,会造成酶作为一种未被水解的蛋白质残留在提取液中的现象,进而降低了硫酸软骨素的得率.结果分析可得,1.0%为最佳碱性蛋白酶添加量.
由图4可以看出,当木瓜蛋白酶添加量在1.6%~2.0%的范围内时,随着酶添加量的增加,硫酸软骨素的得率也随之增加,在2.0%时达到最大值32.57%.酶添加量超过2.0%后,硫酸软骨素得率随添加量的增加而逐渐降低.这可能是因为在酶浓度较低时,底物不能与酶充分反应,从而限制了蛋白质的水解程度,但随着酶添加量的不断加大,所有的底物都能与酶进行充分反应,以蛋白多糖形式存在的硫酸软骨素可以得到充分释放,进而提高了硫酸软骨素的得率.但如果酶添加量继续不断增大,会造成酶作为一种未被水解的蛋白质残留在提取液中的现象,进而降低了硫酸软骨素的得率.结果分析可得,2.0%为最佳木瓜蛋白酶添加量.
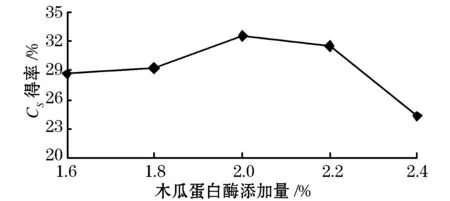
图4 木瓜蛋白酶添加量对硫酸软骨素得率的影响
2.3响应曲面法优化硫酸软骨素提取工艺条件实验的结果分析
见表2.
2.3.1超声时间与碱性蛋白酶添加量的交互作用的分析与优化
图5反映了超声时间和碱性蛋白酶添加量的交互作用对硫酸软骨素得率的影响.从超声时间与碱性蛋白酶添加量的等高线和响应曲面可以看出,当木瓜蛋白酶添加量为2%时,这两个因素的交互作用比较显著.在实验水平范围内,超声时间和碱性蛋白酶添加量分别在110~120 min和1.0~1.1%的范围内,硫酸软骨素得率达到最大值.
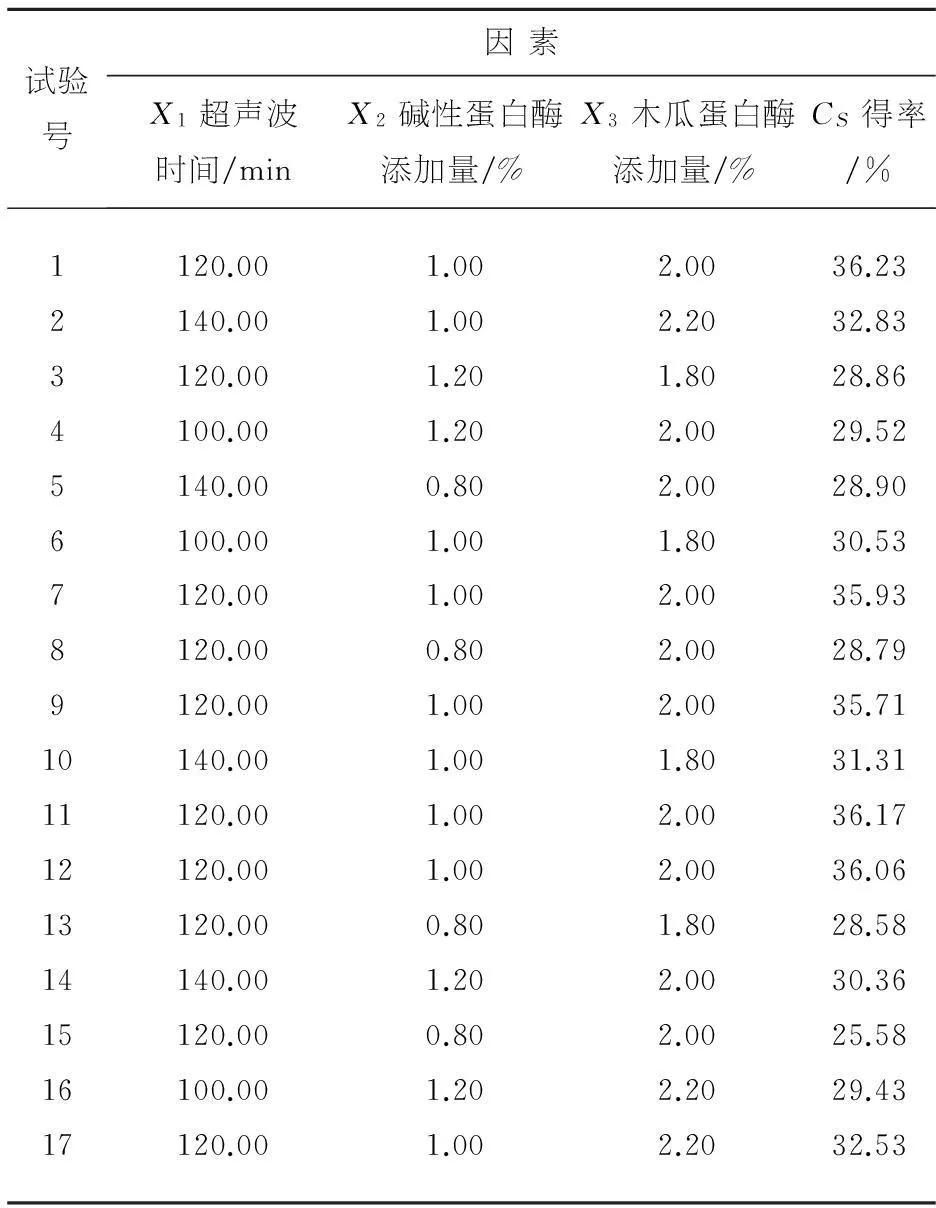
表2 响应曲面实验设计与结果表
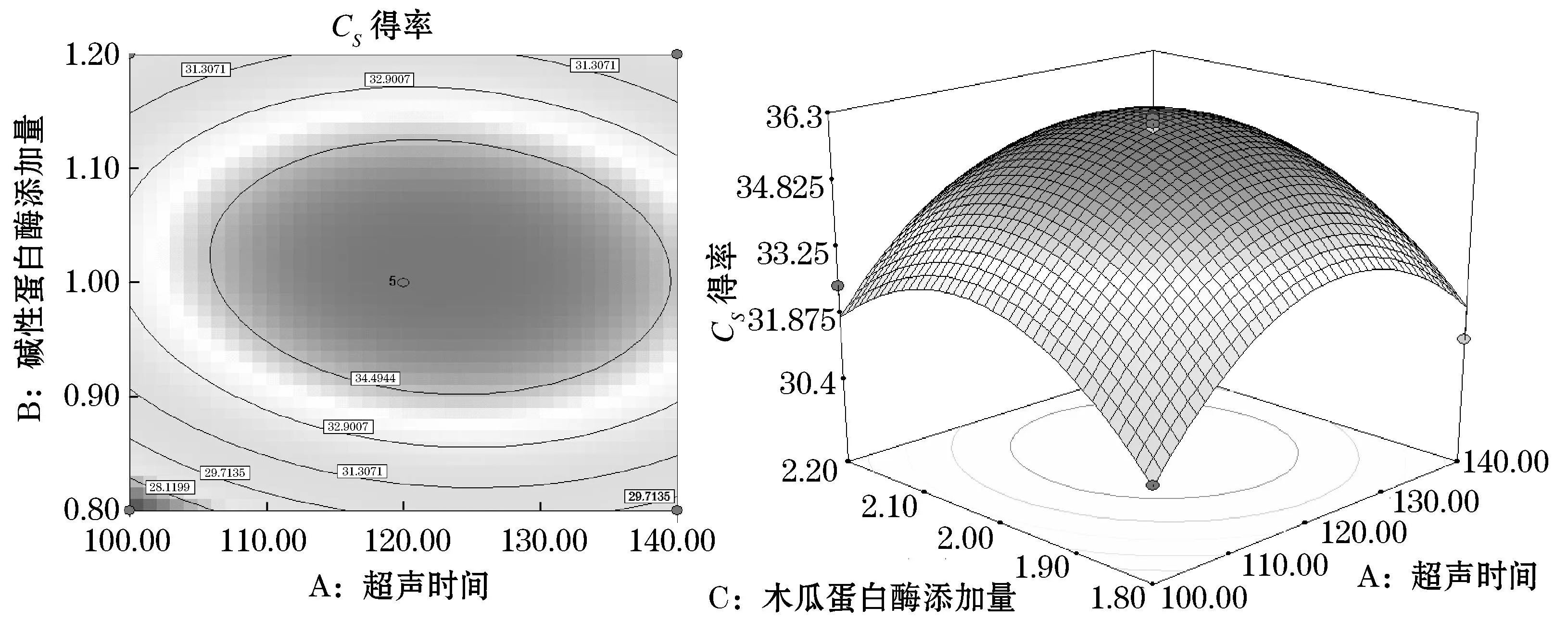
图5 超声时间、碱性蛋白酶添加量及其交互作用对硫酸软骨素得率影响的等高线图和响应图
2.3.2超声时间与木瓜蛋白酶添加量的交互作用的分析与优化
图6反映了超声时间和木瓜蛋白酶添加量的交互作用对硫酸软骨素得率的影响.从超声时间与木瓜蛋白酶添加量的等高线和响应曲面可以看出,当碱性蛋白酶添加量为1%时,这两个因素的交互作用显著.在实验水平范围内,超声时间和木瓜蛋白酶添加量分别在110~120 min和2.0%~2.1%的范围内,硫酸软骨素得率达到最大值.
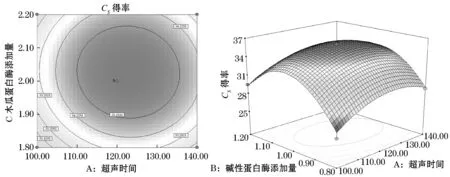
图6 超声时间、木瓜蛋白酶添加量及其交互作用对硫酸软骨素得率影响的等高线图和响应图
2.3.3碱性蛋白酶添加量与木瓜蛋白酶添加量的交互作用的分析与优化
图7反映了碱性蛋白酶添加量和木瓜蛋白酶添加量的交互作用对硫酸软骨素得率的影响.从碱性蛋白酶与木瓜蛋白酶添加量的等高线和响应曲面可以看出,当超声时间为120 min时,这两个因素的交互作用显著.在实验水平范围内,碱性蛋白酶和木瓜蛋白酶添加量分别在1.0%~1.1%和2.0%~2.1%的范围内,硫酸软骨素得率达到最大值.
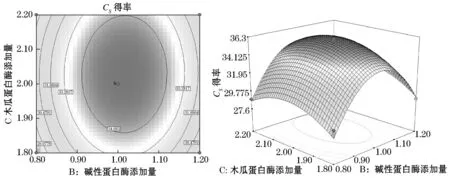
图7 碱性蛋白酶添加量、木瓜蛋白酶添加量及其交互作用对硫酸软骨素得率影响的等高线图和响应图
2.3.4方差分析及显著性检验
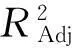
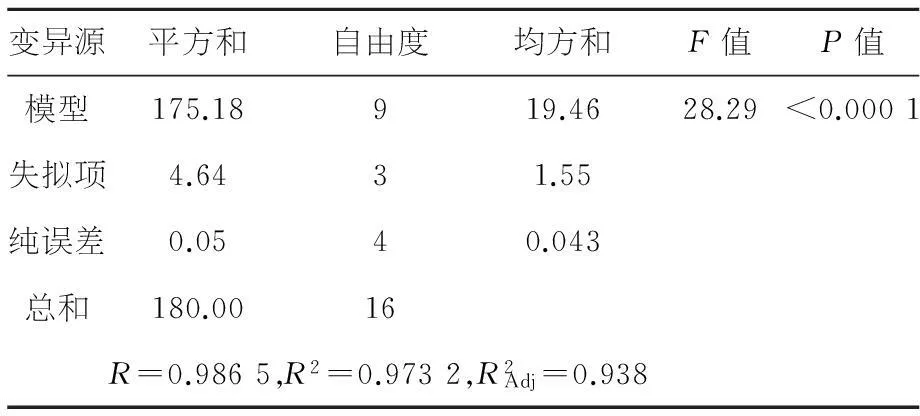
表3 响应面模型方差分析表
利用Design Expert软件对数据进行多元回归拟合,得到超声波辅助碱-双酶法提取硫酸软骨素的超声时间(X1)、碱性蛋白酶添加量(X2)和木瓜蛋白酶添加量(X3)的二次多元回归方程为:
Y=27.63-0.37X1+1.12X2-0.57X3+0.15X1X2+0.15X1X3-0.85X2X3-2.20X12-1.71X22-6.67X32
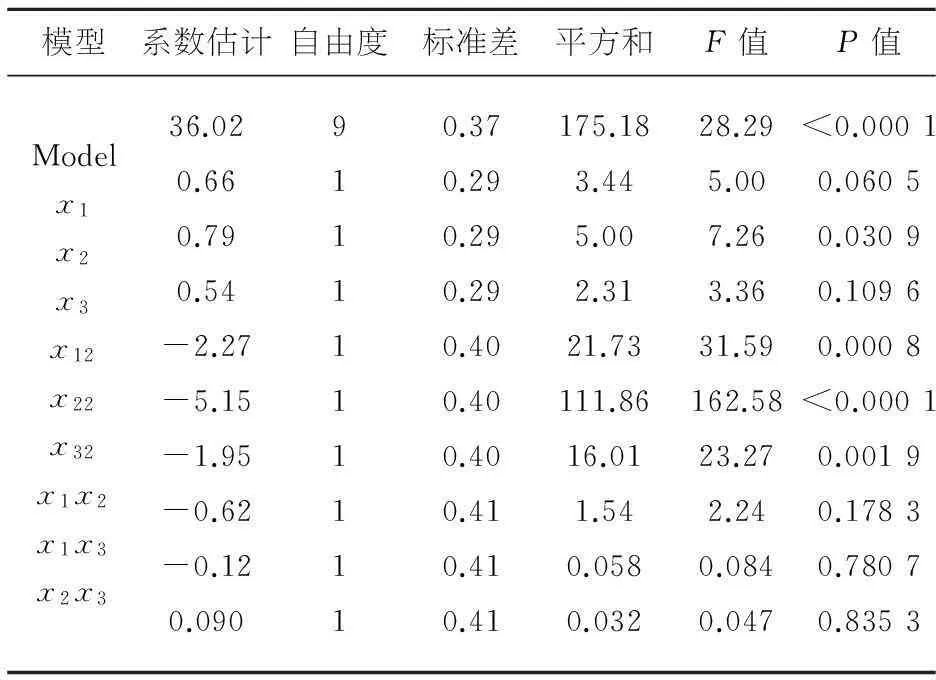
表4 回归方程系数显著性检验
从表4回归方程系数显著性检验数据可知,模型一次项X2显著,二次项均显著.最佳工艺条件:超声时间120.61min、碱性蛋白酶添加量1.01%、木瓜蛋白酶添加量2.03%,硫酸软骨素得率理论值为36.24%.
2.4验证试验结果分析
采用响应曲面法优化后的工艺条件,根据实际试验条件优化工艺条件为:超声时间120.00min、碱性蛋白酶添加量1.00%、木瓜蛋白酶添加量2.00%,进行验证试验,硫酸软骨素得率为36.24%,提取后硫酸软骨素质量分数为44.25%.
3结语
以鸡软骨为原料,采用超声波辅助碱-双酶法提取硫酸软骨素,以硫酸软骨素得率为参考指标,对最佳提取方法的工艺条件进行优化.确定最佳提取工艺为:超声时间120min、碱性蛋白酶添加量1%、木瓜蛋白酶添加量2%,硫酸软骨素得率为36.08%,提取后硫酸软骨素质量分数为44.25%.此方法成本低,耗时短,操作简单,而且对环境污染小,适合大规模工业化生产.
参考文献:
[1]熊双丽, 任飞, 吴照明, 等. 鸡胸软骨硫酸软骨素的制备及结构分析[J]. 食品科学, 2008, 29(12):79-82.
[2]张静文, 张凤清, 张培刚, 等. 玉米芯多糖的提取及其单糖组成研究[J]. 食品工业科技, 2010 (3): 242-244.
[3]TAKANISHI G C, BORST C A. Glucosamine and chondroitin in treatment of osteoarthritis [J].Women's Health Primary Care, 2001, 4(1): 61.
[4]于兹东, 高华, 刘坤. 硫酸软骨素钙制备研究[J]. 青岛大学学报, 2003, 18(3): 50-52.
[5]NAKANO T, LKAWA N, OZIMEK L. An economical method to extract chondroitin sulphate-peptide from bovine nasal cartilage [J]. Canadian Agricultural Enginee-ring, 2000, 42(4): 205-208.
[6]ELENA P, MOISEEVA, BRYAN W, NILESH J S. Galectin inhibits incorporation of vitronectin and chondroitin sulfate B into the extracelluar matrix of human vascular smooth muscle cells [J]. Biochimica et biophysica scta, 2003, 1619: 125-132.
[7]王凤琴. 硫酸软骨素生产新工艺的研究[J]. 淮阴工学院学报, 2003, 12 (3):71-73, 79.
[8]肖凯军, 李琳, 郭祀远, 等. 鲨软骨粘多糖及其分离纯化和应用[J]. 上海水产大学学报, 1999, 8(2): 163-167.
[9]杨佩荣. 壳聚糖及其水解产物在食品工业中的应用[J]. 江苏食品与发酵, 2001(4): 26-27.
[10]沈渤江, 窦韵. 硫酸软骨素制剂在澳大利亚的应用概况[J]. 食品与药品, 2009,11(1): 4-6.
[11]张青. 黏多糖在眼科中的应用[J]. 食品与药品, 2005, 7 (8): 57-59.
[12]PACHECO R G, VICENTE C P. Different antithrombotic mechanisms among glycosaminogly. Revealed with an fucosylated chondroitin sulfate from an echinoderm [J]. Blood Coagul Fibrinolysis, 2009, 11(6): 563-573.
[13]李鑫. 硫酸软骨素提取和纯化方法的研究[D]. 成都: 四川大学, 2005.
[14]李瑞国. 硫酸软骨素不同生产工艺的考察[J]. 中国医药杂志, 2003, 34 (5): 221-222.
[15]田甲春. 硫酸软骨素提取工艺的研究[D]. 兰州: 甘肃农业大学, 2010.
[16]高蕊,王鑫,宋志鹏,等.溶剂沉降法纯化猪软骨中硫酸软骨素[J].哈尔滨商业大学学报:自然科学版,2016,31(5):593-597.
Compound enzyme assisted ultrasonic extraction of chondroitin sulfate from chicken cartilages
SONG Zhi-peng, XU Li-ping, WANG Xin
(Key Laboratory of Food Science and Engineering, School of Food Engineering, Harbin University of Commerce, Harbin 150076, China)
Abstract:Chondroitin sulfate was extracted by ultrasonic assisted compound enzyme with chicken cartilage as raw materials. The best extraction method was selected with chondroitin sulfate extraction yield as the examining index. The results showed that the optimum technological parameters were ultrasonic power of 500 W, ultrasonic time of 120 min, adding 1% alkaline protease, 2% papain, and the yield of CS could reach up to 36.08%. The method of ultrasonic assisted compound enzyme takes short time, and has the merit of simple operation and high purity product.
Key words:chicken cartilages; chondroitin sulfate; compound enzyme; ultrasonic
中图分类号:TS251
文献标识码:A
文章编号:1672-0946(2016)01-0038-06
通讯作者:王鑫(1984-),女,博士,讲师,研究方向:食品化学,食品营养与安全.
作者简介:宋志鹏(1995-),男,硕士,研究方向:农产品加工及贮藏.
基金项目:黑龙江省教育厅项目(12541194)
收稿日期:2015-09-20.

