不同充放电电压对Li1.133Ni0.3Mn0.567O2结构的分析
钟盛文,孙兴勇,尹从岭,张华军,赖美珍
(江西理工大学,江西赣州341000)
不同充放电电压对Li1.133Ni0.3Mn0.567O2结构的分析
钟盛文,孙兴勇,尹从岭,张华军,赖美珍
(江西理工大学,江西赣州341000)
通过共沉淀法合成前驱体和高温固相反应,实现Ni、Mn的固溶合成Li1.133Ni0.3Mn0.567O2富锂锰基正极材料,分别在不同的电压下进行50次充放电循环,然后采用X射线衍射光谱法(XRD)表征在不同电压充放电循环后的正极材料,并对其进行结构精修。研究发现,随着充放电电压的升高,充放电比容量提高,但循环性能迅速下降。另外,XRD测试也表明,充放电电压递升,相应的正极材料的(003)峰的位置逐渐向小角度偏移,此外4.6 V电压充放电后的正极材料的结构变化最大。
不同电压;正极材料;结构变化
近年研究表明,富锂锰材料拥有着高容量和很好的循环稳定性,且有良好的安全性能、倍率性能,可作为良好动力电池的备选正极材料之一,但高压下循环性能亦不太理想[1-2]。为了究其原因,必须从本质着手,所以从结构的角度出发。对于结构变化的研究,Tsutomu Ohzuku、X.Q.Yang等人分别利用非原位、原位XRD技术研究了LiNiO2、LiCoO2充放电过程中内部结构的变化,认为内部充放电伴随着相转变[3-4],而Marca M.Doeff[5]等人则认为充放电的进行使得结构表面发生重组。
正极材料在高电压下充放电电化学性能变化非常大,这与正极材料的内部结构变化有着密切的关系,为了更好地能够观察结构上的变化,我们将正极材料制备成全电池进行充放电循环测试,在电化学性能下降之后对正极材料进行结构表征,与未进行充放电循环的正极材料进行对比,从而更好地发现出正极材料结构的变化,以期探究出结构变化的原因。
1 实验
1.1 Li1.133Ni0.3Mn0.567O2的制备
根据前驱体分子式Ni9/26Mn17/26(OH)2,按照化学计量比称取NiSO4·7H2O、MnSO4·H2O配制成浓度2mol/L的混合盐溶液;4mol/L的NaOH溶液作为沉淀剂。在碱溶液中加入0.5倍过渡金属物质的量的氨水作为缓冲剂,采用化学共沉淀的方法,将盐溶液、碱溶液同时缓慢加入充满氮气的反应釜中,按照一定的速度进行混合均匀物料,控制反应液pH值,反应釜内温度为55℃。将混合液静置12 h后,使用真空泵抽滤,洗涤,反复五次。将抽滤好的沉淀物放置在鼓风干燥箱内,100℃下干燥24 h。得到前驱体Ni9/26Mn17/26(OH)2。将碳酸锂与所得干燥Ni9/26Mn17/26(OH)2前驱体分别按照Li/(Mn+Ni)摩尔比为1.1混合,在行星式球磨机加入适量酒精湿磨5 h,然后在60℃将酒精烘干,然后再磨,得到混合均匀的粉体。再将混合均匀的粉体于以温度梯度为2℃/m in加热到500℃并在500℃下保温10 h,再以温度梯度为4℃/m in加热到950℃,并在相应的温度下保温12 h得到Li1.12Ni0.32Mn0.56O2正极材料。
1.2 电化学测试
制备所得的Li1.133Ni0.3Mn0.567O2正极材料与PVDF粘结剂按质量比90∶6∶4均匀混合,再加入适量有机溶剂N-甲基吡咯烷酮(NMP)球磨至无颗粒糊状物质。经过涂布、卷绕等工艺制成圆柱状电池,然后在除湿房中注入高压电解液,搁置12 h后,放入LAND系列电池测试系统上,在25℃室温下进行充放电测试,充放电测试以1 C倍率在不同充放电电压(4.3、4.4、4.5、4.6 V)下进行50次的充放电循环。
1.3 XRD测试
将循环完的电池进行拆解,刮出其中的正极材料,在120℃下烘干10 h,然后将其放到玛瑙研钵中进行研磨,研磨至一定较细的颗粒时装料进行XRD测试。XRD测试使用德国蔡司电镜EVO10型电镜,加速电压20 kV。CuKα靶辐射,l=0.154 18 nm,衍射时,扫描步长为0.02°,测试扫描范围为10°~80°,采用石墨弯晶单色器,其参数为R c=0.3 mm,4 kV、40mA。
2 结果与讨论
2.1 高电压下循环性能
在相同的条件下,制备成电池,控制不同的循环电压(4.3、4.4、4.5、4.6 V)下循环50次,观察富锂锰基正极材料的放电性能。观察图1可见,不同电压下Li1.133Ni0.3Mn0.567O2正极材料的循环性能有着比较明显的区别,在4.3 V循环时,正极料的电化学性能很稳定,比容量一直保持在120mAh/g以上,且有着上升的趋势。在4.4 V循环开始时,放电比容量在134m Ah/g左右,当循环26次以后,放电比容量逐渐上升,最终达到150mAh/g左右,这个缓慢上升的过程其实也就是比容量迅速衰减的前奏。而4.5 V和4.6 V循环时,放电比容量在缓慢的上升之后便迅速衰减,50次循环后放电比容量仅剩不到100mAh/g,这也就说明充放电电压越高,正极材料的电化学性能越差。

图1 Li1.133Ni0.3Mn0.567O2正极材料高压循环时间-容量图
2.2 不同电压首次充放电
将正极材料在4.3、4.4、4.5、4.6V电压下的首次充放电的数据进行整合成表1,从表1的充放电比容量和充放电效率可见,随着充放电电压的升高,不可逆比容量越来越大。根据比容量理论计算C=n(Li)×NA×e,可通过比容量求出Li的含量,以4.6V为例,充电比容量为298.2mAh/g,
单位转换298.2mAh=298×3 600÷1 000=1 072.8 A·s(C)

表1中脱出嵌入Li的数量表明,理论上首次充放电时,脱出的Li并未能够完全回归到正极中去,也就是有部分Li滞留在了负极或者电解液当中。充放电电压越高,不可逆的Li含量也越高,回到正极的Li也越少,因此充放电结束后,正极材料形成的Li空位也就越多,这对于保持结构的稳定性是一个极大的挑战,所以高电压充放电结构很可能发生了变化。

2.3 XRD测试分析
正极材料在电池充放电过程中发生多次相变,Li+脱出产生的空位引起氧原子和过渡金属原子电子结构和局域结构变化。充放电过程中,Li+的嵌脱引起正极材料结构变化,这种结构变化可从相变的角度表征,主要使用原位XRD技术。所以将制备出的样品进行XRD测试。图2为不同电压下循环后的正极料与原料对照的XRD谱图。从图2中可见随着循环电压的升高,(006)峰和(015)峰逐渐减弱,峰形越来越不明显,有消失的趋势。而(008)峰和(110)峰也表现出很明显的特征,两者分裂越来越厉害,在4.6 V时最为明显,这也就对应着4.6 V充放电循环时,正极材料的电化学性能衰减非常明显。此外,4.6 V充放电后的结构主峰(003)峰的位置由原来的18.68°移到18.31°,且随着充放电电压的升高,(003)的位置逐渐向小角度偏移,从图2可见。根据2dsinθ=n l,(003)的面间距也相应变大。正如首次充放电所观察到的,随着充放电电压的升高,不可逆的Li含量增加,导致正极材料结构出现大量的空位,在内部原子间的相互作用力的作用下,结构出现局部性坍塌,从而阻塞Li+扩散的通道,正极材料的充放电比容量也就迅速衰减,这从其电化学性能和XRD图谱可见。
以a-NaFeO2型LiNiO2为结构模型对不同电压下充放电后的正极材料结构进行结构精修,各样品的精修后的具体数据见表2。从表2中可见随着充放电电压的升高,晶格常数a,c值变大,晶胞体积增大,但当电压大于4.6 V时,a值变小,c值继续增加。这类富锂锰基正极材料在4.5 V左右出现一个充电平台,从而在高于4.5V时,比容量达到200mAh/g,超出过渡金属氧化还原计算所得的容量[6-7]。从4.6 V充放电后的晶格常数和体积可见是类似的,Li1.133Ni0.3M n0.567O2正极材料在4.6 V电压下,也出现一个转折点,即内部的Li2MnO3相开始脱出Li导致内部结构出现坍塌使得空位的空间被压缩,从而体积也就相应减小。对于4.3、4.4、4.5V时,Li的不可逆造成正极结构的空位,原先致密的八面体不再致密,也就丧失体积的最小化和致密化,因此晶胞体积有所增加。

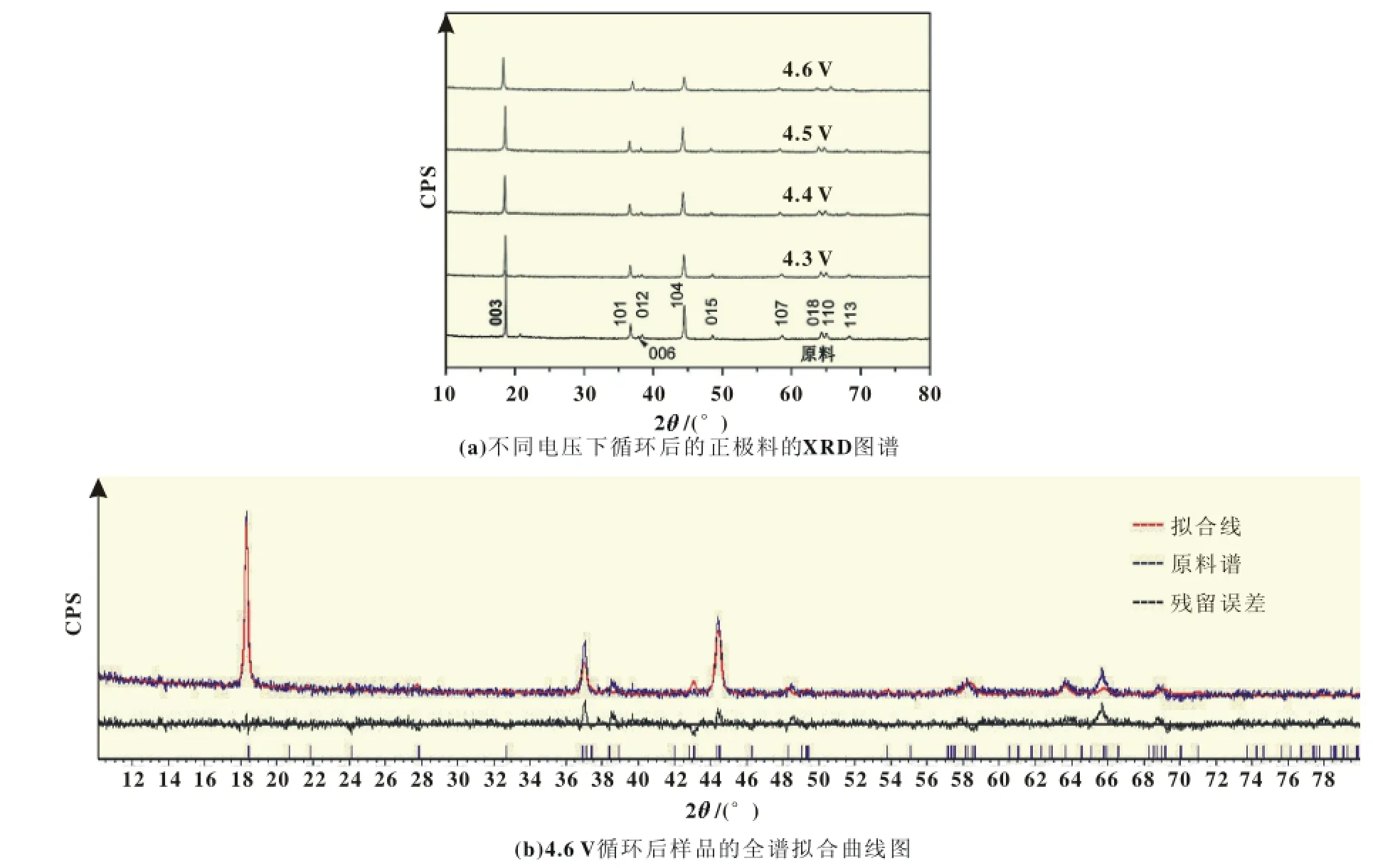
图2 XRD曲线图
3 结论
利用高温固相法制备的Li1.133Ni0.3Mn0.567O2正极材料,在不同的电压下表现出不同的电化学性能,充放电电压越高,放电比容量越高。另外在高电压下充放电前后,正极材料的结构发生了变化,尤其是4.6 V时结构破坏得最严重。充放电电压越高,锂离子嵌入脱出的Li的数目相应地也有所升高,导致这些结构变化的原因与外力作用无关,而是内部嵌入脱出Li造成正极材料结构出现空位,层状结构内部局部开始塌陷,阻塞Li+扩散通道,从而引起比容量的迅速衰减。
[1]NUMATA K,SAKAKIC,YAMANAKA S.Synthesis of solid solutions in a system of LiCoO2-Li2M nO3for cathode materials of secondary lithium batteries[J].Chem Lett,1997(8):725-726.
[2]GAO M,LIAN F,LIU H Q.Synthesis and electrochem ical performance of long lifespan Li-rich Li1+x(Ni0.37Mn0.63)1-xO2cathodematerials for lithium-ion batteries[J].Electrochimica Acta,2013,95:87-94.
[3]DAHN JR,LU Z H,CHEN Z H.Lack of Cation Clustering in Li-[NixLi1/3-2x/3Mn2/3-x/3]O2(0 [4]YANG X Q,SUN X,MCBREEN J.New phases and phase transitionsobserved in Li1-xCoO2during charge:In situ synchrotron X-ray diffraction studies[J].Electrochem Commun,2000,2:100. [5]DOEFF M M,LIN F.Surface reconstruction and chemical evolutionof stoichiometric layered cathodematerials for lithium-ion batteries[J].NatCommun,2014,5:3529. [6]JOHNSON C S,LINAICHAO,LEFIEFC,etal.Synthesis,characterization and electrochem istry of lithium battery electrodes:x Li2-M nO3(1-x)LiM n0.333Ni0.333Co0.333O2(0≤x≤0.7)[J].Chem Mater,2008,20:6095-6106. [7]THACKERAY M M,KANG S H,JOHNSON C S,et al.Li2MnO3-stabilized LiMO2(M=Mn,Ni,Co)electrodes for lithium-ion batteries [J].Journalof M aterials Chem istry,2007,17:3112-3125. Structureanalysisof Li1.133Ni0.3Mn0.567O2under different charge-discharge voltages ZHONG Sheng-w en,SUN Xing-yong,YIN Cong-ling,ZHANG Hua-jun,LAIMei-zhen Li1.133Ni0.3Mn0.567O2cathodematerials were synthesized by co-precipitationmethod and solid phase reaction a t high tem perature.The cathode materia ls we re carried on 50 cyc les at different voltages respectively,and XRD technique was used for structure refinementanalysis of the cathodematerialafter discharge.It’s found thatas the d ischarge voltage inc reases,the capacity inc reases,but the cycling perform ance rapid ly declines.XRD tests show that the charge-discharge voltage steps up,and(003)peak position gradually shifts to a smallangle.The structure change of the cathodema terial reaches them axim um a fter charged and discharged at4.6 V. differentvoltages;cathodematerial;structuralchange TM 912 A 1002-087 X(2016)07-1350-02 2015-12-03 国家自然科学基金资助项目(51372104) 钟盛文(1963—),男,江西省人,博士,教授,主要研究方向为锂离子电池及相关材料。
(JiangxiUniversity ofScience and Technology,Ganzhou Jiangxi341000,China)

