柽柳ThbHLH1上游表达调控基因1)
张兵 及晓宇 聂显光 王玉成
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
柽柳ThbHLH1上游表达调控基因1)
张兵及晓宇聂显光王玉成
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
摘要通过柽柳转录组分析克隆得到了一条bHLH基因(ThbHLH1)。在此基础上,本研究通过TAIL-PCR的方法克隆ThbHLH1转录因子的启动子序列,长2 061 bp。经PLACE等软件分析发现,ThbHLH1启动子中存在多个DOF元件,利用酵母单杂交和染色质免疫共沉淀试验(ChIP试验)研究发现,柽柳的ThDof16基因可识别ThbHLH1基因启动子中的DOF元件,说明ThDof16基因是调控ThbHLH1基因表达的上游调控因子。另外,通过基因枪技术瞬时转化烟草叶片,进行GUS染色和GUS酶活测定的试验,得到进一步验证。
关键词转录因子;ThbHLH1基因;非生物胁迫;基因表达调控;酵母单杂交;ChIP试验;GUS酶活测定;GUS染色
分类号S792.12;Q78
Upstream Regulator ofThbHLH1 fromTamarixhispida
Zhang Bing, Ji Xiaoyu, Nie Xianguang, Wang Yucheng
(The State Key Laboratory of Forest Genetics and Breeding, Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2016,44(4):13-17,24.
AbHLHgene,ThbHLH1 was cloned from transcriptome ofTamarixhispida. The promoter region ofThbHLH1 with 2061 bp in length was cloned using TAIL-PCR. There were many DOF motifs in the promoter ofThbHLH1, and yeast one hybrid and ChIP analysis were performed to determine the upstream of ThbHLH1. The results showed that a DOF protein fromT.hispida,ThDof16 can bind to these DOF motifs in the promoter ofThbHLH1, and is the upstream regulator ofThbHLH1. The GUS staining and GUS enzyme activity determination assays of the transient-transformed tobacco leaves, which were obtained by gene-gun bombardment technology, were performed.
KeywordsTranscription factor;ThbHLH1; Abiotic stress; Gene expression regulation; Yeast one-hybrid; ChIP; GUS enzyme activity assay; GUS staining
bHLH转录因子是一类重要的转录因子家族,植物中的bHLH蛋白分布非常地广泛,功能也相当多样化[1]。在植物中,拟南芥的bHLH基因家族由162个成员组成[2]。研究表明bHLH结构域含有一个特征序列模式,由一个HLHM及其上游富含碱性氨基酸顺序的核酸顺序组成[3]。bHLH转录因子结构中的bHLH结构域,具有与DNA结合和与bHLH蛋白形成同源或异源二聚体的能力。同时,bHLH蛋白以同源或异源二聚体形式与DNA上E—盒(E-box)序列CANNTG结合而发挥功能。研究发现,bHLH转录因子在生物的生长发育调控过程中起着极为重要的作用[4],在高等植物不同组织中广泛存在,在植物花器官发生、激素应答和植物次生代谢中扮演了非常重要的角色[5-6]。目前,对植物bHLH转录因子在抗逆调控方面的研究较少,但研究结果表明,该基因是一类重要的抗逆转录调控基因,对多种逆境都起调控作用[7]。
柽柳(Tamarix),属柽柳科柽柳属植物,为落叶灌木或小乔木,是优良的防风固沙植物,耐干旱、盐碱,广泛分布于不同程度的盐渍化土壤,其体内具有一套有效的抗逆系统。因此,是研究木本植物抗逆机理,分离重要耐盐基因的理想物种之一。植物抗盐的重要机理之一是以各种方式降低地上部分盐分的浓度,一些植物能够进化出特殊器官,通过主动泌盐、被动拒盐以及稀释盐分来达到避盐的目的,从而提高在盐胁迫下的适应性[8]。目前,对于植物bHLH转录因子家族蛋白的功能只有少部分得到了解析,对植物bHLH的生物学功能研究较少。因此,bHLH基因在抗逆中的调控尚有待于深入研究。通过对7个不同柽柳组织不同处理的cDNA文库分析,我们共获得了2万多EST序列。从这些EST序列中鉴定了7个编码bHLH的EST序列。实时定量PCR分析表明,有一条bHLH基因的表达能够被盐、旱等处理所诱导,显示它参与柽柳的耐盐、抗旱的调控。在此基础上,我们对ThbHLH1基因的上游调控因子进行系统研究,进而揭示ThbHLH1基因调控植物耐盐胁迫的分子机理。
1材料与方法
柽柳种子播种于人工土(V(沙)∶V(草炭土)=3∶1)中,温室的相对湿度为65%~75%,光照强度为21.62 lx,置于温度为(22±2)℃。取2月苗龄用于试验研究。小叶烟草(Nicotianatabacum)由本实验室保存。
1.1ThbHLH1基因启动子克隆与分析
以柽柳基因组DNA为模板,进行TAIL-PCR反应。通过PLACE(http://www.dna.affrc.go.jp/PLACE/)数据库和PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/htmL/)预测ThbHLH1基因启动子序列的主要顺式作用元件。
1.2报告载体的构建
ThbHLH1基因启动子中含有多个与抗逆功能相关的DOF元件,分别将含有DOF元件的启动子片段(pHIS2-DOF p+)和它的寡核苷酸片段(串连成3个重复序列pHIS2-DOF)同时引入他们的突变片段(pHIS2-DOF p-、pHIS2-DOF M1-M7),并且引入酶切位点(表1),然后将序列插入pHIS2诱饵载体的报告基因上游,分别构建重组报告载体pHIS2-DOF p+和pHIS2-DOF p-。

表1 靶DNA的单链寡核苷酸序列及pHIS2载体两端引物
注:“__”为引入的限制性内切酶EcoRI和SacI的位点。
1.3柽柳ThDof基因cDNA文库的构建
根据柽柳转录组数据分析,共得到20个柽柳Dof基因(ThDof)。以上述20个ThDof基因为模板,扩增含有pGADT7-Rec2载体同源融合序列的基因片段,与SmaI线性化的pGADT7-Rec2载体同源融合,转入Top10大肠杆菌,测序后保存菌种,提取质粒用于后续试验。
1.4酵母单杂交
按照Clontech公司酵母单杂交手册进行菌株Y187感受态细胞制备,将构建好的报告载体和ThDof基因文库共转化酵母Y187,分别涂布于SD/-Trp、SD/-Leu、SD/-Leu/-Trp和SD/-His/-Leu/-Trp/3-AT互作筛选培养基上固体培养基,30 ℃倒置培养3~5 d。
1.5阳性克隆的互作分析
挑取SD/-His/-Leu/-Trp/3-AT筛选平板上的阳性克隆,于SD/-His/-Leu/-Trp液体培养基中30 ℃震荡(250 r/min)培养1~2 d,提取酵母质粒;以pGADT7-Rec2载体上的引物M5’AD和M3’AD,对酵母文库/AD质粒进行PCR,检测文库/AD质粒中插入片段的长度。把所得到的AD质粒转化大肠杆菌TOP10,在含有Kan的LB平板上筛选,37 ℃倒置培养16~20 h,第2天挑单克隆,进行PCR,选取阳性克隆扩繁,提取质粒,测序。选取测序准确的阳性克隆所对应的酵母菌液,于SD/-His/-Leu/-Trp液体培养基中30 ℃震荡(250 r/min)培养1~2 d,分别稀释10、100、1 000和10 000倍,取2 μL点于SD/-His/-Leu/-Trp(3-AT:30 mM)上,30 ℃倒置培养2 d,拍照。
1.6报告载体与效应载体的构建
将顺式作用元件DOF(AAAG)、DOF的突变体“CCCA”及含有和不含有DOF元件的启动子片段的寡核苷酸片段串连成3个拷贝重复序列,与CaMV 35S minimal promoter(46 bp)连接,并引入HindⅢ和NcoⅠ酶切位点,直接进行DNA合成。将合成的序列定向插入pCAMBIA1301表达载体,构建报告表达载体pCAM-DOF、pCAM-DM7、pCAM-DOF p+和pCAM-DOF p-。
1.7基因枪瞬时转化烟草验证ThDof16与顺式作用元件结合
选取小叶烟草(4周苗)约2 cm×2 cm大小的叶片,背面向上平铺在MS培养基上,暗处理2~3 d,备用。将构建好的报告载体与效应载体用钨粉包埋,制作微弹,按照PDS-1000基因枪操作方法瞬时转化烟草,将轰击完毕的培养皿密封置于人工气候室中暗培养36~48 h,然后用GUS染液染色,观察拍照。
1.8GUS酶活的测定
取0.1 g瞬时转化的烟草叶片于1.5 mL离心管中,加入液氮研磨,加入600 μL酶提取液;13 000 r/min 4 ℃离心10 min,取适量的上清,用考马斯亮蓝法测定蛋白的含量;取50 μL含GUS的上清加入到450 μL 37 ℃预热的检测液(2 mmol/LMUG溶液)中。迅速充分混匀,并立刻取出50 μL加入950 μL反应终止液(0.2 mol/L Na2CO3),将该管作为酶促反应的0点;然后分别在5、10、20、30、45、60 min分别取出50 μL的反应液,转入950 μL的反应终止液中;用荧光分光光度计在激发波长365 nm、发射波长455 nm下,测定不同时间点的荧光值。将MU母液用反应终止液(1 mmol/L)稀释成浓度范围在0~10 μmol/L的系列标准液,通过测定它们的荧光强度作出一条标准曲线,计算GUS酶活值。
1.9ChIP验证ThDof16与DOF元件在ThbHLH1启动子中的互作
将ThDof16基因同源融合到pBI121-GFP载体,构建pBI121-ThDof16-GFP载体,转入EHA105农杆菌,瞬时侵染2~3周苗龄烟草。取转化的烟草20~25棵(质量1~5 g)按照Haring的方法略有改进进行ChIP研究,真空条件下将材料浸泡在3%甲醛溶液中交联10 min,用无菌水洗涤1次,浸泡在180 mmol/L甘氨酸溶液中5 min终止交联。用超声波进行染色质破碎,将其破碎成0.2到0.8 kb。将染色质分成2份,一份用作GFP抗体(碧云天,中国)免疫共沉。另一份进行兔IgG抗体对照。向两个管中加入20 μL的Protein A+G Agarose beads,进行免疫共沉淀。向IP沉淀的两个管加入20 μL的5 M NaCl,65 ℃温浴6 h,逆转交联。用氯仿抽提溶液,作为PCR的模板,电泳检测。
2结果与分析
2.1ThbHLH1启动子序列的生物信息学结果
通过TAIL-PCR获得ThbHLH1基因起始密码子ATG上游2 061 bp长的序列。通过PlantCARE及PLACE进行分析,预测可能含有的主要顺式作用元件,结果如图1。发现其具有启动子的基本转录元件GATA-box、GGATA-box、GATAA-box和CAAT-box,及与抗逆相关的元件DOF、MYC、W-box、I-box等。

图1 ThbHLH1基因启动子序列
2.2重组报告载体的获得
根据启动子元件分析结果发现含有多个DOF元件,其中-610~-256中包含4个DOF顺式作用元件,说明DOF元件在基因ThbHLH1的表达调控中起重要作用。根据各顺式作用元件合成的寡核苷酸单链,进行退火反应,合成靶DNA,将其与线性化的pHIS2载体连接后转化TOP10,菌液PCR,pHIS2-靶DNA的扩增条带与以pHIS2质粒为模板扩增的片段大小一致,pHIS2-靶DNA重组质粒构建成功(图2)。

M.DL2000;1.DOF元件、2~8.DM1~DM 7突变元件报告载体菌液PCR电泳结果。
2.3ThDof基因特异识别DOF顺式作用元件
通过酵母单杂交将重组报告载体质粒、酶切线性化的文库载体(pGADT7-Rec2)和ThDofs共转化酵母Y187细胞,通过其在SD/-His/-Leu/-Trp+3-AT(30 mmol/L)的培养基中,生长出现大小差异明显的菌落,判断不同的酵母菌落中文库/AD载体和报告载体的互作强弱不同,从其中选取互作能力强的菌落进行扩繁。以M5’AD和M3’AD为引物,挑取二次筛选的酵母进行菌落PCR,测序,得到一条Dof基因(ThDof16)(图3)。

M.DL2000;其中4号泳道为ThDof16。
2.4ThDof16基因对元件和突变元件的识别
分别将突变元件报告载体pHIS2-DOF和pHIS2-DM1-7与酶切线性化的文库载体(pGADT7-Rec2)与ThDof16共转化酵母Y187感受态,挑取单菌落于SD-Leu/-Trp液体培养基摇菌至OD值0.8,稀释10、100、1 000和10 000倍,取2 μL菌液点于SD/-His/-Leu/-Trp+3-AT(50 mmol/L)的固体培养基上,30 ℃倒置培养2~3 d,拍照。结果发现突变元件载体pHIS2-M1-7在TDO/30 mM 3-AT上无法正常生长(图4A),说明DOF元件中的每个碱基对于ThDof16的识别都起到不可替代的作用。
2.5ThDof16基因对ThbHLH1基因启动子片段的结合
将构建的含顺式作用元件的pHIS2-DOF P(+)和pHIS2-DOF P(-)如图4B,与酶切线性化的文库载体(pGADT7-Rec2)与ThDof16共转化酵母Y187感受态,pHIS2-P53和pGADT7-Rec2-P53共转化酵母Y187,作为阳性对照;pHIS2-P53和pGADT7-Rec2-ThDof16共转化酵母Y187,作为阴性对照。挑取单菌落于SD-Leu/-Trp液体培养基摇菌至OD值0.8,稀释10、100、1 000和10 000倍,取2 μL菌液点于SD/-His/-Leu/-Trp+3-AT(50 mmol/L)的固体培养基上,30 ℃倒置培养2~3 d(图4C)。结果发现ThDof16可与含有相应顺式作用元件的启动子片段互作,当启动子片段缺失元件,则不能互作。说明,ThDof16能够特异性地结合启动子中的DOF位点,来调控基因的表达。
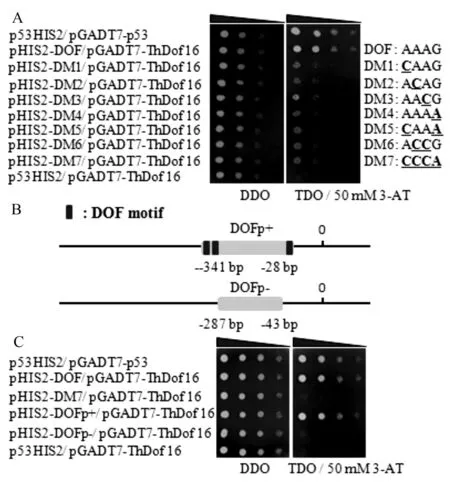
A.酵母单杂交验证ThDof16对DOF元件的识别;B.启动子片段选取;C.酵母单杂交验证ThDof16对包含DOF元件的启动子片段的互作。
图4酵母单杂交验证ThDof16识别DOF元件结果
2.6GUS基因在烟草体内的瞬时表达
植物过表达载体(pROKⅡ-ThDof16)作为效应载体(effector),pCAM-DOF、pCAM-DM7、pCAM-DOFp+、pCAM-DOFp-为报告载体(reporter)(图5A),通过基因枪共转化烟草叶片,GUS染色结果显示烟草叶片呈现斑点状蓝色;而对照组GUS染色结果显示烟草叶片未呈现蓝色(图5B)。ThDof16能够特异性地结合ThbHLH1启动子中的DOF元件来调控基因的表达。GUS酶活测定结果表明,只有报告载体时,通过基因枪转化的烟草的GUS活性很低。表达载体(pROKⅡ-ThDof16)与效应载体(pCAM-DOF、pCAM-DM7、pCAM-DOFp+、pCAM-DOFp-)通过基因枪共转化烟草叶片,进行GUS酶活测定(图5C);结果显示在植物体内ThDof16和能够特异性地结合ThbHLH1启动子中的DOF位点,来调控基因的表达。

A.报告载体和效应载体的构建;B.GUS染色结果;C.GUS酶活测定。
2.7ChIP研究ThDof16与DOF元件在ThbHLH1启动子中的互作
通过启动子分析,选取包含和不包含DOF顺式作用元件的5个片段,1(-1 857~-1 538)、2(-1 531~-1 208)、3(-1 158~-849)、4(-787~-429)、5(-311~-11),其中第一段不包含DOF元件(图6A),以Input,ChIP+,和ChIP-为模板,进行PCR验证,PCR结果表明Input为模板均出现特异条带;ChIP+为模板,片段2、3、4、5均有条带,只有片段1没有条带显示;ChIP-为模板PCR结果均无条带显示(图6B),结果表明植物体内与ThDof16互作的片段为含有DOF元件的启动子片段。该结果验证了ThDof16能够特异识别ThbHLH1启动子中的DOF元件。进一步证明了ThDof16通过识别ThbHLH1启动子中的DOF元件调控ThbHLH1基因的表达,即ThDof16为ThbHLH1的上游调控因子。

A.启动子中包含和不包含DOF顺式作用元件的片段结构;B.ChIP-PCR电泳结果,其中B图中M表示DL2000。
3结论与讨论
本研究根据已知的抗逆相关基因ThbHLH1的cDNA序列克隆得到ThbHLH1的全序列,通过PlantCARE及PLACE分析启动子中可能含有的顺式作用元件发现,其中含有启动子的基本顺式作用元件及DOF(AAAG)、G-box、W-box、I-box、WRKY和MYC等与信号传递途径相关的顺式作用元件,说明其可能与抗逆相关。因此,我们将设计利用酵母单杂交系统来研究ThbHLH1上游调控基因。
3结论
采用过热蒸汽干燥方法对50 mm厚柳杉锯材进行了试验研究,结果表明:干燥周期为110 h,全程干燥速率为0.011 8 h-1,终含水率、厚度含水率偏差及残余应力均达到一级指标要求,且合格率达到100%。外观干燥缺陷方面,顺弯翘曲率、横弯翘曲率和扭曲率平均值均能达到锯材干燥质量标准中的一级指标要求,翘曲率平均值达到干燥质量二级指标要求,总合格率达90.32%。经过热蒸汽干燥后柳杉的纹孔发生破裂,木材的孔隙增加,有利于木材干燥速度及干燥质量的提高。
建议对同一批试材采用常规干燥和过热蒸汽干燥进行直接对比,以为企业提供参考,为柳杉锯材的工业化利用提供技术依据。
参考文献
[1]谢雪霞.我国12种人工林木材机械加工性能研究[D].北京:中国林业科学研究院,2014.
[2]王喜明.木材干燥学[M].北京:中国林业出版社,2007.
[3]KURODA N. Development of fundamental research on drying of boxed-heart square timber of Sugi (Cryptomeriajaponica) (in Japanese with English summary)[J].Mokuzai Gakkaishi,2007,53(5):243-253.
[4]YAMASHITA K, HIRAKAWA Y, SAITO S, et al. Bow variation in kiln-dried boxed-heart square timber of sugi (Cryptomeriajaponica) cultivars[J]. Journal of Wood Science,2011,57(5):363-370.
[5]OBATAYA E, SHIBUTANI S, HANATA K, et al. Effects of high temperature kiln drying on the practical performances of Japanese cedar wood (Cryptomeriajaponica) I: changes in hygroscopicity due to heating[J]. Journal of Wood Science,2006,52(1):33-38.
[6]OBATAYA E, SHIBUTANI S, HANATA K, et al. Effects of high temperature kiln drying on the practical performances of Japanese cedar wood (Cryptomeriajaponica) II: Changes in mechanical properties due to heating[J]. Journal of Wood Science,2006,52(2):111-114.
[7]高利祥,周永东,高瑞清,等.柳杉锯材高温干燥初步研究[J].木材工业,2014,28(5):16-19.
[8]史勇春,李捷,李选友,等.过热蒸汽干燥技术的研究进展[J].干燥技术与设备,2012,10(1):3-9.
[9]张璧光.木材真空过热蒸汽干燥的应用前景[J].木材加工机械,2005,16(3):42-44.
[10]连政国.过热蒸汽干燥理论与实验研究[D].北京:中国农业大学,1998.
[11]程万里,刘一星,齐华春,等.木材过热蒸汽干燥过程中的收缩应力(Ⅰ):径向收缩应力特征[J].东北林业大学学报,2004,32(6):32-34.
[12]龚仁梅,沈隽,何灵芝,等.温度对人工林落叶松木材水分移动及微观结构的影响[J].东北林业大学学报,2001,5(5):31-33.
[13]高利祥.柳杉木材干燥工艺及其对物理性能的影响[D].北京:中国林业科学研究院,2014.
[14]彭毅卿.汽蒸预处理对杨木性质及真空干燥速率的影响[D].北京:北京林业大学,2013.
收稿日期:2015年9月10日。
作者简介:第一张兵,女,1990年11月生,林木遗传育种国家重点实验室(东北林业大学),硕士研究生。E-mail:763557804@qq.com。通信作者:王玉成,林木遗传育种国家重点实验室(东北林业大学),教授。E-mail:wangyucheng@ms.xjb.ac.cn。
1)黑龙江省杰出青年科学基金(JC201102)。
责任编辑:潘华。

