慢病毒介导干扰LSD1基因的卵巢癌稳转细胞株的构建及鉴定
万晓蕾 ,赖文升,邵根宝,李袁霞,刘秀雯,金洁,吴朝阳
(1江苏大学附属人民医院,江苏镇江212002;2江苏大学医学院)
慢病毒介导干扰LSD1基因的卵巢癌稳转细胞株的构建及鉴定
万晓蕾1,2,赖文升2,邵根宝2,李袁霞2,刘秀雯2,金洁2,吴朝阳1
(1江苏大学附属人民医院,江苏镇江212002;2江苏大学医学院)
目的 构建并鉴定慢病毒介导干扰赖氨酸特异性去甲基化酶1(LSD1)基因的卵巢癌稳转细胞株,为深入研究以LSD1为靶点的表观遗传学抗肿瘤治疗奠定基础。方法 扩增并抽提所需质粒,紫外分光光度计检测质粒纯度,计算A260/A280。采用Lipofectamine 2000脂质体转染法将质粒转染入人肾上皮细胞293T,取转染THM质粒后的293T细胞,在倒置荧光显微镜下观察转染情况;分别取转染目的质粒和PLKO空载体质粒后的293T细胞,收集病毒上清液,感染人卵巢癌SKOV3细胞(分别记为观察组和对照组),筛选出稳转细胞株。观察组经浓度梯度(0、1、10、100、1 000 ng/mL)多西环素诱导,以及两组均经100 ng/mL多西环素诱导后,采用Western blotting法检测LSD1及其特异性反应底物H3K4me1、H3K4me2蛋白相对表达量。结果 目的质粒A260/A280在2.0左右,说明纯度较高;THM质粒转染293T细胞呈绿色荧光,为真核载体表达的绿色荧光蛋白,表明成功转染。随着多西环素浓度的升高,观察组诱导后LSD1蛋白相对表达量均逐渐降低,H3K4me1、H3K4me2蛋白相对表达量逐渐升高,各浓度间比较有统计学差异(P均<0.01)。观察组经100 ng/mL多西环素诱导后LSD1蛋白相对表达量均明显低于同组诱导前及对照组诱导后,H3K4me1、H3K4me2蛋白相对表达量明显高于同组诱导前及对照组诱导后(P均<0.01)。 结论 成功构建慢病毒干扰下调LSD1基因表达的卵巢癌稳转细胞株,并经不同浓度多西环素诱导鉴定;该细胞株可用于以LSD1为靶点的表观遗传学抗肿瘤治疗研究。
赖氨酸特异性去甲基化酶1;RNA干扰;人卵巢癌SKOV3细胞;稳转细胞株
研究证实,细胞表观遗传学异常,如DNA甲基化、组蛋白修饰等在卵巢癌的发生、发展中具有重要作用[1,2]。赖氨酸特异性去甲基化酶1(LSD1)是第一个被发现的组蛋白赖氨酸特异性去甲基化酶,特异性作用于组蛋白H3第4位赖氨酸位点,催化移除一甲基团和二甲基团[3,4]。LSD1不仅能够抑制p53的生物学活性,还能抑制p53信号途径的传递和由p53引起的细胞凋亡,从而促进肿瘤的发生和发展[5]。2014年9月~2015年3月,本研究采用慢病毒介导构建LSD1基因干扰的卵巢癌稳转细胞株,并进行鉴定,为深入研究以LSD1为靶点的表观遗传学抗肿瘤治疗奠定基础。
1 材料与方法
1.1 材料 人卵巢癌细胞系SKOV3、人肾上皮细胞系293T由江苏大学基础医学研究所提供。质粒PLKO空载体质粒由美国普渡大学胡长登教授惠赠。脂质体细胞转染试剂 LipofectamineTM2000(Invitrogen公司,美国),一抗LSD1(Cell Signal Technology公司,美国),α-tubulin、蛋白抽提试剂盒(Bioworld Technology公司,美国),H3K4me1、 me2(Upstate Biotechnology公司,美国),Histone H3 antibody (Abcam公司,美国),HRP标记的羊抗兔二抗、HRP 标记的羊抗鼠二抗(Jackson Immuno Research Laboratories公司,美国)。
1.2 细胞培养 SKOV3细胞和293T细胞均置于含10% FBS和抗生素(100 U/mL青霉素和100 mg/mL链霉素)的高糖DMEM培养基中,于37 ℃、5% CO2、饱和湿度培养箱中传代培养。根据细胞生长情况及培养液颜色换液,当培养瓶中细胞生长至80%融合时,用胰酶消化传代1次,传代时以含0.25%胰酶+0.02% EDTA的PBS消化。取对数生长期细胞用于以下研究。
1.3 慢病毒介导干扰LSD1基因的卵巢癌稳转细胞株构建
1.3.1 质粒转化、扩增与抽提 ①转化:将1 μL PLKO空载体质粒加入50 μL感受态细胞DH5α中,混匀后冰浴30 min,于42 ℃温浴90 s,冰浴2 min。加入500 μL LB培养基复苏感受态细胞,37 ℃温箱中静置1 h。取50 μL涂板于含氨苄青霉素的LB培养基上,37 ℃温箱孵育12 h。②扩增、抽提质粒:用接种环挑取大而圆的克隆菌落,接种于5 mL含氨苄青霉素的LB培养基中,37 ℃条件下,220 r/min摇菌16 h以扩增质粒。取1.5 mL菌液,于室温下10 000 g/min离心1 min,收集菌体,倒尽或吸干培养基。在菌体沉淀中加入250 μL含RNase A的SolutionⅠ,混匀静置2 min,加入250 μL Solution Ⅱ,立即温和颠倒离心管5~10次。室温静置5 min,加入350 μL Solution Ⅲ,轻摇5~10次以充分混匀。13 000 g/min离心10 min,将上清全部小心移入吸附柱;10 000 g/min离心1 min。倒掉收集管中的液体,将吸附柱放入同一个收集管中。向吸附柱中加入500 μL Buffer HB,10 000 g/min离心1 min,倒掉收集管中的液体;再加700 μL Wash Buffer,10 000 g/min离心1 min,倒掉收集管中的液体。13 000 g/min离心2 min后,将柱子放入新的EP管,加30 μL预热好的Elution Buffer(67 ℃),37 ℃孵育2 min,13 000 g/min离心1 min,获得所需质粒。采用琼脂糖凝胶电泳法验证本研究所用质粒(shLSD1目的质粒、PLKO空载体质粒、1562包膜质粒、1563包裹质粒),紫外分光光度计检测各质粒纯度,计算A260/A280。
1.3.2 质粒转染 取对数生长期的293T细胞接种于培养皿中,调整细胞密度为2.5×105个/mL;置于无抗生素且含有10% FBS的DMEM培养基中培养,次日观察细胞生长至80%融合,换成DMEM单纯培养基。分别取1562包膜质粒1.5 μg、1563包裹质粒0.5 μg、相关质粒(PLKO空载体质粒、shLSD1目的质粒或用于检测转染效率的THM质粒)2 μg稀释于DMEM 250 μL中,将16 μL脂质体LipofectamineTM2000稀释于DMEM 250 μL,二者混合,室温孵育25 min后加入到各组细胞培养皿。37 ℃、5% CO2、饱和湿度培养箱中孵育6 h,更换含10% FBS的DMEM培养基。将转染THM质粒的细胞置于倒置荧光显微镜下,观察含绿色荧光信号的细胞,评估转染情况。转染PLKO空载体质粒、shLSD1目的质粒的细胞每24 h更换1次新鲜培养基,重复3次,收集病毒上清液,4 ℃保存。
1.3.3 病毒上清液感染及稳转细胞株筛选 取对数生长期SKOV3细胞接种于培养皿中,调整细胞密度为5×104个/mL;置于含10% FBS的DMEM培养基中培养,次日观察细胞生长至60%融合。将细胞分为观察组和对照组,分别取1.3.2中采集到的转染PLKO空载体质粒、shLSD1目的质粒的细胞病毒上清液1 mL,加入含8 μg/mL聚凝胺的完全培养基中,每24 h感染1次靶细胞,重复感染2次。两组经病毒感染48 h后,更换含1 μg/mL嘌呤霉素+10% FBS的DMEM培养基,将存活的细胞株传代培养,筛选出稳转细胞株。
1.4 慢病毒介导干扰LSD1基因的卵巢癌稳转细胞株鉴定 ①观察组经不同浓度多西环素诱导鉴定:取对数生长期的观察组稳转细胞,经浓度梯度(0、1、10、100、1 000 ng/mL)多西环素诱导24 h,提取细胞蛋白,以Tubulin及Histon管家蛋白为内参,采用Western blotting法检测LSD1及其特异性反应底物H3K4me1、H3K4me2蛋白相对表达量,严格按照试剂盒说明书操作。②观察组和对照组经100 ng/mL多西环素诱导鉴定:取对数生长期的观察组和对照组稳转细胞,经100 ng/mL多西环素诱导24 h,采用Western blotting法检测两组经多西环素诱导前后LSD1及H3K4me1、H3K4me2蛋白相对表达量。试验重复3次,取平均值。
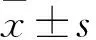
2 结果
2.1 质粒纯度检测及转染情况 各质粒A260/A280在2.0左右,说明纯度较高;琼脂糖凝胶电泳结果显示,各质粒条带清晰,碱基量大小与预期相符(见图1)。转染THM质粒的细胞在倒置荧光显微镜下呈绿色荧光,为真核载体表达的绿色荧光蛋白,表明已成功转染。
2.2 稳转细胞株鉴定结果 ①随着多西环素浓度的升高,观察组诱导后LSD1蛋白相对表达量逐渐降低,其特异性反应底物H3K4me1、H3K4me2蛋白相对表达量逐渐升高,多浓度间比较均有统计学差异(P均<0.01),见表1。②对照组经100 ng/mL多西环素诱导前后LSD1及H3K4me1、H3K4me2蛋白相对表达量比较无统计学差异(P均>0.05);观察组经100 ng/mL多西环素诱导后LSD1蛋白相对表达量明显低于同组诱导前及对照组诱导后,H3K4me1、H3K4me2蛋白相对表达量明显高于同组诱导前及对照组诱导后(P均<0.01)。见表2。
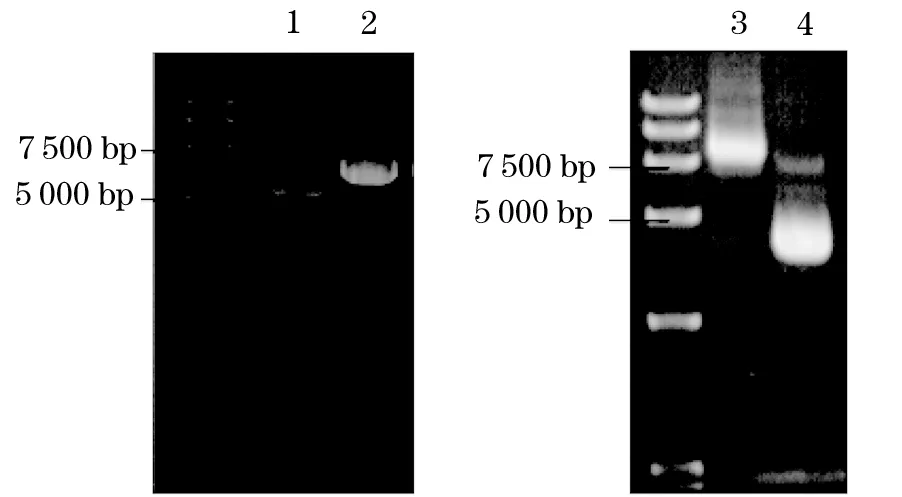
注:1为扩增sh-LSD1目的质粒,2为扩增PLKO空载体质粒;3为1562包膜质粒,4为1563包裹质粒。
图1 各质粒琼脂糖凝胶电泳检测结果
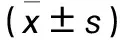

多西环素浓度LSD1/TubulinH3K4me1/HistonH3K4me2/Histon0ng/mL1.167±0.0440.228±0.0240.207±0.0271ng/mL1.055±0.068*0.510±0.075*0.325±0.006*10ng/mL0.618±0.017*0.698±0.085*0.365±0.017*100ng/mL0.587±0.080*1.075±0.011*0.379±0.038*1000ng/mL0.447±0.024*1.077±0.009*0.449±0.084*
注:多组间比较,P均<0.01;与0 ng/mL多西环素比较,*P<0.01。
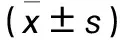
表2 两组经100 ng/mL多西环素诱导前后LSD1及H3K4me1、H3K4me2蛋白相对表达量比较
注:与同组诱导前比较,*P<0.01;与对照组诱导后比较,#P<0.01。
3 讨论
临床对卵巢癌患者多采用手术切除联合药物化疗的方式治疗,但由于癌细胞耐药性的产生,卵巢癌患者5年生存率仅为30%左右[6~8]。表观遗传学修饰是指在不改变DNA序列的情况下,改变核苷酸或染色体可逆性修饰调节基因的表达,主要包括DNA修饰和组蛋白修饰等。表观遗传学异常导致的疾病称为表观遗传病,肿瘤也是表观遗传病中的一种[9]。LSD家族是一类黄素腺嘌呤二核苷酸依赖的去甲基化酶,能够去除组蛋白H3K4和 H3K9的单、双甲基,从而得到单甲基或无甲基的H3K4和H3K9。LSD1 作为第一个被发现的组蛋白去甲基化酶,在多种肿瘤组织中表达升高,如卵巢肿瘤[10]、乳腺癌[11,12]、前列腺癌[13]等。研究表明,LSD1的表达上调与肿瘤的恶性行为呈正相关,可能参与了肿瘤的发生和发展,提示患者预后不良[14,15]。因此,LSD1可以作为表观遗传治疗的一个潜在靶点,为癌症治疗药物的开发提供新方向。
绿色荧光蛋白基因是目前使用最为广泛的荧光基因,表达绿色荧光,具有较高的信噪比,且在细胞内荧光转换效率高,易检测,便于在倒置荧光显微镜下直观观察[16]。本研究采用含绿色荧光蛋白的THM质粒评估转染情况,其在倒置荧光显微镜下呈绿色荧光,为真核载体表达的绿色荧光蛋白,表明已成功转染,有利于下一步病毒包装、细胞感染。慢病毒转染法转染效率较高,可在转染的细胞中传播稳定的DNA片段,并实现稳定表达,近年来应用日益广泛。因此本研究采用慢病毒进行质粒的包装,获得了高滴度的慢病毒载体;收集高滴度携带shLSD1基因的病毒上清液后,成功转染了SKOV3细胞,并获得持续稳定表达。本研究结果显示,随着多西环素浓度升高,观察组诱导后LSD1蛋白相对表达量逐渐降低,其特异性反应底物H3K4me1、H3K4me2蛋白相对表达量逐渐升高,表明多西环素成功作用于稳转SKOV3细胞的PLKO空载体质粒基因靶点,使得shRNA表达并导致目的基因LSD1随多西环素浓度的增加而逐渐沉默表达;观察组经100 ng/mL多西环素诱导后LSD1蛋白相对表达量明显低于同组诱导前及对照组诱导后,H3K4me1、H3K4me2蛋白相对表达量明显高于同组诱导前及对照组诱导后,进一步表明PLKO空载体质粒基因成功整合至SKOV3细胞,经多西环素诱导后可靶向敲减LSD1。
综上所述,本研究成功构建并筛选出慢病毒干扰LSD1基因表达的卵巢癌稳转细胞株,并经不同浓度的多西环素诱导鉴定其表达。本研究为日后深入研究以LSD1为靶点的表观遗传学抗肿瘤治疗打下了基础,也说明通过靶向干扰LSD1基因的表达,可影响其下游特异性反应底物H3K4me1、H3K4me2的表达变化,从而为调控肿瘤的发生、发展提供新的思路。
[1] Ali AY, Farrand L, Ji YK, et al. Molecular determinants of ovarian cancer chemoresistance: new insights into an old conundrum[J]. Ann N Y Acad Sci, 2012,1271(1):58-67.
[2] Meng F, Sun G, Zhong M, et al. Inhibition of DNA methyltransferases, histone deacetylases and lysine-specific demethylase-1 suppresses the tumorigenicity of the ovarian cancer ascites cell line SKOV3[J]. Int J Oncol, 2013,43(2):495-502.
[3] Shi Y, Lan FC, Mulligan P, et al. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1[J]. Cell, 2004,119(7):941-953.
[4] Lan F, Nottke AC, Shi Y. Mechanisms involved in the regulation of histone lysine demethylases[J]. Curr Opini Cell Biol, 2008,20(3):316-325.
[5] Huang J, Sengupta R, Espejo AB, et al. p53 is regulated by the lysine demethylase LSD1[J]. Nature, 2007,449(7158):105-108.
[6] Ferlay J, Parkin DM, Steliarova-Foucher E. Estimates of cancer incidence and mortality in Europe in 2008[J]. Eur J Cancer, 2010,46(4):765-781.
[7] Leitao MM, Chi DS. Surgical management of recurrent ovarian cancer.[J]. Semin Oncol, 2009,36(2):106-111.
[8] Zhan Q, Wang C, Ngai S. Ovarian cancer stem cells: a new target for cancer therapy[J]. Biomed Res Int, 2013,2013(1):916819.
[9] 阮建彬,臧建业.组蛋白去甲基化酶LSD1的结构和功能研究进展[J].中国科学技术大学学报,2008,38(8):930-940.
[10] Konovalov S, Garcia-Bassets I. Analysis of the levels of lysine-specific demethylase 1 (LSD1) mRNA in human ovarian tumors and the effects of chemical LSD1 inhibitors in ovarian cancer cell lines[J]. J Ovarian Res, 2013,6(1):75.
[11] Lim S, Janzer A, Becker A, et al. Lysine-specific demethylase 1 (LSD1) is highly expressed in ER-negative breast cancers and a biomarker predicting aggressive biology[J]. Carcinogenesis, 2010,31(3):512-520.
[12] Serce N, Gnatzy A, Steiner S, et al. Elevated expression of LSD1 (Lysine-specific demethylase 1) during tumour progression from pre-invasive to invasive ductal carcinoma of the breast[J]. Bmc Clin Pathol, 2012,12(1):1-7.
[13] Wu CY, Hsieh CY, Huang KE, et al. Cryptotanshinone down-regulates androgen receptor signaling by modulating lysine-specific demethylase 1 function[J]. Int J Cancer, 2012,131(6):1423-1434.
[14] Kahl P, Gullotti L, Heukamp LC, et al. Androgen receptor coactivators lysine-specific histone demethylase 1 and four and a half LIM domain protein 2 predict risk of prostate cancer recurrence[J]. Cancer Res, 1988,28(1):393-396.
[15] Gao L, Alumkal J. Epigenetic regulation of androgen receptor signaling in prostate cancer[J]. Epigenetics, 2010,5(2):100-104.
[16] 张翀,邢新会.荧光蛋白作为生物过程快速定量的可视化分子信号:潜力和挑战[J].中国化学工程学报:英文版,2010,18(5):210-212.
Construction and identification of stably transfected ovarian cancer cell lines with lentiviral RNA interference-mediated down-regulation of LSD1 gene
WANXiaolei1,LAIWensheng,SHAOGenbao,LIYuanxia,LIUXiuwen,JINJie,WUChaoyang
(1AffiliatedPeople′sHospitalofJiangsuUniversity,Zhenjiang212002,China)
Objective To construct the stably transfected ovarian cancer cell lines SKOV3 with lentiviral RNA interference-mediated down-regulation of lysine-specific demethylase 1 (LSD1) gene and to provide basis for the in-depth study of taking LSD1 gene as a target in the epigenetics anti-tumor treatment. Methods The plasmids was amplified and extracted, and the UV spectrophotometer was used to detect their purity, recording A260/A280. PLKO-TET-On plasmids were transfected into 293T cells via Lipofectamine 2000, The transfection of 293T cells was observed under an inverted fluorescence microscope. Collecting virus supernatants which were infected by ovarian cancer cells SKOV3 (observation group) and the vector PLKO was used as the negative control (control group). The stably transfected cell lines were selected. The cell lines were induced by doxycycline (0, 1, 10, 100 and 1 000 ng/mL) in the observation group, and then they were both induced by 100 ng/mL doxycycline, the expression of LSD1, H3K4me1 and H3K4me2 in the stably transfected cell lines was detected by Western blotting. Results Ultraviolet spectrophotometer showed that the target plasmid A260/A280was around 2.0 with high purity, THM plasmid-transfected 293T cells appeared green fluorescence, which was eukaryotic expression vector of GFP green fluorescent protein, suggesting that transfection was successful. The protein expression level of LSD1 was decreased and its main substration H3K4me1, H3K4me2 expression was increased with the concentration gradient of doxycycline. There were statistically significant differences between multiple concentrations (allP<0.01). The relative expression of LSD1 protein of the observation group induced by 100 ng/mL doxycycline was significantly decreased but the expression of H3K4me1, H3K4me2 was increased as compared with that in the group without doxycycline induction and the control group after the induction of doxycycline (allP<0.01). Conclusion The stably transfected ovarian cancer cell lines SKOV3 with lentiviral RNA interference-mediated down-regulation of LSD1 gene are constructed successfully and identified with concentration gradient of doxycycline induction; this cell line can be used in the epigenetics anti-tumor treatment of taking LSD1 as a target.
lysine-specific demethylase 1; RNA interference; human ovarian cancer SKOV3 cells; stably transfected cells
国家自然科学基金资助项目(81170573)。
万晓蕾(1990-),女,硕士研究生,研究方向为肿瘤分子靶向治疗。E-mail: 965261228@qq.com
吴朝阳(1967-),男,主任医师,研究方向为肿瘤综合治疗。E-mail: wuchaoyang9@163.com
10.3969/j.issn.1002-266X.2016.16.006
R737.31
A
1002-266X(2016)16-0019-04
2015-12-18)

