酶解法提取蒲公英多糖工艺
徐澜,王明华,渠娟娟,安伟(.忻州师范学院生物系,山西忻州034000;.山西省农业科学院玉米研究所,山西忻州034000)
酶解法提取蒲公英多糖工艺
徐澜1,王明华1,渠娟娟1,安伟2
(1.忻州师范学院生物系,山西忻州034000;2.山西省农业科学院玉米研究所,山西忻州034000)
摘要:通过单因素试验和Box-Behnken中心组合试验设计,优化酶解法提取蒲公英多糖工艺。研究了酶解pH、酶解时间、酶解温度、酶浓度等因素对蒲公英多糖提取率的影响,利用响应面法处理试验数据,确定了酶解法优化蒲公英多糖的提取工艺参数。对蒲公英多糖提取率的影响次序为:酶浓度>酶解时间>酶解温度>pH;木瓜蛋白酶提取蒲公英多糖提取率(3.11%)最高;最优提取工艺参数为:pH为9.20,酶解温度为46.18℃,酶解时间为123min,酶含量为3.38%(酶质量/蒲公英质量)。
关键词:蒲公英;多糖;酶解法;响应面法
蒲公英(Herba Taraxaci)为菊科多年生草本植物,我国约有11种[1],分布于东北、华北及陕西、甘肃、青海等地,味苦,性寒,具有清热解毒、消肿散结和利尿通淋的功效。植物多糖具有多种生物活性,抗病毒、降血糖及抗肿瘤和免疫促进的临床应用[2],如蒲公英多糖具有抗突变、抗氧化、抗疲劳和提高免疫等生物活性[3]等功效。多糖提取方法主要有水浸提取法、酸碱提取法、微波辅助提取法、酶提取法等,传统高温水提取工艺时间较长,而且能耗大、效率低;酸碱提取易破坏多糖的结构和活性;微波法省时,但是效率较低;超声波法虽然效率较高,但噪音大,仪器昂贵[4]。酶解法具较温和地分解植物组织的特点,能最大限度地提取有效成分,可大幅提高提取率,且不易破坏多糖的结构和活性[5],近年来已逐渐成为植物活性成分提取工艺研究的热点[6-8]。采用酶解法提取蒲公英多糖,旨在探索一种高效的蒲公英多糖提取工艺。
本研究利用酶解法从蒲公英中提取多糖,该法目前尚少见报道。同时,在单因素试验的基础上,以蒲公英多糖提取率为响应因子,对提取过程中的各主要因素采用响应面法(response surface methodology,RSM)进行优化,为科学、合理地利用蒲公英资源提供参考。
1 材料与仪器
蒲公英:山西忻州。
722s可见分光光度计:上海菁华科技仪器有限公司;pHS-3C型pH(酸度)计:上海天达仪器有限公司;800B离心机:上海安亭科学仪器制造厂;AB204-N电子分析天平:上海梅特勒-托利多仪器有限公司;HH-2数显恒温水浴锅:江苏省金坛市荣华仪器制造有限公司。
葡萄糖标准品(分析纯)、苯酚(分析纯)、浓硫酸(分析纯)均为天津市分船化学试剂科技有限公司;纤维素酶(BR生化试剂):北京奥博星生物技术有限责任公司;果胶酶(生物试剂):天津市光复精细化工研究所;木瓜蛋白酶:北京化学试剂公司。
2 方法
采用硫酸苯酚法[9-10]。
2.1多糖的提取
取蒲公英粉末0.5 g,选择50 mL蒸馏水,加入适量的木瓜蛋白酶,在适量温度下进行不同时间的水浴加热,离心后得多糖提取液。
2.2多糖含量的测定
绘制标准曲线。标准溶液的配制:准确称取干燥恒重葡萄糖100 mg,用蒸馏水定容于100 mL容量瓶中,浓度为1 mg/mL葡萄糖贮备溶液,再准确移取10 mL,用蒸馏水定容至100 mL,得0.1 mg/mL葡萄糖使用液。准确吸取0.1 mg/mL的葡萄糖使用液0、0.1、0.2、0.4、0.8、1.6 mL,分别置于试管中,各加入6.25 %苯酚溶液1mL,摇匀,置于30℃的水浴中,滴加浓硫酸5.0mL,摇匀后,煮15min,取出后用蒸馏水定容到25 mL,于室温下显色20min,于波长490 nm处测定吸光度,绘制标准曲线,求得回归方程A=0.039C+0.013 3,相关系数R2=0.999 2。
准确吸取以上所得蒲公英多糖提取液1 mL,按标准曲线制备方法测定吸光度,并以吸光度求出蒲公英中多糖的含量[9]。多糖含量公式:
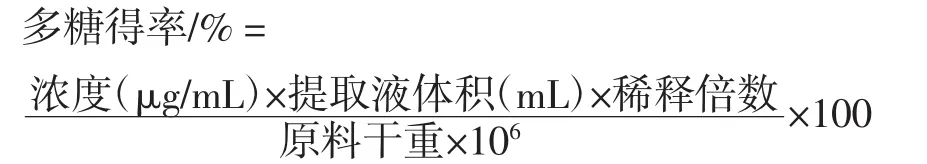
2.3单因素试验
多糖提取率的影响因素很多,本试验选择酶解时间、酶解温度、酶浓度和酶解pH为因素,考察各因素对蒲公英多糖提取工艺的影响,采用单因素试验确定最佳工艺条件。由文献知,木瓜蛋白酶具有一定的优势。因此,在后面的试验中选择用木瓜蛋白酶来进行多糖的提取试验。
2.4响应面法优化试验
在单因素试验的基础上,以酶解温度、酶解时间、酶浓度和酶解pH作为考察对象,以蒲公英多糖提取率为响应值,采用Design Expert 7.0.0统计分析软件的响应面法安排试验,得到最优化提取工艺参数。
3 结果与分析
3.1木瓜蛋白酶提取蒲公英多糖的单因素试验
3.1.1酶解时间对蒲公英多糖提取率的影响
在酶浓度为3 %,温度为50℃,pH=5的条件下,确定最佳酶解时间,以酶解时间为横坐标,蒲公英多糖提取率为纵坐标作图,结果如图1所示。

图1 酶解时间对蒲公英多糖提取率的影响Fig.1 Effect of enzymolysis time on the extraction yield of polysaccharides from Herba Taraxaci
由图1可知,随着酶解时间的增加,多糖提取率逐渐升高,当达到120min时,多糖提取率达到最大,再延长酶解时间,多糖提取率有所下降。因此,最佳酶解时间是120min。
3.1.2酶解温度对蒲公英多糖提取率的影响

图2 酶解温度对蒲公英多糖提取率的影响Fig.2 Effect of enzymolysis solution temperature on the extraction yield of polysaccharides from Herba Taraxaci
在酶浓度为3 %,pH=5,酶解时间为120min的条件下,确定最佳酶解温度,并以酶解温度为横坐标,蒲公英多糖的提取率为纵坐标,见图2。随酶解温度升高,蒲公英多糖提取率增加,当温度达50℃时,多糖提取率达最大值,之后随酶解温度的继续升高,提取率反而下降。这可能是因为温度不仅影响多糖的溶出速度,而且影响蛋白酶的活性,随着温度升高,木瓜蛋白酶的酶解活性增加,进而蒲公英多糖的提取率升高;但当温度超过50℃之后,提取率反而下降,主要是由于此时木瓜蛋白酶的活性反而降低甚至丧失,因为每一种酶的活性都有一个最佳的温度范围,超过这个范围就会引起酶活性降低,并且每一种酶都有一个最适温度,在最适温度时活性最大,即蒲公英多糖的提取率最大。因此,酶解最佳温度为50℃。
3.1.3酶浓度对蒲公英多糖提取率的影响
以酶浓度为横轴,蒲公英多糖提取率为纵轴,在酶解温度是50℃,pH = 5,酶解时间为120min条件下确定最佳酶浓度,见图3。随酶浓度的增加,蒲公英多糖提取率增加。当酶浓度超过3 %后,蒲公英多糖随酶浓度增加变缓。考虑到成本,酶解时的最佳酶浓度为3 %。
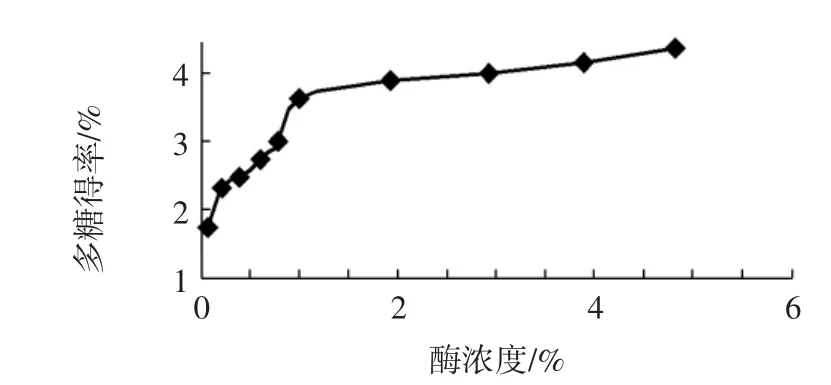
图3 酶浓度对蒲公英多糖提取率的影响Fig.3 Effect of enzyme concentration on the extraction yield ofpolysaccharides from Herba Taraxaci
3.1.4酶解pH对蒲公英多糖提取率的影响
在酶浓度为3%,温度为50℃,酶解时间为120min的条件下,确定最佳酶解pH。以pH为横坐标,蒲公英多糖的提取率为纵坐标作图,见图4。
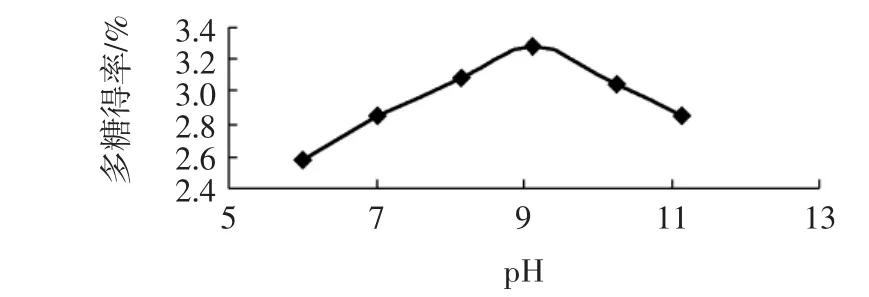
图4 酶解pH对蒲公英多糖提取率的影响Fig.4 Effect of the pH on the extraction yield of polysaccharides from Herba Taraxaci
随着pH的增加,蒲公英多糖的提取率逐渐增加;当pH= 9时,蒲公英多糖的提取率达到最大值,然后随着pH值的继续增加蒲公英多糖的提取率反而下降。这可能是因为酶对pH非常敏感,每一种酶都是在一定pH范围内发挥作用的。如果环境的pH超出这个范围,酶的活性就会降低甚至失去活性,只有在一定的pH时,其活性才会达到最高,该值即是酶的最适pH,偏离该值,无论pH是增加或减少,酶的活性都会下降,进而引起蒲公英多糖提取率下降。由图4知,在pH= 9时蒲公英多糖的提取率最大,所以酶解最佳pH 为9。
3.2响应面分析法优化工艺条件
3.2.1响应面分析因素水平的选取
由单因素试验结果,选取酶解温度(a)、酶解时间(b)、酶浓度(c)和酶的pH(d)4个因素进行中心组合设计(central composite design,CCD)(取中心点为6),利用Design Expert 7.0.0软件进行数据拟合,以+ 1、0、- 1分别代表自变量高、中、低水平,因子编码及水平见表1。
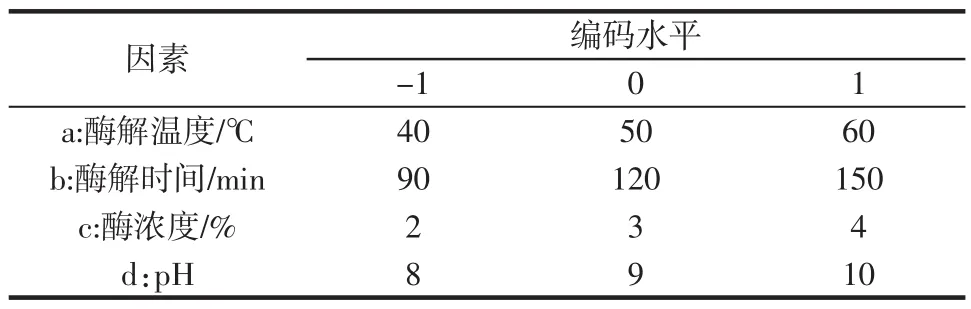
表1 响应面分析因素水平试验设计Table 1 Experiment design of four factors and three levels of RSM
3.2.2响应面分析方案及结果
以多糖提取率为响应值(Y),以A =(a-50)/10,B = (b- 120)/ 30,C =(c - 3)/ 1,D =(d-9)/1为自变量,采用四因素三水平试验进行响应面分析,中心组合设计的试验结果及其预测值见表2。
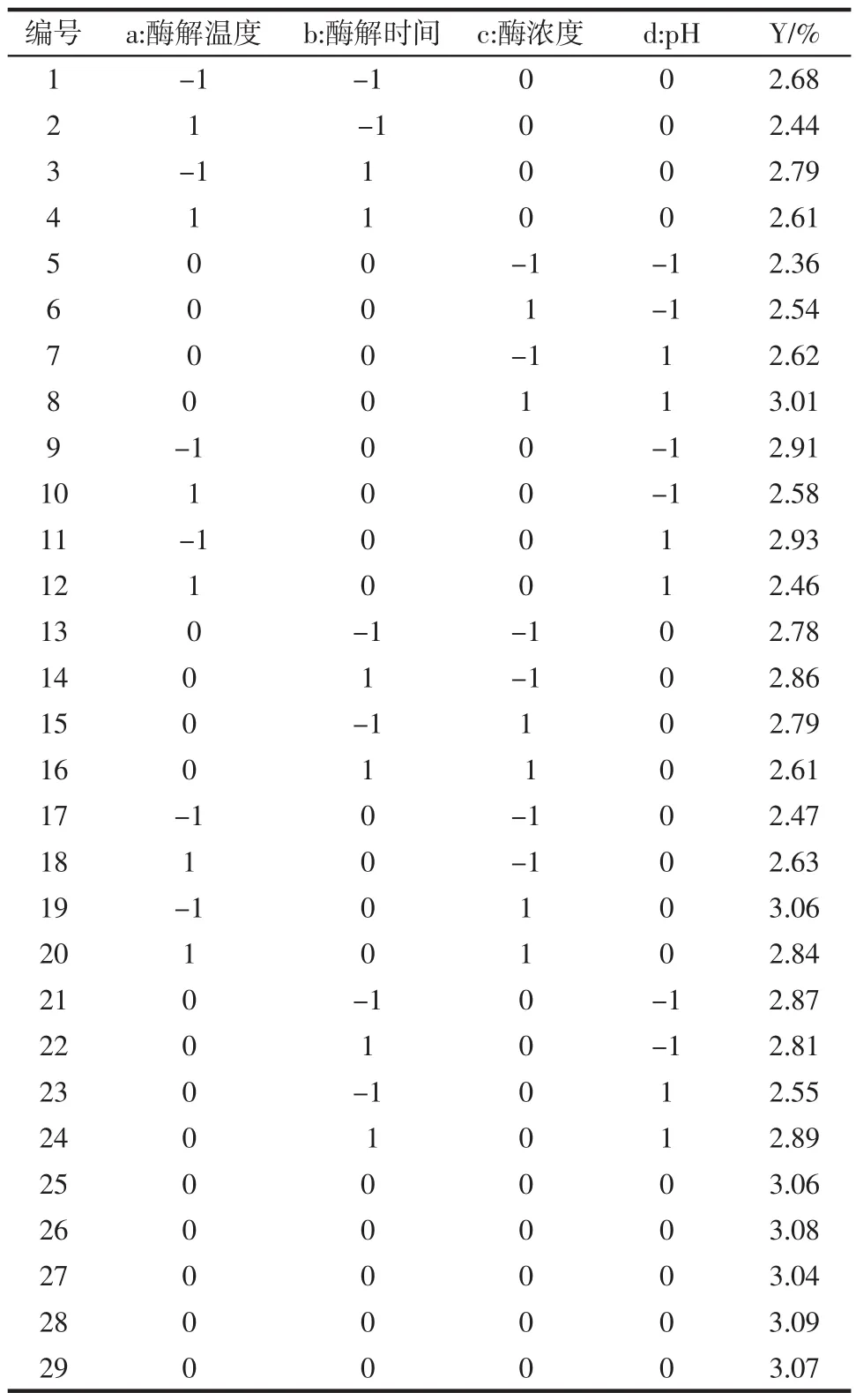
表2 响应面分析方案及试验结果Table 2 Box-Behnkenl central composite design arrangement and experimentral results
对试验数据进行多项拟合回归,建立回归方程Y =+3.07 -0.11A +0.038B +0.094C +0.032D +0.015AB -0.095AC-0.035AD-0.065BC+0.10BD+0.052CD-0.20A2-0.16B2-0.18C2-0.18D2,对模型进行方差分析,结果见表3。
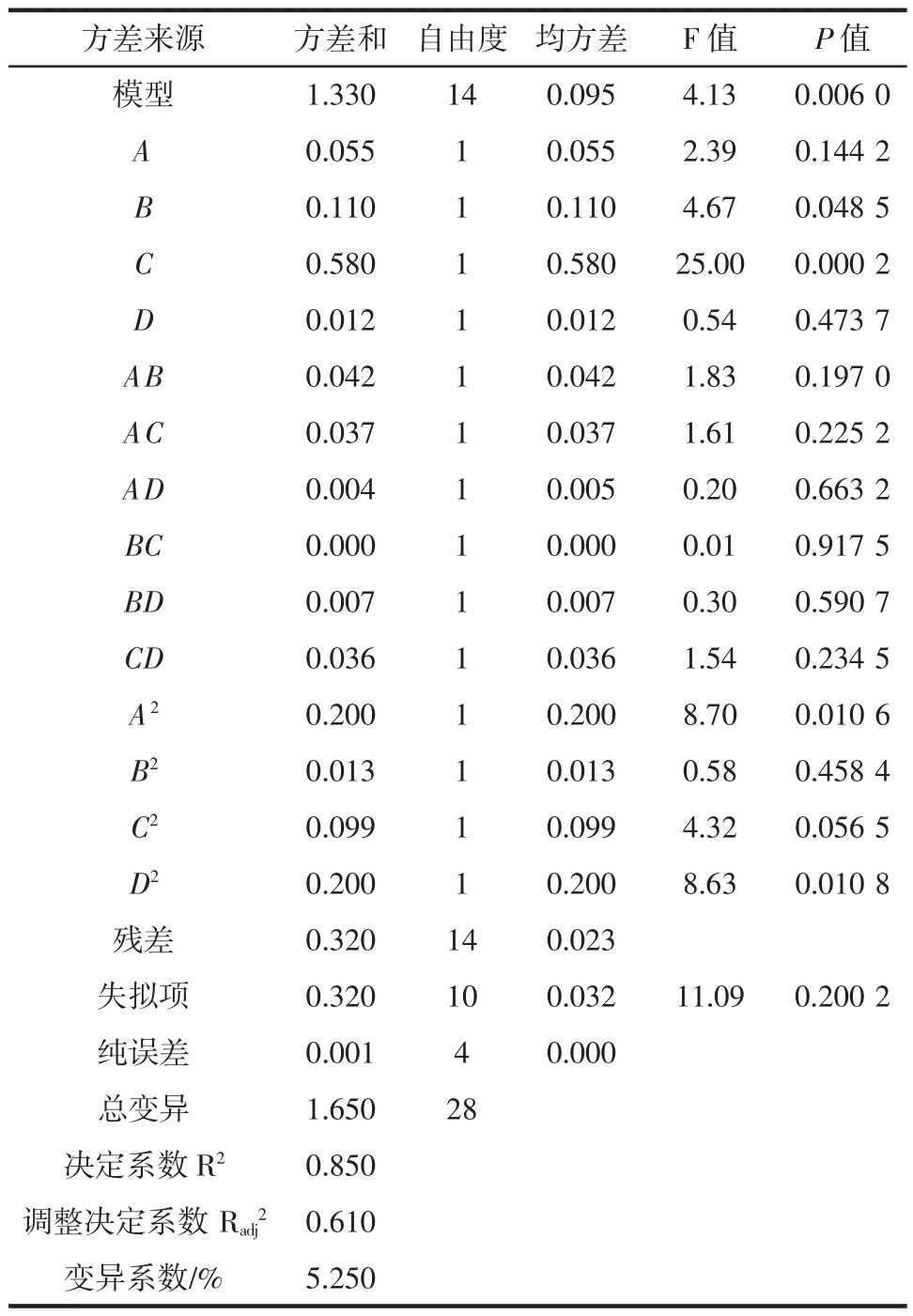
表3 蒲公英多糖提取率的回归模型方差分析Table 3 Variance analysis of regression equation on the extraction yield of Herba Taraxaci polysaccarides
从回归方程模型因变量的方差分析知(表3),P= 0.006 0<0.05,表明所选用的二次多项式模型具有高度的显著性(P<0.01)[10],即回归方程描述各因子与响应值之间的关系时,其应变量与全体自变量之间的线性关系是显著的,即这种试验方法是可靠的;变异系数(5.25 %)较低,表明本试验稳定性较好;模型的相关系数R2=0.850,说明该模型可靠性较好。失拟项用来表示所用模型与试验拟合的程度,P=0.200 2>0.05,表明失拟不显著。模型一次项A从回归方程模型因变量的方差分析知,模型一次项C(P=0.000 2)差异极显著,B (P=0.048 5)差异显著,A(P=0.144 2),D(P=0.473 7)差异不显著;交互项AB(P=0.197),AC(P=0.225 2),差异显著CD(P=0.234 5),BD(P=0.590 7),AD(P=0.663 2),BC(P=0.917 5)差异不显著;二次项A2(P=0.010 6),D2(P=0.010 8)差异显著,C2(P=0.056 5),B2(P=0.458 4)差异不显著。表明酶浓度对多糖提取率的主效应明显,且在酶解时间、酶解温度、酶浓度和pH之间存在交互作用。依据系数值A=2.39,B=4.67,C=25,D=0.54可知因素的主效应关系为:酶浓度>酶解时间>酶解温度>pH值。
3.2.3响应面图分析
响应面可直接反映出各因子对响应值的影响大小,回归方程绘制的响应曲面分析,见图5~图10。
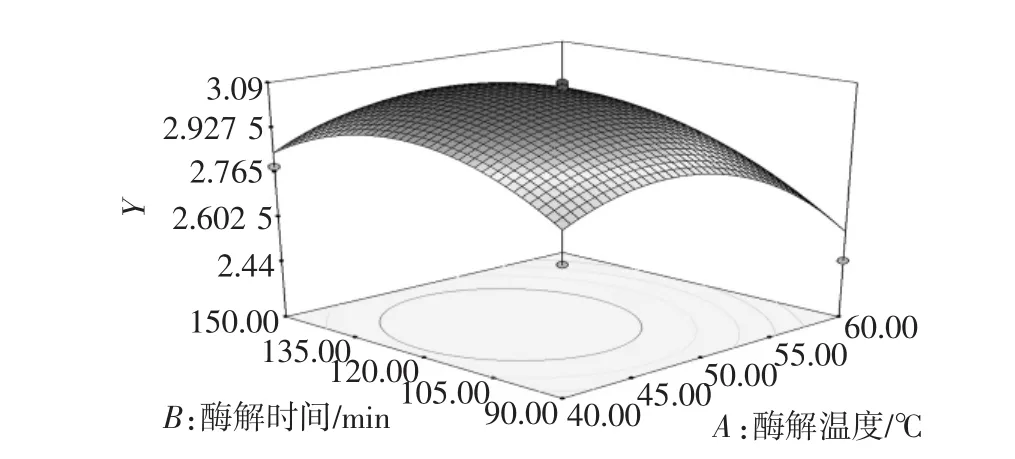
图5 酶解时间和温度对多糖提取率的响应面图Fig.5 Response surface plot of time and temperaturevs extraction yield of polysaccharides
在试验范围内,酶解时间不变,随着酶解温度的增加,多糖提取率增加到最大值然后有所下降;酶解温度不变,酶解时间增加,多糖提取率逐渐增大然后下降;这与单因素试验分析结果相吻合。多糖提取率的变化速率显示酶解时间主效应大于酶解温度。
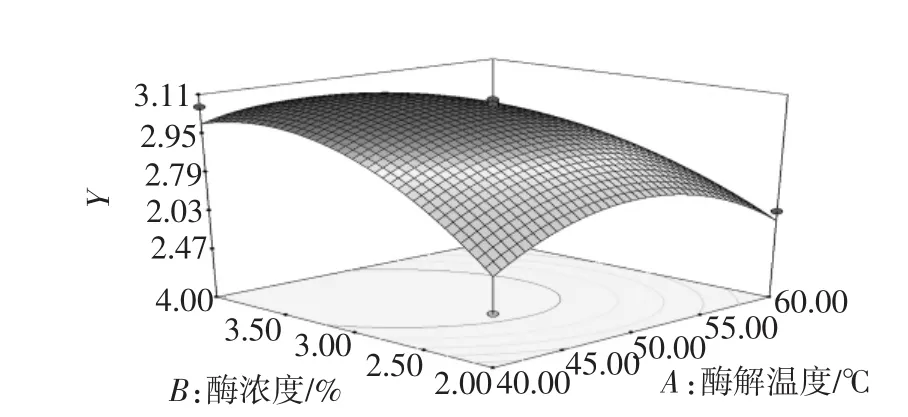
图6 酶浓度和温度对多糖提取率的响应面图Fig.6 Response surface plot of enzyme concentration and temperaturevs extraction yield of polysaccharides
在试验范围内,酶解温度不变,随着酶浓度的增加,蒲公英多糖提取率增加到最大值后有所下降;酶浓度一定,随酶解时间增加,多糖提取率逐渐增大之后下降。这与单因素试验分析结果亦吻合。可见,多糖提取率的变化速率显示酶浓度主效应大于酶解温度,与统计结果相符。
在试验范围内,酶解温度不变,随着pH的增加,多糖提取率增加到最大值然后有所下降;pH不变,酶解温度增加,多糖提取率逐渐增大然后下降。这与单因素试验结果相一致。多糖提取率的变化速率显示酶解温度主效应大于pH,与统计结果一致。
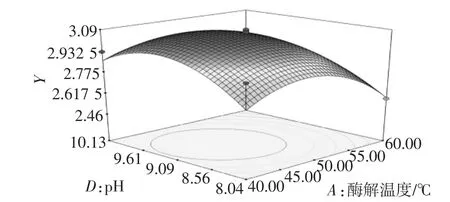
图7 pH和温度对多糖提取率的响应面图Fig.7 Response surface plot of pH and temperaturevs extraction yield of polysaccharides

图8 酶浓度和时间对多糖提取率的响应面图Fig.8 Response surface plot of enzyme concentration and time vs extraction yield of polysaccharides
在试验范围内,酶解时间不变,随着酶浓度的增加,多糖提取率增加到最大值然后有所下降;酶浓度不变,酶解时间增加,多糖提取率逐渐增大然后下降;与单因素实验结果相吻合。多糖提取率的变化速率显示酶浓度主效应大于酶解时间,与统计分析相符。
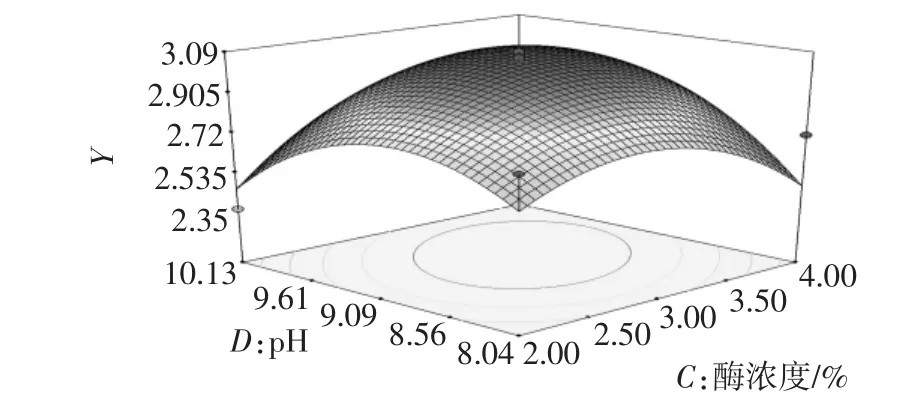
图9 pH和时间对多糖提取率的响应面图Fig.9 Response surface plot of pH and time vs extraction yield of polysaccharides

图10 pH和酶浓度对多糖提取率的响应面图Fig.10 Response surface plot of pH and enzyme concentration vs extraction yield of polysaccharides
在试验范围内,酶解时间不变,随着pH的增加,多糖提取率增加到最大值然后有所下降;pH不变,酶解时间增加,多糖提取率逐渐增大然后下降。这与单因素试验分析结果一致。多糖提取率的变化速率显示酶解时间主效应大于pH,与统计结果相符。
在试验范围内,酶浓度不变,随pH的增加,多糖提取率增加到最大值然后有所下降;pH不变,酶浓度增加,多糖提取率逐渐增大然后下降。与单因素试验分析相吻合。多糖提取率的变化速率显示酶浓度主效应大于pH,与统计结果相符。
3.2.4最优工艺条件求取
为进一步确定最佳点值,对所得回归方程取一阶偏导为零,得到曲面的最大点,求导方程整理为:
-22-80A+3B-19C-7D=0
38+15A-320B-65C+100D=0
94-95A-65B-360C+52D=0
32-35A+100B+52C-320D=0
求解方程组得:A=-0.378 5;B=0.089;C= 0.374 5;D= 0.204 5。最后求得酶解温度、酶解时间、酶浓度、pH分别为:a = 46.18℃,b=123min,c=3.38 %,d=9.20。此时蒲公英多糖的最大提取率为3.11 %。对提取条件进行中心组合设计优化,最佳提取工艺参数为:酶解温度46.18℃、酶解时间123min,酶浓度3.38 %,pH= 9.2,此时多糖提取率理论值可达到3.07 %。验证试验表明,多糖提取率为3.11 %。
3.3酶解法与常规水煮法的对比试验
在前面试验基础上确定了酶解法最优工艺,利用这些确定的参数与常规水煮法进行对比试验。
准确称取0.5 g蒲公英粉3份,分别置于100 mL锥形瓶中,然后加入蒸馏水50 mL,分别提取8 h,然后离心,合并上清液,并将上清液稀释25倍,进行吸光度检测。试验结果见表4。
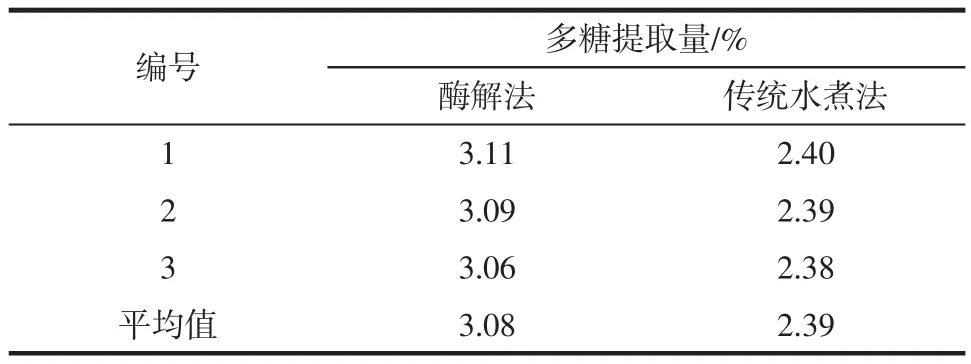
表4 两种方法的多糖提取结果对比Table 4 Contrast of the extraction yield of Herba Taraxaci polysaccharides between two ways of extraction
由表4可知,酶解提取蒲公英中的多糖,其提取率远远优于传统水解提取法。这与酶解对蒲公英细胞的破坏是均匀的,多糖较易溶出有关;而传统水煮提取法尽管耗时很长(8 h),但细胞结构没有遭到破坏,故而提取率较低。
4 结论
1)采用酶解法提取蒲公英多糖的提取率可达3.11%。
2)基于单因素试验得到的较优工艺条件:pH为9.00,酶解温度为50℃,酶解时间为120min,酶含量为3 %(酶质量/蒲公英质量)。
3)在单因素试验的基础上,酶解温度、酶解时间、pH和酶含量选取4个因素进行中心组合设计,使用Design Expert 7.0.0软件进行数据拟合,建立了酶解提取蒲公英中多糖的工艺数学模型Y=+3.07-0.11A+ 0.038B+0.094C+0.032D+0.015AB-0.095AC-0.035AD-0.065BC +0.10BD +0.052CD -0.20A2-0.16B2-0.18C2-0.18D2。回归分析表明该模型稳定性较好;通过模型系数显著性检验,得到因素的主效应关系为:酶浓度>酶解时间>酶解温度>pH值。
4)由响应面法得到的模型进行探讨,蒲公英中多糖的酶解提取过程优化工艺:pH为9.2,酶解温度为46.18℃,酶解时间为123min,酶含量为3.38 %(酶质量/蒲公英质量),在该优化条件下,提取率为3.11 %。验证试验表明,蒲公英多糖的提取率为3.08 %,与理论值相符。因此,响应面法优化工艺获得的蒲公英多糖的酶解提取条件,数据准确,科学可行。
5)酶解法与常规水煮提取法的对比试验表明,采用酶解法提取工艺提取蒲公英中的多糖,提取率高于常规水煮提取工艺。
参考文献:
[1]钟振声,赵蓓蓓,孙昂.蒲公英抑菌物质的提取工艺研究[J].现代食品科技,2009,25(1):58
[2]许春平,杨琛琛,郑坚强,等.植物叶多糖的提取和生物活性综述[J].食品研究与开发,2014,35(14):111-114
[3]宋晓勇,刘强,杨磊,等.蒲公英多糖提取工艺及抗菌活性研究[J].中国药房,2010,21(47):4453-4454
[4]童洋,肖国民,潘晓梅.响应面法优化螺旋藻中叶绿素的超声提取工艺[J].化工学报,2009,60(11):2813-2818
[5]李娜,杨晓杰,李旭业,等.植物多糖提取技术研究[J].高师理科学刊,2012,32(2):87
[6] Shi S Y,Zhao Y,Zhou H H,et al.Identification of antioxidants from Taraxacum mongolicum by high-performance liquid chromatography-diode array detection -radicalscavenging detection -electrospray ionization mass spectrometry and nuclear magnetic resonance experiments[J].J Chromatogr A,2008,1209(1/2):145
[7]魏军青,肖春玲,陆楠,等.酶解法提取黑豆多糖的研究[J].陕西农业科学,2013(1):6-10
[8]刘洋,李克剑,詹冬玲,等.木瓜蛋白酶辅助提取大蒜水溶性粗多糖的工艺[J].食品研究与开发,2013,34(20):26-29
[9]孟志芬,祝勇,张怀.木瓜蛋白酶酶解法提取大枣多糖的工艺研究[J].河南科技学院学报(自然科学版)2006,34(3):49-50
[10]徐鹤桐,陈野.基于响应面法提取花生蛋白工艺优化[J].食品研究与开发,2015,36(9):30-33,64
来稿要求及注意事项
1.来稿务求论点鲜明、论据可靠、数据准确、文字精炼,引用资料请提供文献。文章不得超过10 000字,一般请掌握在6 000字左右。来稿的文题、作者姓名、单位名称以及文章摘要、关键词(3~8个)、图表名称均需附英文译文。
2.凡逻辑性强、具有前瞻性首创性的科技论文、获得相关奖励的论文及国家级、省部级资助项目的研究报告、论文,来稿请注明批准号,并同时将批文(或合同书)、奖励证书的复印件邮寄给本刊(注明文章题目和第一作者),本刊将优先刊登。
3.本刊原则上只介绍第一作者。来稿请在文章首页下脚注明第一作者简介,格式为:姓名(出生年—),性别(民族),职称,学位,研究方向(即专业)。若需要介绍通信作者,请用*注明,且介绍内容宜在20个字以内。
详见中国天津食品网
(www.tjfood.com.cn)
Optimization of Extraction Technology of Polysaccharides from Herba Taraxaci by Enzymatic Hydrolysis
XU Lan1,WANGming-hua1,QU Juan-juan1,AN Wei2
(1.Department of Biology,Xinzhou Teachers University,Xinzhou 034000,Shanxi,China;2.Maize Research Institute,Shanxi Academy of Agricultural Sciences,Xinzhou 034000,Shanxi,China)
Abstract:To optimize the extraction technology of polysaccharides from Herba Taraxaci,contrast experiment were carried out.The single factor experiment and Box-Behnken experiment were designed to study the effects of the pH,enzymolysis time,enzyme solution temperature,enzyme concentration on the extraction yield by enzymatic hydrolysis .On the basis of the type selection of enzyme,the optimum parameters of Herba Taraxaci polysaccharide extraction yield was determined.Results analysis of variance showed that enzyme concentration could have a greater impact on the extraction rate of polysaccharides,then was enzymolysis time and enzyme solution temperature,the last was the pH.The extraction yield by papaya protease was the highest(3.11 %);The optimal conditions of extraction by enzymatic hydrolysis were:pH 9.20,enzyme solution temperature 46.18℃,enzymolysis time 123min,enzyme content 3.38 %(enzyme quality/quality of dandelion).
Key words:Herba Taraxaci;polysaccharides;enzymatic hydrolysis;response surface methodology
DOI:10.3969/j.issn.1005-6521.2016.05.012
基金项目:公益性行业(农业)科研专项经费(201503124);忻州师范学院大学生科技创新项目(自然科学类201428);忻州师范学院青年基金项目(201208)
作者简介:徐澜(1975—),女(汉),副教授,博士,从事植物有效成分提取;旱作栽培与农业生态研究等。
收稿日期:2015-09-06

