我国白酒蒸馏过程及原酒、成品酒中乙醛的研究
朱梦旭,范文来,徐岩
(教育部工业生物技术重点实验室,江南大学 生物工程学院酿造微生物与应用酶学研究室,江苏 无锡,214122)
我国白酒蒸馏过程及原酒、成品酒中乙醛的研究
朱梦旭,范文来*,徐岩
(教育部工业生物技术重点实验室,江南大学 生物工程学院酿造微生物与应用酶学研究室,江苏 无锡,214122)
摘要乙醛广泛存在于酒精饮料中,被国际癌症研究机构(IARC)确认为Ⅰ类致癌物(对人类致癌证据充分)。利用气相色谱-氢火焰离子化检测(GC-FID)技术检测我国馏分酒、原酒和成品白酒中乙醛,发现白酒固态蒸馏和液态二次蒸馏过程中乙醛和乙缩醛很快被馏出,含量较集中于前几个馏分,随着蒸馏进行,含量逐渐减少。原酒中乙醛质量浓度在45.10~763.93 mg/L,乙缩醛的质量浓度在61.50~2 871.52 mg/L,乙缩醛和乙醛的比例在2.26∶1~2.87∶1。成品白酒中乙醛质量浓度42.36~491.70 mg/L,乙缩醛的质量浓度在68.54~811.32 mg/L,乙缩醛和乙醛的比例在1.24∶1~1.96∶1,且成品白酒乙醛的平均质量浓度(173.24 mg/L)高于其他国家蒸馏酒中乙醛的质量浓度(≤86 mg/L)。我国成品白酒中乙醛的暴露边界(margin of exposure,MOE)值为622,因此白酒中乙醛对人类健康的潜在危害应给予较高关注。
关键词乙醛;乙缩醛;蒸馏;原酒;成品酒;暴露边界
乙醛(acetaldehyde),分子量44[1],沸点20.1 ℃[1],易溶于水和乙醇[1],有基因毒性和致癌性[2],广泛存在于啤酒[3]、葡萄酒[4]、白酒[5-6]、水果蒸馏酒[6]、龙舌兰酒[6]、伏特加[4]、威士忌[4]和白兰地[2]等酒精饮料中。1999年,乙醛被国际癌症研究署(International Agency for Research on Cancer,IARC)确认为2B类致癌物,即可能对人类致癌[1]。2009年乙醛被列为Ⅰ类致癌物,即对人类致癌证据充分[7]。我国尚未制定蒸馏酒中乙醛的限量标准。
乙醛浓度低时有水果香,浓度高会产生辛辣的刺激性气味[8]。酒精饮料中的乙醛可能是酵母、醋酸菌产生的、也可能是乙醇和酚类化合物氧化产生的[9]。乙醛在酸性条件下易于乙醇反应生成乙缩醛[10](即结合态的乙醛)。乙醛与乙缩醛在白酒中比例关系及其含量.在一定程度上可以衡量白酒质量好坏及老熟是否完全[11]。关于醛的研究较多集中于游离态的醛,而结合态醛类能在体内代谢为游离态的醛[12],因此研究乙醛应该同时检测乙缩醛的含量。目前,我国对白酒中乙醛研究主要包括白酒中乙醛检测[5]、贮存[13]及蒸馏过程乙醛的变化[14],而乙醛在二次蒸馏过程中的变化尚未见报道,也未对白酒中乙醛进行风险评估。近年来,欧洲食品安全局(European Food Safety Authority,EFSA)提出使用暴露边界(margin of exposure,MOE)进行有害化合物的暴露风险评估[15]。
本研究采用GC-FID技术检测白酒中的乙醛和乙缩醛,揭示了固态蒸馏过程和液态二次蒸馏过程中乙醛和乙缩醛的馏出规律,检测了多香型原酒和成品酒中乙醛和乙缩醛浓度,为进一步控制我国白酒中乙醛浓度奠定了基础。并用MOE法评估我国原酒及成品白酒中的乙醛,更加客观地估计我国白酒中乙醛的暴露风险,为市场监管以及政策制定提供理论依据,同时也为其他化合物的暴露风险评估提供参考。
1材料和方法
1.1材料和仪器
酒样:浓香型(Ⅰ)厂原酒(59.8%~73%vol)、成品酒(38%~52%vol),浓香型(Ⅱ)厂原酒(62.6%~74.8%vol)、成品酒(45%~52%vol),浓香型(Ⅲ)厂原酒(64%~66%vol)、成品酒(50%vol),浓香型(Ⅳ)厂原酒(63%~72%vol)、成品酒(46%~54%vol),浓香型(Ⅴ)厂原酒(60.2%~71.4%vol)、成品酒(42%~52%vol);酱香型原酒(52%~57%vol)、成品酒(均为53%);清香型(Ⅰ)厂原酒(65%vol)、成品酒(48%~53%vol),清香型(Ⅱ)厂原酒(70%~74.6%vol)、成品酒(45%~53%vol),清香型(Ⅲ)厂原酒(49.4%~68.7%vol)、成品酒(52%vol);豉香型原酒(29.5%~30%vol)、成品酒(29.5%~53%vol);凤香型原酒(62%~67%vol)、成品酒(45%~52%vol);芝麻香型原酒(33.3%~65.8%vol)、成品酒(46%~52%vol);老白干香型原酒(58.7%~67%vol)、成品酒(43%~67%vol);特香型原酒(51%~62%vol)、成品酒(45%vol);固态蒸馏分段酒样,这些酒由相应的生产企业提供。
试剂:乙醇和乙醛:色谱纯,Sigma-Aldrich公司;乙缩醛和辛醛- d16:色谱纯,上海安谱科学仪器公司;Milli-Q超纯水(实验用水均为煮沸并冷却至室温的超纯水)。
仪器:铜制壶式蒸馏器(7.5 L),葡萄牙公司Iberian Coppers S. A.;电子万用炉220 V/2 kW,楚水电热电器厂;气相色谱仪GC-6890 N,美国Agilent公司;Milli-Q超纯水系统,美国Milipore公司;超声波清洗仪,天津Autosciennce公司。
1.2实验方法
1.2.1固态蒸馏分段酒样
某酒厂采用传统工艺的小曲酒串蒸大曲香醅,通过串蒸而得到的馏出酒样,每隔4 min分段摘酒,取样1次,每次取样量200 mL。
1.2.2二次蒸馏酒样
壶式蒸馏:参照文献方法[16],4.5 L低度酒(原酒加超纯水稀释至酒精度为28%vol)装入7.5 L铜壶,连接好鹅颈管和冷凝器。常温自来水冷凝,电子万用炉加热,每次接酒100 mL。
1.2.3GC-FID检测乙醛和乙缩醛
用60%vol乙醇水溶液配制体积分数均为0.02%的乙醛溶液和内标辛醛- d16,待色谱仪基线稳定后,进样1 μL。记录乙醛和内标峰的保留时间及峰面积,用其比值计算出乙醛的相对校正因子。酒样(成品酒和酒精度低于60%vol的原酒不稀释、酒精度高于60%vol的原酒稀释至60%vol)中加入内标辛醛- d16(体积分数0.02%),混匀后取1 μL进行GC-FID分析。色谱柱:CP-Wax 57 CB(50 m×0.25 mm×0.2 μm);进样口和检测器温度均为250 ℃;载气为高纯氮,流速1 mL/min,分流比为37∶1,尾吹20 mL/min;氢气流速40 mL/min;空气流速400 mL/min;升温程序为:60 ℃保持3 min,以5 ℃/min升温至118 ℃,再以15 ℃/min升温至210 ℃并保持5 min。根据待测化合物保留时间和校正因子的计算浓度。
1.2.4乙醛浓度计算公式
(1)
(2)
式中:f,乙醛(或乙缩醛)的校正因子;A1,标样f值测定时内标的峰面积;A2,标样f值测定时乙醛(或乙缩醛)的峰面积;d2,乙醛(或乙缩醛)的相对密度;d1,内标辛醛-d16的相对密度。X,样品中乙醛(或乙缩醛)的质量浓度,mg/L;A3,样品中乙醛(或乙缩醛)的峰面积;A4,添加于酒样中内标的峰面积;I,内标物的质量浓度(添加在酒样中),mg/L。
1.2.5MOE的计算公式
基准剂量(benchmark dose,BMD)为某种反应增加到某一特定水平(通常在1%~10%)时相应的剂量[18]。暴露边界的定义为动物实验得到的基准剂量下限值(lower limit of benchmarkdose,BMDL)与每人每天暴露量(Exposure,EXP)的比值[2]。

(3)
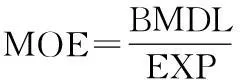
(4)
式中:C,白酒中乙醛质量浓度,mg/L;V,人均饮酒量,L/d;BW,人均体重,60 kg;MOE,暴露边界;BMDL,基准剂量下限值,mg/(kg体重·d);EXP,人均暴露量,mg/(kg体重·d)。
2结果与讨论
2.1白酒中乙醛和乙缩醛的定量
白酒中乙醛含量高,可以用GC-FID检测乙醛。在酒样加入内标辛醛-d16(体积分数0.02%),混匀后直接进样,白酒样品的GC-FID色谱图见图1。根据乙醛和乙缩醛的保留时间和校正因子的计算浓度。向白酒样品中添加相近浓度的乙醛和乙缩醛标准品,测得回收率和相对标准偏差(RSD)见表1,表现出较好的准确性与精确性。
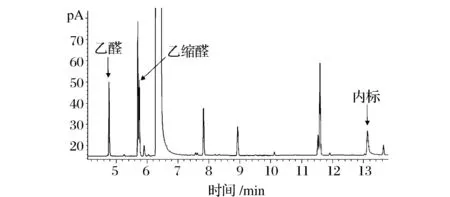
图1 白酒GC-FID色谱图Fig.1 GC-FID chromatogram of Chinese liquor
2.2白酒蒸馏过程中乙醛和乙缩醛的变化
2.2.1白酒固态蒸馏过程乙醛和乙缩醛的变化
图2描述了某酒蒸馏过程中乙醛和乙缩醛的质量浓度变化。蒸馏刚开始时酒精度为77.5%vol,酒中乙醛和乙缩醛质量浓度分别为2 044.81 mg/L和9 386.81 mg/L;在蒸馏的2~14 min内,酒精度缓慢下降至74.2%vol,乙醛和乙缩醛质量浓度迅速降低至126.71 mg/L和473.93 mg/L;14 min至蒸馏结束,酒精度继续下降至0%vol,乙醛和乙缩醛波动减少,蒸馏结束时乙醛和乙缩醛质量浓度分别为33.13 mg/L和0 mg/L。
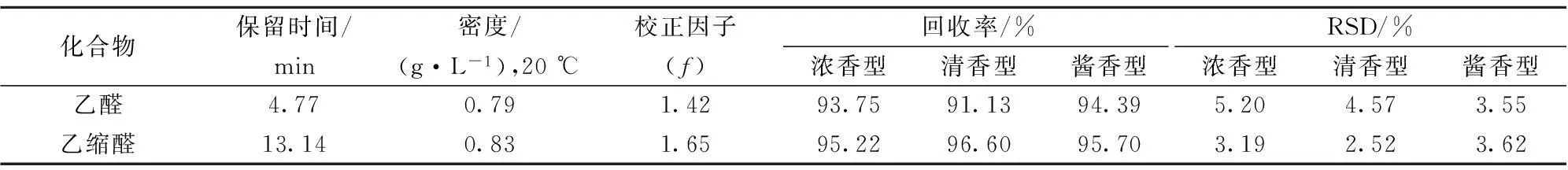
表1 采用GC-FID定量乙醛和乙缩醛的相关参数
由于乙醛沸点低(20.8 ℃),大部分的乙醛在蒸馏前期被馏出。乙缩醛醇溶性较高,蒸馏规律与乙醛相似,即蒸馏过程中乙醛和乙缩醛很快被馏出,且含量较集中于前几个馏分,随着蒸馏进行,含量逐渐减少。乙醛和乙缩醛的馏出规律均为:酒头>酒身>酒尾。可见,传统白酒摘酒过程中“掐头”[19]的工艺能有效控制白酒中乙醛的质量浓度。

图2 白酒蒸馏过程中乙醛和乙缩醛浓度变化Fig.2 Changes of acetaldehyde and acetal in fresh distillate during distillation
2.2.2白酒二次蒸馏过程中乙醛和乙缩醛变化
原酒壶式二次蒸馏(图3)与固态蒸馏过程乙醛和乙缩醛的变化略有不同,但下降趋势相似。二次蒸馏刚开始(4 min)时乙醛和乙缩醛被馏出,浓度分别为1 772.64 mg/L和298.57 mg/L;在蒸馏的4~33 min内酒精度由74.2%vol下降至60.6%vol,乙醛和乙缩醛质量浓度也降低至51.02 mg/L和3.42 mg/L;33 min至蒸馏结束,酒精度降至0%vol,乙醛和乙缩醛质量浓度波动减少,蒸馏结束时质量浓度分别为3.46 mg/L和0 mg/L。总之,蒸馏过程中乙醛和乙缩醛很快被馏出,且含量较集中于前几个馏分(酒精度高于60%vol[20],随着蒸馏进行,含量逐渐减少。
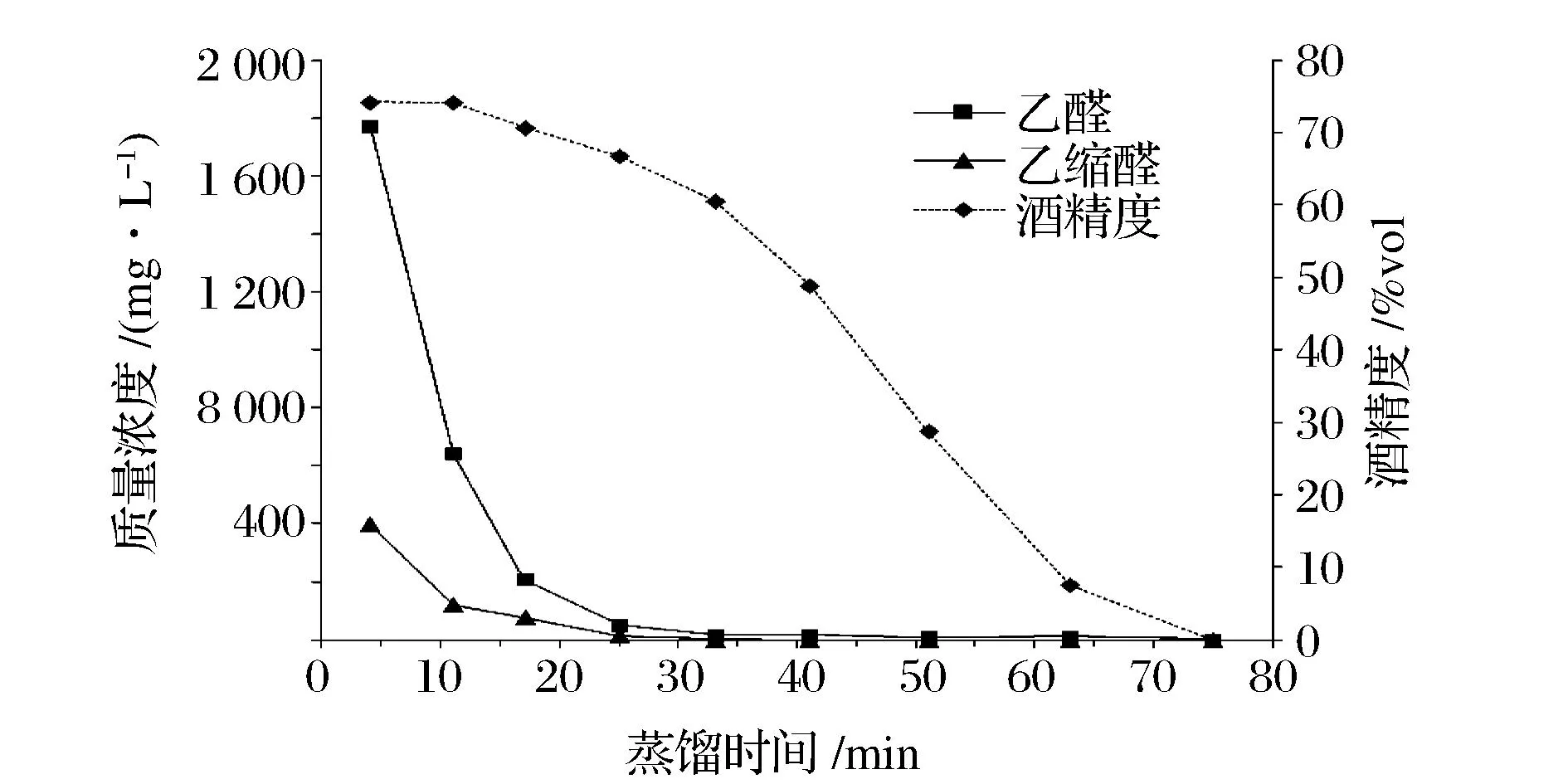
图3 原酒二次蒸馏过程中乙醛和乙缩醛浓度变化Fig.3 Changes of acetaldehyde and acetal in raw liquor during second distillation
取装液量的1.5%体积(67.5 mL)的初馏液作为酒头,酒头之后到馏分酒精度接近60%vol部分作为酒身,酒身之后到馏分酒精度接近0%vol部分作为酒尾,壶中未蒸出的为残液[16]。二次蒸馏出的各馏分中乙醛和乙缩醛的浓度和质量见表2,二次蒸馏乙醛的馏出规律为酒头(1 772.59 mg/L)>酒身(423.06 mg/L)>酒尾(11.21 mg/L)。二次蒸馏中乙醛质量比蒸馏前(335.44 mg)增加了0.99倍,乙缩醛质量比蒸馏前(585.90 mg)减少了2.97倍。推测在二次蒸馏过程中,乙缩醛可能在酸的作用下水解,生成了乙醛[10]。

表2 原酒二次蒸馏中各馏分的乙醛和乙缩醛浓度和质量
注:a:二次蒸馏酒头、酒身、酒尾和残液的乙醛质量之和;b:二次蒸馏酒头、酒身、酒尾和残液的乙缩醛质量之和。
2.3白酒中乙醛的分析
2.3.1不同香型原酒的乙醛
对多种香型原酒的乙醛和乙缩醛进行定量分析,包括浓香型、酱香型、清香型、豉香型、凤香型、芝麻香型、老白干香型、特香型原酒,结果见表3。
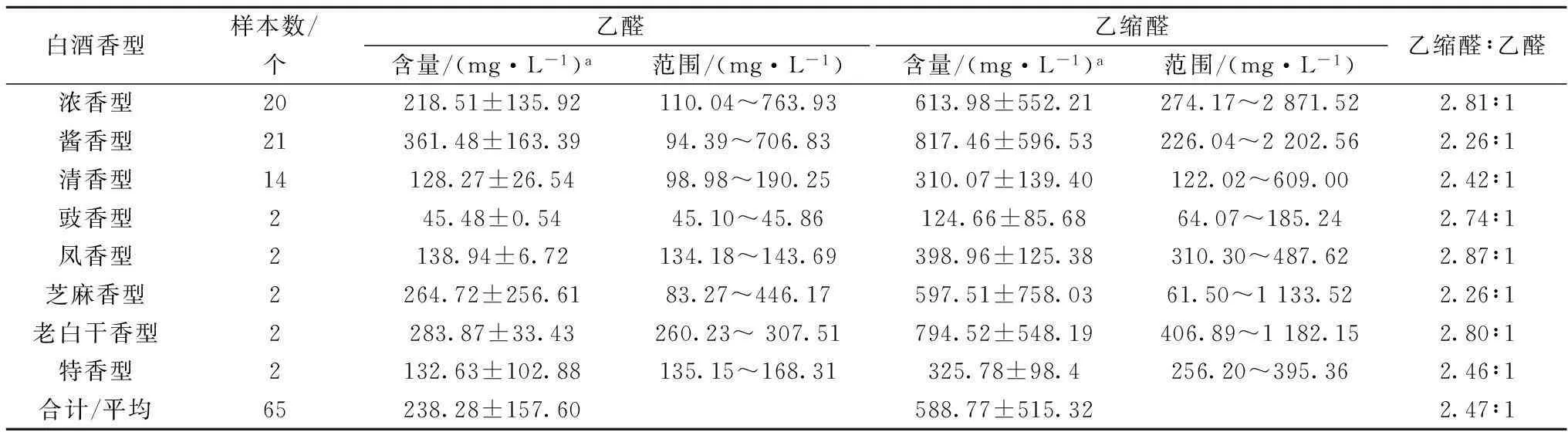
表3 不同香型原酒中乙醛和乙缩醛质量浓度
注:a:平均浓度±标准偏差。
不同香型原酒中乙醛浓度差别较大,酱香型原酒乙醛浓度最高(361.48 mg/L),老白干香型(283.87 mg/L)、芝麻香型(264.72 mg/L)和浓香型(218.51 mg/L)次之,其次是凤香型(138.94 mg/L)、特香型(132.63 mg/L)、清香型(128.27 mg/L),豉香型原酒(45.48 mg/L)乙醛含量最少。原酒中乙缩醛的质量浓度在61.50~2 871.52 mg/L。乙醛与乙缩醛在白酒中比例关系及其含量在一定程度上可以衡量白酒质量好坏及老熟是否完全。从表3看出,原酒中乙缩醛和乙醛的比例在2.26∶1~2.87∶1。
2.3.2不同香型成品酒中的乙醛
对多种香型的成品酒的乙醛和乙缩醛含量进行分析,包括浓香型、清香型、酱香型、豉香型、凤香型、芝麻香型、老白干香型和特香型原酒,结果见表4。
其中芝麻香型成品酒乙醛浓度最高(247.56 mg/L),酱香型成品酒(235.96 mg/L)次之,其次是凤香型(214.56 mg/L)、浓香型(197.46 mg/L)、老白干香型(196.39 mg/L)、特香型(151.73 mg/L)和清香型(123.87 mg/L),豉香型成品酒(71.07 mg/L)乙醛浓度最少。与其他国家的蒸馏酒相比,我国成品白酒乙醛的平均含量(173.24 mg/L)高于伏特加(3 mg/L)、朗姆酒(18 mg/L)、威士忌(28 mg/L)、白兰地(75 mg/L)、水果蒸馏酒(86 mg/L)和龙舌兰酒(60 mg/L)[6]。成品白酒中乙缩醛的浓度在68.54 mg/L~811.32 mg/L。成品白酒中乙缩醛和乙醛的比例在1.24∶1~1.96∶1。

表4 不同香型成品酒中乙醛和乙缩醛质量浓度
注:a:平均浓度±标准偏差 。
2.3.3乙醛和乙缩醛相关性分析
为了检验乙醛和乙缩醛的相关性,将101个样本做SPSS双变量分析,结果见表5,说明乙醛和乙缩醛在0.01水平(双侧)上显著相关。乙醛和乙缩醛线性拟合结果见图3,R2为0.747 4,说明乙醛和乙缩醛相关性较好。乙醛在酸性条件下易于乙醇反应生成乙缩醛(即结合态的乙醛)。结合态醛类能在体内代谢为游离态的醛,因此研究乙醛应该同时检测乙缩醛的含量。
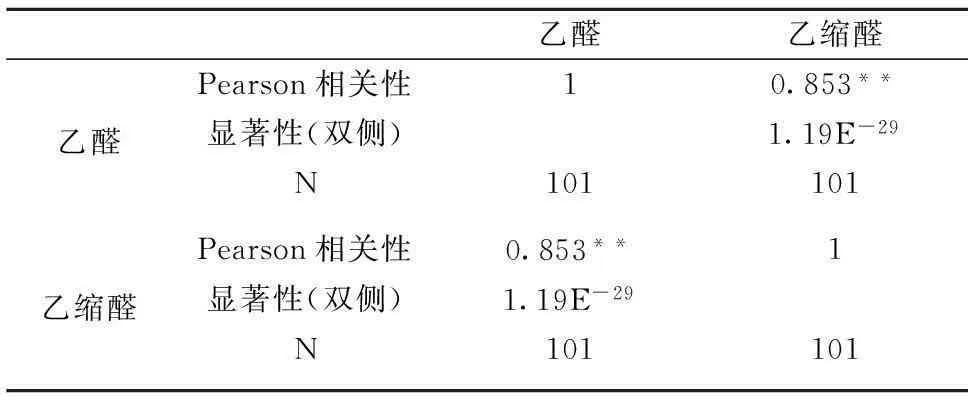
表5 乙醛和乙缩醛相关性
注:**,在0.01 水平(双侧)上显著相关。
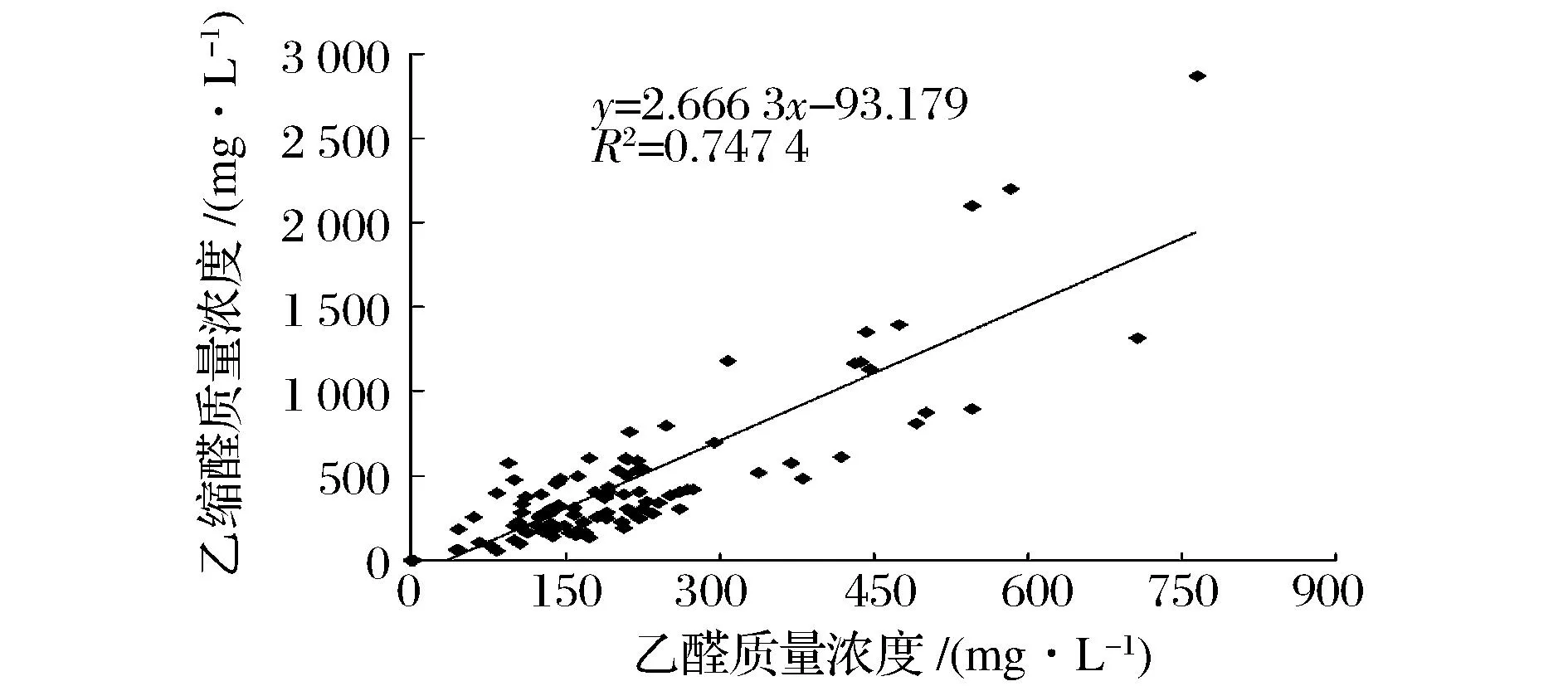
图4 乙醛和乙缩醛相关性Fig.4 Correlations of acetaldehyde and acetal
2.3.4白酒中乙醛的暴露风险评估
本研究不考虑体内乙醇代谢产生的乙醛和乙醛的其他摄入途径。
动物实验得到乙醛的基准剂量95%下限值(the Benchmark Dose Lower Confidence Limit,BMDL)为56 mg/kg体重/d[2]。2013年,我国人均饮酒量0.03 L/d[21]。我国原酒及成品酒中乙醛的保留边界值见表6。基于动物实验数据,当MOE值低于10 000时,有较大的致癌风险,且MOE越小,致癌风险越大[22]。在不考虑其它乙醛摄入途径的情况下,我国成品白酒中乙醛的MOE值为622,大于葡萄酒的MOE值368[4],小于啤酒的MOE值2614[4]。鉴于我国成品白酒中乙醛的MOE值小于10 000,说明诱发动物的致癌剂量与人的可能最大暴露量检差距不大[22],因此白酒中乙醛对人类健康的潜在危害应给予较高关注。且考虑到综合摄入以及国外蒸馏酒中乙醛较低这一现状,有必要降低白酒中乙醛的含量,并制定限量标准。
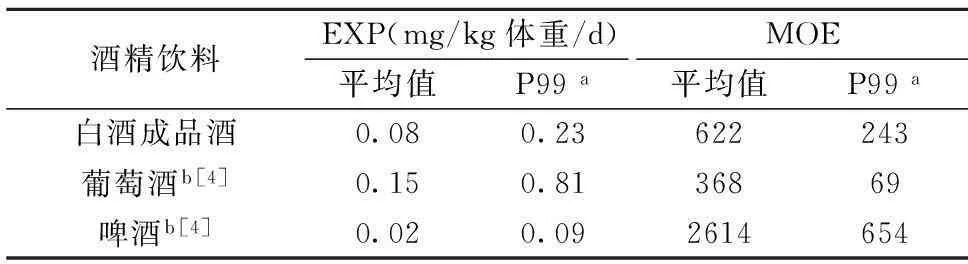
表6 乙醛在酒精饮料中的暴露边界值
注:a:P99指第99百分数时的值;b:数据分别为意大利消费者饮用葡萄酒和啤酒的人均乙醛暴露量和暴露边界。
3结论
采用GC-FID技术检测白酒中的乙醛,能满足白酒中乙醛定量分析要求。白酒固态蒸馏和液态二次蒸馏中乙醛和乙缩醛很快被馏出,且含量较集中于前几个馏分,随着蒸馏进行,含量逐渐减少,且二次蒸馏中乙醛质量比蒸馏前(335.44 mg)增加了0.99倍,乙缩醛质量比蒸馏前(585.90 mg)减少了2.97倍,乙缩醛可能在酸的作用下水解,生成了乙醛。
不同香型原酒中乙醛的平均含量顺序为:酱香型>老白干香型>芝麻香型>浓香型>凤香型>特香型>清香型>豉香型,乙缩醛的浓度在61.50 mg/L~2 871.52 mg/L,乙缩醛和乙醛的比例在2.26∶1~2.87∶1。不同香型成品酒乙醛的平均含量顺序为:芝麻香型>酱香型>凤香型>浓香型>老白干香型>特香型>清香型>豉香型,乙缩醛的浓度在68.54 mg/L~811.32 mg/L,乙缩醛和乙醛的比例在1.24∶1~1.96∶1。且我国成品白酒乙醛的平均质量浓度(173.24 mg/L)高于其他国家蒸馏酒中乙醛的浓度(≤86 mg/L)。我国成品白酒中乙醛的MOE值为622,小于10 000,因此白酒中乙醛对人类健康的潜在危害应给予较高关注。且考虑到综合摄入以及国外蒸馏酒中乙醛较低这一现状,有必要降低白酒中乙醛的含量,并制定限量标准。
参考文献
[1]IARC. Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide[J]. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, 1999,71:319-335.
[2]LACHENMEIER D W, KANTERES F, REHM J.Carcinogenicity of acetaldehyde in alcoholic beverages: risk assessment outside ethanol metabolism[J]. Addiction, 2009, 104(4): 533-550.
[3]GONCALVES L M, MAGALHAES P J, VALENTE I M, et al. Analysis of aldehydes in beer by gas-diffusion microextraction: characterization by high-performance liquid chromatography-diode-array detection-atmospheric pressure chemical ionization-mass spectrometry[J]. Journal of Chromatography A, 2010, 1 217(24): 3 717-3 722.
[4]PAIANO V, BIANCHI G, DAVOLI E, et al. Risk assessment for the Italian population of acetaldehyde in alcoholic and non-alcoholic beverages[J]. Food Chemistry, 2014, 154: 26-31.
[5]熊绪杰, 叶发兵, 黄春保. 1, 3, 5, 7-四甲基-8-丙酰肼-二氟化硼-二吡咯甲烷柱前衍生高效液相色谱测定白酒中的脂肪醛[J]. 分析测试学报, 2011, 30(4): 401-406.
[6]LACHENMEIER D W, SOHNIUS E M. The role of acetaldehyde outside ethanol metabolism in the carcinogenicity of alcoholic beverages: evidence from a large chemical survey[J]. Food and chemical toxicology, 2008, 46(8): 2 903-2 911.
[7]SECRETAN B, STRAIF K, BAAN R, et al. A review of human carcinogens—Part E: tobacco, areca nut, alcohol, coal smoke, and salted fish[J]. The Lancet Oncology, 2009, 10(11): 1 033-1 034.
[8]MIYAKE T, SHIBAMOTO T. Quantitative analysis of acetaldehyde in foods and beverages[J]. J Agric Food Chem, 1993, 41(11): 1 968-1 970.
[9]LIU S Q, PILONE G J. An overview of formation and roles of acetaldehyde in winemaking with emphasis on microbiological implications[J]. International Journal of Food Science and Technology, 2000, 35(1): 49-61.
[10]范文来, 徐岩. 酒类风味化学[M]. 北京: 中国轻工业出版社, 2014.
[11]李大和, 李国红. 新型白酒生产与勾调技术问答[M]. 北京: 中国轻工业出版社, 2001.
[12]http://www.inchem.org/documents/jecfa/jecmono/v48je17.htm[OL]
[13]黄跃勇, 张国强. 新蒸馏白酒贮存过程中乙醛和乙缩醛的变化[J]. 酿酒, 2009, 36(3): 25-26.
[14]张志刚, 吴生文, 赖明霞, 等 特香型酒在蒸馏过程中微量成分分布规律初探[J]. 中国酿造, 2010, 29(9): 143-145.
[15]EFSA. Opinion of the Scientific Committee on a request from EFSA related to a harmonised approach for risk assessment of substances which are both genotoxic and carcinogenic[J]. The EFSA Journal, 2005, 282: 1-31.
[16]吴晨岑, 范文来, 徐岩. 不同二次蒸馏方式对浓香型白酒品质影响的研究[J]. 食品与发酵工业, 2015, 41(3): 14-19.
[17]郭新光, 康永璞, 卢中明. GB/T 10345—2007, 白酒分析方法[S]. 北京: 中国标准出版社, 2007.
[18]MURI S D, SCHLATTER J R, BRÜSCHWEILER B J. The benchmark dose approach in food risk assessment: Is it applicable and worthwhile?[J]. Food and Chemical Toxicology, 2009, 47(12): 2 906-2 925.
[19]沈怡方. 白酒生产技术全书[M]. 北京: 中国轻工业出版社, 1998.
[20]ZHAO Yu-ping, TIAN Tian-tian, LI Ji-ming, et al. Variations in main flavor compounds of freshly distilled brandy during the second distillation[J]. International Journal of Food Engineering, 2014, 10(4): 809-820.
[21]范文来, 徐岩, 黄永光. 白酒对健康有益还是有害?[J]. 酿酒科技, 2014(11): 1-5.
[22]LACHENMEIER D W, PRZYBYLSKI M C, REHM J. Comparative risk assessment of carcinogens in alcoholic beverages using the margin of exposure approach[J]. International Journal of Cancer, 2012, 131(6): 995-1 003.
Research on acetaldehyde from distillation cut, raw liquor, finished liquor
ZHU Meng-xu, FAN Wen-lai*, XU Yan
(Key Laboratory of Industrial Biotechnology, Ministry of Education, Laboratory of Brewing Microbiology and Applied Enzymology, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
ABSTRACTAcetaldehyde, which widely exists in alcoholic beverages, is classified as group 1 carcinogen (sufficient evidence of carcinogenicity) by International Agency for Research on Cancer (IARC). In this paper, acetaldehyde from distillation cut,raw liquor, and Chinese finished liquor was quantified by gas chromatography-flame ionization detector(GC-FID). During solid distillation process, acetaldehyde and acetal had higher values at the beginning of the distillation, but declined sharply along with the distillation process, which was similar to the second distillation of raw liquor. The acetaldehyde (45.10~763.93 mg/L) and acetal concentrations (61.50~2 871.52 mg/L) were detected in raw liquor, and the concentration ratio of acetaldehyde to acetal was 2.26∶1~2.87∶1. The acetaldehyde (42.36~491.70 mg/L) and acetal concentrations (68.54~811.32 mg/L) were detected in Chinese finished liquor, and the concentration ratio of acetaldehyde to acetal was1.24∶1~1.96∶1. The average concentration of acetaldehyde in Chinese finished liquor was 173.24 mg/L, which was higher than that in other distilled spirit from different countries (≤86 mg/L). The margin of exposure(MOE)was calculated to be 622 in Chinese finished liquor. Acetaldehyde in Chinese liquor should be of great concern.
Key wordsacetaldehyde; acetal; distillation; raw liquor; finished liquor; margin of exposure(MOE)
收稿日期:2015-11-12,改回日期:2015-12-16
DOI:10.13995/j.cnki.11-1802/ts.201604002
第一作者:硕士研究生(范文来研究员为通讯作者,E-mail:Wenlai.Fan@163.com)。

