PTPN12与非小细胞肺癌放射敏感性的关系研究
胡文霞 刘志坤 张魏丽 Scott Welford 苏景伟
·临床研究与应用·
PTPN12与非小细胞肺癌放射敏感性的关系研究
胡文霞①刘志坤②张魏丽③Scott Welford④苏景伟②
摘要目的:探讨非小细胞肺癌(non-small cell lung cancer,NSCLC)组织中非受体型蛋白酪氨酸磷酸酶12(protein tyrosine phos⁃phatase non-receptor type 12,PTPN12)表达与放疗疗效的关系,评估PTPN12基因下调与H1299细胞放射敏感性的关系。方法:回顾性分析2013年9月至2014年10月河北医科大学第四医院92例接受根治性放疗的NSCLC患者的临床资料,通过免疫组织化学方法检测肿瘤组织中PTPN12的表达,并分析其与患者放疗疗效的关系。通过shRNA-PTPN12干扰质粒转染H1299细胞,利用实时定量PCR技术及Western blot技术检测PTPN12在mRNA及蛋白水平的表达。通过克隆形成实验构建细胞生存曲线,评估PTPN12基因下调对H1299细胞放射敏感性的作用。结果:PTPN12低表达患者的放疗疗效明显优于高表达者(80.0% vs. 57.1%,P=0.018)。多因素分析显示PTPN12表达是影响放疗疗效的唯一因素。构建shRNA-GFP及shRNA-PTPN12干扰质粒转染H1299细胞,获得稳定转染细胞株H1299-shGFP及H1299-shPTPN12。细胞生存曲线显示H1299-shGFP及H1299-shPTPN12细胞的D0、Dq、SF2值分别为3.02 Gy、3.41 Gy、0.94及1.81 Gy、2.40 Gy、0.72,具有显著性差异(P<0.05)。结论:PTPN12低表达与NSCLC患者的放疗疗效密切相关,而PTPN12基因下调能明显增加H1299细胞的放射敏感性。
关键词PTPN12非小细胞肺癌放疗疗效H1299细胞放射敏感性
肺癌是目前世界范围内发病率及致死率均较高的恶性肿瘤之一[1],其发病率在男性恶性肿瘤中居首位,占女性常见恶性肿瘤的第2或第3位,其中80%以上为非小细胞肺癌(non-small cell lung cancer,NSCLC)。NSCLC患者的治疗方法取决于临床分期、病变部位及合并症,其中放射治疗是重要的治疗手段之一。对于不能手术切除的Ⅱ~Ⅲ期患者,放射治疗是重要的根治性治疗方法;而对于出现远处转移的Ⅳ期患者,放射治疗亦是重要的姑息治疗手段[2]。由于肿瘤细胞类型不同以及肿瘤细胞中特定的基因异常,使其对放射治疗的反应性存在差异。因此明确NSCLC中影响放射敏感性的基因位点可以为NSCLC的靶向治疗提供依据,并能更好地评估预后、提高患者的放射敏感性。
非受体型蛋白酪氨酸磷酸酶12(protein tyrosine phosphatase non-receptor type 12,PTPN12)是蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)家族成员之一,参与调控细胞生长分化、黏附运动等[3]。近年来的研究[4-6]发现PTPN12作为抑癌基因存在于多种肿瘤中,其表达水平降低引起正常细胞恶性生长,过表达则可对细胞恶性生长有一定抑制效果。但PTPN12与肿瘤的放射敏感性的关系尚不清楚。本研究拟从组织水平探讨PTPN12在NSCLC组织中的表达及其与放疗反应性的关系,并从细胞水平分析PTPN12基因下调能否增加肺癌H1299细胞的放射敏感性。
1 材料与方法
1.1临床资料
1.1.1患者一般情况回顾性分析2013年9月至2014年10月河北医科大学第四医院接受根治性放射治疗的92例NSCLC患者临床资料。所有患者均经病理证实为NSCLC,其中鳞状细胞癌31例、腺癌48例、其他类型13例。男性55例、女性37例;中位年龄55岁(37~68岁)。所有患者按照2009年第七版TNM分期标准[7]进行分期,Ⅰ期9例(9.8%)、Ⅱ期21例(22.8%)、Ⅲ期52例(56.5%)、Ⅳ期10例(10.9%)。患者接受三维适形放疗(3-dimensional conformal radia⁃tion therapy,3-DCRT)或调强放疗(intensity-modulat⁃ed radiation therapy,IMRT),主靶区包括肺内病变及纵隔部分肿大淋巴结,放疗剂量45~70 Gy及1.8~2.0 Gy/25~35 f(中位剂量60 Gy)。其中71例患者接受了4~6周期以铂类为基础的全身序贯化疗。
1.1.2疗效评估患者放疗前后进行多次复查,按照实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)[8]对肺内病变进行疗效评估:完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)、进展(pro⁃gressive disease,PD)。同样按照上述标准评估放疗疗效,CR+PR为放射敏感、SD+PD为放射抗拒[9]。
1.1.3免疫组织化学检测所有病例组织标本均行PTPN12蛋白检测(一抗购自美国Abcam公司,1:50稀释),按照免疫组织化学SP法进行染色,同步设有阳性和阴性对照,阳性对照为试剂公司提供的强阳性标本切片,阴性对照采用正常兔血清代替一抗。同时由两位病理科高年资医师阅片。PTPN12蛋白阳性表达为细胞质中出现棕黄色颗粒。根据阳性细胞百分比(0、1:1%~25%、2:26%~50%,3:51%~75%,4:76%~100%)及细胞染色强度(0无染色;1浅棕黄色;2棕黄色;3棕褐色)进行表达系数的确定[10]。表达系数:0分为阴性;1~3分为弱阳性表达;≥4分为强阳性表达。本研究将<4分归为低表达、≥4分归为高表达。
1.2方法
1.2.1细胞系及细胞转染与筛选人非小细胞肺癌H1299细胞系由河北省肿瘤研究所惠赠。利用本研究前期工作获得的shRNA-PTPN12及shRNA-GFP慢病毒液转染处于对数期生长的H1299细胞,24 h后采用puromycin(1 μg/mL)进行稳定筛选。
1.2.2实时定量PCR检测对上述稳定转染的H1299-shPTPN12及H1299-shGFP细胞进行RNA提取。按照RT-PCR试剂盒(瑞士Roche公司)要求进行逆转录,获取cDNA。按照SYBR-Green荧光定量PCR试剂盒(瑞士Roche公司)要求进行扩增。引物由美国凯斯西储大学放疗生物实验室惠赠(sense:5′-TCCTCCTCCAAA ACCACCAA-3′;antisense:5′-GATGGGTGGCACTGGA TGAG-3′)。荧光定量PCR试验条件:94℃30s、60℃40s,40个循环,60℃收集荧光。
1.2.3Western blot检测按照蛋白质提取试剂盒要求对上述稳定转染的H1299-shPTPN12及H1299-shGFP细胞进行蛋白提取,BCA方法进行蛋白质定量检测。采用8%SDS-PAGE胶进行分离、转膜、封闭,加入一抗(PTPN12 1:1 000,美国Abcam公司;β-ac⁃tin 1:20 000,美国Santa Cruz公司),4℃过夜;加入碱性磷酸酶标记IgG二抗(1:1 000)室温下摇床孵育1 h;ECL试剂盒(上海Beyotime生物公司)显色。
1.2.4克隆形成实验上述转染细胞稳定筛选48 h后,将培养皿中细胞重悬并分别按每管100、200、600、1 000、2 000个细胞稀释至离心管中,分别接受0、2、4、6、8 Gy照射(德国西门子直线加速器6MV-X线,源皮距100cm垂直照射)。照射后将细胞分别接种于培养皿中,置于培养箱孵育10天,可见贴壁细胞形成克隆,计数每个培养皿形成的克隆数(≥50个细胞为计数克隆的标准),每组细胞重复上述步骤3次。
各组克隆形成率(%)=(细胞克隆数/接种细胞数)×100%,以及细胞生存分数(survival fraction,SF)=实验组克隆形成率/对照组(0 Gy)克隆形成率。
应用LQ模型拟合细胞生存曲线,计算各组D0值、Dq值、SF2。
1.3统计学方法
应用SPSS 13.0软件包进行数据分析。χ2检验或Fisher's精确检验用于分析PTPN12表达与临床病理资料的关系。Log rank法用于评估影响放疗反应性的单因素分析,多因素分析采用Cox比例风险模型筛选影响放疗反应性因素。组间两两比较用t检验,多组间数据比较采用方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1NSCLC组织中PTPN12蛋白表达及其与临床因素关系分析
PTPN12阳性表达为细胞质中出现棕黄色颗粒。92例病例中,50例(54.3%)为PTPN12低表达,42例(45.7%)为PTPN12高表达。92例患者肿瘤组织中PTPN12的表达在不同性别组、年龄组、病理类型组、肿瘤部位组、TNM分期组、N分期组间表达差异无统计学意义(P>0.05,图1,表1)。
2.2PTPN12蛋白表达水平与放疗疗效的关系
92例NSCLC患者放疗结束后,达到CR者19例(20.7%)、PR者45例(48.9%)、SD者20例(21.7%)、PD者8例(8.7%)。按照RECIST标准,64例(69.6%)患者为放射敏感,而且PTPN12低表达患者的放射敏感性高于PTPN12高表达者,具有显著性差异(80.0% vs. 57.1%,P=0.018,表2)。

A. Absence PTPN12 expression in squamous cell carcinoma (SCC); B-C. Expression of PTPN12 in squamous cell carcinoma (SCC) (B×100, C×200); D. Absence of PTPN12 expression in adenocarcinoma (AC); E-F. Expression of PTPN12 in adenocarcinoma (AC) (E,×100; F,×200)图1 NSCLC组织中PTPN12蛋白表达Figure 1 Immunohistochemistry staining of PTPN12 in NSCLC tissues

表1 NSCLC组织中PTPN12蛋白表达水平与临床病理因素的关系Table 1 Clinicopathological characteristics and expression of PTPN12 in NSCLC tissues of patients
2.3影响NSCLC患者放疗疗效的因素分析
对全组患者的临床病理因素与放疗疗效的关系进行单因素分析,结果显示只有PTPN12蛋白表达水平对放疗疗效差异具有统计学意义(P=0.018,表2)。虽然接受化疗的患者的放射敏感性高于未接受化疗者,但是差异无统计学意义(74.6% vs. 52.4%,P= 0.051)。而多因素分析显示PTPN12蛋白表达水平是影响患者放疗疗效的独立因素(表3)。
2.4PTPN12基因下调增加H1299细胞的放射敏感性
实时定量PCR及Western blot检测结果显示,无论是在mRNA水平,还是在蛋白质水平,转染shRNAPTPN12进行基因下调的H1299细胞中PTPN12的表达均有明显下降(P<0.05,图2A、B)。转染后H1299-shGFP 及H1299-shPTPN12细胞经不同剂量照射后(0、2、4、6、8 Gy),根据LQ模型建立两组细胞生存曲线(图2C),H1299-shGFP及H1299-shPTPN12细胞的D0值、Dq值、SF2值分别为3.02Gy、3.41 Gy、0.94及1.81 Gy、2.40 Gy、0.72,具有显著性差异(P<0.05)。
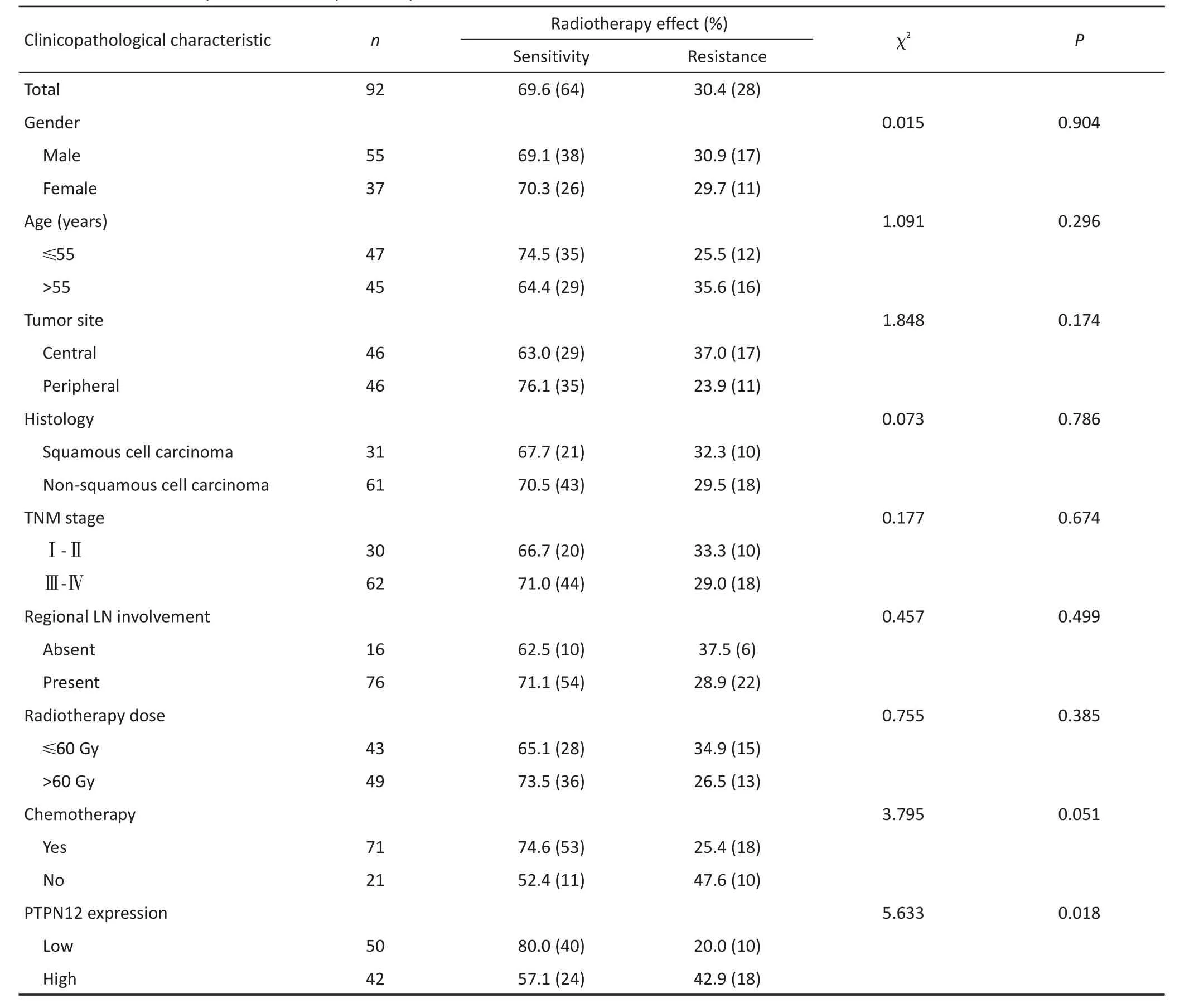
表2 NSCLC患者放疗疗效的单因素分析Table 2 Univariate analysis of radiotherapeutic response

表3 NSCLC患者放疗疗效的多因素分析Table 3 Multivariate analysis of radiotherapeutic response

A. Colony survival assay of H1299 with stable PTPN12 knockdown; B. qRT-PCR of PTPN12 in shPTPN12 cells versus control; C. Western blot of PTPN12 protein in shPTPN12 cells versus control图2 PTPN12基因下调增加H1299细胞放射敏感性Figure 2 PTPN12 knockdown sensitizes lung cancer cells (H1299) to irradiation
3 讨论
放射治疗是NSCLC治疗不可或缺的重要手段[11],是早期和不能或拒绝接受手术的NSCLC患者的首选治疗方法;同期放化疗或单纯根治性放疗是局部晚期NSCLC患者的一线治疗方法;放射治疗亦是Ⅳ期NSCLC患者缓解症状的重要手段[12]。但是仍有部分肿瘤由于对放射线抗拒,从而影响了放疗疗效。因此增加NSCLC患者的放射敏感性是提高疗效的重要手段。
肿瘤放射敏感性受细胞凋亡、DNA损伤修复能力、细胞周期变化、组织内缺氧程度、肿瘤干细胞等多种因素影响[13-14]。有学者发现[15-17]miRNAs具有调控肿瘤放射敏感性的能力。Shen等[15]认为通过下调miR-18a可以增加NSCLC的放射敏感性。Shin等[16]研究发现HMGB2过表达的结直肠癌患者对新辅助放化疗的反应性较差,而HMGB2基因下调则可以增加结直肠癌患者的放射敏感性。Nagel等[17]认为FOXM1及MASTL基因下调对NSCLC细胞系的放射敏感性有较大的影响作用。
PTPN12是近年来用shRNA文库(shRNA Li⁃brary)技术筛选肿瘤细胞转化因子时发现的一个阳性蛋白分子,属于蛋白酪氨酸磷酸化家族,是一个新型抑癌基因[4-6],除了参与到细胞骨架和信号蛋白途径外,还在细胞生长分化、转移、增殖等方面具有重要作用,并与酪氨酸磷酸化具有关键作用[3]。Sun等[4]报道22.6%乳腺癌患者中存在PTPN12表达缺失;在侵袭性乳腺癌中,37%患者存在PTPN12低表达,而在三阴乳腺癌组织中,PTPN12低表达情况更为常见[18]。Cao等[19]发现PTPN12高表达与NSCLC患者的良好预后呈正相关,Ⅱ~Ⅲ期患者PTPN12的表达低于Ⅰ期患者。但本研究中未发现PTPN12表达与临床分期等常见临床病理因素存在相关性,这可能与样本数较少有关。
无论在组织水平,还是在细胞水平,PTPN12表达与放射敏感性的关系有待进一步研究。本研究发现PTPN12低表达的NSCLC患者对放射线的敏感性明显高于PTPN12高表达者,具有显著性差异(P< 0.05)。多因素分析亦显示PTPN12蛋白表达水平是影响患者放疗疗效的独立因素。而在细胞水平,PTPN12基因下调明显增加H1299细胞的放射敏感性。
总而言之,PTPN12低表达与NSCLC患者的放射敏感性密切相关,而且PTPN12基因下调能明显增加H1299细胞的放射敏感性。为此,拟对可能的机制进行深入研究,为提高NSCLC患者的放射敏感性提供靶点,为靶向治疗联合放疗提供依据。
参考文献
[1] Siegel R, Miller KD, Jemal A. Cancer statistics 2015[J]. CA Cancer J Clin, 2015, 65(1):5-29.
[2] Saadeddin A. Radiotherapy for NSCLC: review of conventional and new treatment technique[J]. J Infect Public Health, 2012, 1:S45-49.
[3] Lu Z, Hunter T. Degradation of activated protein kinases by ubiquitination[J]. Annu Rev Biochem, 2009,78:435-475.
[4] Sun T, Aceto N, Meerbrey KL, et al. Activation of multiple proto-oncogenic tyrosine kinases in breast cancer via loss of the PTPN12 phosphatase[J]. Cell, 2011, 144(5):703-718.
[5] Cao X, Li Y, Luo RZ, et al. Tyrosine-Protein phosphatase nonreceptor type 12 is a novel prognostic biomarker for esophageal squamous cell carcinoma[J]. Ann Thorac Surg, 2012, 93(5):1674-1680.
[6] Espejo R, Rengifo-Cam W, Schaller MD, et al. PTP-PEST controls motility, adherens junction assembly, and Rho GTPase activity in colon cancer cells[J]. Am J Physiol Cell Physiol, 2010, 299(2):C454-463.
[7] Rami-Porta R, Crowley JJ, Goldstraw P. The revised TNMstaging system for lung cancer[J]. Ann Thorac Cardiovasc Surg, 2009, 15(1):4-9.
[8] Therasse P, Arbuck SG, Eisenhauer EA, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada[J]. J Natl Cancer Inst, 2000, 92(3):205-216.
[9] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009, 45(2):228-247.
[10] Galgano MT, Hampton GM, Frierson HF Jr. Comprehensive analysis of HE4 expression in normal and malignant human tissues[J]. Mod Pathol, 2006, 19(6):847-853.
[11] Bayman N, Blackhall F, McCloskey P, et al. How can we optimise con-current chemoradiotherapy for inoperable stage III non-small cell lung cancer[J]? Lung cancer, 2014, 83(2):117-125.
[12] Ettinger DS, Wood DE, Akerley W, et al. Non-small cell lung cancer, version 1.2015[J]. J Natl Compr Canc Netw, 2014, 12(12):1738-1761.
[13] Xu JY, Lu S, Xu XY, et al. Knocking down nucleolin expression enhances the radiosensitivity of non-small cell lung cancer by influencing DNA- PKcs activity[J]. Asian Pac J Cancer Prev, 2015, 16(8):3301-3306.
[14] Yang Y, Yang Y, Yang X, et al. Autophagy and its function in radiosensitivity[J]. Tumour Biol, 2015, 36(6):4079-4087.
[15] Shen Z, Wu X, Wang Z, et al. Effect of miR-18a overexpression on the radiosensitivity of non-small cell lung cancer[J]. Int J Clin Exp Pathol, 2015, 8(1): 643-648.
[16] Shin YJ, Kim MS, Kim MS, et al. High-mobility group box 2 (HMGB2) modulates radioresponse and is downregulated by p53 in colorectal cancer cell[J]. Cancer Biol Ther, 2013, 14(3): 213-221.
[17] Nagel R, Stigter-van Walsum M, Buijze M, et al. Genome-wide siRNA screen identifies the radiosensitizing effect of downregulation of MASTL and FOXM1 in NSCLC[J]. Mol Cancer Ther, 2015,14(6): 1434-1444.
[18] Yarden Y, Sliwkowski MX. Untangling the ErbB signaling network[J]. Nat Rev Mol Cell Biol, 2001, 2(2):127-137.
[19] Cao X, Chen YZ, Luo RZ, et al. Tyrosine-protein phosphatase non-receptor type 12 expression is a good prognostic factor in resectable non- small cell lung cancer[J]. Oncotarget, 2015, 6(13):11704-11713.
(2016-01-08收稿)
(2016-03-03修回)
(编辑:杨红欣校对:张亻抿)

Effect of protein tyrosine phosphatase non-receptor type 12 (PTPN12) downregulation on the radiosensitivity of non-small cell lung cancer
Wenxia HU1, Zhikun LIU2, Weili ZHANG3, Scott Welford4, Jingwei SU2
Correspondence to: Jingwei SU; E-mail: 704057795@qq.com
1Department of Respiratory Medicine, the Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China;2Department of Radiation Oncology, the Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China;3School of Public Health, Hebei Medical University, Shijiazhuang 050000, China;4Department of Radiation Oncology, Case Western Reserve University, Cleveland 44106, United States
AbstractObjective: To identify the relationship between the expression of protein tyrosine phosphatase non-receptor type 12 (PTPN12) and radiotherapy effect in non-small cell lung cancer (NSCLC) tissues and to determine whether PTPN12 deficiency can sensitize lung cancer cells to irradiation. Methods: From September 2013 to October 2014, 92 NSCLC patients undergoing radiotherapy with or without platinum-based combination chemotherapy were analyzed retrospectively. Before the treatment, PTPN12 expression was detected through immunohistochemistry. After the completion of radiotherapy, the patients' responses were assessed and radiotherapeutic efficacy analyzed. The human NSCLC cell line H1299 was infected with shPTPN12 knockdown, and colony survival assay was analyzed after irradiation. Chi-square test was used to examine the correlation between PTPN12 expression and clinicopathological characteristics. Univariate analyses and Logistic regression test were used to analyze the relationship between clinicopathological characteristics and radiotherapeutic response. Results: Patients with low PTPN12 expression were more sensitive to radiotherapy than those with high PTPN12 expression (80.0% vs. 57.1%, P=0.018). Multivariate analysis showed that PTPN12 expression was the only independent predictor of radiotherapeutic response in NSCLC. The H1299-shPTPN12-knockdown cells were sensitive to irradiation. Conclusions: The results of the study indicated that downregulation of PTPN12 improved the radiosensitivity of NSCLC cells.
Keywords:PTPN12, non-small cell lung cancer, radiotherapeutic efficacy, H1299 cell line, radiosensitivity
doi:10.3969/j.issn.1000-8179.2016.07.036
作者单位:①河北医科大学第四医院呼吸科(石家庄市050011);②河北医科大学第四医院放疗科;③河北医科大学公共卫生学院;④美国凯斯西储大学放疗生物实验室
通信作者:苏景伟704057795@qq.com
作者简介
胡文霞专业方向为肺癌预防及治疗研究。
E-mail:110694685@qq.com

