纳米载体介导沉默Survivin基因对鼻咽癌细胞增殖凋亡及放疗敏感性的影响*
邓 雯, 孙茂钢, 赵 艳, 赵厚育
(1.贵州医科大学, 贵州 贵阳 550004; 2.贵州医科大学 分子生物学重点实验室, 贵州 贵阳 550004; 3.贵州医科大学附院 耳鼻咽喉科, 贵州 贵阳 550004)
纳米载体介导沉默Survivin基因对鼻咽癌细胞增殖凋亡及放疗敏感性的影响*
邓雯1, 孙茂钢1, 赵艳2, 赵厚育3**
(1.贵州医科大学, 贵州 贵阳550004; 2.贵州医科大学 分子生物学重点实验室, 贵州 贵阳550004; 3.贵州医科大学附院 耳鼻咽喉科, 贵州 贵阳550004)
[摘要]目的: 探讨纳米载体转染沉默鼻咽癌CNEII细胞中Survivin基因后,CNEII细胞增殖、凋亡及对放疗敏感性的改变。方法: 制备聚乙烯亚胺(PEI)-四氧化三铁(Fe3O4)磁性纳米粒,用PEI-Fe3O4磁性纳米粒包被miRNA-Survivin质粒(纳米干扰质粒),将CNEII细胞分为空白对照组(不加质粒,C组)、加纳米干扰质粒组(S组)及加miRNA-NC对照质粒组(NC组);3组细胞转染48 h后,荧光显微镜下观察质粒所带绿色荧光蛋白EGFP的表达,进行细胞计数,计算转染效率;利用Real Time RT-PCR及Western Blot方法检测Survivin mRNA及蛋白表达抑制情况;转染24、48、72及96 h时用MTT法检测3组细胞的增殖情况,转染48 h时用放射线照射3组,采用流式细胞术检测3组细胞放射线照射前后的细胞凋亡率。结果: 转染48 h后,加入包被miRNA-Survivin质粒的PEI-Fe3O4磁性纳米粒的CNEII细胞转染效率为(60.9±3.9)%、mRNA表达抑制率为96.5%、蛋白表达抑制率为82.5%,均高于C组和NC组(P<0.05),说明构建PEI-Fe3O4磁性纳米粒成功;MTT结果显示48 h以后S组细胞的吸光度值低于NC组和C组,说明细胞增殖被抑制;转染48~72 h CNEII细胞施以6Gy的放射线照射,射线照射后S组细胞凋亡率高于S组照射前(P<0.05),S组细胞凋亡率高于NC组和C组(P<0.05)。结论: 鼻咽癌CNEII细胞沉默Survivin基因后的细胞的增殖被抑制、凋亡数增加,放射线照射凋亡更明显。
[关键词]鼻咽癌; Survivin基因; 细胞增殖; 细胞凋亡; 放疗敏感性
鼻咽癌是中国常见的恶性肿瘤之一,以南方地区为主,是头颈部恶性肿瘤的首位。目前临床上放射治疗鼻咽癌多采用调强放射治疗,患者的5年生存率为70%[1],但仍有部分患者经放射治疗后不能得到满意效果,如何提高鼻咽癌的放射敏感性已成为目前临床治疗的难点和研究的重点。凋亡相关基因的异常表达不仅与细胞恶性转化和肿瘤发生、发展及预后有关,而且在辐射诱导的凋亡中也可能扮演着重要的角色。Survivin是凋亡抑制蛋白家族中一员,Survivin的表达过度会使细胞失去正常细胞周期的调控限制而大量无限增殖,正常的细胞增殖与凋亡之间的平衡被打破,造成细胞凋亡减少。由于Survivin特异性表达于恶性肿瘤组织且具有强大的抑制凋亡活性,已成为倍受关注的抗肿瘤治疗的靶点[2]。本研究采用新型非病毒载体聚乙烯亚胺(poly ethylene imine,PEI)-四氧化三铁(Fe3O4)磁性纳米粒介导沉默鼻咽癌CNEII细胞中的survivin基因,观察沉默后CNEII细胞的凋亡、增殖及放疗敏感性的变化,为鼻咽癌的基因治疗提供一定实验依据。
1材料与方法
1.1质料、试剂及仪器
干扰质粒购于上海吉玛公司,miRNA-HIF-1α干扰质粒的靶序列为5′-AAGGATTTAGGCCACTGCCTT-3′,NC对照质粒的靶序列为5′-AAATGTACTGCGCGTGGAGAC-3′,各质粒均带有EGFP绿色荧光;鼻咽癌细胞株CNEII由上海复旦大学亓立峰教授实验室赠与。试剂有FeCl3·6H2O、FeCl2·4H2O、PEI购于上海朗顺化工有限公司,RP1640培养液、胎牛血清购于Invitrogen公司,Survivin抗体、Tubulin抗体及相关二抗均购于美国ABcam公司,小RNA(microRNA,miRNA)干扰质粒购于上海吉玛公司,PCR试剂盒购于Invitrogen公司,AnnexinV-FITC/PI凋亡试剂盒购于碧云天公司,四甲基偶氮唑蓝(MTT)试剂购于Sigma公司。仪器有恒温水浴锅,电子称量器,机械搅拌器购于德国Memmert公司,电泳仪及垂直电泳槽购于美国BioRad公司,荧光显微镜购于OLYMPUS公司,高速离心机购于Eppendorf公司,RT-PCR仪购于美国Biorad公司,流式细胞仪购于BD公司。
1.2方法
1.2.1细胞培养与分组将CNEII细胞加入含有10%胎牛血清的RP1640培养液中,于37 ℃,5% CO2恒温培养箱中常规培养,每2~3 d传代1次。将培养好的CNEII细胞分为空白对照组(不加质粒,C组)、加合成的纳米颗粒PEI-Fe3O4转染miRNA-Survivin干扰质粒组(S组)及转染miRNA-NC对照质粒组(NC组);在细胞生长良好的情况下,以约1×105密度接种于6孔板中,待细胞完全贴壁,密度达40%时利用转染介质转染相应质粒。
1.2.2PEI-Fe3O4纳米载体的制备取8 mmoL 水杨酸与10 mL水混合,用1 mol/L NaOH中和水杨酸,并调PH值为11。称取FeCl20.254 g,FeCl30.65 g,分别溶于5 mL水。将FeCl2、FeCl3溶液加入到配置好的水杨酸溶液中,溶液变成黑色,在氮气保护,冷凝回流,机械搅拌,90 ℃条件下反应4 h。吸取PEI 6.0 g,用10 000透析袋透析2 d,每4~5 h换1次水,透析除去杂质。最后收得25 000 PEI 9.25 mmol/L。取PEI 10 mmol/L:Fe3O41 mol/L等体积涡旋混匀,即得PEI-Fe3O4纳米载体。
1.2.3转染效率转染48 h后,荧光显微镜下观察质粒所带绿色荧光蛋白EGFP的表达,进行细胞计数,计算转染效率。
1.2.4转染后Survivin mRNA表达抑制率采用Real Time RT-PCR,设计Survivin基因扩增引物,上游序列为5′-ACCGCATCTCTACATTCAAG-3′,下游序列为5′-TTGAAGCAGAAGAAACACTG-3′。CNEII细胞转染72 h收集细胞,提取总RNA,以β-actin作为对照。RT-PCR反应条件为:95 ℃ 1 min,95 ℃ 10 s、 60 ℃ 10 s、70 ℃ 10 s共40个循环;70 ℃ 10 min。实时荧光定量检测转染后Survivin mRNA表达,计算抑制率,抑制率=(C组2-ΔΔCT值-S组2-ΔΔCT值)/C组2-ΔΔCT值×100%。
1.2.5转染后Survivin蛋白表达抑制率采用Western Blot法检测,在转染后72 h收集细胞,常规PBS洗涤后提取蛋白,12%及8%聚丙酰胺凝胶恒压分离蛋白,常规转膜及封闭后加入Survivin一抗(1∶5 000)和Tubulin(内对照)一抗(1∶5 000)4 ℃过夜孵育,经过常规TBST洗涤后加入相应二抗室温孵育1 h,显影、定影、洗涤后观察结果,计算抑制率,抑制率=(C组相对灰度值-S组相对灰度值)/C组相对灰度值×100%。
1.2.6转染后CNEII细胞的增殖采用MTT法,培养对数生长期的CNEII细胞,PBS温柔清洗3次,用适量胰酶消化,1640全培养基重悬后,计数细胞,每孔按5×103细胞密度接种于96孔板上,培养基100 μL,于37 ℃,5% CO2恒温培养箱中常规培养,每组设置3个复孔,质粒用量0.2 μg,纳米材料25000 PEI-Fe3O4用2 μL。转染6 h后换液,放入细胞培养箱内培养,转染24 h后弃去培养基,用PBS溶液清洗细胞2遍后,加入含MTT的培养液。每孔加入MTT染色液50 μL,放入细胞培养箱内继续培养4 h。后每孔加入DMSO 100 μL,在摇床上轻轻振荡20 min。放入酶标仪中,在570 nm处测定吸光度值。利用吸光度值反映CNEII细胞的增殖(吸光度值越高细胞增殖越好)。
1.2.7细胞凋亡采用流式细胞术,转染48~72 h的CNEII细胞,PBS清洗3次,用适量不含EDTA胰酶消化1 min,加入含10%FBS 的RP1640培养基,轻轻吹打后收集细胞,2 000 r/min离心5 min,弃上清后在洗涤细胞1次,将剩下的细胞用5 00 μL binding buffer 重悬。加入5 μL Annexin V-FITC混匀后,加入10 μL Propidium lodide,混匀。室温避光5~15 min,1 h内流式细胞仪CNEII细胞凋亡情况。
1.2.8放射线照射细胞后CNEII细胞凋亡转染48~72 h CNEII细胞用 6Gy的放射线照射,按1.2.6步骤检测CNEII细胞凋亡情况。
1.3统计学方法
2结果
2.1构建PEI-Fe3O4磁性纳米粒的鉴定
转染48 h后,加入纳米粒干扰质粒的CNEII细胞转染效率为(60.9±3.9)%、mRNA表达抑制率为96.5%(表1)、蛋白表达抑制率为82.5%(图1),均高于C组和NC组(P<0.05),说明构建PEI-Fe3O4磁性纳米粒成功。
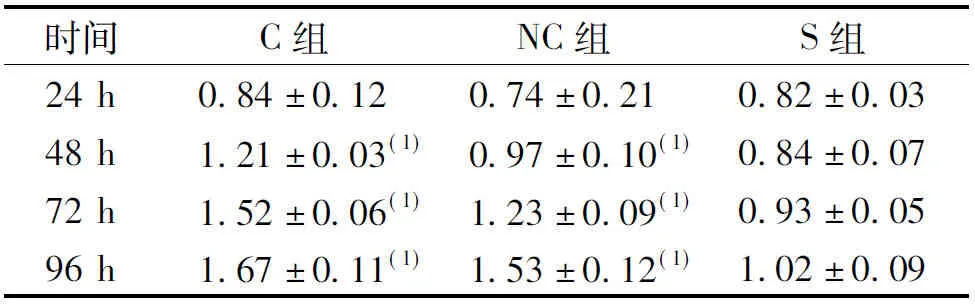
表1 MTT法测定3组CNEII细胞吸光度值
(1)与S组比较,P<0.05
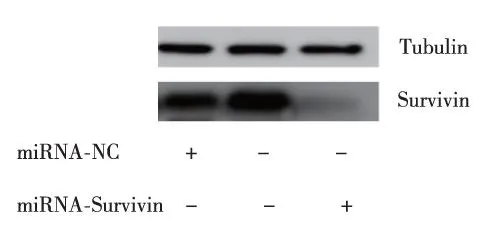
图1 3组CNEII细胞转染48 h时Survivin蛋白表达Fig.1 Survivin protein levels of CNEII cells in the three groups after transfection for 48 h
2.2转染后CNEII细胞的增殖
分别用miRNA-Survivin、miRNA-NC质粒转染鼻咽癌CNEII细胞,S和NC组吸光度低于C组,从48 h开始,差异有统计学意义(P<0.05)。S组降低最明显,与C组及NC组对比,差异具有统计学意义(P<0.05),见图2。
2.3转染后细胞凋亡
3组转染CNEII细胞在未用放射线照射时, C组、NC组及S组的凋亡率分别为(7.3±1.7)%、(9.4±1.5)%、(18.4±2.6)%。S组凋亡率高于与NC组和C组,差异存在统计学意义(P<0.05)。放射线照射后,C组、NC组、S组的凋亡率分别为(20.3±3.3)%、(19.4±4.5)%、(75.3±4.1)%;S组高于NC组和C组,差异存在统计学意义(P<0.05)。见表3。
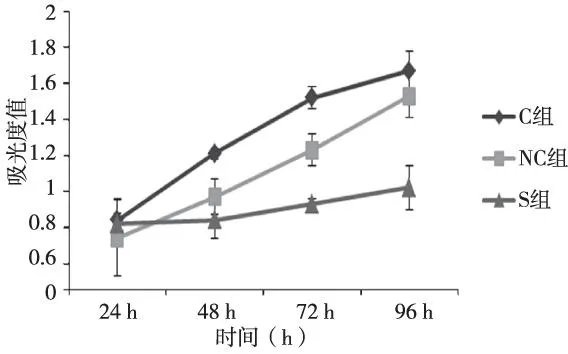
图2 3组CNEII细胞转染后MTT法测定生长曲线Fig.2 Growth curves of CNEII cells detected by MTT in three groups
3讨论
正常组织的内部平衡需要严格准确的细胞凋亡及细胞增殖二者之间的平衡,为了达到这样的平衡,一个庞大的基因网络需要相互协作才能维持。肿瘤的形成大部分是由于异常的基因活跃后使细胞增殖超过细胞凋亡且赋予这些细胞不受控制的分化的能力[3]。作为凋亡抑制蛋白家族成员,Survivin在肿瘤的基因治疗中一直备受关注。Survivin基因具有细胞周期性及肿瘤特异性,即在肿瘤细胞中特异性的表达,已有研究证实在临床病例中,宫颈癌的病人病变组织中Survivin的含量显著高于正常宫颈组织[4]。对44例施行放射线治疗的子宫颈癌病人的组织切片的免疫组化分析显示,组织切片中Survivin高表达的病人5年生存率更低[5]。提示Survivin基因在肿瘤的发生发展中扮演着重要的角色。在胰腺癌细胞系中,Asanuma等[6]首次报道了Survivin mRNA的表达量与胰腺癌细胞对放射线治疗的敏感性呈负相关,另外,施之不致细胞致死的放射线剂量照射后,细胞中Survivin的表达增加,这些结果为Survivin与放射治疗敏感性之间的研究奠定了基础。这也与本研究设计的初衷一致,一方面着眼于沉默Survivin对鼻咽癌细胞的凋亡增殖影响,另一方面更着重于观察沉默Survivin后的鼻咽癌细胞对放射线的敏感性是否有变化。Survivin的抗凋亡机制主要是通过直接或间接抑制Caspase活性而发挥抗凋亡作用[7]。本实验中在分子水平即将Survivin mRNA水平敲低,蛋白水平再次验证其敲除效果,以期从根本降低Survivin蛋白的表达,观察后发现鼻咽癌细胞的增殖被抑制,凋亡增加,肯定了Survivin作为抗癌靶点的突出效用。已经发现,人的Survivin基因启动子之中含3个细胞周期依赖性因子(cellcycle-dependent,CED)和1个细胞周期同源性区域(cellcyclehomologyregion,CHR),CDE和CHR是特异性存在于G2/M期的表达基因。所以,Survivin的表达有明显的细胞周期性,即在细胞周期的G2/M期选择性的表达[8]。缺氧和放射线能够引起肿瘤细胞的G2/M期阻滞,由此可能造成放射线照射后细胞中Survivin蛋白表达量增高,肿瘤细胞凋亡减少,从而造成瘤体对放射线的敏感性下降。在结肠癌的研究中,结肠癌细胞系SW480(对放射治疗低敏感性)及SW48(对放射线治疗高敏感性)的两株细胞比较,Survivin在SW480细胞系中高表达且用放射线照射该细胞后Survivin反应性上调,而在SW48中Survivin低表达且用放射线照射后Survivin并没有反应性上调[9]。另有研究报道,进行单独放疗的4例病人及放化疗一体的14例病人的原代鼻咽癌细胞中,NF-κB和Survivin的高表达和肿瘤细胞凋亡减少相关,在使用RNAi抑制Survivin的表达后再辅以6Gy的放射线照射治疗,肿瘤细胞的凋亡明显增加[10]。本实验中光镜下可观察到细胞接受放射线照射后明显膨胀,部分死亡,大部分细胞不能维持完整性,在流式细胞检测图上亦可证实。在施以放射线照射后,S组凋亡率较放射线照射前明显增加,且差异具有统计学意义(P<0.05),结果与所报道相一致,也为Survivin作为临床使用增加放疗敏感的靶点基因增加了体外实验的依据。
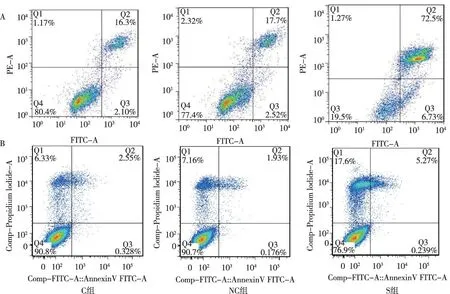
注:A为放射线照射前,B为放射线照射后,横坐标为FITC通道绿色荧光值,纵坐标为PI通道红色荧光值图3 转染并经放射线照射前后3组CNEII细胞的凋亡率Fig.3 Apoptosis rate of CNEII cells in three groups after exposure to radiation
本实验中转染载体采用低毒性、无免疫原性的纳米颗粒,较之病毒载体及传统Lipofectamine在体内实验中有更好的适应性[11],已在前期实验中成功证实其转染可行性,加之本次研究结果,为提高鼻咽癌CNEII细胞对放射线敏感性的体内实验奠定了良好的基础。
4参考文献
[1] 杨保庆,刘宇清.鼻咽癌调强适形放疗应用现状[J].中国医师杂志, 2012(12):1718-1721.
[2] Qi H, Guo J, Zhang YC. Antisense oligonucleotide targeting survivin gene induces cell apoptosis in salivary mucoepidermoid carcinoma[J]. Zhong hua kou qiang yi xue za zhi, 2010(9):525-530.
[3] Hanahan D,Weinberg RA.The hallmarks of cancer[J]. Cell, 2000(1):57-70.
[4] 赵倩.Survivin、FHIT及PTEN在宫颈癌中的表达及意义[J].贵阳医学院学报, 2014(3):261-268.
[5] Bache M, Holzapfel D, Kappler M, et al. Survivin protein expression and hypoxia in advanced cervical carcinoma of patients treated by radiotherapy[J].Gynecol Oncol, 2007(3):139-144.
[6] Asanuma K, Moriai R, Yajima T, et al. Survivin as a radioresistance factor in pancreatic cancer[J].Jpn J Cancer Res, 2000(2):1204-1209.
[7] Qian XY, Xi XW, Li LX.Nuclear survivin is associated with malignant potential in epithelial ovarian carcinoma[J].Applied Immunohistochemistry & Molecular Morphology, 2011(2):126-132.
[8] Liao MH, Lin WC, Wen HC. Tithonia diversifolia and its main active component tagitinin C induce survivin inhibition and G2/Marrest in human malignant glioblastoma cells[J].Fitoterapia, 2011(3):331-341.
[9] Rödel C, Haas J, Groth A, et al. Spontaneous and radiation-induced apop-tosis in colorectal carcinoma cells with different intrinsic radiosensitiv-ities: survivin as a radioresistance factor[J]. Int J Radiat Oncol Biol Phys, 2003(9):1341-1347.
[10]Shi W, Bastianutto C, Li A, et al. Multiple dysregulated pathways in naso-pharyngeal carcinoma revealed by gene expression profiling[J].Int J Cancer, 2006(119):2467-2475.
[11]李琚,李晓桐,赵明.无机纳米材料及其在生物医学方面的应用研究[J].医疗卫生装备, 2015(7):97-101,105.
(2016-01-15收稿,2016-04-06修回)
中文编辑: 刘平; 英文编辑: 周凌
Effects of Silencing Survivin Gene via Nanoparticles Technique on Proliferation and Apoptosis and Radiosensitivity of Nasopharyngeal Carcinoma Cell
DENG Wen1, SUN Maogang1, ZHAO Yan2, ZHAO houyu3
(1.GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.TheKeyLaboratoryofMolecularBiology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 3.DepartmentofOtorhinolaryngology,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550000,Guizhou,China)
[Abstract]Objective: To investigate the effects of Silencing Survivin gene via nanoparticles technique on proliferation, apoptosis and radiosensitivity of nasopharyngeal carcinoma cells (CNEII). Methods: PEI-Fe3O4 magnetic nanoparticles were prepared. miRNA-Survivin plasmid was coated with PEI-Fe3O4 magnetic nanoparticles. CNEII cells were divided into blank control group (without plasmid, group C), nanoparticle interfering plasmid group (group S) and miRNA-NC plasmid control group (group NC). Fluorescence microscope was used to measure efficiency of transfection after 48 hours. Survivin protein was detected by Western blot and mRNAs were detected by RT-PCR. Cell proliferation was detected by MTT 24, 48, 72, 96 h after transfection; all groups were exposed to X ray after transfection at 48 h and cell apoptosis was analyzed by flow cytometry. Results: The transfection rate of miRNA-Survivin plasmid coated with PEI-Fe3O4 nanoparticles into CNEII cells was (60.9±3.9)%. The suppression ratio of Survivin protein and mRNA was 82.5% and 96.5% respectively in group S, which was lower than that of group C and group NC, indicating that PEI-Fe3O4 was successfully constructed. MTT showed that absorbance value of group S was lower than that in group C and group NC, which indicating that the proliferation of CNEII was inhibited. The ratio of cell apoptosis of group S exposed to 6 Gy was higher. The difference of Group S with Group NC and Group C was significant (P<0.05). Conclusion: Proliferation of transfected cells is inhibited while apoptosis rate is increased and even more obvious when exposed to radiation.
[Key words]nasopharyngeal carcinoma; Survivin gene;cell proliferation;apoptosis;radiosensitivity
[中图分类号]R34-33; R739.6
[文献标识码]A
[文章编号]1000-2707(2016)04-0377-05
*基金项目]国家自然科学基金地区科学基金项目(NO.81260353)
**通信作者 E-mail:zhaohouyujia@163.com
网络出版时间:2016-04-20网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160420.1751.006.html

