巨噬细胞活性与子宫内膜异位症发生的关系*
胡玉红, 宋美玉
(1.佳木斯大学附属第一医院 妇产科, 黑龙江 佳木斯 154002; 2.佳木斯大学 临床医学院, 黑龙江 佳木斯 154003)
巨噬细胞活性与子宫内膜异位症发生的关系*
胡玉红1, 宋美玉2
(1.佳木斯大学附属第一医院 妇产科, 黑龙江 佳木斯154002; 2.佳木斯大学 临床医学院, 黑龙江 佳木斯154003)
[摘要]目的: 研究巨噬细胞与子宫内膜异位症(EMT)发生之间的关系。方法: 选取卵巢巧克力囊肿和子宫肌瘤患者各20例,在腹腔镜下进行手术治疗,术前分别抽取约15 mL的腹腔液,制成单细胞悬液,运用显微成像技术、Cell-sense standard系统、Image J系统测量两组患者腹腔液中巨噬细胞的运动速度以及子宫内膜细胞4 h时面积的变化,并用流式细胞仪检测腹腔液中表达特异性标记物的巨噬细胞含量;比较两组患者腹腔积液中CD14+巨噬细胞不同标记物所占百分比差异。结果: 实验组巨噬细胞移动速度小于对照组患者巨噬细胞移动速度,差异有统计学意义(P<0.05);实验组子宫内膜细胞面积增长,对照组患者面积减小,两组比较差异有统计学意义(Z=-4.599,P<0.05);实验组患者腹腔液中表达CD69 、CD71 和CD54的巨噬细胞占CD14+巨噬细胞的百分比明显低于对照组(P<0.05),差异有统计学意义。结论: 巨噬细胞功能的降低可能会引起逆流内膜组织在腹腔中形成新的病灶,导致EMT的发生。
[关键词]巨噬细胞; 子宫内膜异位症; 移动速度
目前,子宫内膜异位症(endometriosis,EMT)的病因尚未明。普遍认为是逆流内膜组织在各种因素的相互作用下,在除子宫体以外的部位形成新的病灶,其中越来越受关注的是免疫功能的异常与EMT发生发展之间的关系。研究表明,当腹腔免疫功能受损时,随经血逆流的子宫内膜细胞在腹腔存活、形成病灶的机会将大大增加[1-3]。腹腔液体中免疫细胞的主要功能为对外来成分具有杀伤作用,而在诸多免疫细胞中,巨噬细胞起主要作用,它具有吞噬功能、抗原呈递及分泌多种细胞因子等功能,腹腔中巨噬细胞的功能变化可能使内膜细胞不能及时被清除,使其顺利粘附、侵袭腹膜而形成病灶[4-8]。本研究通过运用显微成像技术、免疫标记技术及流式细胞仪检测等对EMT患者和子宫肌瘤患者腹腔液中巨噬细胞的移动速度、4 h子宫内膜细胞面积变化及腹腔积液中特异标记巨噬细胞量的差异进行比较,来探讨巨噬细胞与EMT产生之间的关系。具体报道如下。
1材料和方法
1.1对象
选取2015年03月~2015年12月卵巢巧克力囊肿和子宫肌瘤患者各20例为研究对象,卵巢巧克力囊肿为实验组,子宫肌瘤患者为对照组,所有患者25~45岁,平均(25±6.48)岁,均未绝经。纳入标准:所有患者均符合子宫肌瘤和卵巢巧克力囊肿的诊断标准,且就诊前未接受任何治疗。排出标准:所有患者均需排除自身免疫性疾病及盆腔炎性疾病,卵巢巧克力囊肿患者未应用药物治疗,需行腹腔镜手术治疗。所有患者均对本研究知情并签署知情同意书。
1.2实验材料器械
Cellsence standard软件用于控制显微镜对放置于镜下观察的腹腔液单细胞悬液拍照,Image J软件标记巨噬细胞轨迹来测算其速度及测量子宫内膜细胞面积,CytoFLEX 流式细胞仪用于检测细胞特异表型。
1.3实验分组
根据实验设计,将所有患者分为两组,卵巢巧克力囊肿患者为实验组,子宫肌瘤患者为对照组,各20例。实验组患者行腹腔镜下卵巢囊肿切除术,术中根据ASRM修正EMT分期法(1997年)对该组患者分期(6例Ⅰ~Ⅱ期,14例Ⅲ~Ⅳ期患者);对照组患者行腹腔镜下子宫肌瘤切除术或子宫切除术。所有患者在手术前均抽取约15 mL的腹腔液体(留取样本后立即实验),放入离心机中,2 000 r/min离心5 min,留上清液备用。将腹腔液单细胞悬液置于光镜下观察,巨噬细胞形态多呈圆形或椭圆形,功能活跃着有伪足,较其他细胞形体较大,移动速度相对慢。
1.4检测指标
选取具有巨噬细胞和(或)子宫内膜间质细胞的视野,用Cellsence standard软件对显微镜设置为4 h内每2 min拍照1次该视野。运用Image J软件及Manual-Tranking插件标记图片中巨噬细胞轨迹并计算出巨噬细胞运动速度,用Photoshop软件分析照片的实际尺寸及像素,计算得出1.5像素代表实际1 μm,以此为比例在Image J软件中设标尺,测量子宫内膜细胞的面积,通过巨噬细胞移动速度和4 h内面积的变化来表示巨噬细胞功能及腹腔液中相关细胞因子对EMT的作用效果。腹腔液中巨噬细胞的表型运用双色免疫荧光进行标记,使用的抗体有anti.CD14(单核细胞/巨噬细胞的标记物,PE.conjugated),anti.CD69(早期激活分子,FITC.conjugated),anti.CD54 (细胞间黏附分子1,intercellular adhesion molecule.1/ICAM.1,FITC.conjugated),anti.CD71 (增殖标记物,FITC.conjugated)。所有抗体均购于北京安必维(Abway)抗体技术有限公司。用的流式细胞仪为CytoFLEX 流式细胞仪(贝克曼库尔特商贸(中国)有限公司)检测腹腔积液中CD14+巨噬细胞不同标记物所占百分比。
1.5统计学方法
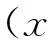
2结果
2.1巨噬细胞移动速度
分析两组患者样本图片所得的数据,实验组巨噬细胞移动速率小于对照组患者巨噬细胞移动速度,差异有统计学意义(P<0.05)。见表1,图1。

表1 两组患者腹腔液中巨噬细胞移动速度

注:图中*与·为离群值图1 不同分组巨噬细胞移动速度比较Fig.1 the macrophages' movement rate of different groups
2.2两组患者腹腔积液样本中子宫内膜细胞面积变化测定及分析
运用统计软件测量4 h子宫内膜细胞面积变化,以增长为正值,减小为负值,其计量资料不符合正态分布,采用秩和检验进行分析,实验组子宫内膜细胞面积增长明显大于对照组患者(Z=-4.599,P<0.05),差异有统计学意义。见表2和图2。

表2 两组子宫内膜细胞面积差值比较
注:两组患者的表中数值为对应视野中对应标记物巨噬细胞数与CD14+巨噬细胞的比值
2.3流式细胞仪检测两组患者腹腔积液中CD14+巨噬细胞标记物的差异
实验组患者腹腔液中表达CD69 、CD71 和CD54的巨噬细胞占CD14+巨噬细胞的百分比明显低于对照组(P<0.05),差异有统计学意义。见表3。
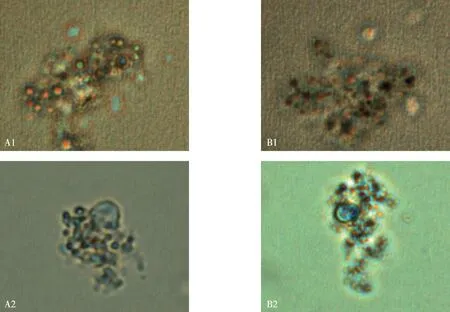
注:A1为实验开始内膜细胞,B1为4 h后内膜细胞,A2为实验开始内膜细胞,B2为4 h后内膜细胞图2 两组子宫内膜细胞面积的变化Fig.2 The ares difference of endometrial cells in observation and control group

标记物对照组实验组PCD6925.6±6.014.3±5.6<0.05CD7124.0±2.36.1±1.7<0.05CD5447.5±13.518.1±3.1<0.05
3讨论
EMT是指子宫内膜组织出现在子宫体以外的部位,该病好发于育龄妇女,易复发,是具有恶性肿瘤侵袭性的良性疾病,易引起女性不孕、慢性骨盆疼痛(35%~50%)等严重影响女性心理和生理健康,降低生活质量。研究表明,70%~90%育龄妇女的经血或早卵泡期的腹腔液中均可见存活的子宫内膜细胞,但只有10%~15%的女性发病[8-13]。因此,EMT的发生除与异位种植有关外,还可能与腹腔清除外源细胞的能力密切相关。异位种植理论(也称经血逆流理论)是指女性月经期的子宫内膜碎片随经血自子宫经输卵管排入腹腔,粘附到腹膜表面发展成为子宫内膜异位症。但在一般情况下,健康女性的免疫系统能够清除外来抗原,可以防止外源细胞的植入与生长;而在各种因素的影响下,腹腔清除外源细胞能力降低时可能使内膜组织经逆行的经血流入腹腔并存活,最终发展成新的病灶。腹腔清除外源细胞能力主要与腹腔免疫细胞密切相关,主要包括巨噬细胞、淋巴细胞、NK细胞等。腹腔液中的免疫细胞以单核细胞为主,因此子宫内膜细胞进入腹腔后遇到的第一道防线主要为腹腔巨噬细胞[14-18]。正常生理情况下,巨噬细胞具有相应的免疫活性,能够清除异位的子宫内膜组织;然而EMT患者巨噬细胞的功能处于低靡状态,大大增加了异位的子宫内膜组织粘附和浸润的机会。
本研究中,抽取腹腔液检测巨噬细胞的运动轨迹并检测其运动速度发现,EMT患者腹腔液中的巨噬细胞运动速度较为缓慢,同时细胞的形态学特征也显示细胞无明显的伪足,功能不活跃;此外,用anti.CD14对所有巨噬细胞进行标记,检测巨噬细胞激活、粘附时表达的分子标记物CD69、CD71 和CD54,发现EMT患者的腹腔液中CD69、 CD54和CD71处于低表达状态,CD69、CD54和CD71的CD14+细胞百分明显低于子宫肌瘤组。腹腔中的巨噬细胞来源于外周血,受细胞因子作用逐渐趋化至腹腔中,此过程中巨噬细胞会表达对应的激活、粘附、迁徙分子;相反,这些分子标记物表达量的增加或者降低也提示了巨噬细胞的功能状态。本研究中,巨噬细胞无论是从子宫内膜细胞面积,或者巨噬细胞运动速度,还是从其表达的黏附、激活分子标记物上来看,巨噬细胞功能均处于低靡状态。正常巨噬细胞功能的发挥是清除异位的子宫内膜组织的关键,其功能降低很可能导致EMT的产生。当腹腔免疫功能发生变化,尤其是巨噬细胞功能受损时,使进入腹腔的子宫内膜细胞不被机体的免疫杀伤作用清除[16,19-22];同时巨噬细胞本身分泌一些细胞因子如IL.1、IL.6、IL.8、TNF.a、前列腺素、血小板活化因子、血管生长因子、巨噬细胞移动抑制因子等导致腹腔微环境发生改变[2-3,9-10];尤其是巨噬细胞移动抑制因子,作用于巨噬细胞抑制其移动,使病灶和腹腔液内的巨噬细胞数量增多,还能促进巨噬细胞分泌功能增强,使巨噬细胞向内膜细胞游走募集的速度降低,影响其吞噬功能同时又增加异位内膜侵袭性、促进其生长并且加重局部炎性反应的作用,促进其在腹腔内种植生长,最终形成病灶,这可能是该病发病的主要病理机制[4-11,23-25]。
综上所述,巨噬细胞的清道夫功能减弱或缺陷时不能有效清除异位子宫内膜细胞,可能是导致子宫内膜异位症重要原因;而对巨噬细胞的功能进行靶向调节可能是防止子宫内膜异位症出现的有效途径。
4参考文献
[1] Koike N, Higashiura Y, Akasaka J, et al.Epigenetic dysregulation of endometriosis susceptibility genes (Review)[J]. Mol Med Rep, 2015(2):1611-1616.
[2] Bulun SE, Monsivais D, Kakinuma T, et al. Molecular biology of endometriosis: from aromatase to genomic abnormalities[J]. Semin Reprod Med, 2015(3): 220-224.
[3] Langan KL, Farrell ME, Keyser EA, et al. Endometriosis: translation of molecular insights to management[J]. Minerva Endocrinol, 2014(3):141-154.
[4] Vitonis AF, Vincent K, Rahmioglu N, et al. World endometriosis research foundation endometriosis phenome and biobanking harmonization project: II.clinical and covariate phenotype data collection in endometriosis research[J]. Fertil Steril, 2014(5):1223-1232.
[5] Mehedintu C, Plotogea MN, Ionescu S, et al. Endometriosis still a challenge. J Med Life. 2014(3):349-357.
[6] Gadducci A, Lanfredini N, Tana R. Novel insights on the malignant transformation of endometriosis into ovarian carcinoma[J]. Gynecol Endocrinol, 2014(9): 612-617.
[7] Langan KL, Farrell ME, Keyser EA, et al. Endometriosis: translation of molecular insights to management[J]. Minerva Endocrinol, 2014(3):141-154.
[8] Hutter S, Heublein S, Knabl J, et al. Macrophages: are they involved in endometriosis, abortion and preeclampsia and how.Nippon Med Sch, 2013(2): 97-103.
[9] Rakhila H, Girard K, Leboeuf M, et al. Macrophage migration inhibitory factor is involved in ectopic endometrial tissue growth and peritoneal.endometrial tissue interaction in vivo: a plausible link to endometriosis development[J]. PLoS One, 2014(10): e110434.
[10]Beste MT, Pfaffle DN, Prentice EA, et al. Molecular network analysis of endometriosis reveals a role for c.Jun.regulated macrophage activation[J]. Sci Transl Med, 2014(222):216-222.
[11]Wang Y, Fu Y, Xue S, et al. The M2 polarization of macrophage induced by fractalkine in the endometriotic milieu enhances invasiveness of endometrial stromal cells[J]. Int J Clin Exp Pathol ,2014(1): 194-203.
[12]Gargett CE, Schwab KE, Brosens JJ, et al. Potential role of endometrial stem/progenitor cells in the pathogenesis of early.onset endometriosis[J]. Mol Hum Reprod, 2014(7): 591-598.
[13]Veillat V, Sengers V, Metz CN, et al. Macrophage migration inhibitory factor is involved in a positive feedback loop increasing aromatase expression in endometriosis[J]. Am J Pathol, 2012(3): 917-927.
[14]Kralickova M, Vetvicka V. Immunological aspects of endometriosis: a review[J]. Ann Transl Med, 2015(11): 153.
[15]Thiruchelvam U, Wingfield M, O'Farrelly C. Natural killer cells: key players in endometriosis[J]. Am J Reprod Immunol, 2015(4): 291-301.
[16]Mahdian S, Aflatoonian R, Yazdi RS, et al. Macrophage migration inhibitory factor as a potential biomarker of endometriosis[J]. Fertil Steril, 2015(1):153-159.
[17]Takebayashi A, Kimura F, Kishi Y, et al. Subpopulations of macrophages within eutopic endometrium of endometriosis patients[J]. Am J Reprod Immunol, 2015(3): 221-231.
[18]Signorile PG, Baldi A. New evidence in endometriosis Int.Biochem Cell Biol,2015(1) :19-22.
[19]Nothnick W, Alali Z. Recent advances in the understanding of endometriosis: the role of inflammatory mediators in disease pathogenesis and treatment[J]. F1000Res, 2016(5):456-457.
[20]Zhang X, Mu L. Association between macrophage migration inhibitory factor in the endometrium and estrogen in endometriosis[J]. Exp Ther Med, 2015(2):787-791.
[21]Baranov VS, Ivaschenko TE, Liehr T, et al. Systems genetics view of endometriosis: a common complex disorder[J]. Eur J Obstet Gynecol Reprod Biol, 2015(1):59-65.
[22]Rizner TL. Diagnostic potential of peritoneal fluid biomarkers of endometriosis[J]. Expert Rev Mol Diagn, 2015(4): 557-580.
[23]Fassbender A, Rahmioglu N, Vitonis AF, et al. World endometriosis research foundation endometriosis phenome and biobanking harmonisation project: IV tissue collection, processing, and storage in endometriosis research[J]. Fertil Steril, 2014(5): 1244-1253.
[24]Rahmioglu N, Fassbender A, Vitonis AF, et al. World endometriosis research foundation endometriosis phenome and biobanking harmonization project: III fluid biospecimen collection, processing, and storage in endometriosis research[J]. Fertil Steril, 2014(5):1233-1243.
[25]Becker CM, Laufer MR, Stratton P, et al. World endometriosis research foundation endometriosis phenome and biobanking harmonisation project: I. Surgical phenotype data collection in endometriosis research[J]. Fertil Steril, 2014(5):1213-1222.
(2016-01-08收稿,2016-04-07修回)
中文编辑: 刘平; 英文编辑: 周凌
The Correlation between Macrophage Activity and Endometriosis
HU Yuhong1, SONG Meiyu2
(1.DepartmentofObstetricsandGynecology, 1stAffiliatedHospitalofJiamusiUniversity,Jiamusi154002,Heilongjiang,China;2.ClinicalMedicineCollege,JiamusiUniversity,Jiamusi154003,Heilongjiang,China)
[Abstract]Objective: To study the relationship between macrophages and endometriosis. Methods: Twenty patients with ovarian chocolate cysts and 20 patients with uterine fibroids were selected; all patients underwent laparoscopic surgery. Approximately 15 mL peritoneal fluid was extracted before operation and single cell suspension was made. The microscopic imaging technique, Cell-sense standard system and Image J system were used to examine the trajectory, velocity of macrophages, as well as the changes in areas of endometrial cells within 4 hours. The ratio of macrophages expressed specific immunological markers measured by the flow cytometry was also calculated. The indicators mentioned above were collected and compared between the two groups. Results: The rate of macrophage movement of experimental group was lower than that in control group (P<0.05); the growth of endometrial cell areas of in experimental group was significant higher than that in control group (Z=-4.599, P<0.05); and the ratio of macrophages expressed specific immunological markers of CD69, CD71 and CD54 was statistically lower than that in control group (P<0.05). Conclusion: The decrease of macrophage function may cause a backflow of endometrial tissue to form new lesions in the abdominal cavity, causing EMT.
[Key words]macrophage; endometriosis; movement speed
[中图分类号]R783.5
[文献标识码]A
[文章编号]1000-2707(2016)04-0418-05
*[基金项目]佳木斯大学重点科技项目资助,项目编号(Sz2014-008)
网络出版时间:2016-04-20网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160420.1757.010.html

