沙拉沙星单克隆抗体制备及鉴定
刘儒彪,胡骁飞,张改平,3,王 慧,王方雨,刘 璐,刘 玺,邓瑞广,宋照军
(1.河南科技学院 食品学院,河南 新乡 453003;2.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002;3.河南农业大学 牧医工程学院,河南 郑州 450002)
沙拉沙星单克隆抗体制备及鉴定
刘儒彪1,胡骁飞2,张改平2,3,王慧1,王方雨2,刘璐1,刘玺1,邓瑞广2,宋照军1
(1.河南科技学院 食品学院,河南 新乡453003;2.河南省农业科学院 动物免疫学重点实验室,河南 郑州450002;3.河南农业大学 牧医工程学院,河南 郑州450002)
摘要:为制备敏感性好、亲和力高、特异性强的抗沙拉沙星(Sarafloxacin,SARA)单克隆抗体,采用碳二亚胺法合成SARA人工抗原,通过免疫BALB/c小鼠,选择血清效价高且敏感性好的小鼠,采用杂交瘤细胞技术进行细胞融合,筛选分泌抗SARA单克隆抗体(Monoclonal antibody,mAb)的杂交瘤细胞株;采用体内诱生腹水法制备SARA mAb,通过间接ELISA和间接竞争ELISA对SARA mAb的免疫学特性进行鉴定。结果表明:小鼠经免疫原免疫后,小鼠多抗血清效价均达到1∶128 000。选择敏感性较好的2号小鼠进行细胞融合,经多次亚克隆后,筛选出1G3、3H3两株杂交瘤细胞株,其中1G3所产SARA mAb效价较高,为1∶512 000,IC50为6.34 ng/mL,亲和常数为8.55×108 L/mol,与诺氟沙星的交叉反应率为1.06%,与其他药物交叉反应率均低于0.50%。
关键词:沙拉沙星;单克隆抗体;杂交瘤细胞;免疫学特性
沙拉沙星(Sarafloxacin,SARA)又称6-氟-1-(4-氟苯基)-1,4-二氢-4-氧代-7-(1-哌嗪基)-3-喹啉羧酸,是氟喹诺酮类药物的一种,属于第3代喹诺酮类药物,于1995年上市并得到应用,同时也是美国食品药品监督管理局(Food and drug administration,FDA)批准用于食用动物的第一个氟喹诺酮类药物[1-2]。由于其具有良好的杀菌效果,且价格低廉而被广泛应用,主要用于治疗家禽、水产、畜牧等养殖业中,由敏感细菌引起的泌尿系统、呼吸系统、消化系统等感染疾病以及霉形体病[3-5]。
虽然SARA被广泛用于动物疾病的治疗,但其在食品动物中的残留,会经过人食用动物组织后转移到人体内并在人体内蓄积,从而增加人体内的病原体对氟喹诺酮类药物的耐药性,以致人在生病时服用氟喹诺酮类药物会降低其药性,从而影响该类药物的临床疗效[6-7]。2002年,我国农业部第235号公告《动物性食品中兽药最高残留限量》中对SARA在动物性食品中的残留作了明确限量要求,规定其在鸡肌肉、脂肪、肝、肾中的最高残留限量分别为10,20,80,80 μg/kg,在鱼肌肉和皮中的最高残留限量均为30 μg/kg。目前,对于SARA的残留检测方法,主要为高效液相色谱法以及液相色谱与质谱串联的检测方法[8-11]。尽管这些检测方法的精确度和灵敏度都很高,但是由于其设备昂贵且体积大,样品处理繁琐费时、成本高且技术复杂,只能限于实验室内检测,无法满足现场大批量快速检测需求。免疫学检测方法具有检测速度快、敏感且一次能检测大量样品的特点,能实现现场快速检测,且成本较低,能够弥补仪器检测的不足并已广泛应用于食品中抗生素残留的检测[12-15]。本研究通过杂交瘤细胞技术制备亲和力高、强特异、强抗SARA的单克隆抗体,建立SARA免疫学快速检测方法。
1材料和方法
1.1试剂与溶液
SARA、诺氟沙星(Norfloxacin)、环丙沙星(Ciprofloxacin)、甲硝唑(Metronidazole)、土霉素(Oxytetracycline)、四环素(Tetracycline)、金霉素(Aureomycin)、新霉素(Neomycin)标准品以及3,3′,5,5′-四甲基联苯胺(TMB)、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)、鼠源单克隆抗体亚型鉴定试剂、牛血清白蛋白(BSA)、鸡卵清蛋白(OVA),均购自美国Sigma公司;司帕沙星(Sparfloxacin)标准品,购自中国兽医药品监察所;1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS),购自美国Pierce Biotechnology公司;羊抗兔酶标二抗(GaMIgG-HRP),购自美国Abbkine公司;细胞培养基RPMI-1640、HAT、HT和PEG-1500,购自美国Gibco公司;其他试剂均为分析纯;试验用水为超纯水;包被液(CBS,0.05 mol/L碳酸盐缓冲液)、封闭液(猪血清含量为5%的PBST溶液)、显色液(TMB磷酸-柠檬酸缓冲液)、终止液(浓度为2 mol/L的H2SO4溶液)、0.01 mol/L磷酸盐缓冲液(PBS),均为动物免疫学重点实验室配制。
1.2仪器与设备
恒温恒湿试验箱,购自上海一恒科学仪器有限公司;高速冷冻离心机,购自美国Thermo Scientific公司;iMark 450/550酶标仪,购自美国Bio-Rad公司;HI9321 pH计,购自美国Hanna公司;One DropTMOD-1000+分光光度计,购自美国NanoDrop公司;涡旋振荡器、控温磁力搅拌器,购自德国IKA公司;AE260电子天平,购自德国Mettler公司;超净工作台,购自美国Forma Scientific公司;倒置显微镜,购自德国Leica公司;CO2培养箱,购自美国Precision公司。
1.3供试动物与瘤细胞
供试动物为SPF级8周龄雌性BALB/c小鼠,由动物免疫学重点实验室繁殖饲养。瘤细胞为小鼠骨髓瘤细胞系NS0,由动物免疫学重点实验室保存。
1.4人工抗原合成及多抗血清鉴定
参照文献[16-17]报道的方法,采用碳二亚胺(EDC)法制备免疫抗原SARA-BSA和包被抗原SARA-OVA,制备路线见图1。以20 μg/只的剂量背部皮下多点注射免疫SPF级BALB/c小鼠,免疫4次(每次免疫间隔时间为3周),第4次免疫30 d后对小鼠进行断尾采血,ELISA测定小鼠多抗血清效价和敏感性,筛选效价高和敏感性好的小鼠进行细胞融合。
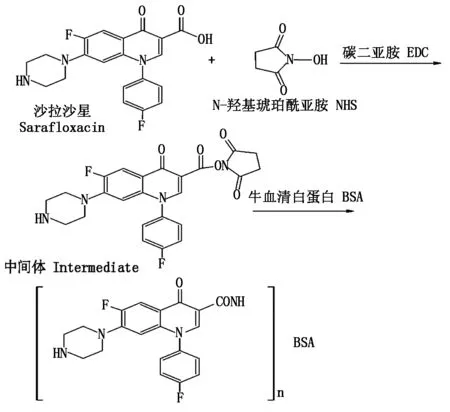
图1 SARA人工抗原制备路线
1.5杂交瘤细胞株的建立
NS0骨髓瘤细胞与BALB/c小鼠脾细胞在PEG1500的作用下融合,将细胞悬液置于37 ℃恒温培养箱中进行培养,7 d后用HT培养基置换半量细胞液,12~14 d后观察细胞生长情况,并抽取细胞上清液,ELISA测定其效价和敏感性,筛选各项指标均较高的细胞进行有限稀释克隆化(部分冻存备用),直至所有克隆鉴定结果一致。
1.6SARA mAb的大量制备
采用体内诱生腹水法制备SARA mAb,取3只8周龄BALB/c小鼠,腹腔注射液体石蜡0.5 mL/只,10 d后将亚克隆后扩大培养的细胞以2×106~5×106个/只注入小鼠腹腔。待小鼠腹部肿瘤明显肿大时即可采集腹水,3 000 r/min离心15 min,除去细胞及杂质沉淀,上清用饱和硫酸铵盐析法纯化得到SARA mAb。
1.7SARA mAb的免疫学特性鉴定
用间接ELISA测定SARA mAb效价,用间接竞争ELISA测定SARA mAb对SARA的抑制率,横坐标为SARA标准液各质量浓度的对数值,纵坐标为抑制率(B/B0)(B为SARA标准液各质量浓度的OD450值,B0是SARA标准液质量浓度为0时的OD450值),绘制标准抑制曲线,进行回归分析,计算SARA mAb对SARA的半数抑制浓度(IC50),并以此来衡量SARA mAb的敏感性[18-21],IC50越小,说明其敏感性越强。
采用间接ELISA对SARA mAb的亚型进行鉴定。具体步骤按照鼠源单克隆抗体亚型鉴定试剂的说明书进行操作。参照Beatty等[22]所述的方法测定SARA mAb的亲和常数Ka。亲和常数计算公式Ka=(n-1)/2(n[Ab′]t-[Ab]t)(其中n=[Ag]t/[Ag′]t,[Ag]t、[Ag′]t分别为2个不同的包被原浓度,[Ab]t、[Ab′]t分别为各包被原浓度下50%OD值时所对应的SARA mAb浓度)。
以SARA的同类药物诺氟沙星、环丙沙星、司帕沙星,以及新霉素、四环素、金霉素、土霉素、甲硝唑等其他药物作为竞争物,测定SARA mAb对其竞争物的IC50,计算其交叉反应率(Cross reactivity,CR),并以交叉反应率的大小来判定SARA mAb的特异性,交叉反应率越高,其特异性越低。
2结果与分析
2.1多抗血清效价测定
由ELISA检测结果可知,被免疫的6只小鼠获得了较好的免疫效果,小鼠多抗血清效价均在1∶128 000以上(图2),2号小鼠多抗血清效价最高,达到了1∶25 600。
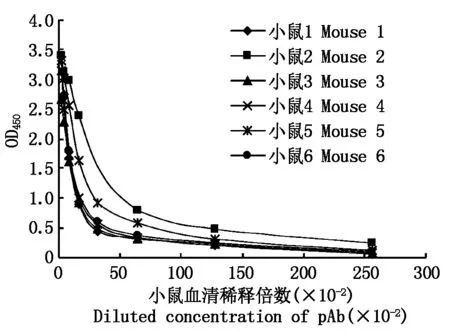
图2 小鼠多抗血清效价
2.2抗SARA单克隆抗体(SARA mAb)杂交瘤细胞株的建立
选择2号小鼠进行融合,通过间接ELISA检测融合的6块细胞培养板中有189个阳性孔,阳性率为32.8%。选取其中6孔强阳性进行多次亚克隆,通过间接竞争ELISA测定IC50,最终筛选出2株效价高、敏感性强的杂交瘤细胞,分别命名为1G3和3H3,经过多次冻存与复苏后,仍能够稳定分泌抗体。
2.3SARA mAb免疫特性的鉴定
2.3.1效价测定杂交瘤细胞上清和腹水效价测定结果见表1。2株杂交瘤细胞分泌的SARA mAb均具有较高的效价,采用体内诱生腹水法制备SARA mAb,经检测1G3株效价较高,可以达到1∶512 000。

表1 SARA mAb效价测定
2.3.2敏感性鉴定间接竞争ELISA测定2株细胞产生的SARA mAb抑制效价,其中1G3株产生SARA mAb抑制效果较好,标准曲线如图3所示,线性回归方程为y=-0.446 8x+0.858 3,R2=0.991 1,IC50为6.34 ng/mL,表明SARA mAb对SARA具有很强的敏感性。
2.3.3亚型鉴定 通过鼠源单克隆抗体亚型检测试剂鉴定,2株杂交瘤细胞所产SARA mAb的亚型均为IgG1型。
2.3.4亲和常数测定 间接ELISA测定不同包被浓度下SARA mAb的亲和常数曲线(图4),以曲线上部接近水平线段的OD值为100%,计算出50%OD值对应的SARA mAb浓度,经计算,亲和常数Ka=8.55×108L/mol。本试验采用Beatty饱和法测定Ka,该方法简便易行,不需复杂的技术和设备。根据Goding[23]的结论,高亲和力抗体的亲和常数通常为107~1012L/mol,所以本试验制备的SARA mAb亲和力较高,适用于免疫学检测方法的建立。
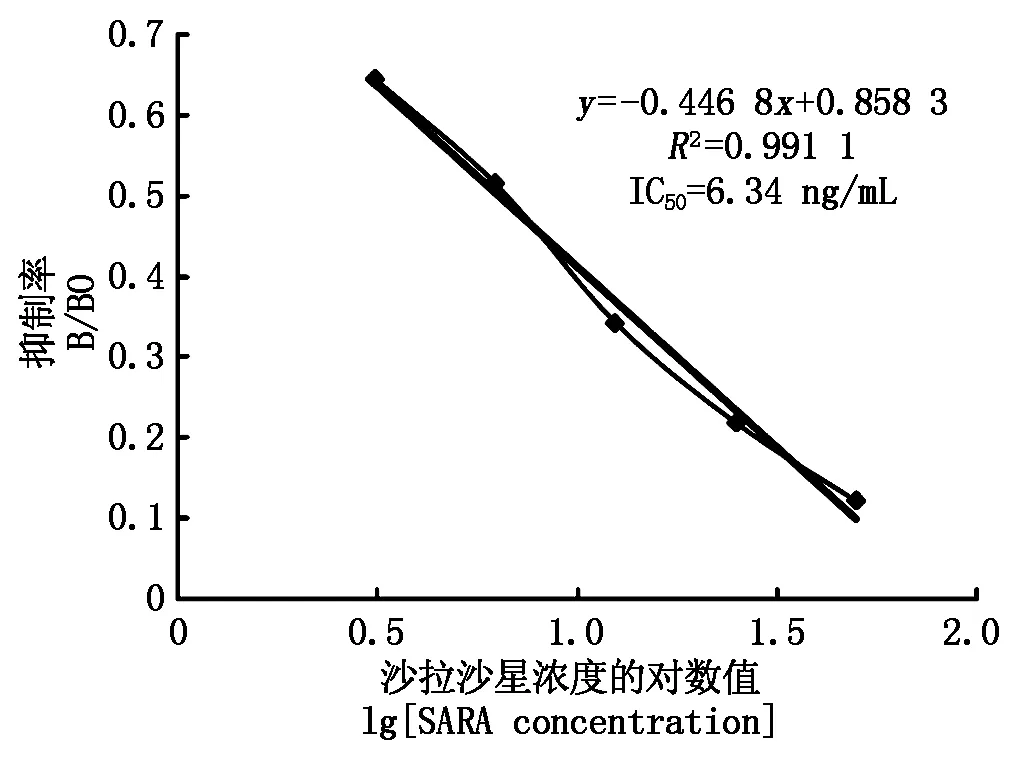
图3 SARA mAb间接竞争ELISA抑制曲线
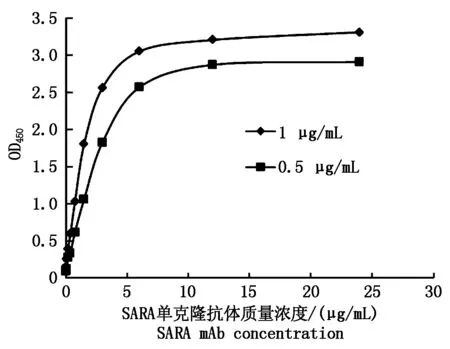
图4 亲和常数测定曲线
2.3.5特异性鉴定间接竞争ELISA对SARA mAb特异性的鉴定结果如表2所示,SARA mAb与诺氟沙星交叉反应率为1.06%,SARA mAb与其他竞争物的IC50均大于1.5×103,交叉反应率均小于0.5%。说明SARA mAb对SARA特异性好,交叉反应率低。
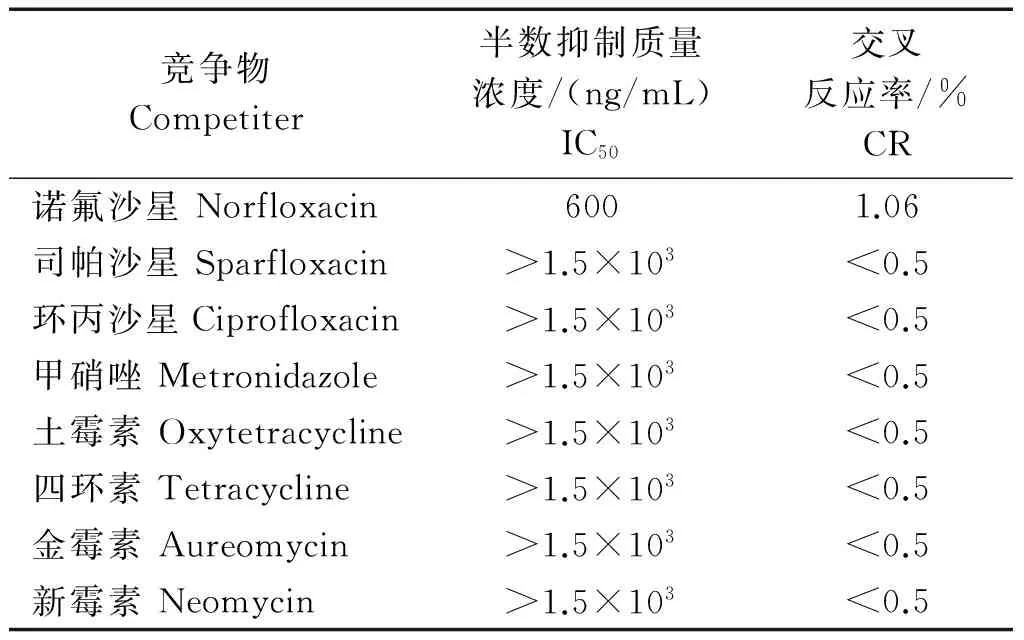
表2 交叉反应率测定
3结论与讨论
在细胞融合过程中,融合剂的选择很重要,正常情况下细胞融合效果与PEG的分子质量及其浓度呈正比,但PEG的分子质量越大、浓度越高,对细胞的毒性越大。另外,PEG的pH值和滴加PEG的速度也会对细胞融合产生影响[24]。本研究采用PEG1500作为融合剂,pH值在8.0~8.2,滴加1 mL PEG,时间为1 min(前15 s加入0.3 mL,30 s加入0.4 mL PEG,后15 s 加入0.3 mL PEG)。反应1.5 min后向离心瓶加入15 mL预热的GNK溶液进行终止反应,(加入时间分别为1 mL/30 s、3 mL/30 s、11 mL/30 s),细胞融合效果最佳。
脾细胞与瘤细胞的融合是一个随机结合过程,融合后的细胞可能会以多种形态存在,需将非目的融合细胞的细胞除去。HAT选择性培养基是在基础培养基上加入氨基蝶呤、次黄嘌呤、胸腺嘧啶核苷等,其中氨基蝶呤能阻止细胞DNA的合成,且瘤细胞本身又不能进行自身繁殖。因此,在HAT选择性培养基上进行细胞培养时,只有脾细胞与瘤细胞融合后的细胞才能正常存活,即目的融合细胞。采用有限稀释法对筛选出的目的融合细胞进行亚克隆,间接ELISA和间接竞争ELISA鉴定抗体,多次亚克隆至筛选出能稳定分泌效价高、特异性好的抗体的杂交瘤细胞株[25]。
本研究利用已获得免疫反应的小鼠,通过杂交瘤细胞融合技术筛选出了2株敏感性高、特异性强的杂交瘤细胞株,采用体内诱生法制备腹水,经纯化、鉴定后,获得了效价高、敏感性好、亲和力高、特异性好的SARA mAb,可用于SARA残留免疫分析方法的建立和SARA残留检测产品的开发。
参考文献:
[1]Holtzapple C K,Buckley S A,Stanker L H.Production and characterization of monoclonal antibodies against sarafloxacin and cross-reactivity studies of related fluoroquinolones[J].Journal of Agricultural and Food Chemistry,1997,45(5):1984-1990.
[2]Mc Conville M L,Dijkstra J W,Stamm J M,et al.Effects of sarafloxacin hydrochloride on human enteric bacteria under simulated human gut conditions[J].Veterinary Quarterly,1995,17(1):1-5.
[3]Martinsen B,Myhr E,Reed E,et al.Invitroantimicrobial activity of sarafloxacin against clinical isolates of bacteria pathogenic to fish[J].Journal of Aquatic Animal Health,1991,3(4):235-241.
[4]Chansiripornchai N,Sasipreeyajan J.Efficacy of sarafloxacin in broilers after experimental infection withEscherichiacoli[J].Veterinary Research Communications,2002,26(4):255-262.
[5]曾振灵,陈杖榴,冯淇辉,等.沙拉沙星对实验性感染猪链球菌病及大肠杆菌病的药效学[J].中国兽医学报,2000,20(1):70-73.
[6]Holtzapple C K,Buckley S A,Stanker L H.Development of antibodies against the fluoroquinolone sarafloxacin and molecular modeling studies of cross-reactive compounds[J].Food and Agricultural Immunology,1997,9(1):13-26.
[7]Ding H Z,Zeng Z L,Fung K F,et al.Pharmacokinetics of sarafloxacin in pigs and broilers following intravenous,intramuscular,and oral single-dose applications[J].Journal of Veterinary Pharmacology and Therapeutics,2001,24(5):303-308.
[8]Roudaut B,Yorke J C.High-performance liquid chromatographic method with fluorescence detection for the screening and quantification of oxolinic acid,flumequine and sarafloxacin in fish[J].Journal of Chromatography B,2002,780(2):481-485.
[9]刘媛,谢孟峡,丁岚,等.高效液相色谱同时测定鸡蛋中4种氟喹诺酮类药物残留[J].分析化学,2004,32(3):352-355.
[10]Schilling J B,Cepa S P,Menacherry S D,et al.Liquid chromatography combined with tandem mass spectrometry for the confirmation of sarafloxacin in catfish tissue[J].Analytical Chemistry,1996,68(11):1905-1909.
[11]董琳琳,刘艳华,汪霞,等.反相高效液相色谱法同时测定4种氟喹诺酮类药物在鸡可食性组织中的残留[J].色谱,2005,23(3):285-288.
[12]Beier R C,Stanker L H.Application of immunoassay for detection of antibiotics in foods and feed:a review[J].Recent Research Developments in Agricultural & Food Chemistry,2000,4(1):59-93.
[13]Zhang L,Jiang J Q,Li G L,et al.Development and optimization of a monoclonal antibody-based indirect competitive ELISA for detecting fluoroquinolone residue in milk[J].Journal of Food Agriculture and Environment,2011,9(2):113-120.
[14]吕书为,雷红涛,唐秋实,等.氟喹诺酮药物格林沙星抗体制备及其icELISA方法建立[J].中国食品学报,2014(6):187-193.
[15]邢广旭,王国栋,胡骁飞,等.诺氟沙星ELISA试剂盒研制与性能鉴定[J].中国农业科学,2013,46(16):3470-3477.
[16]刘儒彪,胡骁飞,孙亚宁,等.沙拉沙星完全抗原的合成及多克隆抗血清制备[J].河南农业科学,2014,43(5):167-171.
[17]刘庆堂,王磊,职爱民,等.碳二亚胺法制备阿莫西林人工抗原及其鉴定[J].河南农业科学,2012,41(3):142-145.
[18]王坤,李清洲,胡骁飞,等.T-2毒素人工抗原的合成及鼠源多克隆抗血清的制备[J].河南农业科学,2013,42(5):158-162.
[19]王耀,胡骁飞,裴亚峰,等.伏马菌素B1人工抗原的合成及鼠源多克隆抗血清的制备[J].核农学报,2012,26(1):113-117.
[20]胡骁飞,魏凤仙,李青梅,等.植酸酶单克隆抗体的制备及鉴定[J].华北农学报,2012,27(5):44-48.
[21]刘宣兵,滕蔓,张改平,等.新霉素单克隆抗体的制备及其免疫学特性鉴定[J].华北农学报,2009,24(4):80-83.
[22]Beatty J D,Beatty B G,Vlahos W G.Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay[J].Journal of Immunological Methods,1987,100(1/2):173-179.
[23]Goding J W.Monoclonal antibodies:principles and practice[M].America:Academic Press,1996:142-147.
[24]王玲玲,职爱民,杨艳艳,等.抗百菌清单克隆抗体的研制与鉴定[J].中国农业科学,2013,46(7):1509-1515.
[25]宋春美,李青梅,刘庆堂,等.喹乙醇单克隆抗体的制备及其免疫学特性的鉴定[J].核农学报,2010,24(4):777-783.
Preparation and Identification of Monoclonal Antibody for Sarafloxacin
LIU Rubiao1,HU Xiaofei2,ZHANG Gaiping2,3,WANG Hui1,WANG Fangyu2,LIU Lu1,LIU Xi1,DENG Ruiguang2,SONG Zhaojun1
(1.College of Food Science and Technology,Henan Institute of Science and Technology,Xinxiang453003,China;2.Henan Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences,Zhengzhou450002,China;3.College of Animal Science and Veterinary Medicine,Henan Agricultural University,Zhengzhou450002,China)
Abstract:In order to preparation of sarafloxacin(SARA)monoclonal antibody with good sensitivity,high affinity and strong specificity,synthesized SARA artificial antigen by carbodiimide method.It was used to immunize BALB/c mice.The mice which possessed high serum titer and good sensitivity were selected for cell fusing through cell hybridoma technique.Then to filtrate the hybridoma cell strain which secreted SARA monoclonal antibody(mAb).Prepared SARA mAb by inducing ascites in vivo,and identificated the immunity characteristics of SARA mAb via indirect ELISA and indirect competitive ELISA.The result indicated that after mice were immune by immunogen,their serum antibody titer were all up to 1∶128 000.Number 2 mouse with good sensitivity was chosen for cell fusion.After multiple sub cloning,1G3 and 3H3 hybridoma cell strain were filtered.The titer of SARA mAb from 1G3 was 1∶512 000,IC50was 6.34 ng/mL,affinity constant was 8.55×108 L/mol,cross-reactivity with norfloxacin was 1.06%,cross-reactivity with other drugs were below 0.50%,higher than that of 3H3.
Key words:Sarafloxacin;Monoclonal antibody;Hybridoma cell;Immunological characteristics
doi:10.7668/hbnxb.2016.02.015
中图分类号:S859.84
文献标识码:A
文章编号:1000-7091(2016)02-0087-05
作者简介:刘儒彪(1987-),男,河南商丘人,在读硕士,主要从事农产品深加工技术研究。通讯作者:宋照军(1973-),男,河南新乡人,副教授,主要从事肉品加工与质量安全控制研究。邓瑞广(1960-),男,河南平顶山人,研究员,硕士,主要从事动物疫病及食品安全免疫学检测技术研究。
基金项目:2015年河南省科技攻关项目(152102310094);河南省高校科技创新团队支持计划项目(13IRTSTHN006)
收稿日期:2016-02-26

