Mutator转座子介导的玉米甜质突变体侧翼序列克隆
成 业,么大轩,刘云婷,胡文静,段会军
(河北农业大学,华北作物种质资源研究与利用教育部重点实验室,河北 保定 071001)
Mutator转座子介导的玉米甜质突变体侧翼序列克隆
成业,么大轩,刘云婷,胡文静,段会军
(河北农业大学,华北作物种质资源研究与利用教育部重点实验室,河北 保定071001)
摘要:为了探讨Mu转座子使玉米发生甜质突变的分子机理,利用Mu-AFLP方法分离Mutator转座子插入位点的侧翼序列,并根据侧翼序列的延伸设计一对特异性引物P1、P2,验证转座子插入的真实性,同时对插入位点所在的基因进行生物信息学分析。结果显示:侧翼序列长299 bp,插入位点位于第3染色体,该转座子的插入属于真实插入;突变基因全长5 746 bp,共编码592个氨基酸;所编码蛋白的理论分子量为67.5 kDa,疏水性氨基酸含量为42.06%,具有10个跨膜结构域,属于亲水性内膜蛋白。该结果为更好地利用Mutator转座子创制甜玉米新种质奠定了基础,也对揭示玉米胚乳发育与淀粉合成机制具有重要意义。
关键词:甜玉米;Mutator转座子;玉米;Mu-AFLP
甜玉米以其丰富的营养及甜、嫩、香等特点成为一种大众化蔬菜[1-3]。由于甜玉米的遗传基础较窄,又没有像普通玉米那样有现成的杂种优势模式可供应用,还需要利用SSR[4]、SNP[5]等分子标记去划分杂种优势类群,这给甜玉米的选育[6-7]带来了困难,甜玉米育种已经远远落后生产的需求,因此,创制甜玉米种质资源显得尤为重要。
Mutator介导法是创造玉米突变体的最有效的技术之一[8]。在玉米突变体库的构建中有物理、化学、农杆菌介导的T-DNA[9-12]和转座子插入突变等多种方法,其中Mutator具有较高的诱变频率、低插入位点偏爱性和基因组内拷贝数多等特点。获得Mu因子诱导的突变体后,必须通过对Mu插入位点侧翼序列的生物信息学分析,才能预测突变基因功能。目前,用于分离Mu插入侧翼序列的方法很多,主要包括PCR步移技术[13]、反向PCR技术[14-15]、热不对称交错 PCR技术[16]、AFLP技术[17]等。其中AFLP所需DNA量少,扩增效率高,标记结果稳定可靠,对Mu插入位点侧翼序列分离的准确性和反应的效率高,适合于分离Mu介导的玉米突变位点侧翼序列。
本研究通过对Mutator转座子介导的玉米甜质突变体侧翼序列克隆及突变基因生物信息学分析,为玉米胚乳发育与淀粉合成机制的进一步研究奠定了基础。
1材料和方法
1.1供试材料
玉米优良自交系综31(Z31)为母本与具有原始来源活性的MuDR转座子的Mu为父本进行杂交构建诱变群体M1,M1自交获得M2果穗,筛选出Mu转座子诱导的甜玉米突变体,作为本研究Mu-AFLP技术分离甜玉米突变体目标基因的试材。提取母本Z31、父本Mu和突变体的DNA作为分离Mu插入位点侧翼序列的模板。
1.2试验方法
1.2.1玉米基因组DNA的提取和纯化采用液氮研磨,CTAB抽提的方法[18]提取玉米基因组DNA,并放于-20 ℃备用。
1.2.2Mu-AFLP方法分离插入位点侧翼序列参照2008年,Wang等[19]的方法,研究分离Mu因子插入位点侧翼序列。
1.2.3差异片段的回收、连接、转化和测序利用6%聚丙烯酰胺凝胶电泳检测选择性扩增的差异片段,把Z31、Mu亲本和突变体的选择性扩增结果进行对比,发现突变体的差异片段,回收差异条带,用选扩体系及PCR程序再次扩增。1.5%琼脂糖回收检测后连接到PMG-T载体上,将重组质粒转化到大肠杆菌,蓝白斑筛选阳性克隆,进行菌液PCR鉴定重组子,之后送上海生工有限公司测序。
1.2.4侧翼序列的基因比对将去除载体后的序列在MaizeGDB(http://www.maizegdb.org)上与B73序列进行对比。
1.2.5插入位点真实性验证在MaizeGDB将侧翼序列上下延伸100~200 bp,使用Primer Premier 6.0软件对该序列设计一对特异引物来进行插入位点的真实性检测,并分别命名引物为P1、P2(图1)。
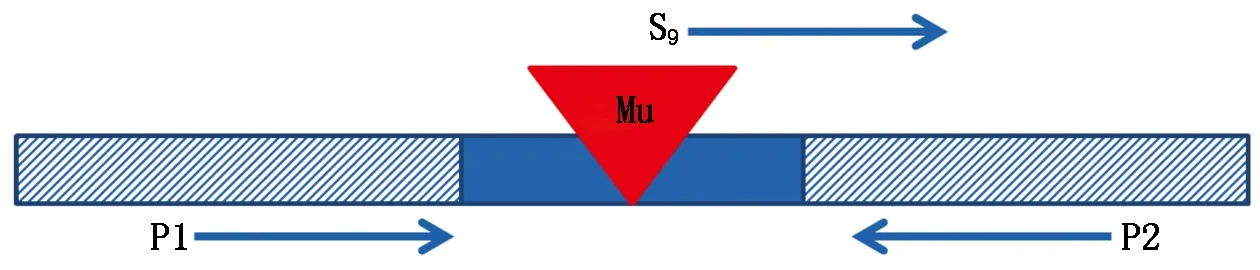
图1 Mu插入位点的真实性验证引物设计示意图
1.2.6ZmEMP70的生物信息学分析利用Mu-AFLP方法得到Mu转座子插入位点侧翼序列,将所获得的序列在MaizeGDB(http://www.maizegdb.org/)中比对基因组获得基因的全长。借助NCBI中的ORF Finder(http://www.nvbi.nlm.nih.gov/gorf/orfig.cgi)工具寻找基因完整的ORF并且利用EditSeq软件对该基因ORF进行分析。利用DNASTAR的Protean对蛋白质所含的氨基酸残基和理论分子量,以及等电点和组成氨基酸的化学性质进行分析。利用http://bioinf.cs.ucl.ac.uk/psipred/对ZmEMP70编码的蛋白的二级结构进行分析。利用TMHMM-2.0对ZmEMP70 编码的蛋白跨膜结构域进行分析。
2结果与分析
2.1插入位点侧翼序列分离
预扩增后吸取10 μL进行琼脂糖凝胶电泳检测,得到弥散条带(图2),再进行下一步选择性扩增。
1.DL2000 Marker;2.Mu亲本;3.Z31亲本;4.突变体。
通过选择性扩增进行检测,检测结果见图3。图中明显检测到了突变体与亲本的差异(A、B箭头)条带,并通过回收、测序等操作分离得到插入位点侧翼序列为299 bp。

Z31.母本;Mu.父本;T.突变体。
2.2插入位点真实性检测
利用P1、P2和S9、P2这2对引物分别对Mu活性亲本、Z31、突变体进行检测。结果显示,以P1、P2为引物,Mu亲本、Z31和突变体均有扩增条带;用S9、P2这对引物检测,Z31与Mu亲本在约300 bp处均无带而突变体有带(图4),证实其为真实插入。

1.Z31、2.Mu、3.突变体,是P1、P2扩增引物检测结果;
2.3生物信息学分析
2.3.1基因定位及基因全长的获得使用NCBI(http://www.ncbi.nlm.nih.gov)去除载体序列,将去除载体后的序列在MaizeGDB(http://www.maizegdb.org)上与B73序列进行对比,发现该侧翼序列与B73第3染色体上的一段区域完全匹配并上下延伸获得基因全长(图5)。
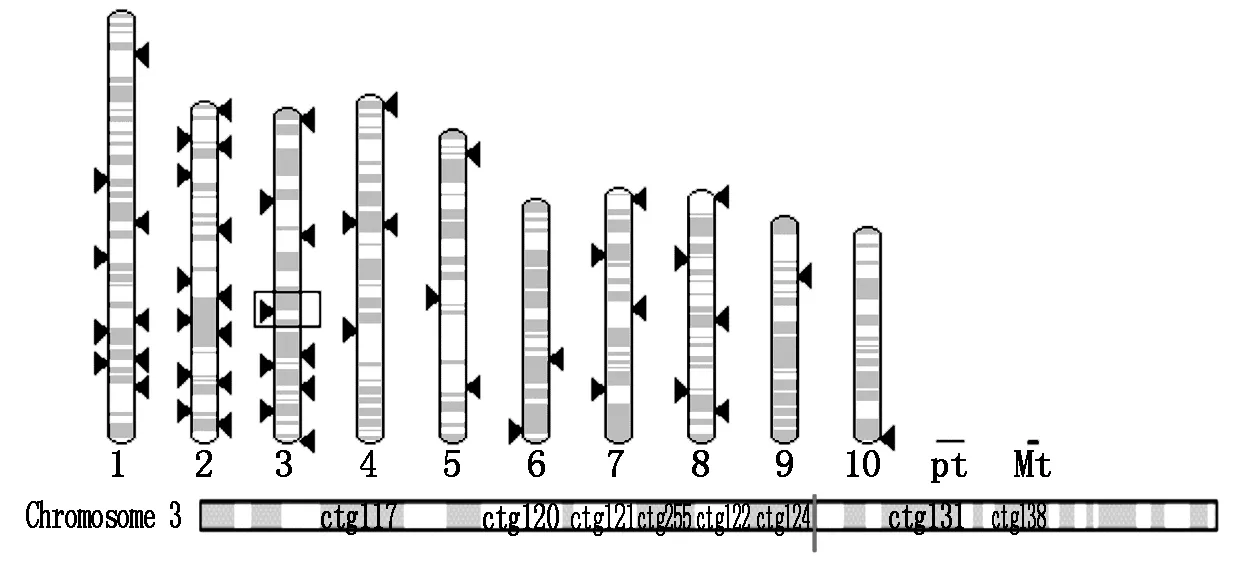
图5 在基因组及染色体上的位置
2.3.2ZmEMP70的克隆及序列分析将侧翼序列在MaizeGDB(http://www.maizegdb.org/)上进行比对并延伸得到基因的全长共5 746 bp。借助NCBI中的ORF Finder (http://www.nvbi.nlm.nih.gov/gorf/orfig.cgi)工具寻找完整的基因ORF 1 896 bp,编码592个氨基酸,5′UTR 117 bp,3′UTR 230 bp。2.3.3ZmEMP70编码蛋白质的分析将ZmEMP70的1 896 bp的核苷酸序列翻译成氨基酸序列并利用DNAStar的Protean进行分析,得到该基因编码的蛋白含有592个氨基酸残基,理论分子量67.5 kDa,等电点7.814;在pH=7时带电量为3.317;疏水性氨基酸含量为42.06%,为亲水性蛋白;酸性氨基酸含量为7.60%,碱性氨基酸含量为7.49%,极性氨基酸含量为26.69%(表1)。
2.3.4ZmEMP70编码的蛋白跨膜结构域利用TMHMM-2.0对ZmEMP70编码的蛋白跨膜结构进行分析,可见该蛋白具有10个跨膜结构域,属于内膜蛋白(图6)。
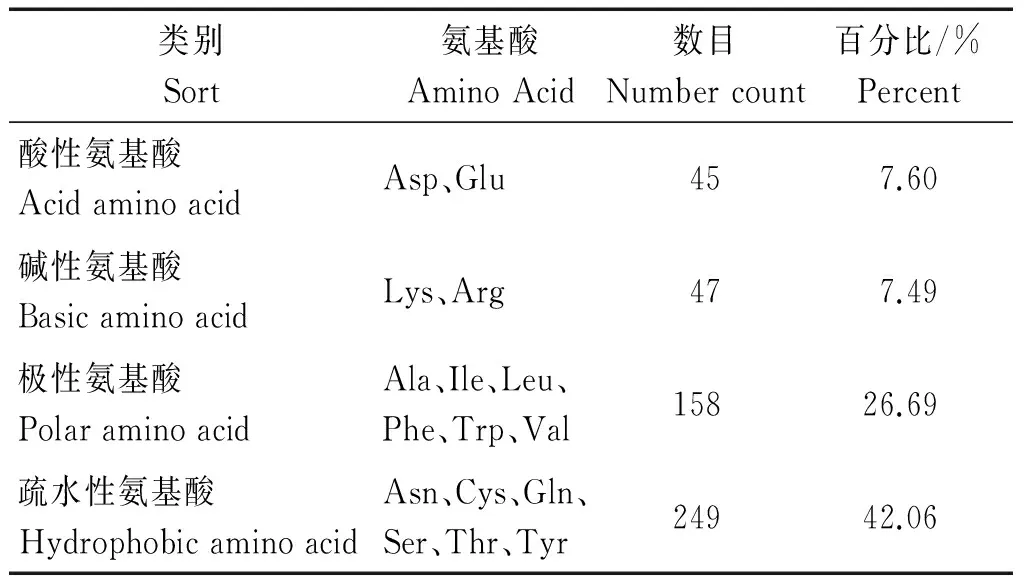
表1 ZmEMP70编码的氨基酸组成分析
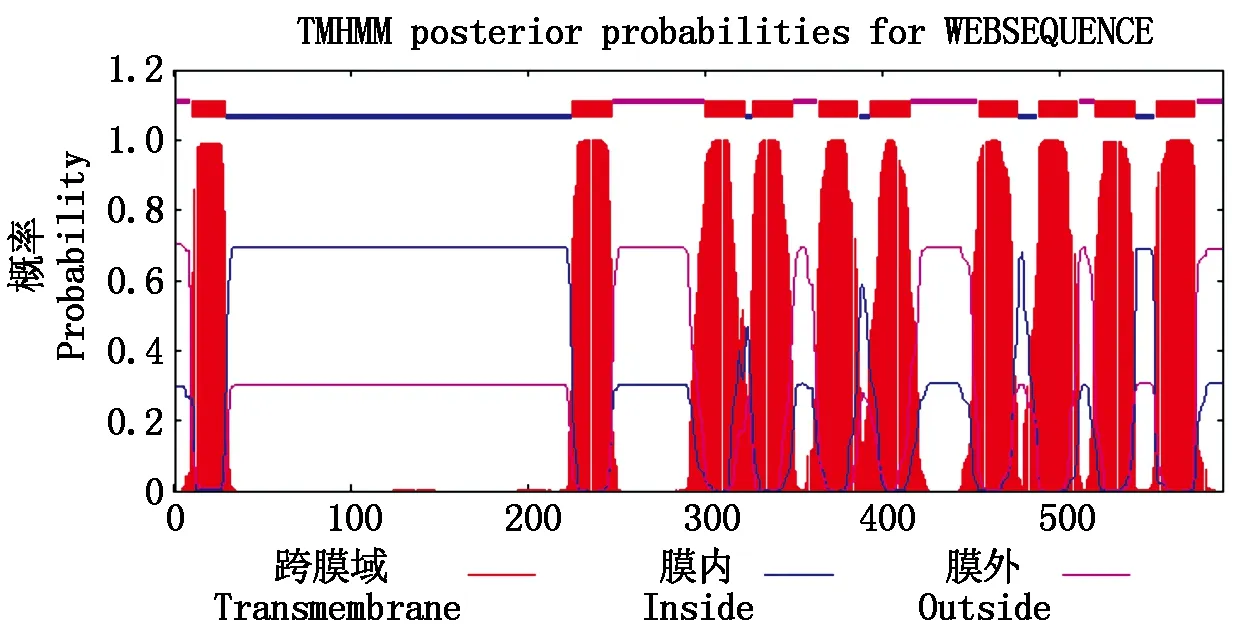
图6 ZmEMP70所编码蛋白的跨膜结构域
3讨论
Mutator转座子具有较高的突变频率、较低的插入专一性、基因组拷贝数多等特点,因此,能够在较少的群体内产生覆盖全基因组的大量突变体[20-23],围绕Mu转座子,国内外构建了不少突变体库,如斯坦福大学的RescueMu突变体库[24],冷泉港实验室的MTMdB突变体库[25],华中农业大学实验室等单位构建的Mu突变体库[26]。通过Mu突变体库己经成功分离克隆了诸多基因。利用Mu突变体库筛选甜玉米突变体进行研究,将加速甜玉米新种质的创制。并有助于对玉米胚乳发育与淀粉合成机制的认识。本研究报道的甜玉米突变体,即是来自于Mu诱导的玉米突变体库。
通过插入真实性检测证明Mu转座子插入到玉米基因组,该插入使得基因结构改变而失活。普通玉米发生突变而变甜涉及复杂的生化过程,玉米的可溶性糖含量可能与胚乳发育机制、淀粉的生物合成等有关。推测该基因能影响玉米胚乳的发育,但该基因的具体功能以及作用机理尚未明确,有望通过RNAi技术[27-29]对该基因进行进一步研究,从而更好地从分子水平控制玉米淀粉的合成。
本研究利用玉米转座子Mutator插入突变的方法获得甜玉米,由于Mutator转座子属于玉米的内源转座子,所以不会对生态环境和食品安全构成威胁。然而,通过转基因技术也可以有目的地创制甜玉米新种质,但当前学术界对转基因食品安全性仍然存在很大争议,并没有一个确切的定论。就各国政府而言,各国对转基因食品均抱有比较谨慎的态度。就我国而言,还是比较保守的,对于含有的任何转基因成分,所有市售食品都必须明确标注。同时,大规模种植转基因甜玉米品种还要防止基因污染,以免给生态环境带来不良影响。因此,利用玉米内源Mu转座子转座而诱导甜玉米的方法更为安全。
参考文献:
[1]刘学铭,陈智毅,唐道邦.甜玉米的营养功能成分、生物活性及保鲜加工研究进展[J].广东农业科学,2010,37(12):90-94.
[2]姚文华,韩学莉,汪燕芬,等.我国甜玉米育种研究现状与发展对策[J].中国农业科技导报,2011,13(2):1-8.
[3]王晓东.我国甜玉米育种的研究现状及发展趋势[J].黑龙江农业科学,2014(10):146-148.
[4]黄华如,梁凯光,蚁珩鑫,等.利用SSR技术分析我国16种甜玉米的遗传特性[J].生物技术通报,2014,05(5):57-61.
[5]卢柏山,史亚兴,宋伟,等.利用SNP标记划分甜玉米自交系的杂种优势类群[J].玉米科学,2015(1):58-62,68.
[6]王慧,卢有林,孙大鹏,等.超甜玉米新品种申科甜1号的选育[J].上海农业学报,2015(5):96-99.
[7]杜如珊,卢保红,魏荣业,等.晋超甜1号水果玉米的选育与栽培技术[J].山西农业科学,2015,43(6):654-656.
[8]张少斌,张力,刘慧,等.玉米Mutator转座子的研究进展[J].贵州农业科学,2013,41(6):5-7.
[9]Shimpei Magori,Vitaly Citovsky.Epigenetic control ofAgrobacteriumT-DNA integration[J].Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms,2011,1809(8):388-394.
[10]Azpiroz-leehan R,Feldmann K A.T-DNA insertion mutagenesis inArabidopsis:going back and forth[J].Trends in Genetics,1997,13(4):152-156.
[11]Katie A C,Patrick J K.Chromosomal translocations are a common phenomenon inArabidopsisthalianaT-DNA insertion lines[J].The Plant Journal,2010,64(6):990-1001.
[12]Li A H,Zhang Y F,Wu C Y,et al.Screening for and genetic analysis on T-DNA-inserted mutant pool in rice[J].Acta Genetica Sinica,2006,33(4):319-329.
[13]Siebert P D,Chenchik A,Kellogg D E,et al.An improved pcr method for walking in uncloned genomic DNA[J].Nucleic Acids Research,1995,23(6):1087-1088.
[14]Triglia T,Peterson M G,Kemp D J.A procedure forinvitroamplification of DNA segments that lie outside the boundaries of known sequences[J].Nucleic Acids Research,1988,16(16):8186.
[15]Does M P,Dekker B M,Degroot M J,et al.A quick method to estimate the t-dna copy number in transgenic plants at an early stage after transformation,using inverse PCR[J].Plant Molecular Biology,1991,17(1):151-153.
[16]Liu Y G,Whittier R F.Thermal asymmetric interlaced PCR:automatable amplification and sequencing of insert end fragments from P1 and YAC clones for chromosome walking[J].Genomics,1995,25(3):674-681.
[17]Cruz-Requenaa M,Aguilar-Gonzáleza C N,Espinoza-Velázquezb J,et al.AFLPs loci associated with polyembryonic maize using selective genotyping analysis[J].Israel Journal of Plant Sciences,2013,61(1-4):46-50.
[18]Murray M G,Thompson W F.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Research,1980,8(19):4321-4325.
[19]Wang Yijun,Yin Guangming,Yang Qin,et al.Identification and isolation ofMu-flanking fragments from maize[J].Journal of Genetics and Genomics,2008,35(4):207-213.
[20]Walbot V.Reactivation of the mutator transposable element system following gamma irradiation of seed[J].Molecular & General Genetics,1988,212(2):259-264.
[21]Walbot V.Reactivation of mutator transposable elements of maize by ultraviolet light[J].Molecular & General Genetics,1992,234(3):353-360.
[22]Walbot V.Strategies for mutagenesis and gene cloning using transposon tagging and T-DNA insertional mutagenesis[J].Annu Rev Plant Physiol Plant Mol Biol,1992(43):49-92.
[23]Walbot V.The Mutator transposable element family of maize[J].Genet Eng,1991,13:1-37.
[24]Fernandes J,Dong Q F,Schneider B,et al.Genome-wide mutagenesis ofZeamaysL.using RescueMutransposons[J].Genome Biology,2004,5(10):82.
[25]May B P,Liu Hong,Vollbrecht E,et al.Maize-targeted mutagenesis:A knockout resource for maize[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(20):11541-11546.
[26]刘文婷,高友军,腾峰,等.Mutator转座子介导的玉米插入突变体库的构建及遗传评价[J].科学通报,2006,51(17):2030-2036.
[27]张桂堂,卢东长城,孙重霞,等.利用正义RNAi技术提高玉米直链淀粉含量效果的研究[J].华北农学报,2010,25(4):92-96.
[28]张志勇,崔艳,黄作喜,等.RNAi技术在玉米遗传改良中的研究进展[J].内江师范学院学报,2013(8):42-45.
[29]郭新梅,宋希云,张晓东.RNAi沉默淀粉分支酶基因SBEI对玉米直链淀粉合成的影响[J].植物学报,2010,06(6):670-678.
Cloning Flanking Sequences Sweet Corn Mutant of Maize Inserted byMutatorTransposon
CHENG Ye,YAO Daxuan,LIU Yunting,HU Wenjing,DUAN Huijun
(Agricultural University of Hebei,North China Key Laboratory for Crop Germplasm Resources of Education Ministry,Baoding071001,China)
Abstract:In order to investigate the molecular mechanism of Mu gene transfer in sweet corn mutant,the flanking sequence of the insertion site of Mutator gene was isolated by Mu-AFLP method,and the authenticity of transposon insertions was verified by a pair of specific primers P1 and P2 designed according to the extension of the flanking sequences.Meanwhile the genetic biological information of the insertion site was analyzed.The results showed that the flanking sequence was 299 bp,which was located on the third chromosome.The full length of the mutant gene was 5 746 bp,encoding 592 amino acid.The theoretical molecular weight of the encoding protein was 67.5 kDa,the hydrophobic amino acid content was 42.06%,which had 10 transmembrane.It belonged to hydrophilic membrane protein.This result laid a foundation for the better use of Mutator to create new germplasm of sweet corn and it was very important for the development of endosperm and starch synthesis in maize.
Key words:Sweet corn;Mutator transposons;Maize;Mu-AFLP
doi:10.7668/hbnxb.2016.02.006
中图分类号:Q785
文献标识码:A
文章编号:1000-7091(2016)02-0028-04
作者简介:成业(1992-),女,河北邢台人,主要从事作物分子设计育种研究。通讯作者:段会军(1965-),男,河北保定人,教授,博士,主要从事作物分子设计育种研究。
基金项目:国家“十二五”科技支撑计划项目“粮食丰产科技工程”课题(2011BAD16B08;2012BAD04BO6;2013BAD07B05);河北农业大学创新创业项目
收稿日期:2016-02-11

