超声造影结合时间-强度定量参数评价肝癌消融术的疗效
何兰芳 刘燕娜 章春泉 皮小兰 叶艳艳 吴建兵
(南昌大学第二附属医院超声科,江西 南昌 330006)
超声造影结合时间-强度定量参数评价肝癌消融术的疗效
何兰芳刘燕娜章春泉皮小兰叶艳艳吴建兵1
(南昌大学第二附属医院超声科,江西南昌330006)
〔摘要〕目的探讨超声造影结合时间强度曲线(TIC)在肝癌微波消融术(MWA)疗效评定中的应用价值。方法选取肝癌患者80例,MWA前及术后1、3、6个月分别行超声造影、增强CT。比较MWA后病灶组织TIC参数变化情况,比较单纯超声造影、超声造影结合TIC和增强CT在肝癌MWA后疗效评估方面的能力。结果完全灭活组术后1、3及6个月病灶的TIC均为一平直线条。部分残留或复发组术前及术后1、3、6个月肿瘤组织的上升时间、平均通道时间、达峰时间均小于周围肝组织(P<0.05),内洗斜率均大于周围肝组织(P<0.05)。MWA术后1、3、6个月单纯超声造影与超声造影结合TIC评估肝癌MWA疗效对比差异显著(P<0.05),超声造影结合TIC与增强CT评估肝癌MWA疗效无显著差异(P>0.05)。结论超声造影结合TIC能准确反映肝脏肿瘤、肝实质、残留或复发肿瘤以及无活性肿瘤组织间的差别,为肝癌TIC疗效评估提供可靠的依据。
〔关键词〕超声造影;时间强度曲线(TIC);肝癌;微波消融术(MWA)
肝癌是世界高发病率和高死亡率的恶性肿瘤之一〔1〕。微波消融术(MWA)由于疗程短、损伤小、重复性好,应用日益广泛。MWA术后疗效的评估主要依靠增强CT(CECT)、磁共振成像(MRI)及超声〔2〕。CECT和MRI由于不能实时引导进针、昂贵、有辐射和禁忌证等原因而受到一定的限制。超声造影成像(CEUS)能准确显示MWA术后病灶的大小、形态、边缘,时间强度曲线(TIC)还可对获取的动态图像进行定量分析,精确反映感兴趣区内的微循环特征。本文对比肝癌患者MWA术前、术后1、3、6个月CEUS表现及TIC定量参数,探讨CEUS结合TIC在肝癌MWA术后疗效评估中的应用价值。
1资料及方法
1.1一般资料 2012年3月至2013年11月我院将要行MWA术的肝癌患者80例,男53例,女27例,年龄63~85〔平均(72.1±10.5)〕岁。原发性肝癌59例,转移性肝癌21例,肿瘤最大直径1.6~5.3 cm,单发灶71例,2~3个病灶9例。MWA术前均经肝组织穿刺活检或两种影像学方法证实。排除已知对六氟化硫有过敏史、孕妇及儿童患者。患者均知情同意。
1.2影像检查与分析方法CEUS:使用Philips IU22型超声诊断仪,C5-1凸阵探头(频率1~5 MHz)。造影剂为声诺维。患者取平卧位或左侧卧位,先常规行二维及彩色多普勒超声扫查肝脏,记录肿瘤声像图特点(病灶大小、数目、位置、回声及血流情况等),切换至实时灰阶谐波造影双幅显像模式,低机械指数(MI:0.05),启动呼吸运动补偿。经前臂浅静脉快速团状声诺维2.4 ml,实时连续地观测病灶动脉相、门脉相、延迟相的灌注模式,动态存储图像并刻盘。进入QLAB9.0工作站脱机分析,获取TIC曲线,用LDRW WIWO拟合获得定量参数:上升时间(RT)、达峰时间(TTP)、峰值强度(PI)、曲线下面积(AUC)、内洗斜率(WIS)、峰值强度减半时间(DT/2)、平均通道时间(MTT)。由两位经验丰富的超声医师共同观察与分析结果得出结论。CECT:使用GE公司Lightspeed 64层螺旋CT机进行全肝增强扫描,层厚5 mm。造影剂为优维显。扫描前行碘过敏皮试。使用高压注射器经肘静脉团注造影剂90~100 ml,注射速度为3 ml/s,于注射后25 s行动脉扫描,70 s行门脉期扫描,120~180 s行平衡期扫描。每次扫描前均告知患者屏气,记录病灶的位置、形态、大小、数量、增强模式及水平,并由两位经验丰富的影像医师分析得出结论。
于MWA术前及术后1、3、6个月行CEUS及CECT检查,按CECT结合血清肿瘤标志物结果分别将术后1、3、6个月患者分为病灶完全灭活组和病灶残存或复发组。分别比较患者术前、术后1、3、6个月的病灶与同期周围肝实质的TIC定量参数值以及单纯CEUS、CEUS结合TIC和CECT在肝癌MWA术后疗效评估方面的能力。如果在复查过程中发现肿瘤复发或残留则行第二次MWA。对于行多次消融治疗的患者,时间推算均以第一次治疗时间为准。
1.3疗效评价若CECT示病灶无异常强化,且血清肿瘤标志物正常,则判定为完全灭活。若CECT示病灶异常强化,且血清肿瘤标志物持续升高,则为病灶残留或复发。若CECT诊断不明确,则以病灶穿刺活检为准。
1.4统计学处理采用SPSS18.0统计软件进行LSD-t检验、t检验及χ2检验。
2结果
完全灭活组病灶术后呈“黑洞样”表现,术后1、3及6个月病灶的TIC曲线均为一平直线条。部分残留或复发组病灶表现为病灶旁或内部结节状、月芽状或环状不规则的异常增强区,为“快进快退”模式。所有患者肝脏TIC定量参数显示,术前及术后1、3、6个月肿瘤组织的RT、MTT、TTP均明显小于同期的周围肝组织(P<0.05),而WIS均明显大于同期的周围肝组织(P<0.05),见表1。单纯CEUS与CEUS结合TIC评估肝癌MWA术后1、3、6个月疗效方面差异均有统计学意义(P<0.05),CEUS结合TIC与CECT评估肝癌MWA术后1、3、6个月疗效方面差异均无统计学意义(P>0.05),见表2。
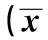
表1 术前、术后1、3、6个月肿瘤组织与周围肝组织TIC定量参数值比较±s,n=80)
与周围肝组织比较:1)P=0.041,2)P=0.000,3)P=0.001,4)P=0.002

表2 CEUS、CEUS结合TIC和CECT
3讨论
由于MWA术的影响,原病灶内部回声变得强弱不等、边界模糊,彻底消融的病灶和残留肿瘤在二维灰阶超声上表现相似,加之残留肿瘤区域通常较小且血流信号微弱,彩色多普勒超声(CDFI)亦不易探及,而CEUS可使图像的空间分辨率和对比分辨率得到提高〔3~5〕。同时,声诺维安全,注射15 min后几乎全部经呼吸道排出体外,这对术后评估具有至关重要的价值〔6〕。
本研究发现残留和复发的肿瘤在CEUS动脉相表现为高增强,与治疗后造影缺失的区域(黑洞)形成强烈对比,使复发肿瘤能清楚地显示出来。通过与治疗前病灶CEUS图像对比,即可判断出MWA疗效。MWA术后残余或复发病灶与其他研究〔7~10〕结果相似。
完全灭活病灶已发生凝固性坏死,其内无微血管灌注,因此无超声造影剂(UCA)进入。部分残留或复发组术前及术后1、3、6个月肿瘤组织的TIC曲线均表现为动脉期UCA迅速被吸收,而在门静脉或延迟期快速消退,与同期正常肝组织的“慢进慢出”形成鲜明对比。上述结果产生的原因可能是由于病灶内的血管密度大、管径粗、间质成分少、动静脉瘘形成造成肿瘤内部缺乏血窦结构难以潴留UCA微泡,从而导致微泡快速廓清〔11,12〕。病灶术前及术后随访中肿瘤活性部分与周围肝实质的PI无明显差异,其原因可能与本组病例中缺乏血管性转移性肝癌在动脉期UCA的快速吸收不明显,而主要表现为延迟期的快速消退有关〔13〕。
由于CT设备普及率高,评价形态及血供等信息完全,已被认为是评价MWA疗效的标准。本研究发现单纯CEUS在评估MWA术后疗效方面明显差于CEUS结合TIC,而CEUS结合TIC与CECT在评估术后疗效方面能力相当。本研究中1例患者曾因患原发性肝癌行肝左叶切除术及肝动脉部分结扎术,后于我院发现残余肝内转移灶,并行MWA治疗。术后1个月CEUS示肿块大部分坏死,而于肿块周边动脉期隐约见一宽约6~9 mm的异常增强带,TIC显示该区域造影剂早于周围肝组织退出,考虑病灶部分残留或复发。但CECT未发现明显异常增强,遂建议患者密切随访观察。术后3个月行CEUS及CECT表现均与术后1个月相似。随访至术后6个月时,CEUS显示肿块周边的异常增强区范围增大,TIC显示异常增强区呈“快进快出”表现,此时CECT亦发现肿块周边的异常强化区,且血清甲胎蛋白(AFP)明显升高,才确诊肿瘤复发并行MWA补充治疗。由此可见,TIC可发现CEUS肉眼难以观察到的细小异常灌注区,CEUS与TIC结合能观察到比CECT早6个月的肿瘤复发灶,二者结合后在探测微小残留或复发灶方面的能力优于CECT。其原因可能与肿瘤术后复发的病灶小,肿瘤血管迂曲、畸形,UCA不易进入且该患者曾行肝动脉部分结扎术,荷瘤血管内血流缓慢有关。UCA为血池造影剂,对血流有着高度的敏感性〔14〕,且TIC可排除人工因素干扰,实现对病灶的定量分析,故能显示出极早期的微小复发灶,而CT所用的碘类造影剂可升高全血黏度,使红细胞易于聚集和变形,使得造影剂进入复发灶内微血管困难〔15〕。
CEUS结合TIC能准确反映肝脏肿瘤、肝实质、残留或复发肿瘤以及无活性肿瘤组织间的差别,MWA术后可及时、准确地辨别出残留或复发的肿瘤组织,在残余肿瘤及微小复发灶上比CECT存在一定的优势,为肝癌MWA治疗疗效评估提供可靠的依据。
4参考文献
1Jemal A,Bray F,Center MM,etal.Global cancer statistics〔J〕.CA:Cancer J Clin,2011;61(2):69-90.
2庄兴俊,王宁宁,侯晓玮,等.影像引导下经皮微波局部消融治疗原发性肝癌疗效观察〔J〕.中华消化病与影像杂志,2013;3(3):147-9.
3Laroia ST,Bawa SS,Jain D,etal.Contrast ultrasound in hepatocellular carcinoma at a tertiary liver center:First Indian experience〔J〕.World J Radiol,2013;5(6):229-40.
4Claudon M,Dietrich CF,Choi BI,etal.Guidelines and good clinical practice recommendations for Contrast Enhanced Ultrasound(CEUS)in the liver-update 2012:A WFUMB-EFSUMB initiative in cooperation with representatives of AFSUMB,AIUM,ASUM,FLAUS and ICUS〔J〕.Ultrasound Med Biol,2013;39(2):187-210.
5Borro P,Testino G.Contrast-enhanced ultrasound for focal liver lesions.Is it necessary an hepatologist expert in ultrasound techniques in the third millennium〔J〕.Liver Int,2013;33(10):1609-10.
6Francesco R,Teresa A,Paolo B,etal.Contrast-enhanced ultrasound evaluation of hepatic microvascular changes in liver diseases〔J〕.World J Gastroenterol,2012;18(37):5225-30.
7Loss M,Schneider J,Uller W,etal.Intraoperative high resolution linear contrast enhanced ultrasound(IOUS)for detection of microvascularization of malignant liver lesions before surgery or radiofrequency ablation〔J〕.Clin Hemorheol Microcirc,2012;50(1):65-77.
8Zhuang H,Yang ZG.Progress in development and application of the contrast-enhanced ultrasound quantitative analysis in perfusion imaging of the abdominal organs〔J〕.J Biomed Engin,2011;28(3):640-4.
9Streba CT,Ionescu M,Gheonea DI,etal.Contrast-enhanced ultrasonography parameters in neural network diagnosis of liver tumors〔J〕.World J Gastroenterol,2012;18(32):4427-34.
10Bolondi L.The appropriate allocation of CEUS in the diagnostic algorithm of liver lesions:a debated issue〔J〕.Ultraschall Med Eur J Ultrasoun,2013;34(1):8-10.
11Yoshida K,Hirokawa T,Moriyasu F,etal.Arterial-phase contrast-enhanced ultrasonography for evaluating anti-angiogenesis treatment:a pilot study〔J〕.World J Gastroenterol,2011;17(8):1045-50.
12Uller W,Wiggermann P,Gossmann H,etal.Evaluation of the microcirculation of hepatocellular carcinomas using contrast-enhanced ultrasound with intraarterial and intravenous contrast application during transarterial chemoembolization with drug-eluting beads(DEB-TACE):preliminary data〔J〕.Clin Hemorheol Microcirc,2011;49(1-4):55-66.
13何雁,李小晶,张玲,等.超声造影时间强度曲线在肝肿瘤定性及评价射频消融效果中的作用〔J〕.中国医学影像学杂志,2013;21(11):844-8.
14Sporea I,Badea RI,Popescu A,etal.The value of Contrast Enhanced Ultrasound(CEUS)for focal liver lesions characterization-a multicenter romanian study〔J〕.Gastroenterology,2013;144(5):s1041.
15黄文福,彭辽宇,梁世伟.碘海醇增强 CT 对受检者血细胞及血液流变学的影响〔J〕.临床误诊误治,2013;26(5):66-7.
〔2014-12-03修回〕
(编辑冯超/曹梦园)
基金项目:江西省科技支撑计划项目(20122BBG70107-2)
通讯作者:刘燕娜(1957-),女,主任医师,教授,博士生导师,主要从事心血管、腹部及浅表器官等超声医学影像诊断研究。
〔中图分类号〕R445.1
〔文献标识码〕A
〔文章编号〕1005-9202(2016)09-2166-03;
doi:10.3969/j.issn.1005-9202.2016.09.054
1南昌大学第二附属医院肿瘤科
第一作者:何兰芳(1987-),女,医师,硕士,主要从事超声医学影像诊断研究。

