食品中单增李斯特菌的血清分型及脉冲场凝胶电泳分型
张亚红,王娉,王玮,陈颖*
1(南京农业大学 食品科技学院,江苏 南京,210095) 2(中国检验检疫科学研究院 农产品安全研究中心,北京,100176)
食品中单增李斯特菌的血清分型及脉冲场凝胶电泳分型
张亚红1,2,王娉2,王玮1,陈颖1,2*
1(南京农业大学 食品科技学院,江苏 南京,210095) 2(中国检验检疫科学研究院 农产品安全研究中心,北京,100176)
摘要对进口食品和国内食品中的单增李斯特菌进行血清学分型和分子分型研究,探讨不同来源菌株之间的遗传相关性及不同分型方法之间的联系。 对分离的单增李斯特菌进行血清学分型和脉冲场凝胶电泳分型。69株单增李斯特菌分为4种血清型,主要血清型为1/2a(3a)型,脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)分型分为55种带型,主要型别为GX6A12.CN0018。食品中的单增李斯特菌分子型别呈现多态性,进口食品分离株和国内食品分离株之间无相关性。
关键词单增李斯特菌;血清分型;脉冲场凝胶电泳(PFGE);分子分型
单增李斯特菌(Listeriamonocytogenes)是一种典型的兼性胞内寄生菌[1],能耐受极端的温度、pH和盐浓度[2-3],是李斯特氏菌属8个种中唯一对人有致病性的种,孕妇、新生儿、老人及免疫力低下的人为易感人群,并且患者死亡率高(20%~30%)[4]。此外,单增李斯特菌易在加工材料表面粘附并形成生物膜,成熟的生物膜更是对理化因子、杀菌剂、抗生素等具有较强抵抗力[5]。这些生物学特性使单增李斯特菌能够在自然环境中广泛存在,并且在食品加工的多个环节均能存活,极易导致食品污染和食物中毒事件的发生。
在全球化时代,随着现代商业及运输业的发展,食品及其生产原料实现了跨地域,甚至跨国别的销售,这也使食品中单增李斯特菌的传播不再局限于某一个地区、一段相对集中的时间里或同一个污染源引起。因此,建立食品中单增李斯特菌的分型研究可以协助生产者追溯、确定食品中该菌的污染来源,并及时切断污染源以减少损失,同时,也对进行单增李斯特菌的流行病学研究和单增李斯特菌引起的食源性疾病的溯源和控制有重要意义。
目前,用于单增李斯特菌的分型方法主要有:传统表型法和分子分型法[6]。血清分型是最常用的表型分析技术,该法简便易操作,且不同血清型的单增李斯特菌分离株呈现不同的环境适应性和致病力,所以血清分型常用作单增李斯特菌流行病学调查的初级方法,用以辅助说明其他分型结果。脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)分子分型方法是目前国际上较认可的流行病学研究方法之一,已被广泛应用于多种食源性致病菌的溯源调查和临床医学研究,该方法分辨率高,重复性好,结果稳定,易于标准化,被誉为细菌分子分型的“金标准”。
本研究应用血清分型和脉冲场凝胶电泳分型技术对69株进口食品及国内食品中分离的单增李斯特菌进行相关性分析,为进行单增李斯特菌的流行病学研究及单增李斯特菌引起的食源性疾病溯源提供基础数据。
1材料与方法
1.1实验材料
1.1.1菌株
实验菌株为中国检验检疫科学研究院菌种保藏管理中心保存的69株单增李斯特菌,其中, 6株为单增李斯特菌标准菌株,41株分离自国内食品,20株分离自国外进口食品,还有2株分离地点不详。菌株信息详见图3。英诺克李斯特氏菌(ATCC 33090)作为RT-PCR鉴定阴性对照,沙门氏菌全球参考菌株Braenderup血清型菌株H9812(ATCC BAA-664)作为PFGE参考菌株。
1.1.2主要试剂和溶液
脑心浸液肉汤培养基,北京陆桥技术股份有限公司;DNA提取试剂盒,美国Promega公司;蛋白酶K,美国Calbiochem公司;Tris-HCl,Biosharp公司;EDTA,美国Amresco公司;SeaKem Gold 琼脂糖,瑞士Lonza公司;XbaⅠ、ApaⅠ限制性内切酶(15 U/mL),大连宝生物工程有限公司);5×TBE(上海生工生物工程股份有限公司;SDS,美国Amresco公司;十二烷基肌氨酸钠,德国Sigma公司;TYPE ONE WATER、琼脂糖,美国Invitrogen公司;MasterMix,美国AB公司;dNTPs(2.5 mmol/L)、ExTaq酶(5 U/μL)、10×Buffer、溴化乙锭、DL2000 DNA Marker,大连宝生物工程有限公司。
1.1.3仪器
核酸蛋白分析仪(DU640),德国Beckman公司;实时荧光定量PCR仪(7500),美国AB公司;PCR扩增仪(Veriti 96 Well Thermal Cycler),美国AB公司;电泳仪(Model 200/2.0 power supply),美国BIO-RAD公司;分子凝胶成像仪(VersaDoc),美国BIO-RAD公司;比浊仪(PhoenlxSpec Nephelometer),美国BD公司;水浴摇床(WS20),德国Wiggens公司;微生物培养箱(IS600),日本Yamato公司;脉冲场凝胶电泳仪(CHEF MAPPER),美国BIO-RAD公司;水浴锅(WNB400),德国Memert公司;凝胶成像系统(VersaDoc),美国BIO-RAD公司。
1.2实验方法
1.2.1DNA提取
单增李斯特菌DNA的提取按照Wizard Magnetic DNA Purification System试剂盒说明进行,用DU640核酸蛋白分析仪对DNA 提取液浓度和纯度进行测定,根据测定的DNA 提取液浓度配制100 μL质量浓度为20 ng/μL的工作液。工作液作为模板 DNA 于4 ℃保存,备用,剩余DNA原液于-20 ℃保存。
1.2.2单增李斯特菌鉴定
单增李斯特菌鉴定采用SN/T 1870—2007 食品中致病菌检测方法 实时PCR法[7],扩增体系(25 μL):MasterMix 12.5 μL,上下游引物(10 μmol/L)各1 μL,探针(10 μmol/L)0.5 μL,DNA模板2 μL,灭菌水补齐至25 μL。扩增条件:95°C 10 min,95°C 15s,60°C 1 min,40个循环。
1.2.3血清分型
单增李斯特菌的血清分型参照MICHEL D等[2]建立的多重PCR的方法进行,血清分型引物见表1。多重PCR扩增体系(50 μL):10×Multi HotStart Buffer(含Mg2+) 5 μL, dNTPs(2.5 mmol/L)4μL,Taq酶(5U/μL)0.5μL,Lmo0737、ORF2819、ORF2110的上下游引物(10 μmol/L)各1μL, Lmo1118引物(10 μmol/L)1.5 μL, prs引物(10 μmol/L)0.5 μL,DNA模板2 μL,灭菌水补齐至50 μL。扩增条件:94 ℃ 10 min、94 ℃ 30 s、53 ℃ 69 s、72 ℃ 69 s、72 ℃ 7 min、35个循环。用2%的琼脂糖胶块对PCR产物对进行电泳,EB染色,用Gel Doc 2000获取图像,对条带进行分析,判断血清型。

表1 单增李斯特菌血清分型引物
1.2.4PFGE分子分型
按照美国疾病预防控制中心单增李斯特菌的PFGE标准操作方法进行[8]。用Bionumerics 6.6 软件对结果进行数据处理,读取数据后用沙门菌Braenderup血清型全球参考菌株H9812校准后进行聚类分析,采用非加权平均法(UPGMA)进行分析。相似性系数计算用Dice表示,在0~100%之间,0表示完全不相关,100%相同的为同一带型,出现不同条带即判定为不同PFGE带型[9]。带型命名参照PulseNet的标准命名原则进行。
2结果与讨论
2.1食品中单增李斯特菌鉴定分析
利用SN/T 1870—2007 中的引物探针,对69株IQCC保存的单增李斯特菌进行实时荧光PCR鉴定,当Ct值≥40,判定结果为阴性,Ct值≤35,判定为阳性,若Ct值>35,而<40,重做样本,重做结果Ct值≥40者为阴性,否则为阳性。实验结果表明所有菌株实时荧光PCR鉴定均为阳性,部分菌株实时荧光鉴定结果见图1。另外,69株单增李斯特菌保存在菌种库前已经过生化鉴定或16s测序,且均为阳性。因此,结合保存前鉴定结果和本研究的实时荧光PCR鉴定结果,所选的69株菌株全部为单增李斯特菌,可用于后续研究。
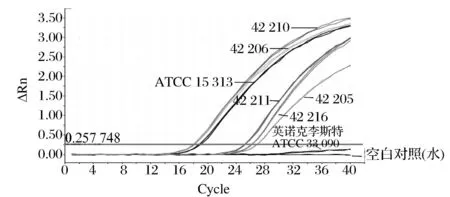
图1 部分单增李斯特菌实时荧光结果Fig.1 RT-PCR results for partial L.monocytogenes
2.2食品中单增李斯特菌血清分型分析
单增李斯特菌血清分型采用的是Michel Doumith等[2]建立的多重PCR方法,部分菌株血清分型凝胶电泳结果见图2。MICHEL等[2]将单增李斯特菌分为4类血清型:(1/2a,3a)、(1/2c,3c)、(1/2b,3b)、(4b,4d,4e)。但是,分离自食品和临床的单增李斯特菌至少95%以上的菌株是1/2a、1/2c、1/2b和4b[2],因此,认为Michel Doumith等[2]建立的单增李斯特菌血清分型多重PCR方法将单增李斯特菌主要分为1/2a、1/2c、1/2b和4b 这4种血清型。
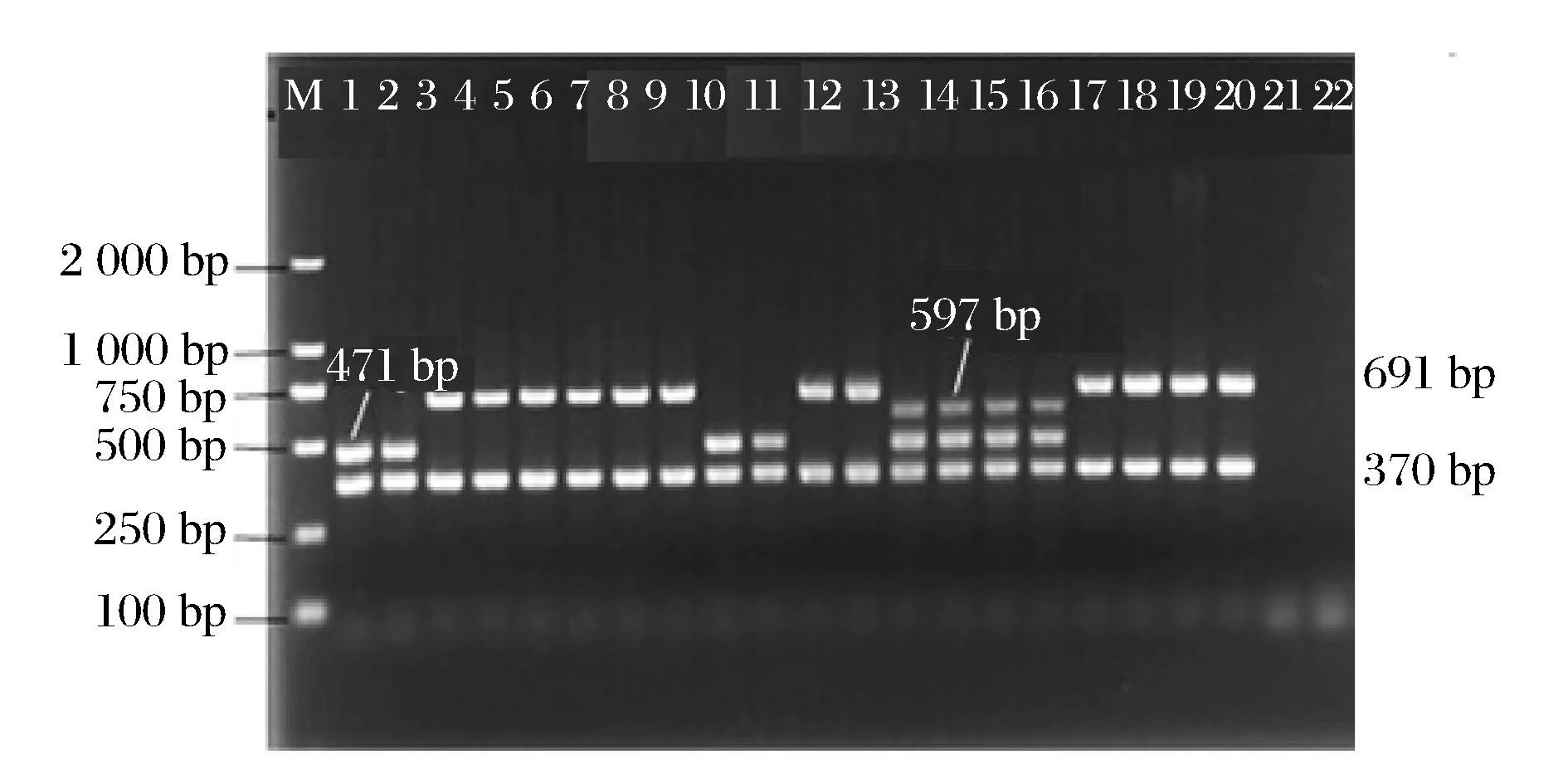
1-2:42206;3-4:42209;5-6:42218;7-8:42210;9-10:42214;11-12:42215;13-14:42217;15-16:ATCC 19115;17-18:CMCC 54003;19-20:CMCC 54004;21-22:空白对照图2 部分单增李斯特菌血清分型凝胶电泳图Fig.2 Serotype results for partial L. monocytogenes
69株单增李斯特菌血清分型结果见图3。参考菌株ATCC 13932和ATCC 19115为4b(4d,4e)型,ATCC 15313、CMCC 54002、CMCC 54003和CMCC 54004为1/2a(3a)型;41株国内分离菌株分属3个血清型,1/2a(3a)型(21/41,51.2%)、1/2c(3c)型(11/41,26.8%)和1/2b(3b)型(9/41,22.0%),没有4b(4d,4e)型;20株国外分离菌株同样分属3个血清型,1/2a(3a)型(14/20,70%)、1/2b(3b)型(3/20,15%)和4b(4d,4e)型(3/20,15%),没有1/2c(3c)型。国内分离菌株和国外分离菌株的主要血清型结果类似,1/2a(3a)型最多,与国内外的相关报道结果一致[10-12]。单增李斯特菌对人致病的主要为血清型为4b、1/2a和1/2b,3者约占本病的90%[13],并且脑膜炎患者的4b型分离率(26%)显著高于一般患者(16%)[14]。实验中3株4b(4d,4e)型均来自进境食品,张惠媛同样没有在国内食品中检测到4b(4d,4e)型血清型菌株,只在进口食品分离株中检测到[15],3株4b型菌株分别来自泰国、越南和韩国,应加强对该3个 国家4b(4d,4e)型菌株的防控。另外,结合PFGE分型结果可以看出, 11株1/2c(3c)血清型菌株的PFGE带型聚类效果较好,有较高相似度(79.9%),这与张耀祺、张兰荣和狄慧玲的研究结果一致[16-18],而1/2a(3a)、1/2b(3b) 和4b(4d,4e)型菌株的PFGE型别较分散,菌株同源性较差。
2.3食品中单增李斯特菌PFGE分型分析
69株单增李斯特菌基因组DNA被ApaⅠ酶切后,产生了10~16个条带,条带大小在49~450 kb之间。经BioNumerics 6.5软件分析,69株单增李斯特菌相似度在31.2%~100%之间,共被分为55种PFGE带型,PFGE聚类图谱见图3。单增李斯特菌的PFGE型别较分散,呈现同一带型情况较少, GX6A12.CN0018型包含5株菌,GX6A12.CN0005型包含4株菌,GX6A12.CN0017型包含3株菌,GX6A12.CN0007、GX6A12.CN0013、GX6A12.CN0025、GX6A12.CN0030、GX6A12.CN0050型均包含2株菌,其余菌株各成一个带型,这可能和样品来源比较广泛有关,实验菌株共涉及12个进口国家和国内6个省。
PFGE分型结果结合菌株分离信息可以看出,北京地区的优势PFGE带型为GX6A12.CN0005(5株)和GX6A12.CN0018(3株),太平洋群岛的优势PFGE带型为GX6A12.CN0017(3株),其他地区菌株太少,无法看出优势带型。另外,从PFGE分型结果中还发现GX6A12.CN0018、GX6A12.CN0025 和GX6A12.CN0050带型的菌株分离来源不单一,如GX6A12.CN0018带型中的5株实验菌株,3株分离自中国北京,1株分离自太平洋岛,另外1株分离自丹麦,表明不同来源的菌株存在很近的亲缘关系,这也预示着随着食品销售的全球化,污染菌株也可能在全球范围内流动。

图3 单增李斯特菌PFGE聚类图Fig.3 PFGE profile of L.monocytogenes
3结论
本研究初步建立了12个进口国家食品和国内食品中的单增李斯特菌的血清分型和PFGE分子分型数据库,对追溯食品中单增李斯特菌来源,进行单增李斯特菌的流行病学研究和单增李斯特菌引起的食源性疾病的溯源和控制提供了基础数据,同时,还可以协助实验室进一步确认所检出单增李斯特菌的来源,排除实验室污染的可能,为食品中单增李斯特菌的检测结果提供确凿的实验证据。
参考文献
[1]GOUIN E,TORRES J J Q,COSSART P.Intracellular bacteria find the right motion[J].Cell,2015, 161(2):199-200.
[2]DOUMITH M,BUCHRIESER C,GLASER P,et al.Differentiation of the majorListeriamonocytogenesserovars by multiplex PCR[J].Journal of Clinical Microbiology,2004,42(8): 3 819-3 822.
[3]MARIAN M N,AMINAH S M S,ZURAINI M I,et al.MPN-PCR detection and antimicrobial resistance ofListeriamonocytogenesisolated from raw and ready-to-eat foods in Malaysia[J].Food Control,2012,28(2): 309-314.
[4]蒋原.食源性病原微生物检测指南[M].北京:中国标准出版社,2010.
[5]柯春林,方维焕.单增李斯特菌生物膜及其形成机制的研究进展[J].中国微生态学杂志, 2011,23(6): 574-576.
[6]狄慧玲.单核细胞增生李斯特菌分子分型研究及CRISPR/Cas 系统解析[D].广州:华南理工大学, 2014.
[7]SN/T 1870—2007,食品中致病菌检测方法实时PCR法[S]
[8]Center for Disease Control and Prevention. Standard Operating Procedure for PulseNet PFGE ofListeriamonocytogenes[EB/OL].http://www.cdc.gov/pulsenet/PDF/listeria-pfge-protocol-508c.pdf
[9]TERRAGNO R,SALVE A,PICHEL M,et al.Characterization and subtyping ofCronobacterspp. from imported powdered infant formulae in Argentina[J].International Journal of Food Microbiology,2009,136(2):193-197.
[10]张丽萍,张克俭,高涛,等.食源性单增李斯特菌血清分型及耐药性的研究[J].实用预防医学, 2013,20(5): 611-613.
[11]WIJENDRA W A S,KULATHUNGA K,RAMESH R,et al.First report ofListeriamonocytogenesserotypes detected from milk and milk products in Sri Lanka[J].Advances in Animal and Veterinary Sciences,2014,2(5S): 11-16.
[12]WANG K,YE K,ZHU Y,et al.Prevalence, antimicrobial resistance and genetic diversity ofListeriamonocytogenesisolated from chilled pork in Nanjing, China[J].LWT-Food Science and Technology,2015,64(2):905-910.
[13]PONTELLO M,GUAITA A,SALA G,et al.Listeriamonocytogenesserotypes in human infections (Italy, 2000-2010)[J]. Annali dell'Istituto superiore di sanit,2012,48(2):146-150.
[14]SWAMINATHAN B,GERNER-SMIDT P.The epidemiology of human listeriosis[J].Microbes and Infection,2007,9(10):1 236-1 243.
[15]张惠媛,汪琦,张昕,等.进出境食品中单核增生李斯特菌的血清分型与脉冲场凝胶电泳分型分析[J].中国食品卫生杂志, 2012(5): 000.
[16]张兰荣,王艳,张扬,等.2007-2011 年北京市通州区分离单增李斯特菌的生物学及分子流行病学特征[J].疾病监测,2012(7): 21.
[17]俞骅,郑伟,王艳, 等.2007年-2011年杭州地区食品中单核细胞增生李斯特菌 PFGE 型别分析[J].中国卫生检验杂志,2013(5): 1 189-1 192.
[18]狄慧玲,张耀祺,单潇潇,等.河北地区食源性单核细胞增生李斯特菌脂肪酸的分型研究[J]. 现代食品科技,2014,30(11): 65-70.
Serotype and PFGE type ofListeriamonocytogenesisolated from foods
ZHANG Ya-hong1,2, WANG Ping2,WANG Wei1, CHEN Ying1,2*
1(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)2(Agro-Product Safety Research Center, Chinese Academy of Inspection and Quarantine, Beijing 100176, China)
ABSTRACTThe serotypes and molecular typing of Listeria monocytogenes in imported food and domestic food were studied. The relativity of the genetic correlation among the strains from different sources and the relationship of different typing methods were discussed. The strains were characterized by serotyping and PFGE typing. The 69 strains belonged to 4 serotypes and 55 PFGE patterns. The predominant serotypes were 1/2a and the major PFGE pattern was GX6A12.CN0018. Listeria monocytogenes strains showed polymorphism in molecular type and there was no correlation between the imported food and the domestic food isolates.
Key wordsListeria monocytogenes; serotypes; pulsed-field gel electrophoresis(PFGE);serotype
收稿日期:2015-07-29,改回日期:2015-10-21
基金项目:“十二五”农村领域国家科技计划(2013BAD19B05,2012BAD29B07-2)
DOI:10.13995/j.cnki.11-1802/ts.201602004
第一作者:硕士研究生(陈颖为通讯作者,E-mail:chenyingcaiq@163.com)。

