利用控pH流加培养法提高雨生红球藻的生物量及虾青素产量
王旎,管斌,孔青,孙翰,耿兆艳,段良飞
(中国海洋大学 食品科学与工程学院,山东 青岛,266003)
利用控pH流加培养法提高雨生红球藻的生物量及虾青素产量
王旎,管斌*,孔青,孙翰,耿兆艳,段良飞
(中国海洋大学 食品科学与工程学院,山东 青岛,266003)
摘要研究了一种新型培养方法——控pH流加培养法,可有效促进雨生红球藻生长并提高虾青素产量。测定雨生红球藻生长期间对营养盐的需求量,依据对数生长期藻液pH与硝酸盐和磷酸盐的含量的线性关系,确定流加液组成及流加方法。流加液的组成为7.88 g/L的 KNO3,1.83 g/L的KH2PO4和24.0 g/L 的CH3COONa,监测对数生长期藻液pH变化情况,通过添加流加液将藻液的pH值持续控制在7.5~8.0内,雨生红球藻的细胞干重可达(1.42 ± 0.04) g/L,虾青素产量可达(60.23 ± 1.81) mg/L。
关键词雨生红球藻;虾青素;pH;流加培养
虾青素(astaxanthin)化学名称为3,3'-二羟基-4,4'-二酮基-β,β'-胡萝卜素,分子式为C10H52O4,含多个共轭双键[1],具有极强的抗氧化作用,可有效清除自由基[2],有抗肿瘤、增强免疫力和改善视力等多种生理功效[3]。虾青素是优质的天然色素,在食品、化妆品、饲料等生产领域均有应用[4]。虾青素可以化学方法合成[5]或者由甲壳类动物体内提取[6],也可利用真菌[7]及微藻[8]生产。雨生红球藻(Haematococcuspluvialis)是最丰富的天然虾青素来源之一[9],虾青素含量占干重的1.5 %~5.0 %[10],被誉为天然虾青素的“浓缩品”[11]。
提高雨生红球藻的生物量是提高虾青素产量的关键,现有的培养方法包括一步法[12]、生长转化两步法[13]、固定膜培养法[14]以及流加动力学模型[15]等。流加培养是一种非常有效的提高雨生红球藻生物量的方法,采用不同的培养周期,在培养9 d后生物量能达1.0 g/L以上[15],培养20 d后达2.0 g/L以上[16]。目前,大规模培养雨生红球藻来生产虾青素仍存在一些技术难点,工业生产中雨生红球藻的含量仅在0.2~0.5 g/L[17],继而使得虾青素生产能力远远低于市场需求量。流加技术成为雨生红球藻工业应用中的迫切需求,然而流加过程中存在的一系列困难大大限制了它的应用,包括流加时间、流加量以及流加液中各营养成分比例的确定。本论文采用连续流加进行培养,测定雨生红球藻生长阶段对营养盐的消耗情况,依据对数生长期藻液pH值与营养盐含量的线性关系,确定流加液组成及流加方法,以期提高雨生红球藻的生物量与虾青素的产量。
1材料与方法
1.1藻种与培养基
实验藻种为本实验室保藏的雨生红球藻712株,培养时采用改良的MCM培养基[18]。
1.2雨生红球藻的生长与转化条件
将已活化的藻种接种到适量培养基中,接种量为10 %,采用白天:黑夜为12 h∶12 h的光照周期,光照强度2 500 lx,培养温度22℃,于恒温箱中培养9 d。自第10天起将雨生红球藻转入营养盐胁迫环境下使之开始积累虾青素,全天光照,光照强度7 500 lx,培养温度30 ℃,于恒温箱中继续培养10 d。
1.3雨生红球藻的控pH值流加培养
生长第4天的雨生红球藻进入控制pH的流加培养阶段。持续监测藻液的pH值,若其超出7.5~8.0的范围,则向藻液中添加适量的流加液,使之稳定保持在此范围内。
1.4藻细胞干重和生长速率的测定
取适量藻液,使用分光光度计分别测定波长680 nm和750 nm下藻液的吸光度[19]。
细胞干重(N)/(g·L-1)=[-4.2 × {(OD680-OD750)/OD680} + 1.4] × OD680
生长速率μ= (lnNt-lnN0) /t,其中Nt表示培养时间为t时的细胞干重(g/L),N0表示初始细胞干重(g/L)。
1.5虾青素含量的测定
取适量的藻液,离心,除上清液。在沉淀物中等体积加入甲醇-KOH溶液(30 %甲醇与5% KOH溶液等体积混合),振荡混匀。将藻悬液于65℃中水浴20 min,离心,洗涤。沉淀中加入二甲基亚砜与丙酮混合液(体积比为4∶1),200 W超声波破碎细胞10 min,40℃中水浴振荡20 min,离心,收集上清液。重复提取直至藻体颜色发白,混合多次提取的上清液,于490 nm波长下测吸光度[20]。上述步骤均在避光条件下操作。
虾青素含量(C)/(mg·L-1)=4.5 ×OD490×(Va/Vb)× f
其中:Va,二甲基亚砜-丙酮提取液的总体积,mL;Vb,所取藻液的体积,mL;f,表示测定吸光度时溶液的稀释倍数。
2结果与讨论
2.1乙酸钠浓度对雨生红球藻生长的影响
含不同初始浓度乙酸钠的培养基对于雨生红球藻细胞生长的影响如图1所示。从图1可看出,培养基中乙酸钠的初始浓度对于雨生红球藻细胞生长的影响较大,当乙酸钠浓度为2.4 g/L时,藻的生长状况最佳,生长速率最大,其细胞干重可达(0.78 ± 0.03) g/L。与未添加乙酸钠的培养结果相比,含乙酸钠培养基中雨生红球藻的细胞干重和生长速率均有大幅度提升,这是由于雨生红球藻可利用乙酸钠进行混合营养生长[21],在缺乏光照的夜间环境里也可以积累生物量。因此,本实验中选用2.4 g/L的乙酸钠作为培养基的碳源。
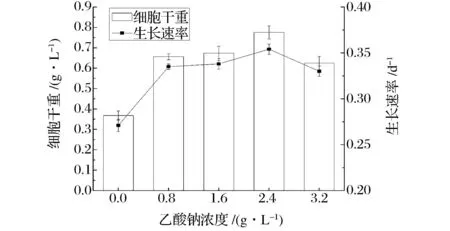
图1 乙酸钠浓度对雨生红球藻生长的影响Fig.1 Effect of sodium acetate concentration on growth of Haematococcus pluvialis
2.2流加液组分及流加方法的确定
将乙酸钠作为碳源,其培养基初始浓度为2.4 g/L,测定生长期间藻液的硝酸盐含量、磷酸盐含量与pH值(见图2)。由于藻细胞在生长期间造成营养盐的消耗,藻液中的营养盐含量及pH值会发生相应的变化。从图2可看出,随着藻细胞增殖而不断消耗氮磷营养物,培养液中的硝酸盐和磷酸盐浓度呈下降趋势,pH值呈升高趋势。从生长的第2天开始,细胞干重增加的速率快速增加,氮磷营养盐的浓度明显降低,表明雨生红球藻的生长进入对数期,藻细胞快速生长,对营养盐的消耗量增大。而在第7天后,营养盐的消耗速率和pH值的升高都开始放缓,并伴随有周期性波动,这是由于营养的消耗使一定的培养环境所能容纳的细胞数量接近上限,营养盐的供给不能满足藻细胞生长的需求,细胞开始调节自身代谢来重新适应环境,细胞生长活力降低,宏观表现为细胞群体向培养液中释放的氮磷盐大于吸收量。从图2还可看出,波动可能是由于细胞在无光照时间段内的死亡率上升,这说明培养液中的碳源也不能满足藻细胞的需求。
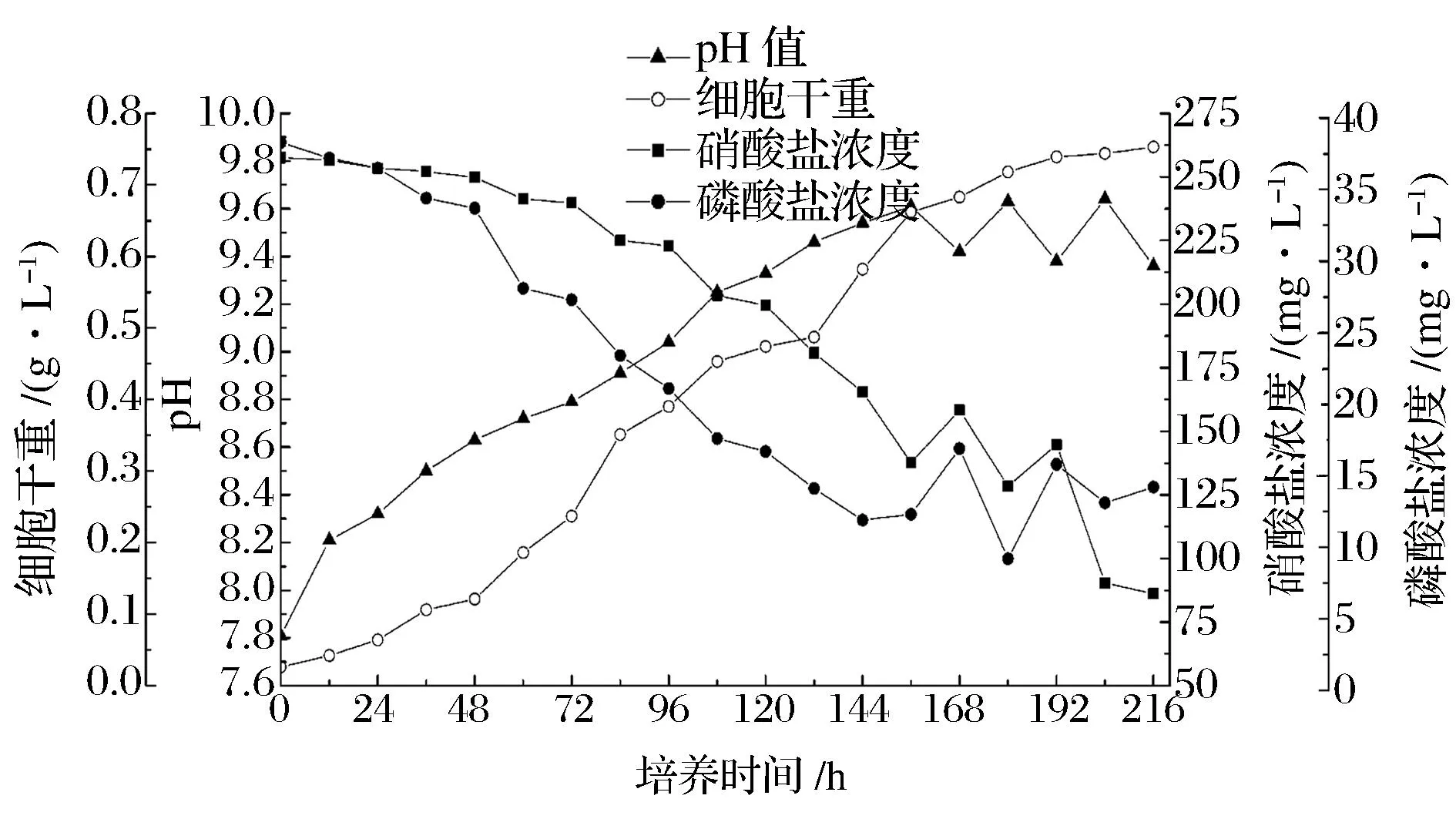
图2 雨生红球藻生长期间营养盐及pH的变化Fig.2 Changes of pH, concentration of nitrate and concentration of phosphate in cultivation process of Haematococcus pluvialis
此外,由图2可见,培养过程中营养盐浓度的变化与pH值的变化步调刚好相反,可推测两者之间存在的相关性。将藻液pH分别与硝酸盐浓度、磷酸盐浓度进行线性拟合,如图3所示,研究发现,对数生长期藻液的pH值与硝酸盐、磷酸盐的浓度分别呈一定的线性关系。藻液pH值与硝酸盐浓度(mg/L)的一次函数关系为y=-80.86x + 950.17,R2= 0.96;藻液pH值与磷酸盐浓度(mg/L)的一次函数关系y=-18.56x + 189.46,R2= 0.98。因此,藻液中营养盐的含量可以由一个简单易测的指标pH来反映,即测得藻液的pH值,便可计算出硝酸盐、磷酸盐的消耗量,进而可得知藻细胞的生长状况。
根据雨生红球藻细胞的生长情况与碳、氮、磷营养物质的消耗情况,考虑进入对数生长期后采用流加营养盐的方法补充细胞所需物质,可改善藻细胞的生长状态。然而,何时流加与流加量的确定是流加培养的关键,既要满足藻细胞的吸收量,又要防止某一时段内培养液中过高的氮磷浓度抑制藻细胞生长[22]。结合图2、图3,根据雨生红球藻细胞在不同生长阶段对营养物质的需求量,以及营养盐的浓度与pH之间存在的特定关系,探究出一种新型的便捷有效的雨生红球藻培养方法——控pH流加培养法,跟踪测定藻液的pH值,适时向藻液中添加流加液,使pH值保持在一定的范围内。这既保证了营养盐的适量补充,满足藻细胞生长所需的适宜pH范围,又将流加时间与流加量用易于监测和控制的指标pH值来指示,具有可操作性。

图3 对数生长期营养盐含量与pH间的关系Fig.3 Relationship among pH, concentration of nitrate and concentration of phosphate in logarithmic phase
流加液中硝酸盐及磷酸盐的含量根据雨生红球藻生长期间的消耗量来确定,乙酸钠浓度取初始培养基浓度的10倍[23]。由图2可得雨生红球藻对KNO3和KH2PO4的总消耗量,根据培养天数可计算日平均消耗量。由图3可得KNO3和KH2PO4的消耗量之比为4.36∶1。实验中根据雨生红球藻的生长情况,对流加液的组成进行一定的优化调整,最终确定流加液的组成为24.0 g/L 的CH3COONa,7.88 g/L的 KNO3和1.83 g/L的KH2PO4。此外,补料从雨生红球藻细胞生长第4天开始进行,防止生长前期产生营养盐的高浓度抑制作用。
2.3pH对雨生红球藻生长的影响
为测定雨生红球藻的最适生长pH范围,生长过程中用HCl调节藻液pH,使培养液的pH值始终维持在一定范围内。在该种条件下,pH对其生长的影响如图4所示。从图4可看出,pH为7.5~8.0的偏碱性环境中雨生红球藻的生长速率最大,细胞干重达(0.91 ± 0.02) g/L,因此确定流加时需将藻液pH值控制在7.5~8.0的范围内。

图4 pH对雨生红球藻生长的影响Fig.4 Effect of types of pH on the growth of Haematococcus pluvialis
2.4控pH流加培养的效果
通过监测pH的变化进行适时适量补料,添加流加液使得藻液的pH维持在最适pH值在7.5~8.0内,既调节了雨生红球藻生长环境的pH,也合理补充了生长所需的营养物质(如图5所示)。从图5可看出,采用控pH流加培养的方法后,雨生红球藻的细胞干重大幅增加,较未流加培养的藻细胞干重提高了1倍多,达到(1.42 ± 0.04) g/L。同时,流加培养后雨生红球藻细胞对数生长期延长,生长速率明显提高。将转化完全的雨生红球藻取出,测定其虾青素产量(如图6所示)。从图6可看出,流加培养组的产量为(60.23 ± 1.81) mg/L,比未流加培养组提高了近1倍。可见,控pH流加培养方法的应用可以很大程度上提高雨生红球藻生物量及产虾青素。

图5 流加培养对雨生红球藻细胞干重的影响Fig.5 Effect of fed-batch culture on dry cell weight of Haematococcus pluvialis

图6 流加培养对雨生红球藻产虾青素的影响Fig.6 Effect of fed-batch culture on production of astaxanthin from Haematococcus pluvialis
3结论
本研究揭示了雨生红球藻生长过程中pH与营养盐消耗的线性关系,从而创新地提出了控pH流加培养方法。控pH流加培养法是一种针对性强、效果显著、理论依据强、可操作性大的新培养方法,为雨生红球藻提供了适宜需求、持续更新的生长环境,提高了生物量及虾青素产量。此外,该方法的最大优势在于将繁琐的营养盐消耗特征用易获取的pH值来表征,这对于规模化生产虾青素有重要的实际意义。目前,该方法的研究尚处于起步阶段,若能进一步完善并运用于工业化生产,定将给雨生红球藻产虾青素创造可观的应用前景。
参考文献
[1]GRUNG M, D'SOUZA F M L, BOROWITZKA M, et al. Algal carotenoids 51. secondary carotenoids 2.Haematococcuspluvialisaplanospores as a source of (3S, 3′ S)-astaxanthin esters[J]. Journal of Applied Phycology, 1992, 4(2): 165-171.
[2]RAO A R, SINDHUJA H N, DHARMESH S M, et al. Effective inhibition of skin cancer, tyrosinase, and antioxidative properties by astaxanthin and astaxanthin esters from the green algaHaematococcuspluvialis[J]. Journal of Agricultural and Food Chemistry, 2013, 61(16): 3 842-3 851.
[3]HUSSEIN G, SANKAWA U, GOTO H, et al. Astaxanthin, a carotenoid with potential in human health and nutrition[J]. Journal of Natural Products, 2006, 69(3): 443-449.
[4]LORENZ R T, CYSEWSKI G R. Commercial potential forHaematococcusmicroalgaeas a natural source of astaxanthin[J]. Trends in Biotechnology, 2000, 18(4): 160-167.
[5]LEFTWICK A P, WEEDON B C L. Total synthesis of astaxanthin and hydroxyechinenone[J]. Chemical Communications, 1967, 1(1): 49-50.
[6]ZHANG H, TANG B, ROW K H. A green deep eutectic solvent-based ultrasound-assisted method to extract astaxanthin from shrimp byproducts[J]. Analytical Letters, 2014, 47(5): 742-749.
[7]STACHOWIAK B. Astaxanthin synthesis by yeast Xanthophyllomyces dendrorhous and its mutants on media based on plant extracts[J]. Indian Journal of Microbiology, 2012, 52(4): 654-659.
[8]SUSEELA M R, TOPPO K.Haematococcuspluvialis-a green alga, richest natural source of astaxanthin[J]. Current Science, 2006, 90(12): 1 602-1 603.
[9]范永仙, 许尧兴. 微生物生产类胡萝卜素的研究进展[J]. 食品与发酵工业, 2003, 29(7):69-74.
[10]DAVIES B H. Carotenoid metabolism in animals: a biochemist's view[J]. Pure and Applied Chemistry, 1985, 57(5): 679-684.
[11]彭小兰. 虾青素的生理功能及其生产与应用研究[J]. 当代畜牧, 2005(11): 50-52.
[12]DEL R E, ACIÉN F G, GARCA-MALEA M C, et al. Efficiency assessment of the one-step production of astaxanthin by the microalgaHaematococcuspluvialis[J]. Biotechnology and Bioengineering, 2008, 100(2): 397-402.
[13]PARK J C, CHOI S P, HONG M E, et al. Enhanced astaxanthin production from microalga,Haematococcuspluvialisby two-stage perfusion culture with stepwise light irradiation[J]. Bioprocess and Biosystems Engineering, 2014, 37(10): 2 039-2 047.
[14]WAN M, HOU D, LI Y, et al. The effective photoinduction ofHaematococcuspluvialisfor accumulating astaxanthin with attached cultivation[J]. Bioresource Technology, 2014, 163(7): 26-32.
[15]ZHANG X W, GONG X D, CHEN F. Kinetic models for astaxanthin production by high cell density mixotrophic culture of the microalgaHaematococcuspluvialis[J]. Journal of Industrial Microbiology and Biotechnology, 1999, 23(1): 691-696.
[16]LABABPOUR A, SHIMAHARA K, HADA K, et al. Fed-batch culture under illumination with blue light emitting diodes (LEDs) for astaxanthin production byHaematococcuspluvialis[J]. Journal of Bioscience and Bioengineering, 2005, 100(3): 339-342.
[17]IMAMOGLU E, DALAY M C, SUKAN F V. Semi-continuous cultivation ofHaematococcuspluvialisfor commercial production[J]. Applied Biochemistry and Biotechnology, 2010, 160(3): 764-772.
[18]金传荫, 宋立荣, 刘永定, 等. 红球藻水生748株(Haematococcus sp. HB748)培养基的选择与对维生素B_(12)的需求[J]. 应用与环境生物学报, 1997, 3(2): 177-179.
[19]LABABPOUR A, SHIMAHARA K, HADA K, et al. Fed-batch culture under illumination with blue light emitting diodes (LEDs) for astaxanthin production by Haematococcus pluvialis[J]. Journal of Bioscience and Bioengineering, 2005, 100(3): 339-342.
[20]BOUSSIBA S, FAN L, VONSHAR A. Enhancement and determination of astaxanthin accumulation in green algaHaematococcuspluvialis[J]. Methods Enzymology, 1992, 213:386-391.
[21]CHOI S L, SUH I S, LEE C G. Lumostatic operation of bubble column photobioreactors forHaematococcuspluvialiscultures using a specific light uptake rate as a control parameter[J]. Enzyme and Microbial Technology, 2003, 33(4): 403-409.
[22]HARKER M, YOUNG A J. Inhibition of astaxanthin synthesis in the green alga,Haematococcuspluvialis[J]. European Journal of Phycology, 1995, 30(3): 179-187.
[23]CHANG D K, SE J H, SEUNG P C, et al. Fed-batch culture of astaxanthin-richHaematococcuspluvialisby exponential nutrient feeding and stepwise light supplementation[J]. Bioprocess and Biosystems Engineering, 2010, 33(1):133-139.
Enhancing biomass ofHaematococcuspluvialisand astaxanthin production by pH-controlled fed-batch culture
WANG Ni, GUAN Bin*, KONG Qing, Sun Han, GENG Zhao-yan, DUAN Liang-fei
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
ABSTRACTIn this research, a new method of pH-controlled fed-batch culture was utilized to enhance dry cell weight of Haematococcus pluvialis and production of astaxanthin. Conditions of nutrient consumption of Haematococcus pluvialis were measured. The composition of fed-batch media and the details of fed-batch were determined based on the linear relationships between pH and consumption of nutrients of Haematococcus pluvialis in its logarithmic phase. The fed-batch media were consisted of 7.88 g/L nitrate, 1.83 g/L phosphate and 24.0 g/L sodium acetate. By monitoring and controlling pH of the suspension to the range of 7.5~8.0 with the fed-batch media in its logarithmic phase, the dry cell weight of Haematococcus pluvialis was enhanced to (1.42 ± 0.04) g/L, with the production of astaxanthin reaching (60.23 ± 1.81) mg/L.
Key wordsHaematococcus pluvialis; astaxanthin; pH; fed-batch culture
收稿日期:2015-05-23,改回日期:2015-09-07
基金项目:国家“十二五”农村领域科技计划项目(2013BAD10B02-06);山东省科技发展计划项目(2014GSF121029);国家自然科学基金资助项目(31471657)
DOI:10.13995/j.cnki.11-1802/ts.201602021
第一作者:硕士研究生(管斌教授为通讯作者,E-mail:guanbin@ouc.edu.cn)。

