钙化性纳米微粒致大鼠肾结石模型的构建*
粟宏伟,王 杰,朱永生,邓青富,裴利军,王 娟
(1.泸州医学院附属中医院泌尿外科,四川泸州 646000;2.泸州医学院附属医院泌尿外科,四川泸州 646000)
钙化性纳米微粒致大鼠肾结石模型的构建*
粟宏伟1,王杰1,朱永生2,邓青富2,裴利军2,王娟2
(1.泸州医学院附属中医院泌尿外科,四川泸州 646000;2.泸州医学院附属医院泌尿外科,四川泸州 646000)
[摘要]目的建立钙化性纳米微粒(CNPs)致大鼠肾结石模型。方法利用临床手术所得肾结石标本分离和培养出CNPs。SD雄性大鼠40只分为CNPs诱石组(A组,鼠尾静脉注射CNPs)、CNPs+肾石通组(B组,鼠尾静脉注射CNPs+肾石通溶液灌胃+生理盐水腹腔注射)、CNPs+硝酸镓组(C组,鼠尾静脉注射CNPs+硝酸镓腹腔注射+生理盐水灌胃)、空白对照组(D组,鼠尾静脉注射生理盐水+生理盐水灌胃和腹腔注射),每组10只。8周后处死大鼠,镜下观察肾脏组织的病理改变及晶体分布并计数。结果A、B、C组大鼠肾脏肾小管内产生钙盐结晶,Von kossa染色阳性,主要分布在远曲小管和近曲小管,D组大鼠肾组织内未见钙盐结晶,4组间成石率差异有统计学意义(P<0.05)。镜下观察A、B、C组肾组织明显可见肾小管上皮细胞变性,肾间质可见炎性细胞浸润灶(主要为淋巴细胞),D组肾组织未见病理性改变。各组大鼠尿Ca2+、尿肌酐水平实验结束前1 d(T2)高于注射CNPs后4周(T1)(P<0.01);与D组T2尿Ca2+和血肌酐水平相比,A、B、C组均增高(P<0.05),与A组T2尿Ca2+相比,B、C组有降低趋势(P<0.05);各组之间T2血Ca2+水平、T2尿肌酐水平差异无统计学意义(P>0.05)。结论CNPs能损伤肾小管上皮细胞,促使肾小管内钙盐晶体的形成。
[关键词]肾结石;钙质沉着症;晶体;钙化性纳米微粒;模型;肾石通;硝酸镓
钙化性纳米微粒因为其独特的生物矿化特性,近年来已成为肾结石形成机制的研究热点之一。本研究应用无菌收集的结石标本分离和培养出钙化性纳米微粒(calcifying nanoparticles,CNPs),通过鼠尾静脉注射初步建立大鼠肾结石模型,并观察肾石通、硝酸镓对CNPs成石的影响。
1材料与方法
1.1材料3月龄雄性SD大鼠40只(泸州医学院实验动物中心提供),体质量150~200 g,分为4组,各组大鼠均先适应性饲养1周。分为CNPs诱石组(A组)、CNPs+肾石通组(B组)、CNPs+硝酸镓组(C组)、空白对照组(D组),每组10只,普通颗粒饲料饲养,饮用自来水。A组:鼠尾静脉注射CNPs 1次(吸光度2.00,0.4 mL);B组在A组的基础上每天2次肾石通溶液灌胃(每次100 mg/kg),同时生理盐水(NS)腹腔注射(3次/周),直至处死;C组在A组的基础上硝酸镓腹腔注射(每次1 mg/kg,3次/周),同时NS灌胃,直至处死;D组鼠尾静脉注射NS(0.4 mL),同时NS灌胃和腹腔注射作为空白对照,直至处死。
1.2方法
1.2.1CNPs的分离和培养术中无菌收集经皮肾镜取石术患者的结石标本,在1 mol/L HCl中浸泡30 min,以去除矿物质,然后用磷酸盐缓冲液(PBS)中和、洗涤,用无菌研钵碾碎结石,加入NS 10 mL混匀,经0.22 μm的滤纸加压过滤,4 ℃离心40 min(20 000×g),取管底滤过液备用。取4 mL含10%(体积分数)热灭活γ-FBS的1640培养基加入细胞培养瓶中,然后将处理后的结石滤过液取1 mL加入培养瓶内,置于37 ℃、5%CO2和95%O2条件下培养6~8周,30 d换液1次,整个操作中严格遵循无菌技术。以等量经0.22 μm的滤纸过滤的NS、含10%(体积分数)热灭活γ-FBS的1640培养基在相同条件下培养作为阴性对照。待有白色沉淀出现时筛选出无污染的标本,用巴氏管吹打均匀后吸入离心管。离心机离心,转速12 000 r/min,离心20 min,弃上清液,再加入注射无菌用水2 mL吹打混匀。重复上诉步骤共计清洗CNPs 3次。倒置相差显微镜下形态学鉴定和Von kossa染色鉴定。紫外分光光度仪测定CNPs最大吸收波长,以此测定CNPs的相对生长浓度。
1.2.2标本采集分别于注射CNPS后4周(T1)及实验结束前1 d(T2)用代谢笼收集大鼠24 h尿液。实验结束前麻醉大鼠,抽取下腔静脉血后处死切取肾脏纵向剖开,10%(体积分数)中性甲醛溶液固定。
1.2.3观察指标固定后的肾脏组织做石蜡切片,Von kossa染色后在普通光学显微镜下观察钙盐结晶在肾组织中的分布情况;苏木素-伊红(HE)染色后在普通光学显微镜下观察肾脏组织的病理改变,偏光显微镜下观察钙盐结晶在肾组织中的分布情况并按文献[1]结晶分级判定标准作统计。全自动生化仪测定血清肌酐、Ca2+及尿肌酐、尿Ca2+水平。
2结果
2.1CNPs的培养及鉴定结果培养6周时,A、B、C组培养液开始出现浑浊,8周肉眼可见白色絮状沉淀,倒置相差显微镜下观察CNPs聚集成团,部分贴壁生长,漂浮生长的CNP团块做不规则布朗运动。Von kossa染色可见CNPs团块呈棕褐色或黑褐色,见图1。
2.2T1与T2各组大鼠尿Ca2+、尿肌酐水平比较T2各组大鼠尿Ca2+、尿肌酐水平明显高于T1,差异有统计学意义(P<0.01),各组在T1和T2时间点上的尿Ca2+、尿肌酐水平变化无统计学意义(P>0.05),见表1。
2.3实验结束前各组大鼠血肌酐、血Ca2+、尿Ca2+、尿肌酐水平比较与D组血肌酐水平相比,A、B、C组均增高(P<0.05),A、B、C 3组间血肌酐水平差异无统计学意义(P>0.05);与D组尿Ca2+水平相比,A、B、C组均增高(P<0.05),与A组尿Ca2+相比,B、C组明显降低(P<0.05),B组与C组间尿Ca2+水平差异无统计学意义(P>0.05);各组之间血Ca2+水平、尿肌酐水平差异无统计学意义(P>0.05),见表2。
2.4各组大鼠肾脏标本钙盐结晶情况的比较Von kossa染色+核固红复染后在普通光学显微镜下观察,A、B、C组大鼠肾组织内可见散在分布不规则的棕褐色或黑褐色钙盐结晶沉积,主要分布在远曲小管和近曲小管,晶体多呈零星散在分布,有的互相连接成片或成堆(图2)。HE染色后在偏光显微镜下观察,A、B、C组大鼠肾脏切片在暗视野下可见高亮结晶,晶体形态不规则,或散在分布,或集合成堆。A、B、C组的成石率与D组相比均升高,差异有统计学意义(P<0.05);A组的成石率与B、C两组相比显著升高,差异有统计学意义(P<0.05);而B组和C组的成石率比较差异无统计学意义(P>0.05)。见表3。

图1 CNPs Von kossa染色阳性结果(×400)
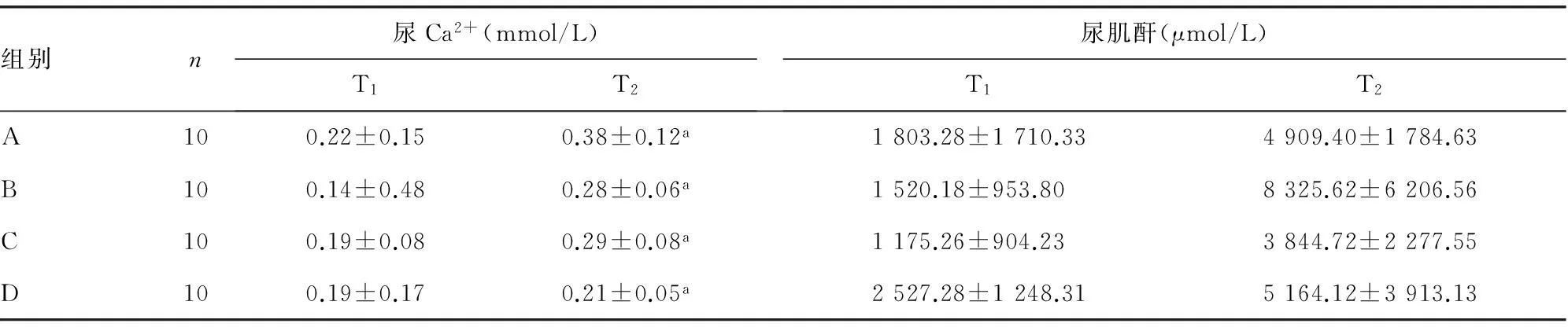
组别n尿Ca2+(mmol/L)T1T2尿肌酐(μmol/L)T1T2A100.22±0.150.38±0.12a1803.28±1710.334909.40±1784.63B100.14±0.480.28±0.06a1520.18±953.808325.62±6206.56C100.19±0.080.29±0.08a1175.26±904.233844.72±2277.55D100.19±0.170.21±0.05a2527.28±1248.315164.12±3913.13
a:P<0.01,与T1比较。

表2 T2各组大鼠血肌酐、血Ca2+、尿Ca2+、尿肌酐水平比较
a:P<0.05,与D组比较;b:P<0.05,与A组比较。
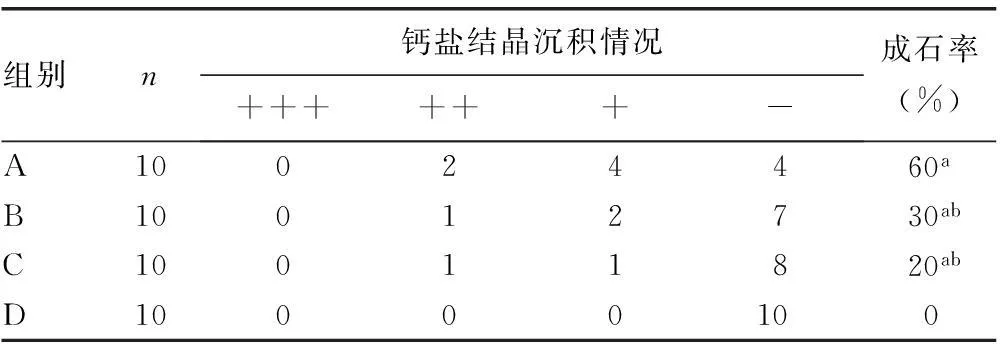
表3 各组大鼠肾脏钙盐结晶沉积情况的比较(n)
a:P<0.05,与D组比较;b:P<0.05,与A组比较。
2.5各组大鼠肾脏标本病理变化的比较肾脏组织HE染色后在普通光学显微镜下观察:A组大鼠肾脏中可见大量肾小管上皮细胞变性,主要为空泡样变性,肾小管上皮细胞高度水肿,并且肾间质可见炎性细胞浸润,主要为淋巴细胞浸润;B、C组较A组相比,发生变性改变的肾小管上皮细胞减少,且主要为颗粒样变性,偶可见间质淋巴细胞浸润;B组和C组肾脏的病理改变比较差异不明显;D组肾小管上皮细胞排列整齐,结构清晰,偶可见颗粒样变性的肾小管上皮细胞,肾小球形状规则,无病理学改变。各组肾脏组织均未见肾小管上皮明显坏死、脱落,见图3。
A:A组;B:B组;C:C组;D:D组。黑色箭头所示为Von kossa染色阳性的钙盐结晶。
图2各组肾脏组织Von kossa染色+核固红复染结果(×200)
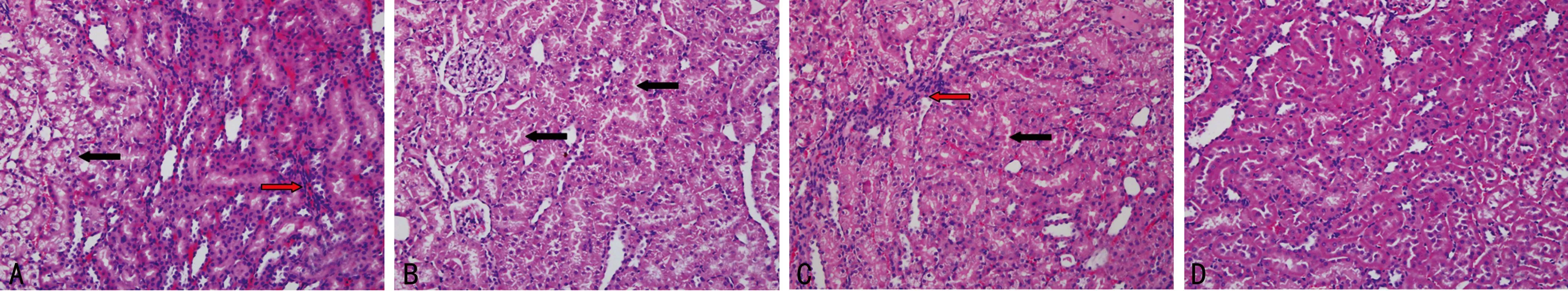
A:A组中黑色箭头所指为肾小管上皮细胞空泡样变性,红色箭头所指为肾间质炎性细胞浸润;B:B组中黑色箭头所指为肾小管上皮细胞颗粒样变性;C:C组中黑色箭头所指为肾小管上皮细胞颗粒样变性,红色箭头所指为肾间质炎性细胞浸润;D:D组无病理学改变。
图3各组肾脏组织HE染色后的病理改变(×200)
3讨论
1998年芬兰科学家Kajander首次描述了一种未知的细胞培养污染物,并命名为纳米细菌(nanobacteria,NB),但它与一般细菌的特征不一样,至今尚未测出其完整的基因序列,故后来又被命名为CNPs[1]。虽然还不能确定CNPs到底是一种纳米级的能自我复制的生命体还是一种矿化蛋白质复合体,但CNPs因其独特的生化矿化活性,近年来已成为病理性钙化相关疾病的研究焦点,在动脉粥样硬化[2]、牙结石[3]、前列腺炎[4]等疾病中都发现有CNPs的参与。粟宏伟等[5]在绝大多数肾结石患者的血清中成功培养出CNPs,阳性率明显高于正常组,这说明CNPs与肾结石形成可能存在密切的关系。
Garcia等[6]通过将培养出来的CNPs直接经皮肾内注射,初步建立了CNPs致大鼠肾结石动物模型,但因经皮肾穿刺小鼠肾脏技术较困难且成功率低,故该方法未能被业界接受。本实验将由结石标本分离培养出的CNPs通过鼠尾静脉注射进大鼠体内,8周后处死大鼠,肾脏组织HE染色后偏光显微镜下可见不规则高亮晶体,肾脏组织Von kossa染色后光镜下可见棕褐色或黑褐色不规则晶体,主要分布在近曲小管和远曲小管,D组则无晶体,成功建立了CNPs致大鼠肾结石的动物模型。实验中发现:T2各组大鼠血Ca2+水平无明显差异,但T2A组大鼠尿Ca2+水平明显高于D组,提示CNPs可能提高尿Ca2+水平,这可能是CNPs导致肾结石形成的原因之一。
目前CNPs致肾结石的具体机制还不清楚,有研究提示肾小管上皮细胞损伤机制可能在肾结石的形成过程中起重要作用。Yu等[7]已证实CNPs能对共同培养的HK-2细胞造成损伤,损伤程度随时间延长而加重。CNPs损伤细胞后,细胞的晶体黏附性也明显增强。本研究结果显示:A组肾脏组织镜下可见大量肾小管上皮细胞变性;肾间质可见炎性细胞浸润灶;近曲小管和远曲小管内可见钙盐晶体沉积。且T2A组大鼠血肌酐水平高于D组,这些证实了CNPs能损伤肾小管上皮细胞,促进肾小管内钙盐晶体的黏附、沉积,这可能是肾结石形成过程中的关键环节。
肾石通具有清热利湿、排石的功效,能减轻局部组织水肿,其治疗泌尿系结石的疗效确切可靠[8]。本实验研究结果中,肾石通降低了大鼠尿钙浓度及成石率,且肾小管上皮细胞变性和肾间质淋巴细胞浸润程度相比于A组都有所减轻。提示肾石通的抗结石活性成分可能对CNPs致肾小管上皮细胞损伤过程有抵抗作用,并且有可能通过降低尿钙水平而削弱CNPs的自我矿化作用,影响晶体对肾小管上皮细胞的黏附作用。
Eby[9]发现三价镓盐具有强大的抗炎、抗癌和抗高钙血钙症特点。他在临床中观察到1例发生肾绞痛的尿路结石患者,在应用硝酸镓后于第2、3日就有溶解的结石陆续排出。由此提出了硝酸镓可能能治疗肾结石,但具体机制还有待进一步研究验证。本研究结果中的C组肾脏组织中钙盐结晶沉积较A组明显减少,血肌酐和尿Ca2+水平明显降低,提示硝酸镓可能通过抗CNPs机制,有保护肾功能、抑制钙盐结
晶沉积和肾结石形成的作用。
本研究成功建立了CNPs致大鼠肾结石动物模型,与目前普遍使用的大鼠肾结石模型改良造模方法相比[10],CNPs致肾结石动物模型的特点是造模时间偏长。肾小管晶体数量偏少;尿Ca2+、血肌酐水平都相对偏低,这虽然增加了造模的时间和成本,但这可能更接近人体肾结石形成的病理生理过程。因此,CNPs致大鼠肾结石动物模型的建立,可为进一步研究肾结石形成机制及肾结石的防治提供新的思路。
参考文献
[1]Kajander EO.Nanobacteria--propagating calcifying nanoparticles[J].Lett Appl Microbiol,2006,42(6):549-552.
[2]Hunter LW,Charlesworth JE,Yu S,et al.Calcifying nanoparticles promote mineralization in vascular smooth muscle cells:implications for atherosclerosis[J].World J Orol,2006,24(1):51-54.
[3]Zeng J,Yang F,Zhang W,et al.Association between dental pulp stones and calcifying nanoparticles[J].Int J Nanomedicine,2014,9:2689-2698.
[4]Kim TH,Kim HR,Myung SC.Detection of nanobacteria in patients with chronic prostatitis and vaginitis by reverse transcriptase polymerase chain reaction[J].Korean J Urol,2011,52(3):194-199.
[5]粟宏伟,朱永生,邓青富,等.上尿路结石患者血清、尿液、结石中纳米细菌的检测[J].重庆医学,2013,42(31):3754-3756.
[6]Garcia CE,Olavi KE,Ciftcioglu N,et al.Nanobacteria.An experimental neo-lithogenesis model[J].Arch Esp Urol,2000,53(4):291-303.
[7]Yu CF,Huang XB,Chen L,et al.Effect of nanobacteria on cell damage and crystal retention in renal tubular epithelial cells[J].Beijing Da Xue Xue Bao,2010,42(4):436-442.
[8]江文凛,杨志伟.肾石通丸治疗泌尿系结石200例疗效观察[J].临床医药实践,2010(4):219-221.
[9]Eby GA.A hypothesis for anti-nanobacteria effects of gallium with observations from treating kidney disease[J].Medical Hypotheses,2008,71(4):584-590.
[10]李笑然,岳中瑾,裴薇,等.4种大鼠肾草酸钙结石模型的比较[J].现代泌尿外科杂志,2013,18(4):329-331,338.
Establishment renal calculus rat model induced by calcifying nanoparticles*
SuHongwei1,WangJie1,ZhuYongsheng2,DengQingfu2,PeiLijun2,WangJuan2
(1.DepartmentofUrology,theAffiliatedT.C.MHospitalofLuzhouMedicalCollege,Luzhou,Sichuan646000,China;2.DepartmentofUrology,theAffiliatedHospitalofLuzhouMedicalCollege,Luzhou,Sichuan646000,China)
[Abstract]ObjectiveTo establish renal calculus rat model induced by calcifying nanoparticles.MethodsWe extracted and cultivated calcifying nanoparticles from clinically diagnosed patients with nephrolithiasis.Forty adult male SD rats were divided into 4 groups (n=10 each):group A(given an intravenous injection of calcifying nanoparticles),group B(given an intravenous injection of calcifying nanoparticles and taken Shenshitong granules),group C(given an intravenous injection of calcifying nanoparticles and intraperitoneal injection of gallium nitrate),group D(as normal control).Eight weeks later,all rats were sacrificed.The kidneys were examined for pathology.ResultsHistopathological studies revealed calcifying nanoparticles induced renal tubular epithelial cells fatty degeneration and renal tubular crystallization,and caused renal interstitial infiltration with inflammatory cells.The formation of renal crystals in group A was more obvious than those in group B and C(P<0.05).In group D,no crystals were formed and no pathological changes occurred.The levels of urinary calcium and urinary creatinine(of All group) at one day before the observation period (T2) were higher than those at 4 weeks after injection(T1)(P<0.01).The levels of urinary calcium and serum creatinine in group A and B and C were significantly higher than those in group D at T2(P<0.05).The levels of urinary calcium in group B and C were lower than that in group A at T2(P<0.05).However,there were no apparent differences of the levels of serum calcium and urinary creatinine between groups at T2(P>0.05).ConclusionCalcifying nanoparticles could cause renal tubular epithelial cells injury,which leads to the formation of kidney stones.
[Key words]nephrolithiasis;calcinosis;lens,crystalline;calcifying nanoparticles;model;shenshitong;gallium nitrate
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.03.007
*基金项目:四川省科技厅资助项目(14JC0105);四川省卫生厅资助项目(100288)。
作者简介:粟宏伟(1973-),副教授,硕士,主要从事泌尿系结石研究。
[中图分类号]R692.4
[文献标识码]A
[文章编号]1671-8348(2016)03-0310-03
(收稿日期:2015-08-18修回日期:2015-10-26)

