雌二醇通过BDNF促进端脑神经细胞增殖与分化*
陈 琼,林丽英,唐晓华,郭旭光,夏 勇
(广州医科大学附属第三医院检验科,广州 510150)
雌二醇通过BDNF促进端脑神经细胞增殖与分化*
陈琼,林丽英,唐晓华,郭旭光,夏勇
(广州医科大学附属第三医院检验科,广州 510150)
[摘要]目的探讨雌二醇(E2)在神经组织中的作用机制,分析E2对神经细胞增殖及神经元分化的影响,以及其是否由脑源性神经营养因子(BDNF)介导。方法离体条件下培养动物端脑神经组织,设置各实验组,分别以E2、E2受体抑制剂、BDNF、BDNF抗体或以上试剂联合处理,之后进行相关免疫组织化学染色分析不同处理条件下神经细胞的增殖、神经元分化情况;在此基础上通过实时荧光定量PCR检测E2能否调节BDNF基因的表达。结果E2和BDNF均能促进新生神经细胞的产生,增加Hu+神经元数目,E2受体抑制剂及BDNF抗体则有相反作用;并且E2的作用效果能被BDNF抗体消减,而E2受体抑制剂不能影响BDNF正常发挥作用;实时荧光定量PCR实验结果显示,E2能显著上调BDNF mRNA的表达,而E2受体抑制剂能抑制BDNF mRNA表达。结论体外培养条件下,E2对神经组织内细胞增殖、神经元分化的促进作用可由BDNF介导。
[关键词]雌二醇;脑源性神经营养因子;神经组织
雌二醇(estradiol,E2)是动物体内最普遍和生物活性最强的一种雌激素,在脑发育及其功能行使过程中扮演着重要角色。大量研究表明E2能改善多种神经系统疾病病况,例如,在以黑质纹状体多巴胺神经元功能障碍为病因的帕金森病中,E2表现出明显的神经保护功能[1];中风后,E2能抑制神经细胞的凋亡,促进新生细胞的产生与迁移,以及下调小胶质细胞及星形胶质细胞中前炎症因子的表达以控制炎性反应[2];多发性硬化和其他脱髓鞘病中,E2能抑制细胞凋亡、加快髓磷脂膜组成,与孕酮相互配合,有效促进髓鞘再生[3];此外,在阿尔茨海默病、认知与情绪障碍等其他疾病中,雌激素亦有着举足轻重的地位。
然而神经组织中E2对神经细胞增殖、分化、凋亡等的调控机制尚不明确,E2有可能直接作用于靶细胞影响其上述活动,或通过其他因子间接调节。如E2已经被证实能调节多种基因的表达[4-5],其中包括中枢神经系统中极为重要的脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)。为了验证BDNF是否与E2的调控通路相关,本文以离体培养的鸟类端脑神经组织为实验对象,在确认了E2、BDNF对神经细胞增殖、分化作用的基础上,进一步分析了E2对神经细胞增殖、分化的促进作用是否由BDNF介导,现报道如下。
1材料与方法
1.1材料神经组织体外培养方法与此前一致[6],基本流程如下:实验幼鸟经麻醉后,用无菌冰冷的Hank′s缓冲液(含青霉素、链霉素、葡萄糖,pH 7.2)从心脏灌流,将脑组织中血液冲洗干净;将全脑拨出于Hank′s缓冲液中浸泡1 min左右,从正中线分开左右端脑;用振动切片机于缓冲液中将端脑切成400 μm厚的组织片,用于培养。向6孔板中加入1.8 mL培养基(DMEM∶F-12=1∶1,神经细胞培养基添加因子 N2,B27,加上100 μg/mL的维生素C,2 mmol/L谷氨酰胺,100 U/mL青霉素和链霉素),放入培养专用的聚碳酸酯膜插件(孔径为0.4 μm),之后将待培养组织置于插件膜上,培养皿放入37 ℃、5%CO2培养箱中。根据实验需要,分别培养1 d或5 d,培养期间每2天换1次培养基。培养结束后将组织块移入4%多聚甲醛溶液[(0.1 mol/L的磷酸缓冲液(PBS)配制]中4 ℃固定过夜;30%蔗糖溶液脱水。之后用恒冷切片机进一步切成10 μm厚切片,以备后续免疫组织化学染色。
1.2方法
1.2.1实验分组及处理用于分析神经细胞增殖情况的组织块离体培养时间为1 d,期间培养基中加入终浓度为10 μmol/L的5-溴脱氧尿嘧啶核苷(BrdU)以标记培养期间的新生细胞。除对照组(培养基内不添加下列任何试剂)外,根据实验需要设置有E2组、雌激素受体阻断剂(Tamoxifen)组、BDNF组、BDNF抗体组。此外,本文还增加了以下两组实验,即T+B组(培养基里同时添加Tamoxifen、BDNF)与E2+抗B组(培养基内同时添加E2、BDNF抗体),用以分析在阻断了E2通路的情况下,BDNF能否继续产生作用;或者在阻断了BDNF通路的情况下,E2能否继续发挥其效用。各组往培养基中添加的其他各种实验试剂最终浓度分别如下:E2(Sigma,E2758),20 ng/mL;Tamoxifen(Merck,579002),5 μmol/L;BDNF(Sigma,B3795),10 ng/mL;BDNF抗体(Chemicon,AB1513P),2 μg/mL。用于分析神经元分化的组织块离体培养时间为5 d,分组情况同上。
1.2.2免疫组织化学BrdU免疫组织化学流程如下:PBS清洗,3×5 min;2N HCl/PBS孵育,室温3 h;PBS清洗,3×5 min;0.1 mmol/L硼酸-硼砂缓冲液(pH 8.4)孵育,30 min;PBS清洗,3×5 min;5%正常驴血清/ 0.5%TritonX-100 PBS,室温30 min;大鼠抗BrdU抗体(1∶2 000),室温2 h;PBS清洗,3×5 min;荧光素Texas red标记的驴抗大鼠免疫球蛋白G(IgG,1∶100),室温2 h;PBS清洗,3×5 min;荧光封片剂封片,镜检观察。Hu免疫组织化学染色流程如下:PBS清洗,3×5 min;5%正常羊血清/ 0.5%TritonX-100 PBS,室温30 min;小鼠抗HuC/D单克隆抗体(1∶800),室温2 h;PBS清洗,3×5 min;Alexa Fluor 488荧光素标记的山羊抗小鼠(1∶100),室温孵育2 h;PBS清洗,3×5 min;荧光封片剂封片,镜检观察。
1.2.3实时荧光定量PCR接下来,为了验证E2是否参与了BDNF基因的表达调控,在离体培养48 h后通过实时荧光定量PCR检测E2及Tamoxifen组内BDNF mRNA水平。组织块按上文流程离体培养2 d以后(对照组,E2组,Tamoxifen组)将其放入Trizol(Invitrogen)中,反复冻融以破碎细胞后提取RNA,反转录成cDNA。之后通过ABI 7500 Sequence Detection System (Applied Biosystems)及SYBR实时荧光定量试剂盒(全式金),利用β-actin为内参进行相对定量,检测组织样本中BDNF mRNA的表达水平,每个样本做4个重复。实时定量PCR所得数据使用2-ΔΔCT统计方法分析。
2结果
2.1E2、BDNF对神经细胞增殖与分化的影响本文用BrdU标记神经组织内的新生细胞,组织经培养1 d后固定、切片,进行BrdU免疫组织化学染色以显示出培养期间产生的新生细胞。如图1A所示,新生细胞此时主要呈线性分布于室带区,与对照组[(27.5±1.4)个/mm]相比,E2组[(32.5±1.7)个/mm]、BDNF组[(33.6±2.8)个/mm]BrdU+细胞数量显著升高;相应地,Tamoxifen组[(21.6±1.1)个/mm],以及BDNF抗体组[(20.9±1.1)个/mm]的处理能明显降低新生细胞数目。培养5 d后的组织经固定、切片后,通过神经元标记物Hu的免疫组织化学染色以显示组织中的神经元,见图1。如图所示,Hu+神经元均匀分布于组织中,本文比较了各实验组经离体培养后的神经元密度,发现E2组[(627.0±44.0)个/mm2]、BDNF组[(545.4±19.5)个/mm2]Hu+神经元数量明显高于对照组[(425.0±31.1)个/mm2];同样,Tamoxifen组[(310.8±24.6)个/mm2]及BDNF抗体组[(317.5±26.6)个/mm2]的处理使离体培养组织内神经元数目明显低于对照组,见图1。
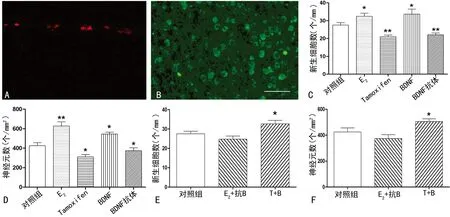
A:BrdU标记的新生细胞;B:Hu标记的神经元;C:E2,tamoxifen,BDNF,BDNF抗体对新生细胞数目的影响;D:E2,tamoxifen,BDNF,BDNF抗体对神经元数目的影响;E:E2与BDNF抗体、tamoxifen与BDNF联合对新生细胞数目的影响;F:E2与BDNF抗体、tamoxifen与BDNF联合对神经元数目的影响。Bar=50 μm;*:P<0.05,**:P<0.01,与对照组比较。
图1E2及BDNF对神经细胞增殖及神经元分化的影响
2.2BDNF与E2作用的联系结果显示,与对照组相比,T+B组在24 h内BrdU+新生细胞数目显著增加[(32.7±1.8)个/mm],培养5 d后Hu+神经元密度也高于对照组[(505.4±21.0)个/mm2];而E2+抗B组无论新增殖细胞数[(23.6±1.7)个/mm],还是神经元密度[(374.5±29.3)个/mm2]与对照组相比均差异无统计学意义(P>0.05),见图1E、F。
2.3E2调节BDNF的表达在48 h内E2明显提高了端脑神经组织BDNF mRNA表达水平(1.877±0.270),而Tamoxifen有明显的抑制作用(0.791±0.048)。此结果有效证明了E2能够调节BDNF基因的表达,见图2。

*:P<0.05,**:P<0.01,与对照组比较。
图2E2及其受体抑制剂对BDNF mRNA表达的影响
3讨论
对于E2在神经组织中的作用机制,一般认为是通过雌激素受体(ER)直接调节靶细胞的相关生理活动,从而实现对细胞功能的影响[7]。然而,通过对多种实验动物大脑内ER分布的研究发现,ER(包括ERα和ERβ)仅在某些特定区域有表达[8-9],范围远小于它能影响的区域。如鸟类脑中整个鸣唱系统的结构、功能均受雌激素的影响,而ER仅在其位于端脑的高级发声中枢尾侧有所表达[10]。因此E2对无ER分布的脑区的调控势必是通过其他间接方式,本文对神经组织的离体培养实验结果进一步证实了这一说法。本实验结果表明,E2很有可能通过调节ER+细胞合成及分泌BDNF,从而控制神经细胞的增殖、分化,此过程中BDNF作为E2的下游因子发挥作用。而本文的实时荧光定量PCR实验证实E2能在短时间内上调BDNF mRNA水平,为上述推论提供了有利证据。
BDNF是在神经组织中能促进多种神经元的增殖、分化、存活,以及神经生长,还能通过多条信号通路调节神经元的结构与功能[11],它能顺着或逆着神经投射通路实现在不同区域之间的转运,也可通过旁分泌途径影响周围神经组织的活动[12]。通过调节BDNF的表达量及分布,E2的影响范围能扩大到无ER分布的脑区,而ER对BDNF基因的表达的调控则可能是ER的直接作用。有研究发现BDNF基因序列前端具有类似ER结合位点[13],提示ER能直接干预BDNF基因的转录。
参考文献
[1]Bourque M,Dluzen DE,Di Paolo T.Neuroprotective actions of sex steroids in Parkinson′s disease[J].Front Neuroendocrinol,2009,30(2):142-157.
[2]Suzuki S,Brown CM,Wise PM.Neuroprotective effects of estrogens following ischemic stroke[J].Front Neuroendocrinol,2009,30(2):201-211.
[3]Kipp M,Beyer C.Impact of sex steroids on neuroinflammatory processes and experimental multiple sclerosis[J].Front Neuroendocrinol,2009,30(2):188-200.
[4]Chen C,Kuo J,Wong A,et al.Estradiol modulates translocator protein (TSPO) and steroid acute regulatory protein (StAR) via protein kinase A (PKA) signaling in hypothalamic astrocytes[J].Endocrinology,2014,155(8):2976-2985.
[5]Mori H,Matsuda K,Yamawaki M,et al.Estrogenic regulation of histamine receptor subtype H1 expression in the ventromedial nucleus of the hypothalamus in female rats[J].PLoS One,2014,9(5):e96232.
[6]陈琼,夏勇,江镜全,等.幼年鸣禽白腰文鸟端脑高级发声中枢的离体培养[J].解剖学杂志,2013,36(4):849-851.
[7]Bean LA,Ianov L,Foster TC.Estrogen receptors,the hippocampus,and memory[J].Neuroscientist,2014,20(5):534-545.
[8]Hedges VL,Ebner TJ,Meisel RL,et al.The cerebellum as a target for estrogen action[J].Front Neuroendocrinol,2012,33(4):403-411.
[9]Laflamme N,Nappi RE,Drolet G,et al.Expression and neuropeptidergic characterization of estrogen receptors (ERalpha and ERbeta) throughout the rat brain:anatomical evidence of distinct roles of each subtype[J].J Neurobiol,1998,36(3):357-378.
[10]Metzdorf R,Gahr M,Fusani L.Distribution of aromatase,estrogen receptor,and androgen receptor mRNA in the forebrain of songbirds and nonsongbirds[J].J Comp Neurol,1999,407(1):115-129.
[11]Nagahara AH,Tuszynski MH.Potential therapeutic uses of BDNF in neurological and psychiatric disorders[J].Nat Rev Drug Discov,2011,10(3):209-219.
[12]Dittrich F,Feng Y,Metzdorf R,et al.Estrogen-inducible,sex-specific expression of brain-derived neurotrophic factor mRNA in a forebrain song control nucleus of the juvenile zebra finch[J].Proc Natl Acad Sci U S A,1999,96(14):8241-8246.
[13]Sohrabji F,Miranda RC,Toran-Allerand CD.Identification of a putative estrogen response element in the gene encoding brain-derived neurotrophic factor[J].Proc Natl Acad Sci U S A,1995,92(24):11110-11114.
Estradiol induce neural proliferation and differetiation through regulating the expression of BDNF*
ChenQiong,LinLiying,TangXiaohua,GuoXuguang,XiaYong
(DepartmentofLaboratoryMedicine,theThirdAffiliatedHospital,GuangzhouMedicalUniversity,Guangzhou,Guangdong510150,China)
[Abstract]ObjectiveTo address the influences of estradiol on the proliferation and neuronal differentiation in neural tissues,and then analyse whether BDNF involves in the pathway of this estradiol-induced cell division and specification.MethodsThe forebrain tissues of experimental animals were cultured in vitro,and treated respectively with estradiol,estrogen receptor inhibitor,BDNF,BDNF antibody,or received a combined treatment.And the immunohistochemistry was performed to reveal the situation of cell proliferation,neuronal differentiation in different experimental groups.Then real-time PCR was carried out to detect whether the expression of BDNF was regulated by estradiol.ResultsBoth estradiol and BDNF increased the newborn cells and Hu positive neurons in cultured tissues,estrogen receptor inhibitor tamoxifen and BDNF antibody decreased the measurements conversely;the effects of estradiol were diminished by anti-BDNF,while BDNF′s effect didn′t changed by tamoxifen.Moreover,the expression of BDNF mRNA were up-regulated by estradiol and were inhibited by estrogen receptor inhibitor.ConclusionEstradiol might induce neural proliferation and differentiation in vitro by regulating the level of BDNF.
[Key words]estradiol;brain-derived neurotrophic factor;neural tissue
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.03.011
*基金项目:广州市医药卫生科技项目(20131A011160);广州医学院第三附属医院博士启动项目(2012Y19)。
作者简介:陈琼(1983-),主管技师,博士,主要从事神经系统感染性疾病方面研究。
[中图分类号]R3
[文献标识码]A
[文章编号]1671-8348(2016)03-0323-03
(收稿日期:2015-08-18修回日期:2015-10-20)

