金属线码标记操作对大黄鱼5种血清酶活力的影响
黄建华,沈斌,黄晓婷,朱爱意
(浙江海洋大学,国家海洋设施养殖工程技术研究中心,浙江舟山316022)
金属线码标记操作对大黄鱼5种血清酶活力的影响
黄建华,沈斌,黄晓婷,朱爱意
(浙江海洋大学,国家海洋设施养殖工程技术研究中心,浙江舟山316022)
金属线码标记体积非常小,对标记生物的存活、生长、发育影响都比较小,且保持率很高,代码能力强,能研究到每个个体,可进行大规模标志并且检测方便,具有广阔的应用前景。本研究采用长3±0.05 mm、直径0.57±0.02 mm的涂铬金属丝,模拟金属线码注射到大黄鱼背部肌肉中,通过分析大黄鱼血清中与抗氧化、非特异性免疫相关的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、溶菌酶(LZM)、酸性磷酸酶(ACP)及碱性磷酸酶(AKP)的活性变化,观察大黄鱼对金属标记操作的应激反应。研究结果发现:血清SOD、CAT、LZM、ACP和AKP的活性均呈现出先升高后降低并逐渐恢复至正常水平的趋势。SOD酶活性在12 h时与对照组存在显著差异,其余4个酶活性在6 h与12 h时均与对照组存在显著差异。24 h时各酶的活性均开始降低且与对照组已无显著差异,金属标记操作3 d后各酶的活性均基本恢复至正常水平。结果表明,在金属标记的早期,由标记引起的应激会对大黄鱼的抗氧化、非特异性免疫系统产生轻微的影响,但该影响随着标记后暂养时间的推移逐渐减弱,至3 d时其影响已基本消失。因此,建议应将金属线码标记的大黄鱼暂养3 d以上再进行放流比较合适。
金属线码标记;大黄鱼;抗氧化;免疫;酶活
金属线码标志方法发明于20世纪60年代,在国外现已成为最广泛使用的鱼类标志技术之一[1],是使用专门设备将印有数字编码的磁性金属细丝注射到鱼体皮下组织,在回捕时使用专门的检测仪器进行鉴定的标记方法[2]。金属线码标由直径0.25 mm的磁性金属丝制作,标上刻有编码,能区分不同个体。标准长度为1.1 mm,视鱼体大小选用[3]。其体积非常小,注入鱼体的伤口小,愈合快,很少引起鱼体组织的损伤,与体外标相比,几乎不影响鱼类的捕食、游泳和生境选择[4-6];且保持率很高[1-6],标记的生物存活率、标记的保持率直接影响着日后标记放流效果的评估。而且线码标记的部位很少被食用,即使被食用,由于线码标记体积小,没有危害成分,且无毒性,所以对人体基本无影响[3]。金属线码标记和检测可以通过自动化仪器进行,便于进行大规模标志和检测。但此技术从外表通常无法识别是否为已标记生物,需要专门的仪器进行检测,而此类设备较昂贵,所以在国内这种方法暂时使用得不多[6-8]。
大黄鱼Larimichthys crocea是我国近海最重要的传统经济鱼类之一,因其肉味鲜美而驰名中外,曾创造了巨大的商业价值。上世纪80年代后,随着捕捞强度和捕捞力度的日益增加、海洋环境污染及其他未知因素,致使渔业资源遭到严重破坏,使大黄鱼资源严重衰退,近乎销声匿迹[9]。为了恢复这一传统渔业资源,补充自然海域大黄鱼的群体数量,促进海洋渔业可持续发展,政府每年投入大量经费用于大黄鱼的增殖放流。但是,由于目前尚未对放流大黄鱼开展全面的标志研究,因此关于大黄鱼增殖放流的效果至今尚无法进行较好的评估。鉴此,建立一种适用于大黄鱼增殖苗种的规模化标记及检测方法已成当务之急。传统的挂牌、剪鳍等标志方法存在对鱼体损伤及放流后死亡率较高的缺点[10],并不适用于大黄鱼规模化标记放流。化学标记易被鱼体排异或同化吸收而使效果不明显[8],还可能存在鱼体中过量有毒物质残留等缺点[10]。而金属线码标志由于其体积小、标志保持率高、具有编码功能等特点,在大黄鱼规模化增殖放流及效果评估方面具有广泛的潜在应用前景。
但金属线码作为异物植入鱼体内,会引起鱼体排异、应激等一些不良反应,很可能会导致鱼体死亡并导致标记的失败。本研究通过分析标记前后大黄鱼血清SOD、CAT、LZM、ACP和AKP的活性变化,对金属线码标记操作可能引起的应激反应、免疫排异等开展研究,并为该标记方法在大黄鱼增殖放流中的大规模应用提供参考依据。
1 材料和方法
1.1 实验材料
1.1.1 实验鱼
本实验所用的大黄鱼购自浙江舟山某养殖基地,充氧运回,120尾,平均体长12.4±2.1 cm,体重24.1± 4.6 g。大黄鱼运回实验室后暂养于直径4 m、深1.5 m的海水循环养殖系统内,24 h水循环,每天换水约5%,海水盐度25.6,水质溶解氧8.0 mg/L左右。每天09:00和16:00定时投喂大黄鱼养殖配合饲料,投喂1 h后吸去残饵,投喂量约为鱼体重的5%,暂养1周,实验前一天停止投喂。
1.1.2 金属线码
涂铬金属丝长度3±0.05 mm,直径0.57±0.02 mm,无菌消毒处理备用。
1.1.3 主要试剂
超氧化物歧化酶(SOD)(货号:A001-1)、过氧化氢酶(CAT)(货号:A007-1)、溶菌酶(LZM)(货号:A050)、酸性磷酸酶(ACP)(货号:A060)、碱性磷酸酶(AKP)(货号:A059-2)酶活测定试剂盒,均购自南京建成生物工程有限公司;麻醉剂:取海水加入MS-222,制成2.5%MS-222溶液备用。
1.1.4 主要实验仪器及器材
Microfuge 22R台式离心机(美国贝克曼公司),MultiskanFC酶标仪,DR5000分光光度计。
1.2 实验方案
实验时随机取体色、体表、运动正常的鱼放到2.5%MS-222麻醉剂溶液中,麻醉3~5 min,待鱼出现侧翻时取出鱼,用毛巾裹住,露出鱼背部,用一次性注射器,通过空压法将金属丝注射至鱼背部皮下,迅速放入海水循环养殖系统内。根据预实验结果,在标记后0 h(未打标记,其他与标记组相同操作)、3 h、6 h、12 h、24 h、3 d、5 d时分别取10尾大黄鱼,麻醉处理,进行尾静脉取血、称重、测体长。血液样品室温静置3小时后,3 000 r/min离心10 min,取血清,放入-25℃冰箱保存,备用。
1.3 酶活力单位定义
SOD活力单位定义:每100 mL血清在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U/mL)。
CAT活力单位定义:每毫升血清每秒钟分解1 μmol的H2O2的量为一个活力单位(U/mL)。
LZM采用免疫比浊法进行测定,单位U/mL。
ACP活力单位定义:100 mL血清在37℃与基质作用30 min产生1 mg酚为1个ACP活力单位(U/ 100 mL)。
AKP活力单位定义:100 mL血清在37℃与基质作用15 min产生1 mg酚为1个AKP活力单位(U/ 100 mL)。
1.4 酶活的测定
血清SOD、CAT、LZM、ACP和AKP的酶活测定均按南京建成试剂盒说明书进行操作。
1.5 数据分析
利用Excel 2003软件对实验数据进行整理,数据以平均值±标准差(Mean±SD)表示。利用SPSS 18.0软件对结果进行独立样本T检验,显著水平为P<0.05(*)和P<0.01(**)。
2 结果
2.1 金属线码标记对大黄鱼存活率的影响
标记大黄鱼放回养殖池内后,开始时由于麻醉作用尚未消除,鱼体出现侧翻、头朝上并随着水流浮动的现象并持续3~5 min。随后,大黄鱼开始游动并伴有较为明显的应激反应(如游速较快、易受惊吓等)。约6 h后游动放缓,24 h后游动基本正常,投喂饲料,部分鱼开始摄食,3 d后摄食、活动基本恢复正常。在标记伤口处,刚开始能看到有轻微伤口痕迹,1 d时基本愈合,3 d时标记伤口几乎不明显。试验期间标记大黄鱼的存活率为100%。
2.2 金属线码标记操作胁迫对大黄鱼血清酶活的影响
2.2.1 标记操作对SOD活性的影响
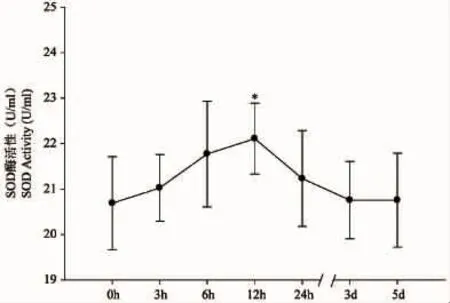
图1 标记操作对大黄鱼血清SOD活性的影响Fig.1Effect of tagging on serum SOD activity of L.crocea
如图1所示,对照组大黄鱼血清SOD酶活性平均20.687 U/mL,标记操作后血清SOD酶的活性开始逐渐上升,标记12 h后其血清SOD酶活性升至最高(平均22.107 U/mL),与对照组相比上升了6.9%,酶活性显著差异(P<0.05)。随后血清SOD酶活性开始逐渐下降,标记24 h后SOD酶活性降至平均21.228 U/mL且与对照组相比无显著差异(P>0.05),标记3 d后降至正常水平。
2.2.2 标记操作对对CAT活性的影响

图2 标记操作对大黄鱼血清溶CAT活性的影响Fig.2Effect of tagging on serum CAT activity of L.crocea
如图2所示,对照组大黄鱼的血清CAT酶活性平均4.986 U/mL,标记操作后其血液中CAT酶活性呈现先升高再降低的趋势。标记6 h后,其血清CAT酶活性平均为5.474 U/mL,与对照组相比升高了9.8%(P<0.05)。标记12 h后CAT酶活性升至最高,平均5.657 U/mL(P<0.05)。随后,血清CAT酶活性开始下降,24 h时与对照组无显著差异(P>0.05),3 d时已基本恢复到初始水平。
2.2.3 标记操作对对溶菌酶活性的影响

图3 标记操作对大黄鱼血清溶菌酶活性的影响Fig.3Effect of tagging on serum LZM activity of L.crocea
如图3所示,对照组大黄鱼血清LZM活性平均47.109 U/mL,标记操作后其血清中LZM活性同样呈现先升高再下降的趋势。标记6 h后,大黄鱼血清LZM活性平均49.123 U/mL,与对照组相比上升了4.3%(P<0.05)。标记12 h后,LZM活性升至最高,平均49.317 U/mL(P<0.05)。随后LZM酶活性开始逐渐下降,标记24 h后与对照组无显著差异(P>0.05),3 d后基本降到初始水平。
2.2.4 标记操作对对ACP活性的影响

图4 标记操作对大黄鱼血清ACP活性的影响Fig.4Effect of tagging on serum ACP activity of L.crocea
如图4所示,对照组大黄鱼血清ACP的活性平均为2.385 U/100 mL,标记操作后ACP活性同样呈现出先升高再降低的变化趋势。从0~12 h,血清ACP活性持续升高,标记6 h后ACP活性平均为2.731 U/100 mL,比对照组升高了14.5%(P<0.05)。标记12 h后,ACP活性达到最大值(平均2.962 U/100 mL),比对照组升高了24.2%(P< 0.01)。随后,大黄鱼血清ACP活性逐渐降低,标记24 h后与对照组已无显著差异(P>0.05),3 d后恢复初始水平。
2.2.5 标记操作对对AKP活性的影响
如图5所示,对照组大黄鱼的血清AKP活性平均为15.613 U/ 100 mL,金属线码标记后,AKP活性出现了与ACP类似的先升高再降低的变化趋势。从0~12 h,血清中AKP活性逐渐升高,标记6 h后AKP活性平均达到18.088 U/100 mL,与对照组相比升高了15.9%,差异极显著(P<0.01)。标记12 h后,大黄鱼血清AKP酶活性达到最大值,平均18.278 U/100 mL,与对照组相比显著升高了17.1%(P< 0.01)。之后,血清AKP活性开始逐渐降低,标记24 h后与对照组无显著差异(P>0.05),3 d后恢复初始水平。

图5 标记操作对大黄鱼血清AKP活性的影响Fig.5Effect of tagging on serum AKP activity of L.crocea
3 讨论
3.1 金属线码标记操作对大黄鱼血清抗氧化酶SOD和CAT活性的影响
SOD和CAT是生物体内清除自由基的主要抗氧化酶。SOD是一种广泛存在于动植物、微生物中的金属酶,能催化生物体内新陈代谢过程中产生的超氧自由基(O2-)发生歧化反应,是机体内O2-的天然清除剂[11],在生物体的自我保护系统中起着极为重要的作用。CAT存在于红细胞及某些组织内的过氧化体中,是生物防御体系的关键酶之一,它的主要作用就是催化清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害[12],其酶促活性为机体提供了抗氧化防御机理。
环境胁迫[13]、创伤应激[14-15]等会引起动物体内活性氧的积累,对动物体的健康造成威胁。本研究结果表明,金属线码标记后,大黄鱼血清SOD和CAT活性均在短时间内迅速升高,并在12 h时活性达到最高(图1和图2)。该结果提示由标记操作引起的创伤应激和炎症反应很可能导致大黄鱼体内脂质过氧化显著增强并引起大黄鱼体内活性氧积聚,大黄鱼血清中SOD和CAT活性应激性升高,并通过两种酶的协同作用清除体内的氧自由基,从而避免氧自由基对机体造成的损伤。这与其他一些研究的结果相类似。例如,聂海等[14]研究发现,大鼠Rattus norvegicus血清SOD活性在创伤刺激早期也略有升高。而魏宁等[15]研究了采血应激对白羽肉鸡Gallus gallus血清SOD活性的影响,结果发现采血应激同样能够导致白羽肉鸡血清SOD活性在24 h内显著升高。周继红等[16]对创伤处理的猪Sus scrofa的血液CAT活性开展了研究,结果表明创伤应激后猪血液CAT活性在12 h内显著升高。另外,高碳酸盐碱度[17]、低海水盐度[18-19]、重金属[20]和农药胁迫[12,21]等均能导致鱼体内SOD和CAT活性的显著升高,以达到快速消除体内由应激产生和过量活性氧。
随着金属线码标记操作暂养恢复时间的延长,大黄鱼体内由于标记操作胁迫所产生的氧自由基被应激产生SOD和CAT的逐渐清除,大黄鱼血清SOD和CAT活性开始缓慢下降并逐渐恢复到正常水平(图1和图2)。该结果提示,随着标记时间的延长(>3 d),金属线码标记操作对大黄鱼产生的生理影响也逐渐减弱并恢复至正常水平。
3.2 金属线码标记操作对大黄鱼血清非特异性免疫酶LZM活性的影响
溶菌酶LZM是生物体重要的非特异性免疫因子之一,具有杀菌、抗感染、诱导调节其他免疫因子合成和分泌、增加免疫力、修复伤口等功能[22]。本研究的结果表明,标记操作后,大黄鱼血清LZM活性在6 h时显著上升并在12 h时活性达到最高(图3),该结果提示,标记操作导致的创伤应激和炎症反应等使大黄鱼处于防御机制的快速动员期,并引起大黄鱼血清LZM活性在短时间内快速上升,除了创伤应激,有研究表明高密度养殖、温度胁迫、重金属和农药胁迫等都会诱导鱼类血清LZM活性的快速升高;王文博等[23]研究发现鲫鱼Carassius auratus血液LZM活性在拥挤胁迫3 d时显著升高,随后活性大幅下降,胁迫30 d时已显著低于对照组。孙学亮等[24]对半滑舌鳎Cynoglossus semilaevis进行了急性高温胁迫研究,结果发现温度胁迫后6 h其血液LZM活性急剧升高,之后维持在较高水平。而对草鱼Ctenopharyngodon idella开展的重金属[22]和农药[25]胁迫研究发现,低浓度的有毒物质暴露能够显著提高草鱼血清LZM的活性。因此,鱼类血清LZM活性不但是衡量机体免疫状态的指标之一,还是衡量养殖环境好坏的重要指标。与SOD和CAT类似,大黄鱼随着标记操作后暂养时间的延长,大黄鱼血清LZM活性开始缓慢下降并逐渐恢复到正常水平(图3)。该结果提示,在LZM以及其他免疫因子的作用下,标记操作对大黄鱼产生的炎症反应等影响随着时间的推延开始逐渐减弱并恢复至正常水平。
3.3 金属线码标记操作对大黄鱼血液磷酸酶ACP和AKP活性的影响
与LZM一样,ACP和AKP也是溶酶体酶的重要组成部分,在非特异性免疫中发挥重要的作用,是衡量机体免疫机能和健康状况的重要指标[17]。ACP和AKP参与磷酸基团的转移和代谢,将代谢产物水解成磷酸和乙醇,然后将水解生成的小分子物质排出体外[17]。另外,AKP还是血细胞溶酶体的特征酶,会对异物产生水解破坏作用[26]。本研究的结果表明,标记操作胁迫后,大黄鱼血清ACP和AKP活性同样在短时间内迅速升高,6 h时活性显著高于对照组,并在12 h时活性达到最高(图4和图5)这可能是由于金属线码标记引起大黄鱼产生创伤应激和局部炎症反应,诱导大黄鱼血清ACP和AKP活性应激性升高,从而参与非特异性免疫、排异反应等生理过程,增强机体免疫力,封青川等人的研究结果表明,大鼠肝脏部分切除能够引起肝脏ACP和AKP活性显著升高[27]。而葛明峰等人通过对大黄鱼开展致病弧菌感染研究发现,弧菌感染大黄鱼也出现了血清ACP和AKP活性升高的现象[28]。另外,一些有毒有害物质的胁迫也能诱导鱼体内ACP和AKP活性的升高。例如,鲤鱼Cyprinus carpio经不同浓度的三聚氰胺胁迫后,其体内的ACP和AKP活性均出现了显著的升高[29]。恩诺沙星可以使红笛鲷Lutjanus sanguineus血清AKP活性先升高后降低[30]。与其他酶的活性变化相类似,大黄鱼随着金属线码标记后暂养时间的延长,大黄鱼血清ACP和AKP活性也开始缓慢下降并逐渐恢复到正常水平(图4和图5)。该结果提示,随着标记时间的延长,金属线码标记操作对大黄鱼产生的影响开始逐渐减弱并恢复至正常水平,同时也说明金属线码标记本身对鱼体造成创伤较小,鱼体完全可以通过自身的免疫调节在短期内恢复。
4 结论
金属线码标记操作会使大黄鱼产生一定的创伤应激、免疫反应及操作胁迫,但随着标记操作后暂养时间的延长,其对大黄鱼产生的影响会快速减弱,至3 d时其影响已基本消失。因此,建议应将金属线码标记操作后的大黄鱼至少暂养3 d后再进行放流。
[1]HEIDINGER R C,COOK S B.Use of Coded Wire Tags for Marking Fingerling Fishes[J].N Am J Fish Mange,1988,8(2):268-272.
[2]洪波,孙振中.标志放流技术在渔业中的应用现状及发展前景[J].水产科技情报,2006,33(1):73-76.
[3]周永东,徐汉祥,戴小杰,等.几种标志方法在渔业资源增殖放流中的应用效果[J].福建水产,2008(1):6-12.
[4]张堂林,李钟杰,舒少武.鱼类标志技术的研究进展[J].中国水产科学,2003,10(3):246-253.
[5]陈锦淘,戴小杰.鱼类标志放流技术的研究现状[J].上海水产大学学报,2005,14(4):451-456.
[6]徐开达,周永东,王伟定,等.舟山海域黑绸标志放流试验[J].上海水产大学学报,2008,17(1):93-97.
[7]杨德国,危起楼,王凯,等.人工标志放流中华鲟幼鱼的降河洄游[J].水生生物学报,2005,29(1):26-30.
[8]马晓林,周永东,徐开达,等.浙江沿岸大黄鱼标志放流及回捕率调查研究[J].浙江海洋学院学报:自然科学版,2016,35(1): 24-29.
[9]丁爱侠,贺依尔.岱衢族大黄鱼放流增殖试验[J].南方水产科学,2011,7(1):73-77.
[10]张辉,姜亚洲,袁兴伟,等.大黄鱼耳石锶标记研究[J].中国水产科学,2015,22(6):1 270-1 277.
[11]姚翠鸾,王维娜,王安利.水生动物体内超氧化物歧化酶的研究进展[J].海洋科学,2003,27(10):18-21.
[12]靳晓敏,吴垠,杨松,等.两种菊酯类农药对鲤血清CAT和SOD的影响[J].农业环境科学学报,2006,25(3):615-618.
[13]LUSHCHAK V I,BAGNYUKOVA T V.Hypoxia induces oxidative stress in tissues of a goby,the rotan Perccottus glenii[J].Comp Biochem Phys B,2007,148(4):390-397.
[14]聂海,黄显凯,赖西南,等.舱内腹部爆炸伤大鼠血清及肠道组织MDA含量和SOD、GSH-Px活力变化及意义[J].第三军医大学学报,2008,30(10):910-913.
[15]魏宁,张步彩,蔡丙严,等.采血应激对白羽肉鸡血清超氧化物歧化酶活性的影响[J].江苏农业科学,2012,40(12): 222-224.
[16]周继红,朱佩芳,周宝桐,等.猪钢珠弹伤后粒细胞功能和血浆过氧化脂质的变化[J].中华创伤杂志,1992,8(4):254.
[17]王卓,么宗利,林听听,等.碳酸盐碱度对青海湖裸鲤幼鱼肝和肾SOD、ACP和AKP酶活性的影响[J].中国水产科学, 2013,20(6):1 212-1 218.
[18]陈庆凯.低盐胁迫对黄姑鱼幼鱼血清免疫和抗氧化性能的影响[J].海洋渔业,2014,36(6):516-522.
[19]尹飞,孙鹏,彭士明,等.低盐度胁迫对银鲳幼鱼肝脏抗氧化酶、鳃和肾脏ATP酶活力的影响[J].应用生态学报,2011,22 (4):1 059-1 066.
[20]赵汉取,施沁璇,沈萍萍,等.低浓度Cd2+胁迫对青鱼组织SOD活性和MT诱导的影响[J].水生态学杂志,2014,35(2):90-94.
[21]焦铭,孙雪,李笔,等.毒死蜱对斑马鱼血清CAT和SOD活性的影响[J].江西农业学报,2014,26(3):110-111.
[22]陈昌福,罗宇良,蔡冰,等.饲养水温对草鱼溶菌酶活性的影响[J].中国水产科学,1996,3(3):24-30.
[23]王文博,汪建国,李爱华,等.拥挤胁迫后鲫鱼血液皮质醇和溶菌酶水平的变化及对病原的敏感性[J].中国水产科学, 2004,11(5):408-412.
[24]孙学亮,邢克智,陈成勋,等.急性温度胁迫对半滑舌鳎血液指标的影响[J].水产科学,2010,29(7):387-392.
[25]武焕阳,许莉佳,靳涛,等.硫丹对草鱼溶菌酶及过氧化氢酶活性的影响[J].水产科学,2012,31(6):346-349.
[26]张辉,张海莲.碱性磷酸酶在水产动物中的作用[J].河北渔业,2003(5):12-13.
[27]封青川,卢爱灵,李庚午,等.连续4次(每次间隔36 h)部分肝切除对大鼠肝ACP、AKP、HSC70/HSP68和PCNA的影响[J].动物学报,2001,47(专刊):190-198.
[28]葛明峰,李思源,王国良,等.3种致病弧菌感染对大黄鱼7种酶活性的影响[J].海洋学研究,2012,30(2):74-80.
[29]吴红松.三聚氰胺对鲤鱼ACP、AKP、AST和LDH酶活性的影响[J].毒理学杂志,2014,28(4):301-303.
[30]张丽敏,吴灶和,简纪常,等.恩诺沙星对红笛鲷血清中碱性磷酸酶活力、抗体IgM含量、溶菌酶含量及其抗菌能力的影响[J].水产养殖,2009,30(4):1-7.
The Effects of Coded Wire Tagging on Activities of Five Serum Enzymes of Large Yellow Croaker
HUANG Jian-hua,SHEN Bin,HUANG Xiao-ting,et al
(National Engineering Research Center of Marine Facilities Aquaculture,Zhejiang Ocean University,Zhoushan316022,China)
The coded wire tag is so tiny that it has little influence on tagged fish’s survival,growth and development.Besides,given high retention rate and great coding capability,it contributes to studying each individual and tagging on a large scale as well as detecting easily.Thus there is a broad application prospect of CWT.In this study,the Chrome plated wire(3±0.05 mm long,0.57±0.02 mm in diameter)was injected into the back muscle of large yellow croaker to mimic the coded wire tagging.The activities of serum enzymes involved in antioxidation[Superoxide Dismutase(SOD)and Catalase(CAT)]and innate immunity[Acid phosphatase (ACP),alkaline phosphatase(AKP)and Lysozyme(LZM)]were measured to evaluate the stress reaction of coded wire tagging to large yellow croaker.Our results showed that the activities of serum SOD,CAT,LZM,ACPand AKP are all increased first and then reduced and gradually returned to levels of control group.The activity of SOD was significantly higher than the control at 12 h after coded wire tagging.While the activities of CAT, ACP,AKP and LZM were all significantly higher than the control at both 6 h and 12 h after tagging.At 24 h after tagging,the activities of five enzymes were all reduced and showed no significant difference to control group.At 3 d after tagging,the activities of five enzymes were all returned to levels of control group.Such results indicate that,in the early stage,the stress of coded wire tagging could cause slight effects to the antioxidation and innate immunity of large yellow croaker.However,these effects were gradually weakened as time goes on,then almost completely disappeared at 3 d after coded wire tagging.Thus,we suggest that the coded wire tagged large yellow croaker species should be domesticated for at least three days before releasing.
coded wire tag;large yellow croaker;antioxidation;immunity;enzymatic activity
S917.4
A
1008-830X(2016)06-0483-06
2016-10-20
国家国际科技合作专项(L2015RR0104);国家海洋局海洋公益性行业科研专项(201405014)
黄建华(1989-),男,安徽安庆人,硕士研究生,研究方向:大黄鱼标记技术.E-mail:1099676512@qq.com
朱爱意,教授.E-mail:zay008@163.com

