猪传染性胃肠炎病毒S蛋白C和D抗原位点在大肠杆菌中的串联表达
于天飞,陈 刚,张 双,史俊龙,朱可佳,张喜文(.齐齐哈尔大学生命科学与农林学院,黑龙江齐齐哈尔6006;.东北农业大学生命科学学院,黑龙江哈尔滨50030)
猪传染性胃肠炎病毒S蛋白C和D抗原位点在大肠杆菌中的串联表达
于天飞1,陈刚1,张双2,史俊龙1,朱可佳1,张喜文1
(1.齐齐哈尔大学生命科学与农林学院,黑龙江齐齐哈尔161006;2.东北农业大学生命科学学院,黑龙江哈尔滨150030)
摘要:使用大肠杆菌偏好性密码子人工合成了猪传染性胃肠炎病毒(TGEV)S蛋白C和D抗原位点多肽基因序列。依次将C和D抗原位点多肽基因序列克隆至表达载体pET-32a中。将重组质粒转化大肠杆菌Rosetta(DE3),经IPTG诱导表达,收集诱导的菌液进行SDS-PAGE电泳和Western Blot分析。结果显示,在分子量25 kDa处有1条明显的蛋白表达条带,且能被TGEV阳性血清识别。本研究为TGEV的血清学检测方法的建立提供了必要的物质基础。
关键词:猪传染性胃肠炎病毒;纤突蛋白;抗原位点;串联表达
猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是由猪传染性胃肠炎病毒(Transmissible gastroenteritis virus of swine,TGEV)引起的以仔猪腹泻为主要特征的传染病,2周龄以内发病仔猪的死亡率可达100%。研究表明,TGEV纤突(S)蛋白携带主要的B淋巴细胞抗原决定簇,是惟一能诱导产生中和抗体和提供免疫保护作用的结构蛋白[1]。S蛋白含有4个抗原位点,从氨基末端开始依次定为C、B、D和A。其中位点C和位点D是不依赖于糖基化修饰的线性抗原表位[2]。因此,这两个位点适合在原核系统中进行体外表达。本研究拟在大肠杆菌表达系统中串联表达TGEV S蛋白C和D抗原位点,利用Western Blot方法检测重组蛋白的抗原性。本研究将为建立TGEV感染的血清学诊断方法和检测技术奠定一定的物质基础。
1 材料与方法
1.1菌种和质粒大肠杆菌DH5α和Rosetta(DE3),表达载体pET-32a由齐齐哈尔大学生命科学与农林学院动物免疫学实验室(以下简称本实验室)保存。
1.2酶和抗体T4 DNA连接酶,限制性内切酶XhoⅠ和BamHⅠ,购自TaKaRa公司;TGEV阳性血清和健康猪血清由本实验室保存。羊抗猪辣根过氧化物酶标记抗体,购自北京中杉金桥生物技术有限公司。
1.3核苷酸链的合成及退火参照GenBank收录的TGEV TH-98株S基因(GenBank登录号:AF494337)中的C和D抗原位点的核苷酸序列,根据大肠杆菌偏爱密码子表,对2种类型的B细胞线性表位[2]C1(LPPNSDVVL)和C2(LIPNSDVVL)以及D抗原表位(CYTVSDSSFFSYGEIPFGVTDGPR)编码核酸序列进行了优化。设计合成了4条互补的寡聚核酸片段,5′端磷酸化。设计合成的C基因序列为含有C1和C2的双拷贝基因。其中C(F)或D(F)5′端引入BglⅡ(AGATCT)酶切位点和柔性氨基酸序列(GGGGS)的编码核酸碱基,3′端引入BamHⅠ(GGATCC)和XhoⅠ(CTCGAG)酶切位点;C(R)或D(R)5′端引入XhoⅠ和BamHⅠ酶切位点,3′端引入BglⅡ酶切位点。4条寡聚核酸片段由南京金斯瑞生物科技有限公司合成。C(F):GATCTGGTGGTGGTGGTTCCTGCTATACCGTGAGC GATAGCAGCTTTTTTAGCTATGGCGAAATTCCGTTTGGCGTGACCGATGGCCCGCGTGGATCCAC;C(R):TCGAGTGGATCCACGCGGGCCATCGGTCACGCCAAACGGAATTTCGCCATAGCTAAAAAAGCTGCTATCGCTCACGGTATAGCAGGAACCACCACCACCA;D-(F):GATCTGGTGGTGGTGGTTCCTGCTATACCGTGAGCGATAGCAGCTTTTTTAGCTATGGCGAAATTC CGTTTGGCGTGACCGATGGCCCGCGTGGATCCAC;D(R):TCGAGTGGATCCACGCGGGCCATCGGTCACGCCAAACGGAATTTCGCCATAGCTAAAAAAGCTGCTATCGCTCACGGTATAGCAGGAACCACCACCACCA。
合成的短链核苷酸片段分别稀释成25 pmol/mL的溶液,各取25 μL,C(F)和C(R)1∶1混合;D(F)和D(R)1:1混合。用PCR仪设定程序为96℃至4℃缓慢降温。退火后溶液于-20℃保存备用。
1.4表达载体构建质粒pET-32a经BamHⅠ和XhoⅠ双酶切后回收。回收片段与C抗原位点基因退火片段在T4 DNA连接酶的作用下16℃连接过夜。连接产物转化感受态大肠杆菌DH5α。将酶切鉴定正确的菌液送由南京金斯瑞生物科技有限公司测序。将经测序鉴定正确的重组质粒命名为pET-32a-C1C2。将质粒pET-32a-C1C2继续用BamHⅠ和XhoⅠ双酶切后回收。回收片段与D抗原位点基因退火片段连接并转化感受态大肠杆菌DH5α。酶切鉴定正确的菌液测序。经测序鉴定正确的重组质粒命名为pET-32a-C1C2D。
1.5重组蛋白的表达重组质粒pET-32a-C1C2D转化感受态大肠杆菌Rosetta(DE3)。重组菌37℃培养至对数生长中后期(OD600值=0.6~0.8时),加IPTG至终浓度1.0 mmol/L,诱导4 h。取诱导后菌液1 mL,12 000 r/min离心5 min,弃上清。按照每1 mg菌体湿重加30 μL PBS的比例重悬菌体沉淀。SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳检测表达情况。利用BandScan 5.0软件对重组蛋白相对表达量进行分析。
1.6表达蛋白的纯化及抗原性鉴定表达蛋白经SDS-PAGE电泳后,凝胶放入4℃预冷的0.3 mol/L KCl 5 min,切下含目的蛋白的凝胶,捣碎,加入PBS悬起,反复冻融3次,12 000 r/min离心5 min,留取上清。采用Bradford检测法对重组蛋白的含量进行测定[3]。纯化的表达蛋白经SDSPAGE电泳后,转印至硝酸纤维素膜(NC膜)上,5%脱脂乳4℃封闭过夜,PBST洗3遍,浸入1∶100 PBS稀释的TGEV阳性血清或健康猪血清中,37℃2 h,PBST洗3遍后浸入1∶1 000 PBS稀释的羊抗猪辣根过氧化物酶标记抗体,室温作用1 h,PBST洗涤3次后用4-氯-1-萘酚(4-CN)显色。
2 结果与分析
2.1重组蛋白的表达含有重组质粒pET-32a-C1C2D的大肠杆菌Rosetta(DE3),IPTG 37℃诱导4 h后全菌体细胞沉淀SDS-PAGE分析见图1。在诱导后,重组菌表达出约为25 kDa的蛋白,25 kDa 与pET-32a载体携带的Trx标签蛋白加上目的蛋白的理论分子量大小相符。利用BandScan图象分析软件分析表明,IPTG诱导4 h后全菌体细胞沉淀中表达蛋白的相对含量最高为26.5%。

图1 原核表达产物的SDS- PAGE分析
2.2重组蛋白的抗原性鉴定SDS-PAGE预制胶每孔加入纯化的Trx标签蛋白或表达蛋白20 μg,Western Blot结果表明,Trx标签蛋白不能与TGEV阳性血清反应而表达蛋白能被TGEV阳性血清所识别(图2),且表达蛋白不与健康猪血清反应(结果未列出)。
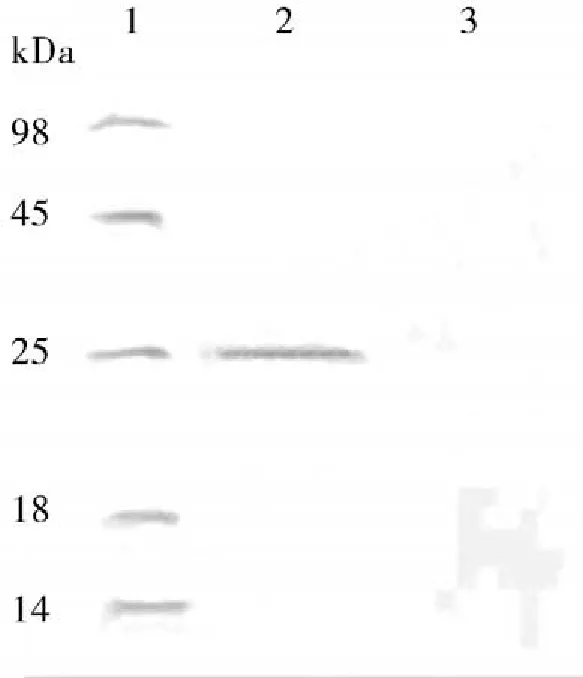
图2 Western Blot鉴定重组蛋白的抗原性1:Marker标记;2:重组蛋白与TGEV阳性血清的反应;3:Trx标签蛋白与TGEV阳性血清的反应
3 讨论
S蛋白包含的A和B抗原位点为依赖于糖基化作用的构象表位,因此限制了对它们进行原核表达的研究[4]。而C和D是抗原位点不依赖于糖基化修饰的线性抗原表位[5],适合在原核系统中进行体外表达。根据于天飞等[2]利用DNAStar软件抗原性模拟结果,C抗原位点可以分为2种类型,分别命名为C1和C2。本研究中利用合成的方法将2种类型的C抗原位点串联,形成双拷贝基因,以期重组抗原可针对不同的TGEV抗体产生免疫反应性。Western Blot试验表明,在大肠杆菌Rosetta(DE3)中串联表达的C、D抗原位点蛋白具有良好的抗原性。本研究所获得的重组蛋白为TGEV的血清学检测方法的建立提供了必要的物质基础。
参考文献:
[1]Morales L,Mateos-Gomez P A,Capiscol C,et al . Transmissible gastroenteritis coronavirus genome packaging signal is located at the 5' end of the genome and promotes viral RNA incorporation into virions in a replication- independent process[J]. J Virol,2013,87(21):11579-11590.
[2]于天飞,朱红标,孙天国,等.猪传染性胃肠炎病毒S蛋白抗原位点分子特征分析[J].生物技术通报,2010,26(3):135-138.
[3]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:42-46.
[4]Meng F,Zhao Z,Li G,et al . Bacterial expression of antigenic sites A and D in the spike protein of transmissible gastroenteritis virus and evaluation of their inhibitory effects on viral infection [J].Virus Genes,2011,43(3):335-341.
[5]Correa I,Gebauer F,Bullido M J,et al.Localization of Antigenic Sites of the E2 Glycoprotein of Transmissible Gastroenteritis Coronavirus[J].J Gen Virol,1990,71(Pt 2):271-279.
Tandem Expression of C and D Antigenic Sites of TGEV S Protein in E.coli
YU Tian-fei1,CHEN Gang1,ZHANG Shuang2,SHI Jun-long1,ZHU Ke-jia1,ZHANG Xi-wen (1.College of Life Science and Agriculture and Forestry,Qiqihar University,Qiqihar 161006,China;2.College of life science,Northeast Agricultural University,Harbin 150030,China)
Abstract:The genes which code transmissible gastroenteritis virus(TGEV)S protein C and D antigen sites were respectively using E.coli optimal codons,respectively.The recombinant expression vector was constructed by cloning genes of C and D antigen sites into the prokaryotic expression plasmid pET-32a in turn.The E.coli Rosetta(DE3)was transformed with recombinant plasmid,and the recombinant protein was expressed after induction with IPTG .SDS-PAGE and Western blot with the product of bacterial culture induction with IPTG showed that the molecular mass of the protein was approximately 25 kDa,which was identified by positive sera of TGEV.This study provided essential material foundation for establishment of TGEV serology diagnostic method.
Key words:TGEV;spike protein;antigen site;expression
中图分类号:S852.65
文献标志码:A
文章编号:0529- 6005(2016)03- 0031- 03
收稿日期:2014-07-22
基金项目:黑龙江省自然科学基金(QC2014C034);齐齐哈尔大学青年教师科研启动项目(2010k-M08)
作者简介:于天飞(1980-),男,副教授,博士,主要从事动物病毒分子生物学研究,E-mail:yutianfei2001@163.com

