江苏地区火鸡组织滴虫β-微管蛋白基因的克隆及系统发育分析
许金俊,禚振男,郭 平,曲昌宝,刘丹丹,陶建平(1.江苏动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009;2.扬州大学兽医学院禽类预防医学教育部重点实验室,江苏扬州225009)
江苏地区火鸡组织滴虫β-微管蛋白基因的克隆及系统发育分析
许金俊1,2,禚振男1,2,郭平1,2,曲昌宝1,2,刘丹丹1,2,陶建平1,2
(1.江苏动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009;2.扬州大学兽医学院禽类预防医学教育部重点实验室,江苏扬州225009)
摘要:从分子水平了解江苏地区火鸡组织滴虫的分类地位与进化特征,以江苏地区感染火鸡组织滴虫发病鸡群的病变肝脏组织为材料,通过DNA提取、PCR扩增、DNA片段的克隆与测序,获得该地区火鸡组织滴虫β-微管蛋白(Betatubulin)序列,通过软件与GenBank收录的其他地区火鸡组织滴虫和相关虫体β-微管蛋白基因序列进行系统发育分析。结果获得的11个火鸡组织滴虫β-微管蛋白基因序列相互之间同源性在95.3%~100.0%之间,亲缘关系较近,与德国株相似性94.9%以上,与美国株相似性91.6%以上。同时,该地区虫体在基因进化过程中形成2个大的分枝和多个小的分枝。表明江苏地区火鸡组织滴虫存在不同的基因型,应进一步研究其分子流行病学与种群遗传学特征。
关键词:火鸡组织滴虫;β-微管蛋白;同源性;进化关系
禚振男(1989-),女,硕士生,主要从事兽医寄生虫学研究,E-mail:zzn0810@163.com
注:禚振男与许金俊对本文具有同等贡献
组织滴虫病又称“黑头病”,是由火鸡组织滴虫(Histomonas meleagridis)引起鸡形目禽类盲肠和肝脏寄生性机能紊乱的原虫病,以盲肠肿大、肝脏坏死和排硫磺样粪便为主要特征。近年来,随着我国养殖业的不断发展,该病在很多地区有不同程度发生,死亡率达到20%~30%,给养殖业造成了巨大危害。在欧美等发达国家和地区,出于对食品安全方面的考虑,大部分治疗该病的有效药物被禁止使用,使得该病又重新暴发和流行,造成了严重的经济损失。因此,开展火鸡组织滴虫病的研究,对于保障养殖业的健康快速发展具有重要的意义。
微管是组成细胞骨架的重要组分,它存在于所有真核细胞中,是由微管蛋白装配成的长管状细胞器结构。细胞内微管呈网状或束状分布,参与许多细胞的功能,如维持细胞形态、鞭毛和纤毛的运动、染色体运动等[1]。微管又是信号转导和物质运输通道,通过干扰微管形成可影响与凋亡相关的信号转导通路,引起细胞的凋亡[2-3]。因此,针对微管参与细胞的分裂增殖和细胞内物质运输等多种生物学特性,可以设计阻断微管功能的抗微管药物,用于抗肿瘤、抗痛风、抗寄生虫等领域[4]。编码该蛋白的基因相对较为保守,其进化与核子进化是平行的,在寄生虫系统发育分析方面的研究报道则相对较少[5]。
本试验拟对该地区鸡群的火鸡组织滴虫β-微管蛋白基因进行扩增、测序分析,并与其他地区火鸡组织滴虫和相关虫体β-微管蛋白基因序列进行了系统发育分析,以了解它们之间的遗传和进化关系,为组织滴虫病诊断、分子流行病学调查、种群遗传学研究和药物靶位研究奠定基础。
1 材料与方法
1.1临床样品用于PCR扩增的11例具有组织滴虫病典型病变的鸡肝组织样品,来源于江苏各地(苏南地区1例,苏中地区6例,苏北地区4例)送至扬州大学附属动物医院就诊的病例,分别标号为HM1~HM11,肝脏采集后于-20℃冰箱冻存。
1.2试剂克隆用载体pGEM-T-Easy,购自Promega公司;宿主菌大肠杆菌DH5α由本实验室保存;DL-2 000 Marker、DNA胶回收试剂盒、LA Taq DNA聚合酶,购自TaKaRa公司;1kb DNA Ladder、25 mmol/L MgCl2、dNTP Mix、DNA聚合酶,购自上海生工生物工程技术服务有限公司。
1.3样品DNA按照酚-氯仿-异戊醇方法提取肝组织DNA,测定浓度后置于-20℃保存备用。
1.4PCR扩增按参考文献[6]设计1对引物扩增Beta-tublin基因:P1,5′-TTC GTA AAG AAG CTG AAT CC -3′;P2,5′-ACG AGG GAA TGG TAC AAG G-3′。引物由北京六合华大基因科技股份有限公司合成,预期扩增片段大小约为400 bp。25 μL PCR扩增体系为:2.5 μL 10×PCR Buffer,2 μL dNTP(10 μmol/L),0.25 μL LA Taq酶,P1、P2引物各2 μL(10 μmol/L),5 μL DNA模板(50 ng/μL),ddH2O 11.25 μL。PCR反应条件为:95℃预变性2 min,95℃变性35 s,55℃退火35 s,72℃延伸45 s,36个循环,72℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳,溴化乙锭染色,凝胶成像系统下观察并拍照。
1.5β-微管蛋白基因的克隆及测序在紫外灯下小心切取目的条带,用TaKaRa公司的琼脂糖核酸回收试剂盒纯化目的条带。将纯化产物与pGEM-T-Easy载体常规连接,转化大肠杆菌DH5α,通过蓝白斑筛选随机挑取数个单克隆,在LB液体培养基内摇床过夜,碱裂解法抽提质粒,经EcoR I酶切鉴定阳性克隆。将鉴定为阳性的质粒送英潍捷基(上海)贸易有限公司测序。
1.6β-微管蛋白基因序列分析及系统发育树构建采用DNAStar软件,对所获得序列进行同源性分析,并与从GenBank中读取的其他虫体的β-微管蛋白基因序列(表1)进行比对。采用MEGA程序中的最大简约法(MP)绘制系统发育树,并采用自展检验(bootsteap test)估算系统发育树的可靠性。
2 结果
2.1β-微管蛋白基因的PCR扩增结果将扩增后得到的11个样品PCR产物,经1%琼脂糖凝胶电泳,得到约为400 bp左右的目的条带,目的片段与预期大小相符。图为HM1、HM2、HM3、HM4样品的PCR电泳图,其余样品的扩增结果相同。
2.2PCR产物的克隆及鉴定用纯化回收试剂盒分别回收11个样品的PCR扩增产物并克隆到pGEMT-Easy载体中,每个样品挑取白色菌落碱裂解法提取质粒,EcoR I酶切鉴定。图2为HM1样品:M12345电泳结果,出现3.0 kb的载体片段和M123左右的目的片段(图2),与预计相符。
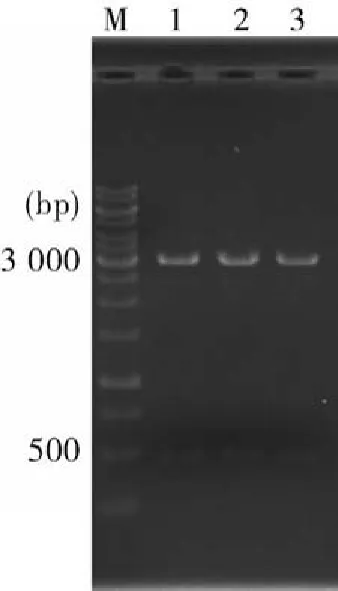
图2 重组质粒的酶切鉴定结果M:1kb DNA Ladder;1~3:阳性肝脏样品HM1的1号、2号、3号重组质粒
2.3β-微管蛋白基因序列同源性分析经过测序获得的11个β-微管蛋白基因序列均提交到GenBank,登录号分别为KM006029~KM006039。11个基因序列之间及与相似原虫的同源性分析结果见图3。由图3可知:江苏地区火鸡组织滴虫β-微管蛋白基因序列同源性在95.3%~100.0%之间,与德国株相似性94.9%以上、美国株相似性91.6%以上,与胎儿三毛滴虫相似性在85.6%~83.6%之间,高于鸡四毛滴虫的82.8%~79.6%,巨型艾美耳球虫的68.0%~51.7%和柔嫩艾美耳球虫的67.1%~50.8%。
2.4系统发育分析构建了系统发育树(图4)。系统发育树分析结果表明,江苏地区火鸡组织滴虫向2个方向进化,其与美国株的亲缘关系相对较远。在进化的过程中,HM8与德国株的亲缘关系较近,进化方向基本一致,且较于火鸡组织滴虫其他株的进化是更早的;另一个进化方向中又进一步分化成两个方向,即HM1、HM2、HM6、HM7、HM11的进化是一个方向的,HM3、HM4、HM5、HM9、HM10的进化是一个方向的,可能存在不同的基因型差异。进化树即显示了该地区火鸡组织滴虫的同属关系,又表明了该地区不同虫株的个体差异。同时,该地区火鸡组织滴虫与毛滴虫的关系密切,其进化方向是一致的,而八肋游仆虫的进化更早于其他原虫。

图3 江苏地区与其他地区火鸡组织滴虫及类似原虫的β-微管蛋白基因同源性分析

图4 以β-微管蛋白基因基因序列为分子标记的火鸡组织滴虫的系统发育树
3 讨论
2006年Van der Heijden等利用ITS-1序列的C-profiling技术将火鸡组织滴虫基因型分为I、II型和III型[7],Hauck等2010年同样利用5.8 S和flanking ITS区域的C-profiling技术将火鸡组织滴虫分为A、B、C、D四个基因型[8]。本研究采用β-微管蛋白基因序列进行系统发育分析,所构建的系统发育树显示,江苏地区鸡源火鸡组织滴虫存在多个不同的分枝,可能存在不同的基因型。中国地域辽阔,家禽饲养量巨大,组织滴虫病流行又非常严重[9],因此,有必要分离更多的地理株或采集更多的病料,利用分子生物学方法进行系统的鉴定、分类和评定,确定火鸡组织滴虫的基因型和变异情况,为该病的预防和治疗提供一定的理论依据。下一步我们将进一步扩增相关基因,借鉴C-profiling技术在中国火鸡组织滴虫分型方面进行更深入的研究。
本研究对江苏地区的11个β-微管蛋白基因序列分析表明:一方面,江苏不同地区之间以及国外不同株之间的火鸡组织滴虫β-微管蛋白基因序列同源性较高,均在91%以上;另一方面,不同地区间的火鸡组织滴虫基因序列存在一定的差异,这与许金俊等针对18S rRNA基因进行进化分析的结果类似[10]。本研究结果同时表明,同18S rRNA基因一样,微管蛋白基因也是一个研究生物系统发育、分子进化和种群遗传学研究的有效候选靶基因,可以进一步深入研究β-微管蛋白基因及其功能,微管蛋白与药物之间的作用机制,为开发用于控制组织滴虫病的高效安全的新药奠定基础。
参考文献:
[1]Libusova L,Sulimenko T,Sulimenko V,et al.Distinct localization of a beta- tubulin epitope in the Tetrahymena thermophila and Paramecium caudatum cortex[J].Protoplasma,2005,225(3-4):157-167.
[2]Giannakakou P,Gussio R,Noqales E,et al.A common pharmacophore for epothilone and taxanes:Molecular basis for drug resistance conferred by tubulin mutations in human cancer cells[J]. Proc Natl Acad Sci USA,2000,97(6):2904-2909.
[3]Giannakakou P,Sackett D,Fojo T.Tubulin/Microtubules:Still a promising target for new chemotherapeutic agents[J].J Natl Cancer Inst,2000,92(3):182-183.
[4]李建农,蒋建东.微管的生物学特性与药物研究[J].药学学报,2003,38(4):311-315.
[5]Zhao Z,Liu H,Luo Y,et al.Molecular evolution and functional divergence of tubulin superfamily in the fungal tree of life[J].Sci Rep,2014,4:6746.doi:10.1038/srep06746.
[6]Hauck R,Hafez H M.Partial sequence of the beta-tubulin of Histomonas meleagridis and the activity of benzimidazoles against H. meleagridis in vitro[J].Parasitol Res,2009,104:1183-1189.
[7]Van Der Heijden H M,Landman W J,Greve S,et al. Genotyping of Histomonas meleagridis isolates based on Internal Transcribed Spacer-1 sequences[J].Avian Pathol,2006,35:330-334.
[8]Hauck R,Balczulat S,Hafez H M.Detection of DNA of Histomonas meleagridis and Tetratrichomonas gallinarum in German poultry flocks between 2004 and 2008[J].Avian Dis,2010,54(3):1021-1025.
[9]陈静,陈雪,陶建平,等.动物医院门诊鸡组织滴虫病例的流行病学调查[J].中国畜牧兽医,2010,37(9):217-220.
[10]Jinjun Xu,Chanbao Qu,Ping Guo,et al.Phylogenetic Relationships of the 18S rRNA Gene Sequence of Histomonas meleagridis from Chickens in East China[J].J Anim Vet Adv,2013,12(16):1338-1342.
中图分类号:S852.72
文献标志码:A
文章编号:0529- 6005(2016)03- 0050- 03
收稿日期:2014-12-02
基金项目:江苏省普通高校专业学位研究生科研实践计划(2014 SJZZ_0185);江苏省基础研究计划(自然科学基金)面上项目(BK20131229);扬州大学“新世纪人才工程”项目(2012);江苏高校优势学科建设二期工程资助项目(2014);扬州大学科技创新培育基金(2014CXJ053)
作者简介:许金俊(1972-),男,副教授,博士,主要从事兽医寄生虫学教学与科研工作,E-mail:jjxu@yzu.edu.cn

